2021-2022学年高一下学期化学苏教版(2019)必修第二册6.3.2化学电源课件
文档属性
| 名称 | 2021-2022学年高一下学期化学苏教版(2019)必修第二册6.3.2化学电源课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-21 16:57:47 | ||
图片预览





文档简介
(共15张PPT)
6.3.2 化学电源
温故知新
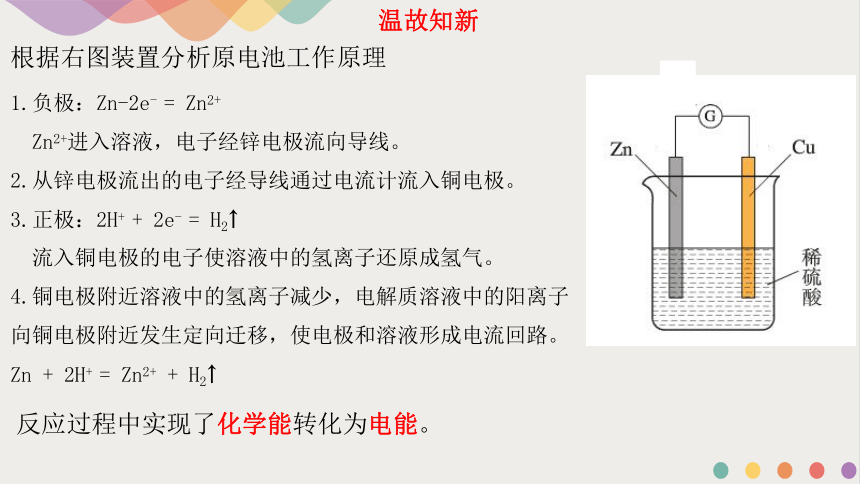
根据右图装置分析原电池工作原理
1.负极:Zn-2e- = Zn2+
Zn2+进入溶液,电子经锌电极流向导线。
2.从锌电极流出的电子经导线通过电流计流入铜电极。
3.正极:2H+ + 2e- = H2↑
流入铜电极的电子使溶液中的氢离子还原成氢气。
4.铜电极附近溶液中的氢离子减少,电解质溶液中的阳离子向铜电极附近发生定向迁移,使电极和溶液形成电流回路。
Zn + 2H+ = Zn2+ + H2↑
反应过程中实现了化学能转化为电能。
燃料电池
铅蓄电池
人们根据原电池反应的原理,设计了很多种类的电池来实现化学能转化为电能。
银锌扣电池
干电池
锂离子电池
锂电池
镍镉电池
太阳能电池
上述能够较长时间稳定持续供电的被称为化学电源,可分为一次电池、二次电池和燃料电池。
化学电源
一、一次电池
1、结构:锌锰干电池是以锌筒为 极,石墨棒为 极,在石墨棒周围填充糊状的MnO2和NH4Cl作 。
负
正
电解质
负极(锌筒):Zn-2e- = Zn2+
正极(碳棒):
2MnO2 + 2NH4+ + 2e- + Zn2+ = 2MnO(OH)+[Zn(NH3)2]2+
总反应为: Zn+2MnO2+2NH4Cl==Zn(NH3)2Cl2 + 2MnO(OH)
2、原理
一次性电池,放电之后不能充电,内部的氧化还原反应是不可逆的
(一)锌锰干电池
银锌电池是一种纽扣式大容量电池,负极Zn,正极是Ag2O 电解质溶液为KOH溶液,电极反应式为:
负极:Zn-2e-+ 2OH-==Zn(OH)2
正极:Ag2O + H2O +2e-==2Ag + 2OH-
总反应为:Zn +Ag2O + H2O ==2Ag + Zn(OH)2
(二)银锌电池—纽扣电池(了解)
二、二次电池(又称为可充电电池)
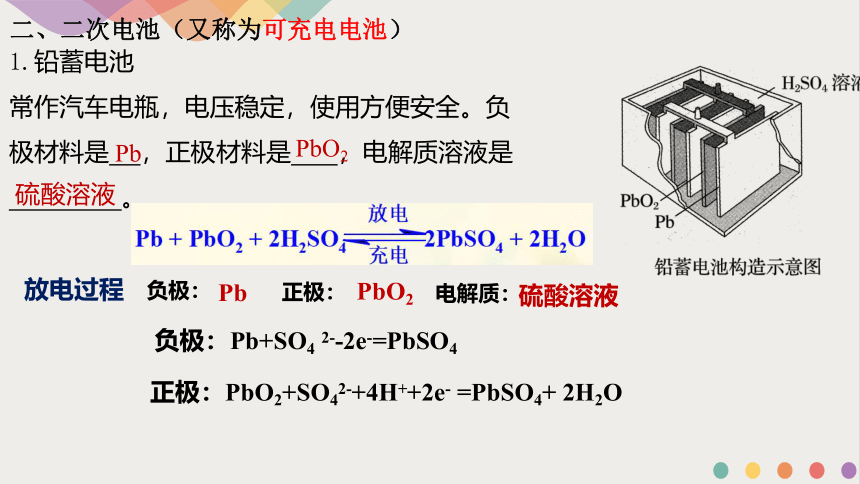
1.铅蓄电池
常作汽车电瓶,电压稳定,使用方便安全。负
极材料是 ,正极材料是 ,电解质溶液是
。
Pb
PbO2
硫酸溶液
放电过程 负极:
正极:
负极:Pb+SO4 2--2e-=PbSO4
PbO2
硫酸溶液
电解质:
正极:PbO2+SO42-+4H++2e- =PbSO4+ 2H2O
Pb
3.锂离子电池
它是新一代可充电的绿色电池,现已成为笔记本电脑、移动电话、摄像机等低功耗电器的主流。
特点:供电稳定、可反复充放电、使用寿命长、便携、无污染等
2.镍氢电池
以 为负极, 为正极,以 为电解质,寿命比铅蓄电池 ,
MH
NiO(OH)
KOH
长
三、燃料电池
1、燃料电池:是通过燃料与氧化剂分别在两个电极上发生氧化还原反应,将化学能直接转化为电能的装置。
2、以KOH溶液为电解质溶液的氢氧燃料电池的电极(原理图如右图)反应如下:
负极:__________________________(氧化反应);
正极:__________________________(还原反应);
总反应: 。
2H2+4OH--4e-===4H2O
O2+2H2O+4e-===4OH-
2H2+O2===2H2O
3、特点:干电池或者蓄电池的主要差别在于反应物不是储存在电池内部,而是由外设装备提供燃料和氧化剂等。能量转化率高(超过80%),有利于节约能源。
拓展视野:电解池
将电能转化为化学能的装置
利用电解我们可以获得普通化学方法难以制备的物质
应用:
二次电池的充电,冶炼活泼金属钠、镁、铝等
应用:
电解水制得氢气和氧气;电解饱和食盐水制备烧碱、氯气和氢气。
电解
电解池
课堂小结
电极反应式的书写及判断
书写电极反应式的原则
电极反应式遵循质量守恒
得失电子守恒
电荷守恒
遵循离子方程式的书写规则
两电极反应式相加得电池总化学(或离子)方程式
课堂小结
课堂检测
1.下列电池工作时,O2在正极得电子的是( )
答案
A B C D
锌锰电池 铅蓄电池 氢氧燃料电池 镍镉电池
C
2.铅蓄电池,其放电时的原电池反应如下:PbO2+Pb+2H2SO4===2PbSO4+2H2O,根据此反应判断,下列叙述中正确的是( )
A.Pb是正极
B.PbO2得电子,被氧化
C.负极反应是Pb+ -2e-===PbSO4
D.电池放电时,溶液的酸性增强
C
3.某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可能为( )
A.铝 B.铜 C.锡 D.硅
C
感谢您的观看
6.3.2 化学电源
温故知新
根据右图装置分析原电池工作原理
1.负极:Zn-2e- = Zn2+
Zn2+进入溶液,电子经锌电极流向导线。
2.从锌电极流出的电子经导线通过电流计流入铜电极。
3.正极:2H+ + 2e- = H2↑
流入铜电极的电子使溶液中的氢离子还原成氢气。
4.铜电极附近溶液中的氢离子减少,电解质溶液中的阳离子向铜电极附近发生定向迁移,使电极和溶液形成电流回路。
Zn + 2H+ = Zn2+ + H2↑
反应过程中实现了化学能转化为电能。
燃料电池
铅蓄电池
人们根据原电池反应的原理,设计了很多种类的电池来实现化学能转化为电能。
银锌扣电池
干电池
锂离子电池
锂电池
镍镉电池
太阳能电池
上述能够较长时间稳定持续供电的被称为化学电源,可分为一次电池、二次电池和燃料电池。
化学电源
一、一次电池
1、结构:锌锰干电池是以锌筒为 极,石墨棒为 极,在石墨棒周围填充糊状的MnO2和NH4Cl作 。
负
正
电解质
负极(锌筒):Zn-2e- = Zn2+
正极(碳棒):
2MnO2 + 2NH4+ + 2e- + Zn2+ = 2MnO(OH)+[Zn(NH3)2]2+
总反应为: Zn+2MnO2+2NH4Cl==Zn(NH3)2Cl2 + 2MnO(OH)
2、原理
一次性电池,放电之后不能充电,内部的氧化还原反应是不可逆的
(一)锌锰干电池
银锌电池是一种纽扣式大容量电池,负极Zn,正极是Ag2O 电解质溶液为KOH溶液,电极反应式为:
负极:Zn-2e-+ 2OH-==Zn(OH)2
正极:Ag2O + H2O +2e-==2Ag + 2OH-
总反应为:Zn +Ag2O + H2O ==2Ag + Zn(OH)2
(二)银锌电池—纽扣电池(了解)
二、二次电池(又称为可充电电池)
1.铅蓄电池
常作汽车电瓶,电压稳定,使用方便安全。负
极材料是 ,正极材料是 ,电解质溶液是
。
Pb
PbO2
硫酸溶液
放电过程 负极:
正极:
负极:Pb+SO4 2--2e-=PbSO4
PbO2
硫酸溶液
电解质:
正极:PbO2+SO42-+4H++2e- =PbSO4+ 2H2O
Pb
3.锂离子电池
它是新一代可充电的绿色电池,现已成为笔记本电脑、移动电话、摄像机等低功耗电器的主流。
特点:供电稳定、可反复充放电、使用寿命长、便携、无污染等
2.镍氢电池
以 为负极, 为正极,以 为电解质,寿命比铅蓄电池 ,
MH
NiO(OH)
KOH
长
三、燃料电池
1、燃料电池:是通过燃料与氧化剂分别在两个电极上发生氧化还原反应,将化学能直接转化为电能的装置。
2、以KOH溶液为电解质溶液的氢氧燃料电池的电极(原理图如右图)反应如下:
负极:__________________________(氧化反应);
正极:__________________________(还原反应);
总反应: 。
2H2+4OH--4e-===4H2O
O2+2H2O+4e-===4OH-
2H2+O2===2H2O
3、特点:干电池或者蓄电池的主要差别在于反应物不是储存在电池内部,而是由外设装备提供燃料和氧化剂等。能量转化率高(超过80%),有利于节约能源。
拓展视野:电解池
将电能转化为化学能的装置
利用电解我们可以获得普通化学方法难以制备的物质
应用:
二次电池的充电,冶炼活泼金属钠、镁、铝等
应用:
电解水制得氢气和氧气;电解饱和食盐水制备烧碱、氯气和氢气。
电解
电解池
课堂小结
电极反应式的书写及判断
书写电极反应式的原则
电极反应式遵循质量守恒
得失电子守恒
电荷守恒
遵循离子方程式的书写规则
两电极反应式相加得电池总化学(或离子)方程式
课堂小结
课堂检测
1.下列电池工作时,O2在正极得电子的是( )
答案
A B C D
锌锰电池 铅蓄电池 氢氧燃料电池 镍镉电池
C
2.铅蓄电池,其放电时的原电池反应如下:PbO2+Pb+2H2SO4===2PbSO4+2H2O,根据此反应判断,下列叙述中正确的是( )
A.Pb是正极
B.PbO2得电子,被氧化
C.负极反应是Pb+ -2e-===PbSO4
D.电池放电时,溶液的酸性增强
C
3.某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可能为( )
A.铝 B.铜 C.锡 D.硅
C
感谢您的观看
