2021-2022学年 高中化学新鲁科版选择性必修3 -2.3醛和酮 糖类和核酸(一) 课件(39张ppt)
文档属性
| 名称 | 2021-2022学年 高中化学新鲁科版选择性必修3 -2.3醛和酮 糖类和核酸(一) 课件(39张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 27.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-21 20:15:22 | ||
图片预览





文档简介
(共39张PPT)
醛和酮 糖类和核酸(1)
高二年级 化学
主讲人
联想 质疑
甲醛水溶液——福尔马林
丙酮——重要的有机溶剂
葡萄糖——供给人体能量
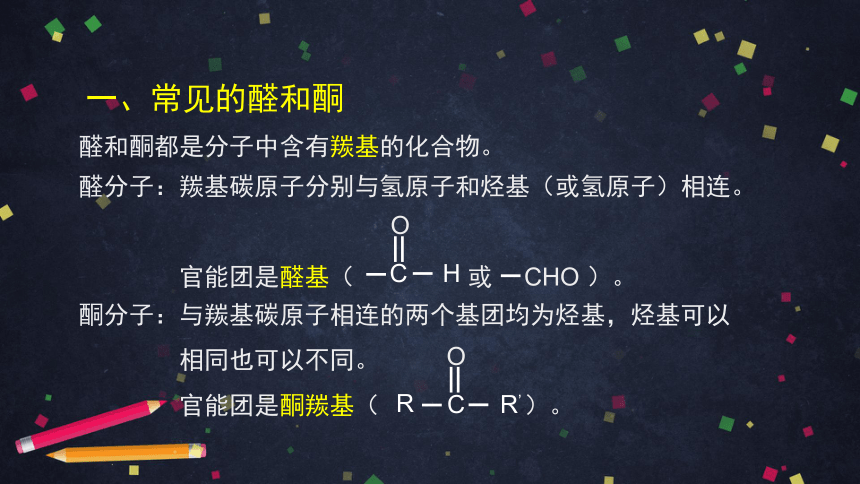
一、常见的醛和酮
醛分子:羰基碳原子分别与氢原子和烃基(或氢原子)相连。
官能团是醛基( 或 CHO )。
醛和酮都是分子中含有羰基的化合物。
C H
O
酮分子:与羰基碳原子相连的两个基团均为烃基,烃基可以
相同也可以不同。
官能团是酮羰基( )。
C R’
O
R
命名规则
(1)选取分子中连有醛基或酮羰基的最长碳链作为主链,按照
主链所含碳原子数称为“某醛”或“某酮” 。
(2)从醛基开始或距离酮羰基最近的一端给主链碳原子编号。
(3)在“某醛”或“某酮”之前加上取代基的位次号和名称。
醛、酮的命名
CH3
CH3 CH CHO
CH3
2 甲基丙醛
应用 实践
CH3
2 戊酮
1
2
3
CH2
CH2
C
O
1
2
3
5
4
CnH2nO
饱和一元醛的通式
饱和一元酮的通式
CH3CH2CHO
CH3 CH3
C
O
交流 研讨
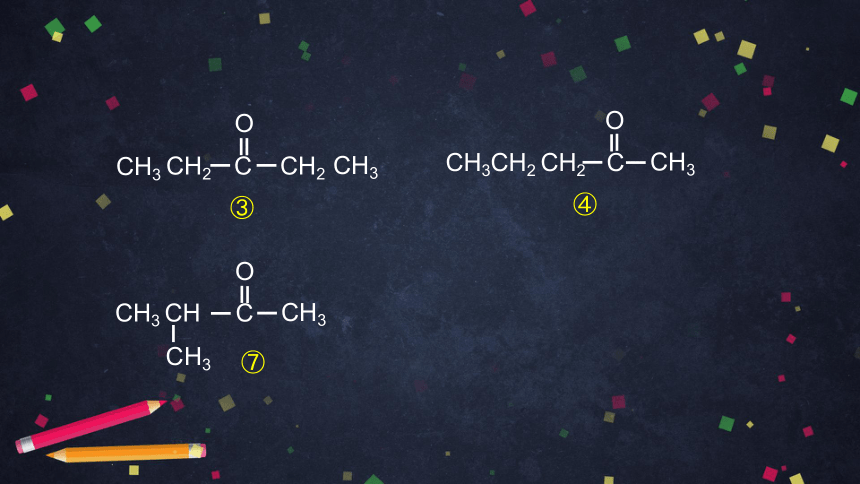
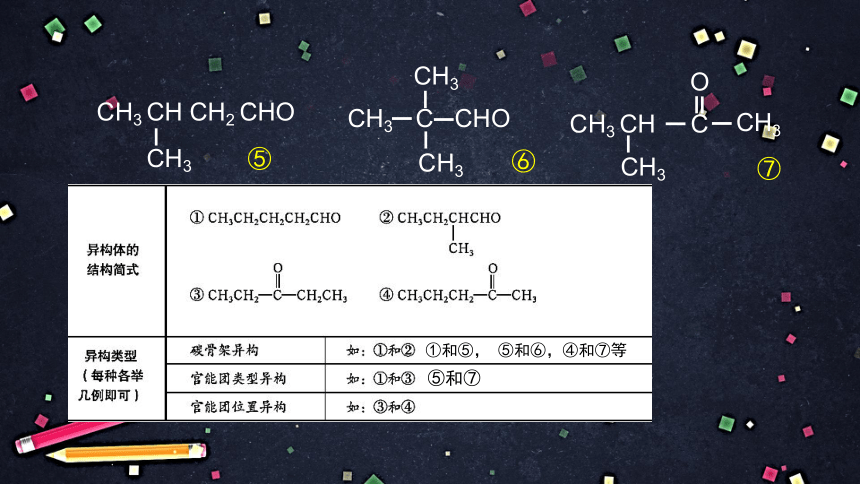
下表列出了分子式为 C5H10O 的醛和酮的部分同分异构体的结构简式,请写出属于醛、酮的其他同分异构体的结构简式,并举例说明这些异构体异构关系的类型。
CH3 CH CH2 CHO
CH3
⑤
⑥
CH3 CH2 CH CHO
CH3
CH3 CH2CH2 CH2 CHO
①
②
CH3 C CHO
CH3
CH3
⑦
CH2 C CH2
CH3
CH3
O
CH3CH2 CH2 C
CH3
O
④
CH3 CH C
CH3
CH3
O
③
CH3 CH CH2 CHO
CH3
CH3 CH C
CH3
CH3
O
⑦
⑤
⑥
⑤ 和 ⑦
CH3 C CHO
CH3
CH3
①和⑤, ⑤和⑥,④和⑦等
⑤和⑦
甲醛是最简单的醛,是无色有强烈刺激性气味的气体,易溶于水。甲醛的水溶液具有杀菌和防腐
性能,可用于消毒和制作生物标本。还可
用于制备酚醛树脂和脲醛树脂。
右图为甲醛的球棍模型:
常见的醛、酮
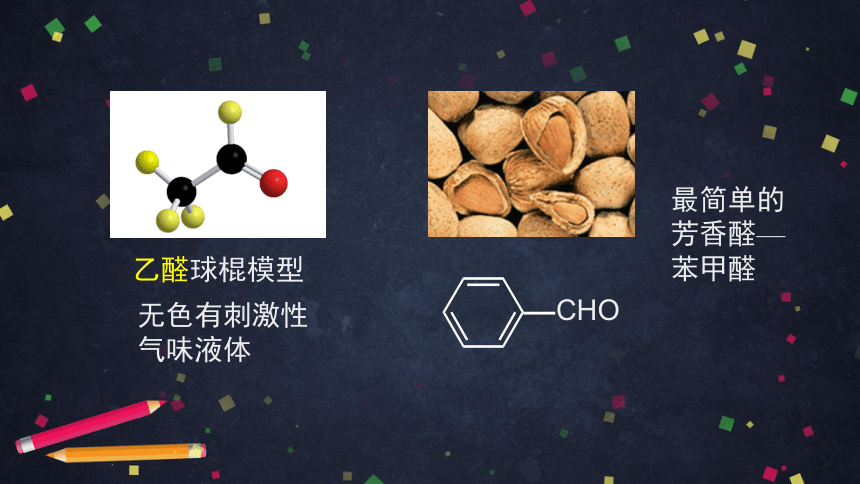
乙醛球棍模型
最简单的芳香醛—
苯甲醛
无色有刺激性气味液体
CHO
丙酮——最简单的酮
有特殊气味的无色液体,沸点为 56.5 ℃ ,能与水以任意比例互溶,并能溶解多种有机化合物。丙酮不仅是常用的有机溶剂,还是重要的有机合成原料。
身边的化学
R C C H
H
H
O
α
官能团:
是否含不饱和键:
键的极性:
基团之间的相互影响:
分析结构
二、醛、酮的化学性质
交流 研讨
α
分析结构
二、醛、酮的化学性质
交流 研讨
δ-
δ+
醛基
碳氧双键
碳氢单键
均为极性共价键
R C C H
H
H
O
R’
C
O
R
R C C H
H
H
O
酮的化学性质与醛的化学性质有哪些相同点和不同点?
加成反应
二、醛、酮的化学性质
1.羰基的加成反应
醛和酮分子中的羰基含有不饱和键,可以发生加成反应。能与醛、酮中的羰基发生加成反应的试剂有氢氰酸、氨及氨的衍生物、醇类等
H CN
乙醛与氢氰酸( HCN)反应
d
-
d
-
d
+
H C C H
H
H
O
+
H C C H
H
O
CN
H
H
d
+
催化剂
CH3 C H
O
CH3 CH NHR
OH
+
催化剂
NH
H
R
d
+
d
-
乙醛与氨及氨的衍生物( 以 RNH2 为例 )反应
d
+
d
-
H OCH3
乙醛与醇类(以 CH3OH 为例)反应
d
-
d
+
d
-
d
+
C H
O
+
CH3 CH OCH3
OH
催化剂
CH3
这类加成反应在有机合成中可以增长碳链
甲醛为什么有毒?
身边的化学
二、醛、酮的化学性质
2.氧化反应和还原反应
R’
C
O
R
R C C H
H
H
O
C OH
O
CH3 C H
O
CH3
如:
活动 探究
醛的氧化反应
实验用品:
乙醛,0.5% 酸性高锰酸钾溶液, 2% AgNO3溶液, 2% 氨水,10% NaOH 溶液,2% CuSO4 溶液;
试管,烧杯,胶头滴管,酒精灯,三脚架,石棉网,试管夹等。
实验 1:乙醛与银氨溶液反应
银氨溶液的制取
① AgNO3 + NH3·H2O AgOH + NH4NO3
② AgOH + 2 NH3·H2O Ag(NH3)2OH + 2 H2O
氢氧化二氨合银
Ag(NH3)2OH Ag
CH3CHO ?
+1
0
被还原
被氧化
Ag(NH3)2OH Ag
CH3CHO
+1
0
被还原
被氧化
CH3COONH4
△
CH3CHO + 2 Ag(NH3)2OH
CH3COONH4 + 2 Ag ↓ +
3 NH3 + H2O
反应类型:氧化反应
常用于检验醛基
反应名称:银镜反应
实验 2:乙醛与新制氢氧化铜反应
+2
+1
被还原
被氧化
Cu(OH)2 Cu2O
CH3CHO
?
+2
+1
被还原
被氧化
Cu(OH)2 Cu2O
CH3CHO
CH3COONa
CH3CHO + 2 Cu(OH)2 + NaOH
CH3COONa + Cu2O ↓
△
+ 3H2O
反应类型:氧化反应
常用于检验醛基
H 2
+
催化剂
RCH2OH
RCHO
C R’
O
R
+
H 2
RCHOH
R’
还原反应
醛的化学性质
【总结】
R C C H
H
H
O
加成反应
(与 H2 、HCN、氨及氨的衍生物、醇类等)
氧化反应
(酸性 KMnO4 溶液)
( O2,催化剂)
(银氨溶液)
(新制氢氧化铜
悬浊液)
d
+
d
-
酮的化学性质
R C R’
O
d
+
d
-
加成反应
(与 H2 、HCN、氨及氨的衍生物、醇类等)
氧化反应
( 比较稳定,只有很强的氧化剂才能将其氧化)
【总结反思】
R C C H
H
H
O
从结构角度分析有机化合物化学性质的思路
先关注官能团
再分析化学键
关注邻近基团的相互影响
预测分子的反应
活性部位
(键的饱和性、键的极性)
【总结】
反应物
反应类型
试剂
生成物
条件
反应现象
取代反应
加成反应
消去反应
氧化反应
还原反应
认识有机化学反应的角度
醛和酮 糖类和核酸(1)
高二年级 化学
主讲人
联想 质疑
甲醛水溶液——福尔马林
丙酮——重要的有机溶剂
葡萄糖——供给人体能量
一、常见的醛和酮
醛分子:羰基碳原子分别与氢原子和烃基(或氢原子)相连。
官能团是醛基( 或 CHO )。
醛和酮都是分子中含有羰基的化合物。
C H
O
酮分子:与羰基碳原子相连的两个基团均为烃基,烃基可以
相同也可以不同。
官能团是酮羰基( )。
C R’
O
R
命名规则
(1)选取分子中连有醛基或酮羰基的最长碳链作为主链,按照
主链所含碳原子数称为“某醛”或“某酮” 。
(2)从醛基开始或距离酮羰基最近的一端给主链碳原子编号。
(3)在“某醛”或“某酮”之前加上取代基的位次号和名称。
醛、酮的命名
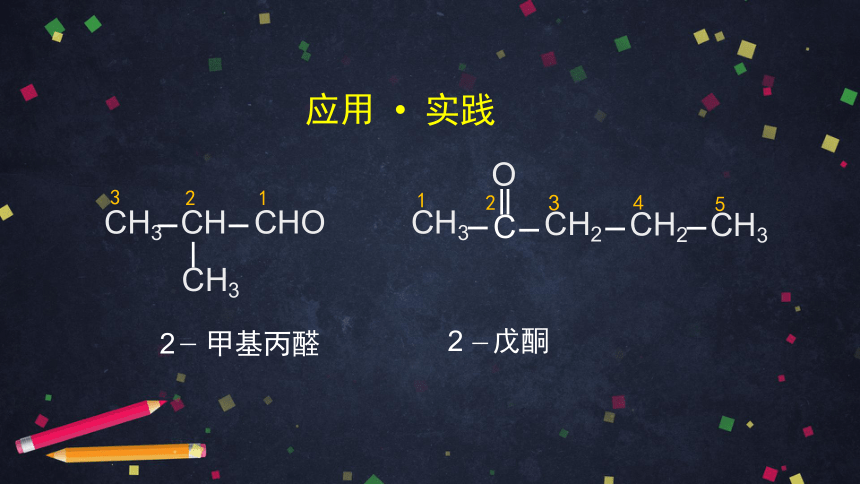
CH3
CH3 CH CHO
CH3
2 甲基丙醛
应用 实践
CH3
2 戊酮
1
2
3
CH2
CH2
C
O
1
2
3
5
4
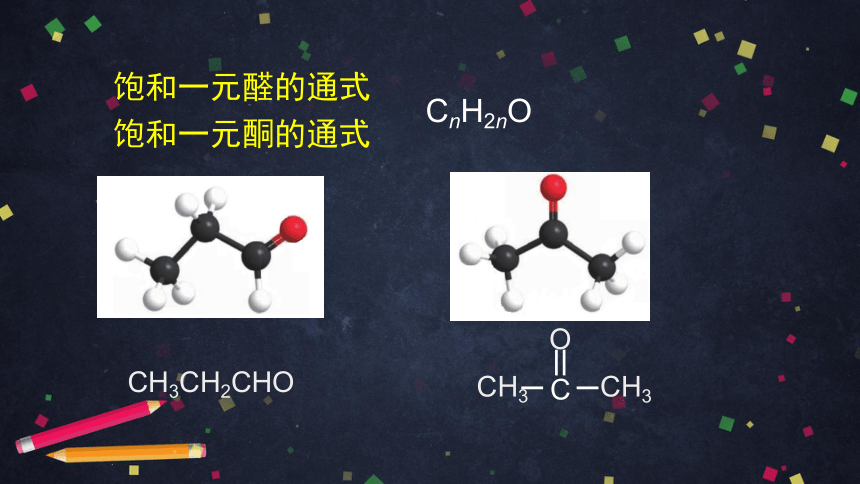
CnH2nO
饱和一元醛的通式
饱和一元酮的通式
CH3CH2CHO
CH3 CH3
C
O
交流 研讨
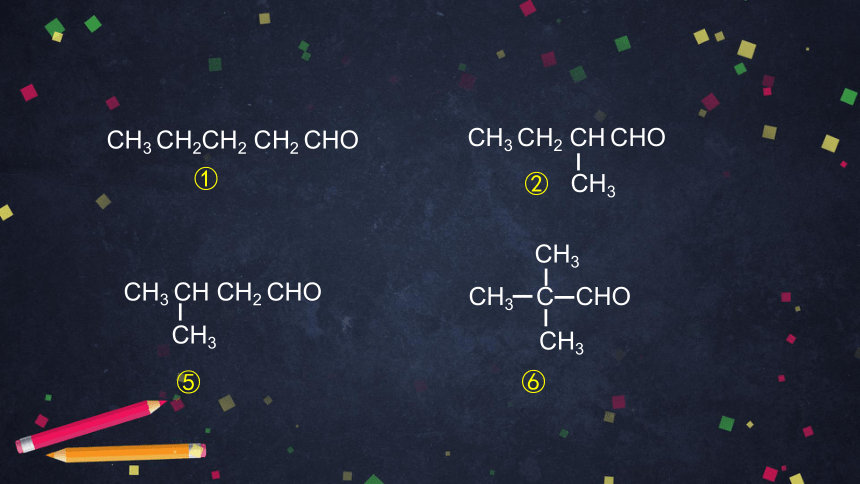
下表列出了分子式为 C5H10O 的醛和酮的部分同分异构体的结构简式,请写出属于醛、酮的其他同分异构体的结构简式,并举例说明这些异构体异构关系的类型。
CH3 CH CH2 CHO
CH3
⑤
⑥
CH3 CH2 CH CHO
CH3
CH3 CH2CH2 CH2 CHO
①
②
CH3 C CHO
CH3
CH3
⑦
CH2 C CH2
CH3
CH3
O
CH3CH2 CH2 C
CH3
O
④
CH3 CH C
CH3
CH3
O
③
CH3 CH CH2 CHO
CH3
CH3 CH C
CH3
CH3
O
⑦
⑤
⑥
⑤ 和 ⑦
CH3 C CHO
CH3
CH3
①和⑤, ⑤和⑥,④和⑦等
⑤和⑦
甲醛是最简单的醛,是无色有强烈刺激性气味的气体,易溶于水。甲醛的水溶液具有杀菌和防腐
性能,可用于消毒和制作生物标本。还可
用于制备酚醛树脂和脲醛树脂。
右图为甲醛的球棍模型:
常见的醛、酮
乙醛球棍模型
最简单的芳香醛—
苯甲醛
无色有刺激性气味液体
CHO
丙酮——最简单的酮
有特殊气味的无色液体,沸点为 56.5 ℃ ,能与水以任意比例互溶,并能溶解多种有机化合物。丙酮不仅是常用的有机溶剂,还是重要的有机合成原料。
身边的化学
R C C H
H
H
O
α
官能团:
是否含不饱和键:
键的极性:
基团之间的相互影响:
分析结构
二、醛、酮的化学性质
交流 研讨
α
分析结构
二、醛、酮的化学性质
交流 研讨
δ-
δ+
醛基
碳氧双键
碳氢单键
均为极性共价键
R C C H
H
H
O
R’
C
O
R
R C C H
H
H
O
酮的化学性质与醛的化学性质有哪些相同点和不同点?
加成反应
二、醛、酮的化学性质
1.羰基的加成反应
醛和酮分子中的羰基含有不饱和键,可以发生加成反应。能与醛、酮中的羰基发生加成反应的试剂有氢氰酸、氨及氨的衍生物、醇类等
H CN
乙醛与氢氰酸( HCN)反应
d
-
d
-
d
+
H C C H
H
H
O
+
H C C H
H
O
CN
H
H
d
+
催化剂
CH3 C H
O
CH3 CH NHR
OH
+
催化剂
NH
H
R
d
+
d
-
乙醛与氨及氨的衍生物( 以 RNH2 为例 )反应
d
+
d
-
H OCH3
乙醛与醇类(以 CH3OH 为例)反应
d
-
d
+
d
-
d
+
C H
O
+
CH3 CH OCH3
OH
催化剂
CH3
这类加成反应在有机合成中可以增长碳链
甲醛为什么有毒?
身边的化学
二、醛、酮的化学性质
2.氧化反应和还原反应
R’
C
O
R
R C C H
H
H
O
C OH
O
CH3 C H
O
CH3
如:
活动 探究
醛的氧化反应
实验用品:
乙醛,0.5% 酸性高锰酸钾溶液, 2% AgNO3溶液, 2% 氨水,10% NaOH 溶液,2% CuSO4 溶液;
试管,烧杯,胶头滴管,酒精灯,三脚架,石棉网,试管夹等。
实验 1:乙醛与银氨溶液反应
银氨溶液的制取
① AgNO3 + NH3·H2O AgOH + NH4NO3
② AgOH + 2 NH3·H2O Ag(NH3)2OH + 2 H2O
氢氧化二氨合银
Ag(NH3)2OH Ag
CH3CHO ?
+1
0
被还原
被氧化
Ag(NH3)2OH Ag
CH3CHO
+1
0
被还原
被氧化
CH3COONH4
△
CH3CHO + 2 Ag(NH3)2OH
CH3COONH4 + 2 Ag ↓ +
3 NH3 + H2O
反应类型:氧化反应
常用于检验醛基
反应名称:银镜反应
实验 2:乙醛与新制氢氧化铜反应
+2
+1
被还原
被氧化
Cu(OH)2 Cu2O
CH3CHO
?
+2
+1
被还原
被氧化
Cu(OH)2 Cu2O
CH3CHO
CH3COONa
CH3CHO + 2 Cu(OH)2 + NaOH
CH3COONa + Cu2O ↓
△
+ 3H2O
反应类型:氧化反应
常用于检验醛基
H 2
+
催化剂
RCH2OH
RCHO
C R’
O
R
+
H 2
RCHOH
R’
还原反应
醛的化学性质
【总结】
R C C H
H
H
O
加成反应
(与 H2 、HCN、氨及氨的衍生物、醇类等)
氧化反应
(酸性 KMnO4 溶液)
( O2,催化剂)
(银氨溶液)
(新制氢氧化铜
悬浊液)
d
+
d
-
酮的化学性质
R C R’
O
d
+
d
-
加成反应
(与 H2 、HCN、氨及氨的衍生物、醇类等)
氧化反应
( 比较稳定,只有很强的氧化剂才能将其氧化)
【总结反思】
R C C H
H
H
O
从结构角度分析有机化合物化学性质的思路
先关注官能团
再分析化学键
关注邻近基团的相互影响
预测分子的反应
活性部位
(键的饱和性、键的极性)
【总结】
反应物
反应类型
试剂
生成物
条件
反应现象
取代反应
加成反应
消去反应
氧化反应
还原反应
认识有机化学反应的角度
