山东省大教育联盟学校2021-2022学年高三下学期2月收心考试(开学考试)化学试题(Word版含解析)
文档属性
| 名称 | 山东省大教育联盟学校2021-2022学年高三下学期2月收心考试(开学考试)化学试题(Word版含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 790.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-21 20:52:43 | ||
图片预览



文档简介
绝密★启用前
大教育山东联盟学校2022届高三收心考试
化学
注意事项
1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H—1 C—12 O—16 Cu—64 Zn—65 Se—79 I—127
一、选择题:本题共10小题,每题2分,共20分。每小题只有一个选项符合题意。
1.我国科技成就日新月异。下列对有关科技成果的解读不正确的是
科技成就 解读
A. 首次采用有机萃取法富集分离7Li丰度>99.99% 7Li的中子数为4
B. 首次揭示硒化钢(InSe)光电子器件应用潜力 硒位于第四周期ⅥA族
C. 开发了多肽、蛋白质和脂类进行生物偶联的新方法 它们都是高分子化合物
D. 首次研发了RuO2/Co球形电催化剂 它能提高某反应速率
2.化学与社会、生产、科技等密切相关,下列说法不正确的是
A.用X射线衍射仪可测定菁蒿素的晶体结构
B.用电解还原法可在铝制品表面形成致密的Al2O3膜
C.用聚四氟乙烯可制造耐腐蚀的设备和仪器
D.用油水分离膜可以从石油和水的混合物中提取石油
3.利用下列装置进行实验,操作规范且能达到实验目的的是
A.利用①除去Cl2中的水蒸气
B.利用②以CCl4萃取碘水中的碘,振荡时打开活塞
C.利用③准确量取一定体积的高锰酸钾标准溶液
D.利用④测定盐酸与氢氧化钠中和反应的反应热
4.R、X、Y、Z、W为原子序数依次增大的短周期主族元素,且Y、Z位于同主族。由R、X、Y、Z组成的有机物M是日用化妆品冷烫精的主要原料,其结构如图所示。下列说法正确的是
A.电负性:Y>Z>R>X B.XZ2、XW4、XR4都是非极性分子
C.简单离子结合质子能力:W>Z D.1molM含7molσ键
5.下列由实验所得结论不正确的是
A.在I2的淀粉溶液中滴加过量的KCN溶液,蓝色不褪去,说明氧化性(CN)2>I2
B.在溴水中滴加丙烯酸溶液,橙色褪去,说明丙烯酸含有碳碳双键
C.在酸性KMnO4溶液中加入过量维生素C溶液,紫色褪去,说明维生素C具有还原性
D.室温下,测得0.1mol·L-1NaX溶液pH大于0.1mol·L-1NaY溶液,说明HY酸性比HX弱
6.各取0.1mol饱和醇X、Y分别与足量钠反应放出H2体积分别为amL,bmL(同温同压下测定)。下列推断正确的是
A.X、Y分子含羟基数之比为a:b B.X、Y的摩尔质量之比为a:b
C.X,Y的质量之比为b:a D.X、Y消耗钠的质量之比为b:a
7.某小组实验探究瓶胆镀银原理,实验操作如下:①先用热纯碱溶液清洗试管,再用蒸馏水洗涤试管;②取适量的AgNO3溶液于试管,滴加过量的氨水得到银氨溶液;③在银氨溶液中加入适量葡萄糖溶液,用酒精灯加热,观察试管壁上光亮的银镜;④用浓氨水清洗试管里的银镜。实验中存在错误有几处
A.1 B.2 C.3 D.5
8.工业上以黄铁矿(主要成分为FeS2)为原料,采用接触法制备浓硫酸的原理如下:
下列说法不正确的是
A.用盐酸和烧碱可从烧渣中提取铁红 B.净化SO2的目的是防催化剂中毒降低活性
C.用水替代98.3%浓硫酸能提高吸收效率 D.制备硫酸的3个反应中2个是氧化还原反应
9.已知:在水中H—O键比H—C键易断裂。下列有关氢氰酸(H—C≡N)、氧氰酸(H—O—C≡N)、硫氰酸(H—S—C≡N)和异硫氰酸(S=C=N—H说法正确的是
A.硫氰酸沸点高于异硫氰酸 B.1mol上述4种酸含π键数相等
C.298K下,Ka(HOCN)≤Ka(HCN) D.上述酸中C、O的杂化类型相同
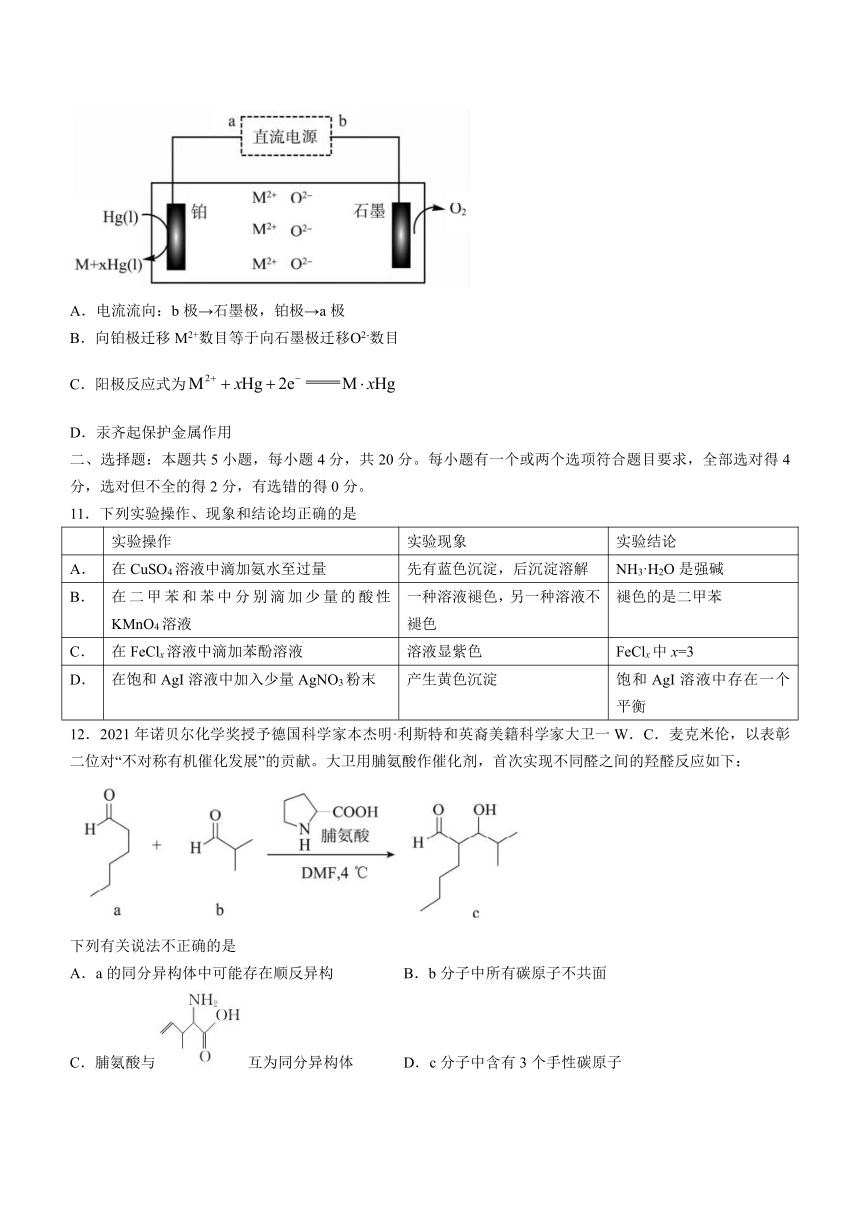
10.1808年戴维电解一种碱土金属氧化物(用MO表示)与汞的混合物,得到汞齐后再蒸去汞,发现了镁、钙、锶、钡。下列说法不正确的是
A.电流流向:b极→石墨极,铂极→a极
B.向铂极迁移M2+数目等于向石墨极迁移О2-数目
C.阳极反应式为
D.汞齐起保护金属作用
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
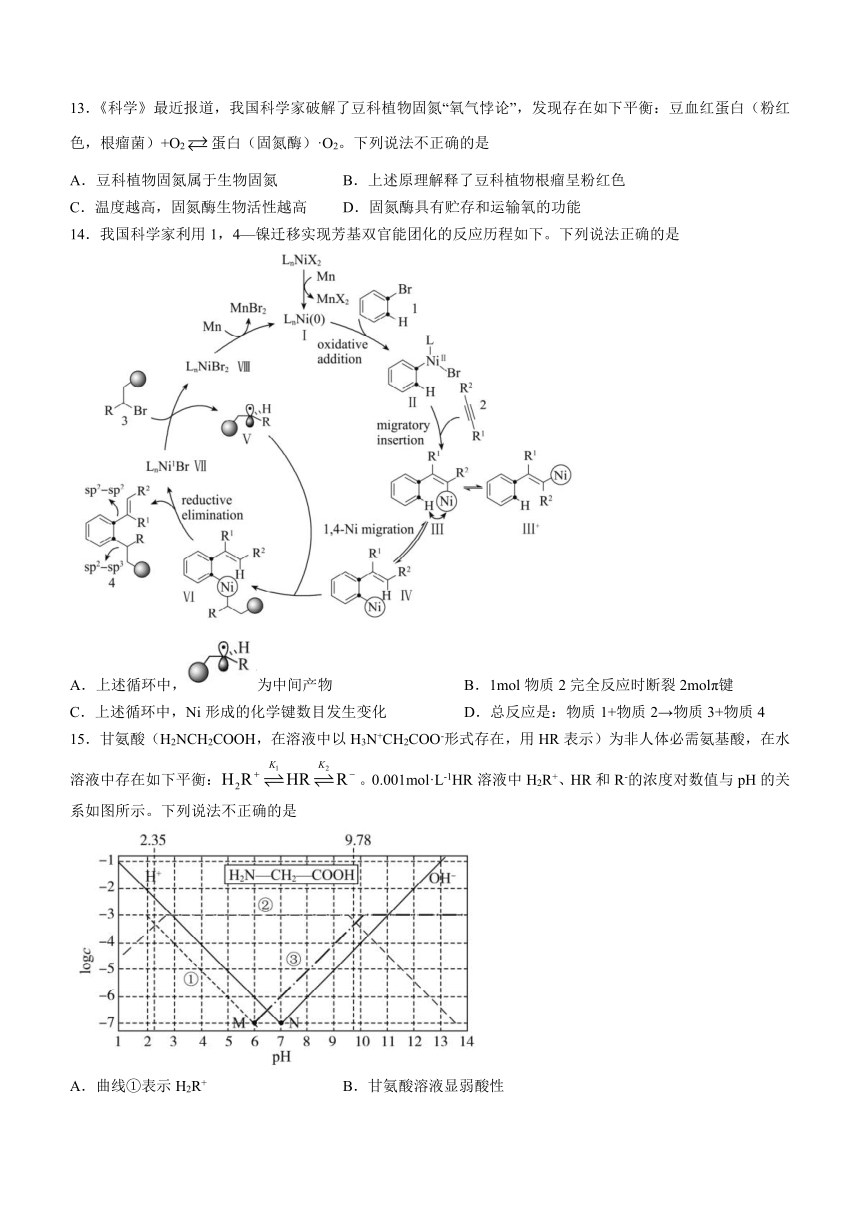
11.下列实验操作、现象和结论均正确的是
实验操作 实验现象 实验结论
A. 在CuSO4溶液中滴加氨水至过量 先有蓝色沉淀,后沉淀溶解 NH3·H2O是强碱
B. 在二甲苯和苯中分别滴加少量的酸性KMnO4溶液 一种溶液褪色,另一种溶液不褪色 褪色的是二甲苯
C. 在FeClx溶液中滴加苯酚溶液 溶液显紫色 FeClx中x=3
D. 在饱和AgI溶液中加入少量AgNO3粉末 产生黄色沉淀 饱和AgI溶液中存在一个平衡
12.2021年诺贝尔化学奖授予德国科学家本杰明·利斯特和英裔美籍科学家大卫一W.C.麦克米伦,以表彰二位对“不对称有机催化发展”的贡献。大卫用脯氨酸作催化剂,首次实现不同醛之间的羟醛反应如下:
下列有关说法不正确的是
A.a的同分异构体中可能存在顺反异构 B.b分子中所有碳原子不共面
C.脯氨酸与互为同分异构体 D.c分子中含有3个手性碳原子
13.《科学》最近报道,我国科学家破解了豆科植物固氮“氧气悖论”,发现存在如下平衡:豆血红蛋白(粉红色,根瘤菌)+O2蛋白(固氮酶)·O2。下列说法不正确的是
A.豆科植物固氮属于生物固氮 B.上述原理解释了豆科植物根瘤呈粉红色
C.温度越高,固氮酶生物活性越高 D.固氮酶具有贮存和运输氧的功能
14.我国科学家利用1,4—镍迁移实现芳基双官能团化的反应历程如下。下列说法正确的是
A.上述循环中,为中间产物 B.1mol物质2完全反应时断裂2molπ键
C.上述循环中,Ni形成的化学键数目发生变化 D.总反应是:物质1+物质2→物质3+物质4
15.甘氨酸(H2NCH2COOH,在溶液中以H3N+CH2COO-形式存在,用HR表示)为非人体必需氨基酸,在水溶液中存在如下平衡:。0.001mol·L-1HR溶液中H2R+、HR和R-的浓度对数值与pH的关系如图所示。下列说法不正确的是
A.曲线①表示H2R+ B.甘氨酸溶液显弱酸性
C.M点, D.NaR溶液中
三、非选择题:本题共5小题,共60分。
16.(12分)我国科学家最近开发了柔性热电材料β—硒化银(β—Ag2Se),其功能与半导体材料硫化铋(Bi2Te3)媲美。氧、硫、硒、碲位于同主族,原子序数依次增大。
请回答下列问题:
(1)基态硒原子的价层电子排布式为___________。铋与砷位于同主族,基态铋原子有____________个未成对电子。
(2)简单气态氢化物H2O、H2S、H2Se、H2Te中,稳定性依次减弱,其主要原因是其沸点最低的是__________(填化学式)。
(3)我国科学家利用亚硒酸盐和硫酸盐追踪固氮酶取得新进展。SeO32-的空间构型是____________,TeO42-中Te的杂化类型是___________。
(4)三氧化硒(SeO3)的熔点为165℃,在126℃时升华。SeO3的晶体类型是___________。
(5)半导体材料硒化锌的晶胞如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在ZnSe晶胞坐标系中,A点硒原子坐标为,B点锌原子坐标为,则C点锌原子坐标为___________。已知面心上硒与顶点硒之间距离为anm,代表阿伏加德罗常数的值。硒化锌晶体密度为___________g·cm-3。
17.(12分)我国科学家以ZrO2、Al2O3、TiO2和活性炭为载体合成具有低温活性的钨酸盐催化剂。以天然锆英石(主要成分是ZrSiO4,含少量FeO、Al2O3、CuO,SiO2等杂质)为原料制备ZrO2的流程如下(部分条件和产物省略):
请回答下列问题:
(1)锆单质晶体有最密面心立方、体心立方两种,如图所示。图1、图2晶胞中错原子配位数之比为___________。
(2)“粉碎过筛”的目的是____________________________________________。
(3)滤渣1的主要成分是___________(填化学式);实验室完成操作A时,装Zr(OH)4的仪器名称为___________。
(4)室温下,。为了使,溶液范围为___________。
(5)利用滤渣2可以制备铁红,其操作过程是:将滤渣2溶于过量的烧碱溶液,经过___________(填操作名称)、洗涤、灼烧得到纯铁红。
(6)滤液1中CN-经处理达标后才能排放,常用电化学法处理,装置如图所示。
处理CN-的离子方程式为__________。石墨(1)上产生4.48L气体(标准状况),理论上通过交换膜的主要离子的物质的量及符号为___________离子。
18.(12分)碘化亚铜(CuI)是重要的有机催化剂,白色固体,难溶于水和乙醇。以含少量铁的废铜为原料制备CuI的流程如下:
(1)“酸浸”中O2的作用是___________;“还原”反应的离子方程式为____________。
(2)“还原”反应的实验装置如图1所示。
①仪器D的名称是___________。装置A中___________(填“能”或“不能”)用98.3%硫酸替换75%硫酸。
②实验完毕后,用图2所示装置分离CuI的突出优点是______________________。
(3)设计下表方案探究CuI的性质。
实验 实验操作及现象
Ⅰ 取少量CuI于试管,加入NaOH溶液,振荡;产生砖红色沉淀;上层清液中滴加淀粉溶液,无明显变化。取砖红色固体溶于稀硫酸,产生红色固体和蓝色溶液
Ⅱ 取少量CuI于试管,加入KI溶液,白色固体溶解得到无色溶液;加水,又生成白色沉淀
①根据实验Ⅰ,CuI与NaOH溶液反应的化学方程式为___________。
②根据实验Ⅱ,CuI溶于KI溶液可能生成___________(填化学式)。
(4)测定CuI样品纯度。取wgCuI样品溶于适量NaOH溶液,充分反应后,过滤;在滤液中加入足量酸化的双氧水,滴几滴淀粉溶液,用标准溶液滴定至终点,消耗Na2S2O3溶液体积为VmL(已知:滴定反应为)。该样品纯度为___________(用含w、c、V的代数式表示)。如果其他操作均正确,仅滴定管没有用待装液润洗,测得结果___________(填“偏高”“偏低”或“无影响”)。
19.(12分)G是合成某药物的中间体,一种合成路线如下:
已知:
①;②
请回答下列问题:
(1)E中含官能团有羟基、醚键和___________;B的名称是___________。
(2)B→C的反应类型是___________,在核磁共振氢谱上C有___________组峰(填数字)。
(3)F→G的化学方程式为______________________。
(4)在E的同分异构体中,符合下列条件的有机物有___________种(不考虑立体异构体)。
①遇氯化铁溶液发生显色反应;②能发生银镜反应和水解反应;③苯环上有3个取代基
(5)以苯甲醇为原料合成某药物中间体,设计合成路线___________(无机试剂自选)。
20.(12分)化学链燃烧(CLC)是利用载氧体将空气中的氧传输至燃料的新技术。基于CuO/Cu2O载氧体的丙烷化学链燃烧技术示息图如下。
空气反应器与燃料反应器中发生的反应分别为:
反应1:
反应2:
请回答下列问题:
(1)反应 __________(用、表示)。
(2)氧的质量分数:载氧体I__________载氧体Ⅱ(填“>”“=”或“<”)。
(3)一定温度下,在容积可变的密闭容器中充入足量Cu2O(s)和适量的O2发生反应1,达到平衡时测得气体压强为akPa。
①温度不变,将体积扩大至原来的2倍且不再改变,达到新平衡时气体压强________kPa。
②当Cu2O的质量不变时,__________(填“能”或“不能”)说明该反应达到平衡状态。
③若达到平衡之后,保持恒温恒容条件下再充入少量O2,平衡__________(填“向正反应方向”“向逆反应方向”或“不”)移动,达到新平衡之后,O2的平衡转化率__________(填“增大”“减小”或“不变”)。
(4)在一定温度下,总压强恒定为68kPa,在密闭容器中充入丙烷和氮气的混合气体以及足量CuО(s),只发生上述反应2(氮气不参与反应),测得丙烷的平衡转化率与投料比的关系如图所示,
①随着投料比增大,C3H8的平衡转化率减小的原因是____________________。
②在上述温度下,平衡常数____________(以分压表示,列出计算式,不带单位。分压=总压×物质的量分数)。
大教育山东联盟学校2022届高三收心考试
化学参考答案及解析
一、选择题:本题共10小题,每题2分,共20分。每小题只有一个选项符合题意。
1.【答案】C
【解析】7Li的质量数为7,质子数为3,中子数为4,A正确;在周期表中硒在硫正下方,与硫同主族,B正确;脂类包括油和脂,它们都属于酯类,属于小分子,C错误;催化剂降低反应活化能,提高某反应的速率,D正确。
2.【答案】B
【解析】X射线衍射仪可以测定晶体结构,A正确;用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,B错误;聚四氟乙烯具有耐高温、耐腐蚀性,可以做化学仪器,C正确;油水分离膜可以分离所有的油类(如植物油、矿物油等)与水,具有超亲水性,超疏油性,D正确。
3.【答案】D
【解析】图①不可用于除去Cl2中的水蒸气,因为浓硫酸是液体,Cl2无法通过,而且U形管不能盛装液体干燥剂,A错误;萃取时振荡操作,右手压住分液漏斗口部,左手握住活塞,把分液漏斗倒转振荡,使两种液体充分接触,应避免分液漏斗内压强过大,振荡后,应打开活塞放气,但振荡过程中不能打开活塞,B错误;高锰酸钾标准溶液具有强氧化性,会腐蚀碱式滴定管下端的乳胶管,应盛放在酸式滴定管中,C错误;测定中和热实验中温度计用于测定溶液温度,并且大烧杯杯口与小烧杯杯口相平,空隙需用碎泡沫填充,防止热量散失,故D能达到实验目的。
4.【答案】B
【解析】依题意,Y和Z位于同主族,Y原子能形成1个双键,Z原子形成2个单键,说明Z原子最外层有6个电子,Y为氧,Z为硫。X原子能形成2个单键、1个双键(或4个单键),说明X原子最外层有4个电子,原子序数小于8,故X为碳。R原子形成1个单键,上述五种元素中R的原子序数最小,R为氢;W为短周期主族元素且原子序数大于16,故W为氯。氧、硫、碳、氢的电负性依次减小,A错误;CS2是直线形分子,CH4,CCl4分子都是正四面体形分子,它们都是非极性分子,B正确;结合质子能力越强,形成的酸越弱,酸性:HCl>H2S,结合质子(H+)能力:S2->Cl-,C错误;单键都是g键,双键中有1个σ键,1个M分子含8个σ键,D错误。
5.【答案】D
【解析】碘单质不能与KCN反应,说明(CN)2的氧化性大于I2,A正确;丙烯酸含有碳碳双键和羧基,溴水褪色,说明丙烯酸含有碳碳双键,B正确;维生素C与高锰酸钾发生氧化还原反应,维生素C表现还原性,C正确;根据盐类水解规律,相同条件下,越弱越易水解,故HY的酸性比HX的强,D错误。
6.【答案】A
【解析】依题意,X、Y的物质的量相等,产生H2的量与羟基数目有关,与摩尔质量无关,故A正确,B错误;等物质的量条件下,质量与摩尔质量成正比例,摩尔质量不确定,质量不确定,C错误;消耗钠的质量与产生氢气的物质的量成正比例,X、Y消耗钠的质量之比为a:b,D错误。
7.【答案】C
【解析】操作②配制银氨溶液时,滴加氨水至浊液刚好变澄清时即得到银氨溶液。要防止加入过量的氨水,否则有可能生成雷酸银,雷酸银在受热或撞击时有爆炸的危险,同时银氨溶液本身也将失去灵敏性;操作③中用水浴加热;操作④中用稀硝酸溶解银镜,氨水不能溶解银,共3处错误。
8.【答案】C
【解析】用盐酸溶解烧渣,可除去二氧化硅;再用氢氧化钠可分离铝元素和铁元素,灼烧氢氧化铁制铁红,A正确;二氧化硫中有砷等杂质会使催化剂中毒(降低活性),B正确;三氧化硫与水反应放出大量热量,用水直接吸收三氧化硫会形成“酸雾”,污染环境且吸收率低,C错误;黄铁矿(FeS2)与O2反应SO2和O2反应是氧化还原反应,D正确。
9.【答案】B
【解析】异硫氰酸含N—H键,分子间能形成氢键,沸点高于硫氰酸,A错误;1个三键含2个π键、1个双键含1个π键,所以1个上述酸分子含2个π键,B正确;H—О键比H—C键易断裂,故HOCN的酸性比HCN的强,Ka(HOCN)>Ka(HCN),C错误;上述分子中,C原子采用sp杂化,O原子采用sp3杂化,D错误。
10.【答案】C
【解析】由图示分析可知:铂电极为阴极,石墨电极为阳极,电流由正极流出,经阳极;阴极流向负极,A正确;MO中阴、阳离子带电荷数相等,通电时向两极迁移的阴,阳离子数目相等,B正确;阳极反应式为,阴离子反应式为,C错误;镁、钙、锶,钡等活泼金属容易与空气中氧气反应,液态汞包裹金属,避免活泼金属在高温下被氧化,D正确。
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.【答案】BC
【解析】一水合氨是弱碱,氢氧化铜溶于氨水形成四氨合铜离子,A错误;二甲苯与酸性高锰酸钾溶液反应,B正确;铁离子与苯酚形成配合物,C正确;碘化银溶液中存在沉淀溶解平衡,还有水的电离平衡,故存在2个平衡,D错误。
12.【答案】CD
【解析】a的同分异构体中如,等存在顺反异构,故A正确;b分子中有一个碳原子与其他3个碳原子不共面,故B正确;C.比脯氨酸多一个碳原子和2个氢原子,不是同分异构体,故C错误;D.c分子中含有2个手性碳原子,故D错误。
13.【答案】C
【解析】固氮分人工固氮、自然固氮,自然固氮又有雷雨固氮和生物固氮,豆科植物固氮属于生物固氮,A正确;豆血红蛋白呈粉红色,所以,根瘤菌呈粉红色,B正确;固氮酶属于蛋白质,在高温下固氮酶会失去活性,酶催化活性需要适当的温度,C错误;缺氧时,平衡向逆反应方向移动,固氮酶释放氧气,富氧条件下,平衡向正反应方向移动,固氮酶贮存氧气,D正确。
14.【答案】AC
【解析】观察图示,上述循环中,为中间产物,A正确;物质2分子只断裂1个π键,B错误;镍原子形成化学键数目有1、2、3等,C正确;物质1、2、3是反应物,物质4是产物,D错误。
15.【答案】D
【解析】由图像分析可知:曲线①②3分别代表、HR,,A正确;由知,M点,,pH=6,说明甘氨酸溶液显弱酸性,B正确;由于,,则,M点,,,C正确;NaR溶液中由质子守恒可知,,D错误。
三、非选择题:本题共5小题,共60分。
16.【答案】(1)4s24p4(1分)3(1分)
(2)O、S、Se、Te的原子半径依次增大,与H形成的共价键键长增大,键能减小(2分)H2S(1分)
(3)三角锥形(1分)sp3(1分)
(4)分子晶体(2分)
(5)(1分)(2分)
【解析】(1)硒是34号元素,基态硒原子的价层电子排布式为4s24p4。Bi与N位于同主族,它们的未成对电子数为3。(2)气态氢化物的稳定性与键能有关,而键能与原子半径有关。氧、硫、硒、确的原子半径依次增大,与氢形成共价键的键能依次减小,故稳定性依次减弱。H2О分子之间形成氢键,沸点比H2S高,H2S、H2Se、H2Te范德华力逐渐增大,沸点逐渐升高,故H,S沸点最低。(3)SeO32-中硒原子价层有4个电子对,其中1个孤电子对,3个成键电子对,空间构型为三角锥形。TeO42-中确的价层有4个电子对,采用sp3杂化。(4)三氧化硒的熔点较低,易升华,说明粒子之间作用力小,它是分子晶体。(5)根据A点、B点原子坐标,C点原子坐标:x=1/4,y=3/4,z=1/4。硒化锌晶胞中含4个锌、4个硒。硒在晶胞中面心立方分布,面对角线上三个硒相切,晶胞参数为,由密度公式知,。
17.【答案】(1)3:2(2分)
(2)增大固体接触面,提高反应速率(1分)
(3)H2SiO3(1分)坩埚(1分)
(4)(2分)
(5)过滤(1分)
(6)(2分)0.4molOH-(2分)
【解析】(1)图1是面心立方晶胞,配位数为12;图2是体心立方晶胞,配位数为8。(2)固体反应速率与接触面有关,粉碎过筛的目的是增大固体接触面,加快反应。(3)二氧化硅在碱熔时转化成硅酸钠,酸浸过程中转化成硅酸。操作A为灼烧,装固体的仪器是坩埚。(4)根据溶度积计算,。(5)氢氧化铁不溶氢氧化钠溶液,氢氧化铝与氢氧化钠溶液反应,过滤,得到氢氧化铁。(6)观察图示知,在碱性条件下,次氯酸根离子氧化氰根离子生成氮气和碳酸根离子,本身被还原成氯离子。石墨(1)的电极反应式为,,向阳极区迁移0.4molOH-离子。
18.【答案】(1)氧化Fe2+中和Cu(1分)
(2分)
(2)①恒压滴液漏斗(1分)不能(1分)②过滤速率快(1分)
(3)①(2分)或KCuI2(1分)
(4)(2分)偏高(1分)
【解析】(1)铜不和硫酸反应,氧气作用是氧化亚铁离子和铜单质。,加入CuO调节溶液pH,促进Fe3+转化成。(2)硫酸铜作氧化剂,SO2作还原剂生成碘化亚铜和硫酸,反应离子方程式为。(3)①仪器D为滴液恒压漏斗,便于硫酸铜溶液顺利下滴。制备SO2中硫酸表现酸的作用,如果用浓硫酸,酸性表现不充分,不能很好的产生气体。②减压过滤,过滤速率较快,避免产品长时间与空气接触而被氧化。(4)①根据实验Ⅰ,碘化亚铜与氢氧化钠反应发生非氧化还原反应,生成红色沉淀Cu2O,Cu2O溶于稀硫酸生成硫酸铜、铜:。所以,CuI和NaOH反应方程式为。②根据实验Ⅱ,碘化亚铜溶于KI溶液形成配合物,存在平衡:。
(4)由关系式得,,。
没有用待装液润洗滴定管,消耗滴定液体积偏大,结果偏高。
19.【答案】(⑴醛基(1分)1,3—苯二酚(或间苯二酚或间二苯酚)(2分)
(2)取代反应(1分)4(1分)
(3)(2分)
(4)10(2分)
(5)(3分)
【解析】(1)E中含有官能团除羟基、醚键外,还有醛基。A在稀硫酸中水解生成间苯二酚。
(2)B→C是B中羟基上氢被甲基取代。有机物C具有对称结构,C分子有4种氢原子,在核磁共振氢谱上有4组峰。(3)根据已知信息,结合F的结构简式知,G为,副产物为HI。(4)依题意,同分异构体的苯环上有三个取代基:甲基、羟基、甲酸酯基,共有10种结构。(5)依题意,在苯环侧链上引入—CN,设计合成路线如下:
20.(12分【答案】(1)(2分)
(2)>(1分)
(3)①a(2分)②能(1分)③向正反应方向(1分)增大(1分)
(4)①由于总压恒定,随着投料比增大,N2分压减小,C3H8分压增大,相当于增大可逆反应平衡体系压强,平衡向逆方向移动(2分,其他答案合理即可给分)
②(2分)
【解析】(1)根据盖斯定律,反应1×5+反应2得目标反应。
(2)由图可知:载氧体Ⅰ是把空气中的氧气转移到燃料反应器,载氧体Ⅱ是氧气和丙烷发生反应释放出水和二氧化碳,所以氧的质量分数:载氧体I≥载氧体II。
(3)①反应1的特点是只有氧气是气体,温度不变,平衡常数不变,故平衡时O2的压强不变。。②反应体系中,随着反应进行,Cu2O的质量逐渐减小,不变时达到平衡状态。③恒温恒容条件下,平衡后再充入氧气,氧气浓度增大,平衡向正反应方向移动。达到新平衡时О2浓度不变,故消耗О2增大,O2平衡转化率增大。例如,开始投入1molO2,平衡时О2为0.5mol,氧气平衡转化率为50%;温度不变,再充入1molO2,平衡时仍然有0.5molO2,O2平衡转化率为75%。也可以用构造法分析,再充入氧气,相当于增大原平衡压强(缩小体积),平衡向正反应方向移动,氧气的平衡转化率增大。
(4)①从分压角度分析,由于总压恒定,随着投料比增大,N2占分压减小,可逆反应中各物质占总压强增大,平衡向逆方向移动,故C3H8的平衡转化率减小。
②设起始投入丙烷、氮气各1mol,用M点数据计算平衡常数:
起始物质的量/mol: 1.0 0 0
变化物质的量/mol: 0.8 2.4 3.2
平衡物质的量/mol: 0.2 2.4 3.2
。
,。。
大教育山东联盟学校2022届高三收心考试
化学
注意事项
1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H—1 C—12 O—16 Cu—64 Zn—65 Se—79 I—127
一、选择题:本题共10小题,每题2分,共20分。每小题只有一个选项符合题意。
1.我国科技成就日新月异。下列对有关科技成果的解读不正确的是
科技成就 解读
A. 首次采用有机萃取法富集分离7Li丰度>99.99% 7Li的中子数为4
B. 首次揭示硒化钢(InSe)光电子器件应用潜力 硒位于第四周期ⅥA族
C. 开发了多肽、蛋白质和脂类进行生物偶联的新方法 它们都是高分子化合物
D. 首次研发了RuO2/Co球形电催化剂 它能提高某反应速率
2.化学与社会、生产、科技等密切相关,下列说法不正确的是
A.用X射线衍射仪可测定菁蒿素的晶体结构
B.用电解还原法可在铝制品表面形成致密的Al2O3膜
C.用聚四氟乙烯可制造耐腐蚀的设备和仪器
D.用油水分离膜可以从石油和水的混合物中提取石油
3.利用下列装置进行实验,操作规范且能达到实验目的的是
A.利用①除去Cl2中的水蒸气
B.利用②以CCl4萃取碘水中的碘,振荡时打开活塞
C.利用③准确量取一定体积的高锰酸钾标准溶液
D.利用④测定盐酸与氢氧化钠中和反应的反应热
4.R、X、Y、Z、W为原子序数依次增大的短周期主族元素,且Y、Z位于同主族。由R、X、Y、Z组成的有机物M是日用化妆品冷烫精的主要原料,其结构如图所示。下列说法正确的是
A.电负性:Y>Z>R>X B.XZ2、XW4、XR4都是非极性分子
C.简单离子结合质子能力:W>Z D.1molM含7molσ键
5.下列由实验所得结论不正确的是
A.在I2的淀粉溶液中滴加过量的KCN溶液,蓝色不褪去,说明氧化性(CN)2>I2
B.在溴水中滴加丙烯酸溶液,橙色褪去,说明丙烯酸含有碳碳双键
C.在酸性KMnO4溶液中加入过量维生素C溶液,紫色褪去,说明维生素C具有还原性
D.室温下,测得0.1mol·L-1NaX溶液pH大于0.1mol·L-1NaY溶液,说明HY酸性比HX弱
6.各取0.1mol饱和醇X、Y分别与足量钠反应放出H2体积分别为amL,bmL(同温同压下测定)。下列推断正确的是
A.X、Y分子含羟基数之比为a:b B.X、Y的摩尔质量之比为a:b
C.X,Y的质量之比为b:a D.X、Y消耗钠的质量之比为b:a
7.某小组实验探究瓶胆镀银原理,实验操作如下:①先用热纯碱溶液清洗试管,再用蒸馏水洗涤试管;②取适量的AgNO3溶液于试管,滴加过量的氨水得到银氨溶液;③在银氨溶液中加入适量葡萄糖溶液,用酒精灯加热,观察试管壁上光亮的银镜;④用浓氨水清洗试管里的银镜。实验中存在错误有几处
A.1 B.2 C.3 D.5
8.工业上以黄铁矿(主要成分为FeS2)为原料,采用接触法制备浓硫酸的原理如下:
下列说法不正确的是
A.用盐酸和烧碱可从烧渣中提取铁红 B.净化SO2的目的是防催化剂中毒降低活性
C.用水替代98.3%浓硫酸能提高吸收效率 D.制备硫酸的3个反应中2个是氧化还原反应
9.已知:在水中H—O键比H—C键易断裂。下列有关氢氰酸(H—C≡N)、氧氰酸(H—O—C≡N)、硫氰酸(H—S—C≡N)和异硫氰酸(S=C=N—H说法正确的是
A.硫氰酸沸点高于异硫氰酸 B.1mol上述4种酸含π键数相等
C.298K下,Ka(HOCN)≤Ka(HCN) D.上述酸中C、O的杂化类型相同
10.1808年戴维电解一种碱土金属氧化物(用MO表示)与汞的混合物,得到汞齐后再蒸去汞,发现了镁、钙、锶、钡。下列说法不正确的是
A.电流流向:b极→石墨极,铂极→a极
B.向铂极迁移M2+数目等于向石墨极迁移О2-数目
C.阳极反应式为
D.汞齐起保护金属作用
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.下列实验操作、现象和结论均正确的是
实验操作 实验现象 实验结论
A. 在CuSO4溶液中滴加氨水至过量 先有蓝色沉淀,后沉淀溶解 NH3·H2O是强碱
B. 在二甲苯和苯中分别滴加少量的酸性KMnO4溶液 一种溶液褪色,另一种溶液不褪色 褪色的是二甲苯
C. 在FeClx溶液中滴加苯酚溶液 溶液显紫色 FeClx中x=3
D. 在饱和AgI溶液中加入少量AgNO3粉末 产生黄色沉淀 饱和AgI溶液中存在一个平衡
12.2021年诺贝尔化学奖授予德国科学家本杰明·利斯特和英裔美籍科学家大卫一W.C.麦克米伦,以表彰二位对“不对称有机催化发展”的贡献。大卫用脯氨酸作催化剂,首次实现不同醛之间的羟醛反应如下:
下列有关说法不正确的是
A.a的同分异构体中可能存在顺反异构 B.b分子中所有碳原子不共面
C.脯氨酸与互为同分异构体 D.c分子中含有3个手性碳原子
13.《科学》最近报道,我国科学家破解了豆科植物固氮“氧气悖论”,发现存在如下平衡:豆血红蛋白(粉红色,根瘤菌)+O2蛋白(固氮酶)·O2。下列说法不正确的是
A.豆科植物固氮属于生物固氮 B.上述原理解释了豆科植物根瘤呈粉红色
C.温度越高,固氮酶生物活性越高 D.固氮酶具有贮存和运输氧的功能
14.我国科学家利用1,4—镍迁移实现芳基双官能团化的反应历程如下。下列说法正确的是
A.上述循环中,为中间产物 B.1mol物质2完全反应时断裂2molπ键
C.上述循环中,Ni形成的化学键数目发生变化 D.总反应是:物质1+物质2→物质3+物质4
15.甘氨酸(H2NCH2COOH,在溶液中以H3N+CH2COO-形式存在,用HR表示)为非人体必需氨基酸,在水溶液中存在如下平衡:。0.001mol·L-1HR溶液中H2R+、HR和R-的浓度对数值与pH的关系如图所示。下列说法不正确的是
A.曲线①表示H2R+ B.甘氨酸溶液显弱酸性
C.M点, D.NaR溶液中
三、非选择题:本题共5小题,共60分。
16.(12分)我国科学家最近开发了柔性热电材料β—硒化银(β—Ag2Se),其功能与半导体材料硫化铋(Bi2Te3)媲美。氧、硫、硒、碲位于同主族,原子序数依次增大。
请回答下列问题:
(1)基态硒原子的价层电子排布式为___________。铋与砷位于同主族,基态铋原子有____________个未成对电子。
(2)简单气态氢化物H2O、H2S、H2Se、H2Te中,稳定性依次减弱,其主要原因是其沸点最低的是__________(填化学式)。
(3)我国科学家利用亚硒酸盐和硫酸盐追踪固氮酶取得新进展。SeO32-的空间构型是____________,TeO42-中Te的杂化类型是___________。
(4)三氧化硒(SeO3)的熔点为165℃,在126℃时升华。SeO3的晶体类型是___________。
(5)半导体材料硒化锌的晶胞如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在ZnSe晶胞坐标系中,A点硒原子坐标为,B点锌原子坐标为,则C点锌原子坐标为___________。已知面心上硒与顶点硒之间距离为anm,代表阿伏加德罗常数的值。硒化锌晶体密度为___________g·cm-3。
17.(12分)我国科学家以ZrO2、Al2O3、TiO2和活性炭为载体合成具有低温活性的钨酸盐催化剂。以天然锆英石(主要成分是ZrSiO4,含少量FeO、Al2O3、CuO,SiO2等杂质)为原料制备ZrO2的流程如下(部分条件和产物省略):
请回答下列问题:
(1)锆单质晶体有最密面心立方、体心立方两种,如图所示。图1、图2晶胞中错原子配位数之比为___________。
(2)“粉碎过筛”的目的是____________________________________________。
(3)滤渣1的主要成分是___________(填化学式);实验室完成操作A时,装Zr(OH)4的仪器名称为___________。
(4)室温下,。为了使,溶液范围为___________。
(5)利用滤渣2可以制备铁红,其操作过程是:将滤渣2溶于过量的烧碱溶液,经过___________(填操作名称)、洗涤、灼烧得到纯铁红。
(6)滤液1中CN-经处理达标后才能排放,常用电化学法处理,装置如图所示。
处理CN-的离子方程式为__________。石墨(1)上产生4.48L气体(标准状况),理论上通过交换膜的主要离子的物质的量及符号为___________离子。
18.(12分)碘化亚铜(CuI)是重要的有机催化剂,白色固体,难溶于水和乙醇。以含少量铁的废铜为原料制备CuI的流程如下:
(1)“酸浸”中O2的作用是___________;“还原”反应的离子方程式为____________。
(2)“还原”反应的实验装置如图1所示。
①仪器D的名称是___________。装置A中___________(填“能”或“不能”)用98.3%硫酸替换75%硫酸。
②实验完毕后,用图2所示装置分离CuI的突出优点是______________________。
(3)设计下表方案探究CuI的性质。
实验 实验操作及现象
Ⅰ 取少量CuI于试管,加入NaOH溶液,振荡;产生砖红色沉淀;上层清液中滴加淀粉溶液,无明显变化。取砖红色固体溶于稀硫酸,产生红色固体和蓝色溶液
Ⅱ 取少量CuI于试管,加入KI溶液,白色固体溶解得到无色溶液;加水,又生成白色沉淀
①根据实验Ⅰ,CuI与NaOH溶液反应的化学方程式为___________。
②根据实验Ⅱ,CuI溶于KI溶液可能生成___________(填化学式)。
(4)测定CuI样品纯度。取wgCuI样品溶于适量NaOH溶液,充分反应后,过滤;在滤液中加入足量酸化的双氧水,滴几滴淀粉溶液,用标准溶液滴定至终点,消耗Na2S2O3溶液体积为VmL(已知:滴定反应为)。该样品纯度为___________(用含w、c、V的代数式表示)。如果其他操作均正确,仅滴定管没有用待装液润洗,测得结果___________(填“偏高”“偏低”或“无影响”)。
19.(12分)G是合成某药物的中间体,一种合成路线如下:
已知:
①;②
请回答下列问题:
(1)E中含官能团有羟基、醚键和___________;B的名称是___________。
(2)B→C的反应类型是___________,在核磁共振氢谱上C有___________组峰(填数字)。
(3)F→G的化学方程式为______________________。
(4)在E的同分异构体中,符合下列条件的有机物有___________种(不考虑立体异构体)。
①遇氯化铁溶液发生显色反应;②能发生银镜反应和水解反应;③苯环上有3个取代基
(5)以苯甲醇为原料合成某药物中间体,设计合成路线___________(无机试剂自选)。
20.(12分)化学链燃烧(CLC)是利用载氧体将空气中的氧传输至燃料的新技术。基于CuO/Cu2O载氧体的丙烷化学链燃烧技术示息图如下。
空气反应器与燃料反应器中发生的反应分别为:
反应1:
反应2:
请回答下列问题:
(1)反应 __________(用、表示)。
(2)氧的质量分数:载氧体I__________载氧体Ⅱ(填“>”“=”或“<”)。
(3)一定温度下,在容积可变的密闭容器中充入足量Cu2O(s)和适量的O2发生反应1,达到平衡时测得气体压强为akPa。
①温度不变,将体积扩大至原来的2倍且不再改变,达到新平衡时气体压强________kPa。
②当Cu2O的质量不变时,__________(填“能”或“不能”)说明该反应达到平衡状态。
③若达到平衡之后,保持恒温恒容条件下再充入少量O2,平衡__________(填“向正反应方向”“向逆反应方向”或“不”)移动,达到新平衡之后,O2的平衡转化率__________(填“增大”“减小”或“不变”)。
(4)在一定温度下,总压强恒定为68kPa,在密闭容器中充入丙烷和氮气的混合气体以及足量CuО(s),只发生上述反应2(氮气不参与反应),测得丙烷的平衡转化率与投料比的关系如图所示,
①随着投料比增大,C3H8的平衡转化率减小的原因是____________________。
②在上述温度下,平衡常数____________(以分压表示,列出计算式,不带单位。分压=总压×物质的量分数)。
大教育山东联盟学校2022届高三收心考试
化学参考答案及解析
一、选择题:本题共10小题,每题2分,共20分。每小题只有一个选项符合题意。
1.【答案】C
【解析】7Li的质量数为7,质子数为3,中子数为4,A正确;在周期表中硒在硫正下方,与硫同主族,B正确;脂类包括油和脂,它们都属于酯类,属于小分子,C错误;催化剂降低反应活化能,提高某反应的速率,D正确。
2.【答案】B
【解析】X射线衍射仪可以测定晶体结构,A正确;用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,B错误;聚四氟乙烯具有耐高温、耐腐蚀性,可以做化学仪器,C正确;油水分离膜可以分离所有的油类(如植物油、矿物油等)与水,具有超亲水性,超疏油性,D正确。
3.【答案】D
【解析】图①不可用于除去Cl2中的水蒸气,因为浓硫酸是液体,Cl2无法通过,而且U形管不能盛装液体干燥剂,A错误;萃取时振荡操作,右手压住分液漏斗口部,左手握住活塞,把分液漏斗倒转振荡,使两种液体充分接触,应避免分液漏斗内压强过大,振荡后,应打开活塞放气,但振荡过程中不能打开活塞,B错误;高锰酸钾标准溶液具有强氧化性,会腐蚀碱式滴定管下端的乳胶管,应盛放在酸式滴定管中,C错误;测定中和热实验中温度计用于测定溶液温度,并且大烧杯杯口与小烧杯杯口相平,空隙需用碎泡沫填充,防止热量散失,故D能达到实验目的。
4.【答案】B
【解析】依题意,Y和Z位于同主族,Y原子能形成1个双键,Z原子形成2个单键,说明Z原子最外层有6个电子,Y为氧,Z为硫。X原子能形成2个单键、1个双键(或4个单键),说明X原子最外层有4个电子,原子序数小于8,故X为碳。R原子形成1个单键,上述五种元素中R的原子序数最小,R为氢;W为短周期主族元素且原子序数大于16,故W为氯。氧、硫、碳、氢的电负性依次减小,A错误;CS2是直线形分子,CH4,CCl4分子都是正四面体形分子,它们都是非极性分子,B正确;结合质子能力越强,形成的酸越弱,酸性:HCl>H2S,结合质子(H+)能力:S2->Cl-,C错误;单键都是g键,双键中有1个σ键,1个M分子含8个σ键,D错误。
5.【答案】D
【解析】碘单质不能与KCN反应,说明(CN)2的氧化性大于I2,A正确;丙烯酸含有碳碳双键和羧基,溴水褪色,说明丙烯酸含有碳碳双键,B正确;维生素C与高锰酸钾发生氧化还原反应,维生素C表现还原性,C正确;根据盐类水解规律,相同条件下,越弱越易水解,故HY的酸性比HX的强,D错误。
6.【答案】A
【解析】依题意,X、Y的物质的量相等,产生H2的量与羟基数目有关,与摩尔质量无关,故A正确,B错误;等物质的量条件下,质量与摩尔质量成正比例,摩尔质量不确定,质量不确定,C错误;消耗钠的质量与产生氢气的物质的量成正比例,X、Y消耗钠的质量之比为a:b,D错误。
7.【答案】C
【解析】操作②配制银氨溶液时,滴加氨水至浊液刚好变澄清时即得到银氨溶液。要防止加入过量的氨水,否则有可能生成雷酸银,雷酸银在受热或撞击时有爆炸的危险,同时银氨溶液本身也将失去灵敏性;操作③中用水浴加热;操作④中用稀硝酸溶解银镜,氨水不能溶解银,共3处错误。
8.【答案】C
【解析】用盐酸溶解烧渣,可除去二氧化硅;再用氢氧化钠可分离铝元素和铁元素,灼烧氢氧化铁制铁红,A正确;二氧化硫中有砷等杂质会使催化剂中毒(降低活性),B正确;三氧化硫与水反应放出大量热量,用水直接吸收三氧化硫会形成“酸雾”,污染环境且吸收率低,C错误;黄铁矿(FeS2)与O2反应SO2和O2反应是氧化还原反应,D正确。
9.【答案】B
【解析】异硫氰酸含N—H键,分子间能形成氢键,沸点高于硫氰酸,A错误;1个三键含2个π键、1个双键含1个π键,所以1个上述酸分子含2个π键,B正确;H—О键比H—C键易断裂,故HOCN的酸性比HCN的强,Ka(HOCN)>Ka(HCN),C错误;上述分子中,C原子采用sp杂化,O原子采用sp3杂化,D错误。
10.【答案】C
【解析】由图示分析可知:铂电极为阴极,石墨电极为阳极,电流由正极流出,经阳极;阴极流向负极,A正确;MO中阴、阳离子带电荷数相等,通电时向两极迁移的阴,阳离子数目相等,B正确;阳极反应式为,阴离子反应式为,C错误;镁、钙、锶,钡等活泼金属容易与空气中氧气反应,液态汞包裹金属,避免活泼金属在高温下被氧化,D正确。
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.【答案】BC
【解析】一水合氨是弱碱,氢氧化铜溶于氨水形成四氨合铜离子,A错误;二甲苯与酸性高锰酸钾溶液反应,B正确;铁离子与苯酚形成配合物,C正确;碘化银溶液中存在沉淀溶解平衡,还有水的电离平衡,故存在2个平衡,D错误。
12.【答案】CD
【解析】a的同分异构体中如,等存在顺反异构,故A正确;b分子中有一个碳原子与其他3个碳原子不共面,故B正确;C.比脯氨酸多一个碳原子和2个氢原子,不是同分异构体,故C错误;D.c分子中含有2个手性碳原子,故D错误。
13.【答案】C
【解析】固氮分人工固氮、自然固氮,自然固氮又有雷雨固氮和生物固氮,豆科植物固氮属于生物固氮,A正确;豆血红蛋白呈粉红色,所以,根瘤菌呈粉红色,B正确;固氮酶属于蛋白质,在高温下固氮酶会失去活性,酶催化活性需要适当的温度,C错误;缺氧时,平衡向逆反应方向移动,固氮酶释放氧气,富氧条件下,平衡向正反应方向移动,固氮酶贮存氧气,D正确。
14.【答案】AC
【解析】观察图示,上述循环中,为中间产物,A正确;物质2分子只断裂1个π键,B错误;镍原子形成化学键数目有1、2、3等,C正确;物质1、2、3是反应物,物质4是产物,D错误。
15.【答案】D
【解析】由图像分析可知:曲线①②3分别代表、HR,,A正确;由知,M点,,pH=6,说明甘氨酸溶液显弱酸性,B正确;由于,,则,M点,,,C正确;NaR溶液中由质子守恒可知,,D错误。
三、非选择题:本题共5小题,共60分。
16.【答案】(1)4s24p4(1分)3(1分)
(2)O、S、Se、Te的原子半径依次增大,与H形成的共价键键长增大,键能减小(2分)H2S(1分)
(3)三角锥形(1分)sp3(1分)
(4)分子晶体(2分)
(5)(1分)(2分)
【解析】(1)硒是34号元素,基态硒原子的价层电子排布式为4s24p4。Bi与N位于同主族,它们的未成对电子数为3。(2)气态氢化物的稳定性与键能有关,而键能与原子半径有关。氧、硫、硒、确的原子半径依次增大,与氢形成共价键的键能依次减小,故稳定性依次减弱。H2О分子之间形成氢键,沸点比H2S高,H2S、H2Se、H2Te范德华力逐渐增大,沸点逐渐升高,故H,S沸点最低。(3)SeO32-中硒原子价层有4个电子对,其中1个孤电子对,3个成键电子对,空间构型为三角锥形。TeO42-中确的价层有4个电子对,采用sp3杂化。(4)三氧化硒的熔点较低,易升华,说明粒子之间作用力小,它是分子晶体。(5)根据A点、B点原子坐标,C点原子坐标:x=1/4,y=3/4,z=1/4。硒化锌晶胞中含4个锌、4个硒。硒在晶胞中面心立方分布,面对角线上三个硒相切,晶胞参数为,由密度公式知,。
17.【答案】(1)3:2(2分)
(2)增大固体接触面,提高反应速率(1分)
(3)H2SiO3(1分)坩埚(1分)
(4)(2分)
(5)过滤(1分)
(6)(2分)0.4molOH-(2分)
【解析】(1)图1是面心立方晶胞,配位数为12;图2是体心立方晶胞,配位数为8。(2)固体反应速率与接触面有关,粉碎过筛的目的是增大固体接触面,加快反应。(3)二氧化硅在碱熔时转化成硅酸钠,酸浸过程中转化成硅酸。操作A为灼烧,装固体的仪器是坩埚。(4)根据溶度积计算,。(5)氢氧化铁不溶氢氧化钠溶液,氢氧化铝与氢氧化钠溶液反应,过滤,得到氢氧化铁。(6)观察图示知,在碱性条件下,次氯酸根离子氧化氰根离子生成氮气和碳酸根离子,本身被还原成氯离子。石墨(1)的电极反应式为,,向阳极区迁移0.4molOH-离子。
18.【答案】(1)氧化Fe2+中和Cu(1分)
(2分)
(2)①恒压滴液漏斗(1分)不能(1分)②过滤速率快(1分)
(3)①(2分)或KCuI2(1分)
(4)(2分)偏高(1分)
【解析】(1)铜不和硫酸反应,氧气作用是氧化亚铁离子和铜单质。,加入CuO调节溶液pH,促进Fe3+转化成。(2)硫酸铜作氧化剂,SO2作还原剂生成碘化亚铜和硫酸,反应离子方程式为。(3)①仪器D为滴液恒压漏斗,便于硫酸铜溶液顺利下滴。制备SO2中硫酸表现酸的作用,如果用浓硫酸,酸性表现不充分,不能很好的产生气体。②减压过滤,过滤速率较快,避免产品长时间与空气接触而被氧化。(4)①根据实验Ⅰ,碘化亚铜与氢氧化钠反应发生非氧化还原反应,生成红色沉淀Cu2O,Cu2O溶于稀硫酸生成硫酸铜、铜:。所以,CuI和NaOH反应方程式为。②根据实验Ⅱ,碘化亚铜溶于KI溶液形成配合物,存在平衡:。
(4)由关系式得,,。
没有用待装液润洗滴定管,消耗滴定液体积偏大,结果偏高。
19.【答案】(⑴醛基(1分)1,3—苯二酚(或间苯二酚或间二苯酚)(2分)
(2)取代反应(1分)4(1分)
(3)(2分)
(4)10(2分)
(5)(3分)
【解析】(1)E中含有官能团除羟基、醚键外,还有醛基。A在稀硫酸中水解生成间苯二酚。
(2)B→C是B中羟基上氢被甲基取代。有机物C具有对称结构,C分子有4种氢原子,在核磁共振氢谱上有4组峰。(3)根据已知信息,结合F的结构简式知,G为,副产物为HI。(4)依题意,同分异构体的苯环上有三个取代基:甲基、羟基、甲酸酯基,共有10种结构。(5)依题意,在苯环侧链上引入—CN,设计合成路线如下:
20.(12分【答案】(1)(2分)
(2)>(1分)
(3)①a(2分)②能(1分)③向正反应方向(1分)增大(1分)
(4)①由于总压恒定,随着投料比增大,N2分压减小,C3H8分压增大,相当于增大可逆反应平衡体系压强,平衡向逆方向移动(2分,其他答案合理即可给分)
②(2分)
【解析】(1)根据盖斯定律,反应1×5+反应2得目标反应。
(2)由图可知:载氧体Ⅰ是把空气中的氧气转移到燃料反应器,载氧体Ⅱ是氧气和丙烷发生反应释放出水和二氧化碳,所以氧的质量分数:载氧体I≥载氧体II。
(3)①反应1的特点是只有氧气是气体,温度不变,平衡常数不变,故平衡时O2的压强不变。。②反应体系中,随着反应进行,Cu2O的质量逐渐减小,不变时达到平衡状态。③恒温恒容条件下,平衡后再充入氧气,氧气浓度增大,平衡向正反应方向移动。达到新平衡时О2浓度不变,故消耗О2增大,O2平衡转化率增大。例如,开始投入1molO2,平衡时О2为0.5mol,氧气平衡转化率为50%;温度不变,再充入1molO2,平衡时仍然有0.5molO2,O2平衡转化率为75%。也可以用构造法分析,再充入氧气,相当于增大原平衡压强(缩小体积),平衡向正反应方向移动,氧气的平衡转化率增大。
(4)①从分压角度分析,由于总压恒定,随着投料比增大,N2占分压减小,可逆反应中各物质占总压强增大,平衡向逆方向移动,故C3H8的平衡转化率减小。
②设起始投入丙烷、氮气各1mol,用M点数据计算平衡常数:
起始物质的量/mol: 1.0 0 0
变化物质的量/mol: 0.8 2.4 3.2
平衡物质的量/mol: 0.2 2.4 3.2
。
,。。
同课章节目录
