湖北省华大新高考联盟2021-2022学年高三下学期2月开学考试化学试题(Word版含解析)
文档属性
| 名称 | 湖北省华大新高考联盟2021-2022学年高三下学期2月开学考试化学试题(Word版含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-21 20:55:43 | ||
图片预览



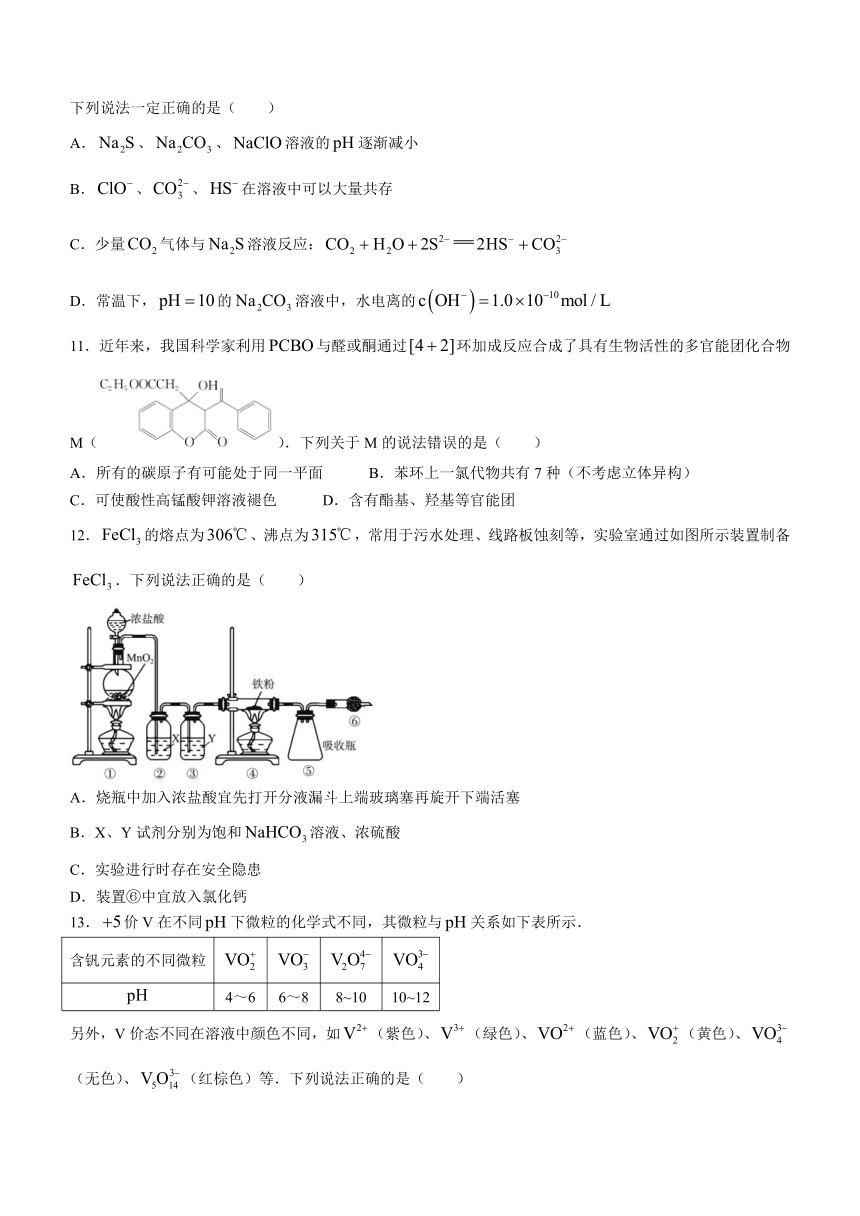
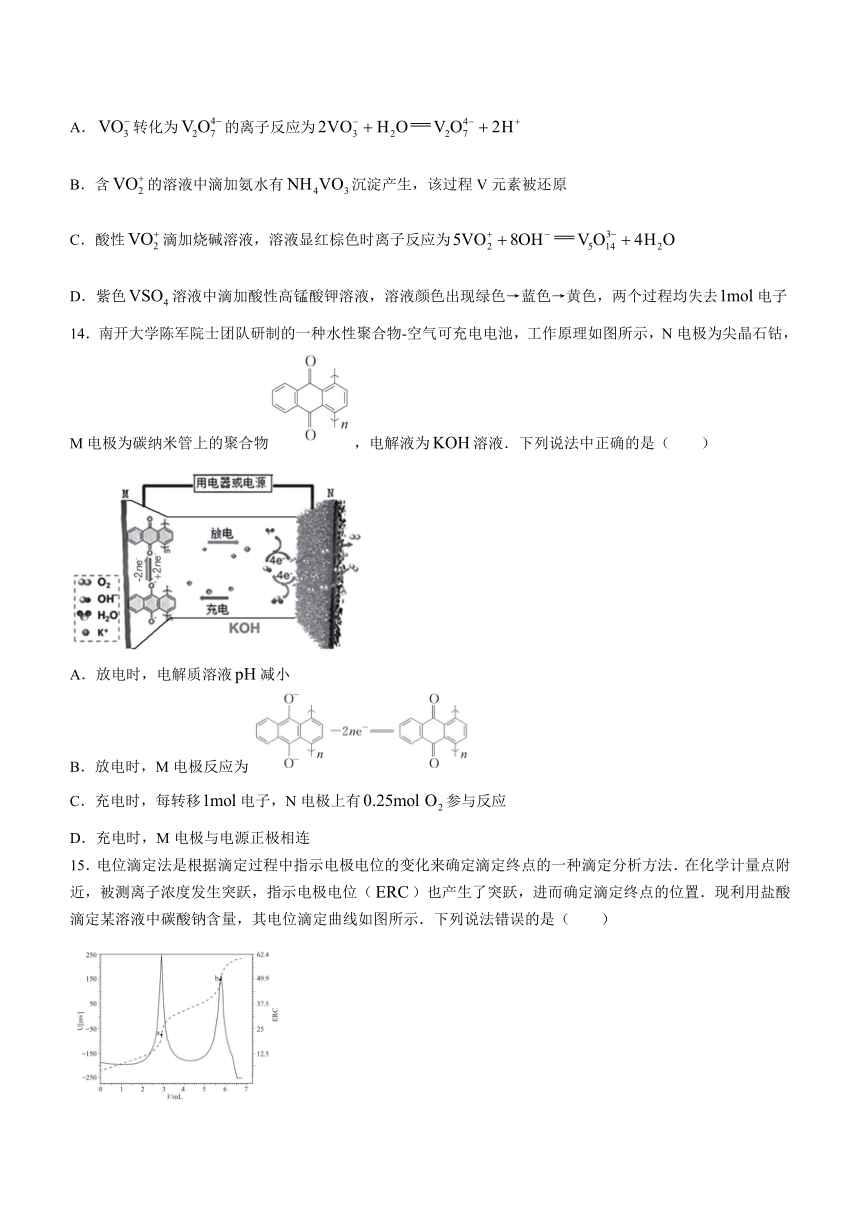
文档简介
机密★启用前(新高考湖北卷)
华大新高考联盟2021-2022学年高三下学期2月开学考试
化学
本试题卷共6页.全卷满分100分,考试用时75分钟.
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上.
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑.如需改动,用橡皮擦干净后,再选涂其他答案标号.回答非选择题时,将答案写在答题卡上.写在本试卷上无效.
3.考试结束后,将本试卷和答题卡一并交回.
可能用到的相对原子质量:H 1 C 12 O 16 Ti 48 Cu 64 Zn 65
一、选择题:本题共15小题,每小题3分,共45分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.化学与生活、生产密切相关,下列说法正确的是( )
A.大豆富含蛋白质,适宜用来酿酒
B.《内经》记载“五谷为养、五果为助、五禽为益、五菜为充”,文中涉及糖类、维生素、蛋白质等人体需要的营养素
C.明矾可有效除去水中含有的、重金属离子
D.垃圾宜分类投放,废纸、塑料、废充电电池均为可回收垃圾,图标为
2.《天工开物一作咸篇》有如下记载:“潮波浅被地,不用灰压.候潮一过,明日天晴,半日晒出盐霜,疾趋扫起煎炼.”下列说法正确的是( )
A.“煎炼”所得物质俗称“火碱” B.“作咸”过程涉及“蒸馏”操作
C.“作咸”在实验室完成会用到蒸发皿、酒精灯 D.该记载过程中涉及氧化还原反应和复分解反应
3.1919年,卢瑟福做了用粒子()轰击原子核的实验,实现了原子核的人工转变,发现了质子:,其中Y的某种单质可用作自来水消毒剂.下列说法正确的是( )
A.X与Y均能与氢组成含18电子的化合物 B.Y存在、、多种同素异形体
C.与中子数相同 D.X的氧化物的水化物一定属于强酸
4.研究表明,氮元素可以参与如图所示的自然界中的循环.表示阿伏伽德罗常数的值,下列说法正确的是( )
A.消耗的质量与生成的质量相同时,它们转移电子数相同
B.、与三种微粒均含有个电子
C.在反硝化细菌作用下,每生成至少消耗个
D.在硝化细菌作用下,每生成个至少有个键断裂
5.燃煤燃烧过程中易产生、气体,下列关于、说法正确的是( )
A.均为含有极性键的极性分子 B.空间构型相同
C.分子中键角大于 D.C与S杂化类型相同
6.药物异博定(盐酸维拉帕米)能有效控制血压升高、促进血液循环,其合成路线中有如下转化过程:
已知晶体属晶型,则下列说法正确的是( )
A.Z分子中C、H、O第一电离能大小顺序为
B.Y分子中基态原子电子排布式为
C.X的沸点高于其同分异构体
D.晶体中,与最近的有12个
7.冰晶石是一种重要的助熔剂,化工上常通过如下方法制备:
已知萤石、石英砂、冰晶石均难溶于水.下列说法错误的是( )
A.冰晶石含有离子键和共价键
B.实验室模拟“煅烧”时需要的实验仪器有酒精喷灯、蒸发皿、玻璃棒
C.“水浸”时所得残渣主要成分有
D.“调”时,若过大则冰晶石的产率会降低
8.与置于溶液中可以构成原电池,如图M所示,实验发现电流表指针发生偏转,但是表面仍有红色铜吸附,有同学做出如下改进,如图N所示.下列说法正确的是( )
A.图N中X溶液为溶液
B.图N盐桥中向右池移动
C.图M与图N中,转移电子数日相同时,极质量减少量相同
D.图M中,极增重,极减少,实际消耗应为
9.在无催化剂和有催化剂条件下,和之间发生异构化反应的历程与相对能量变化如上右图所示.下列说法错误的是( )
A.比稳定
B.比沸点高
C.催化剂不改变正反应与逆反应活化能的差值
D.曲线Ⅱ为催化剂条件下的反应历程,其中第一步反应为决速反应
10.室温下,几种酸的电离常数如下表所示:
弱酸
电离平衡常数
下列说法一定正确的是( )
A.、、溶液的逐渐减小
B.、、在溶液中可以大量共存
C.少量气体与溶液反应:
D.常温下,的溶液中,水电离的
11.近年来,我国科学家利用与醛或酮通过环加成反应合成了具有生物活性的多官能团化合物M().下列关于M的说法错误的是( )
A.所有的碳原子有可能处于同一平面 B.苯环上一氯代物共有7种(不考虑立体异构)
C.可使酸性高锰酸钾溶液褪色 D.含有酯基、羟基等官能团
12.的熔点为、沸点为,常用于污水处理、线路板蚀刻等,实验室通过如图所示装置制备.下列说法正确的是( )
A.烧瓶中加入浓盐酸宜先打开分液漏斗上端玻璃塞再旋开下端活塞
B.X、Y试剂分别为饱和溶液、浓硫酸
C.实验进行时存在安全隐患
D.装置⑥中宜放入氯化钙
13.价V在不同下微粒的化学式不同,其微粒与关系如下表所示.
含钒元素的不同微粒
4~6 6~8 8~10 10~12
另外,V价态不同在溶液中颜色不同,如(紫色)、(绿色)、(蓝色)、(黄色)、(无色)、(红棕色)等.下列说法正确的是( )
A.转化为的离子反应为
B.含的溶液中滴加氨水有沉淀产生,该过程V元素被还原
C.酸性滴加烧碱溶液,溶液显红棕色时离子反应为
D.紫色溶液中滴加酸性高锰酸钾溶液,溶液颜色出现绿色→蓝色→黄色,两个过程均失去电子
14.南开大学陈军院士团队研制的一种水性聚合物-空气可充电电池,工作原理如图所示,N电极为尖晶石钴,M电极为碳纳米管上的聚合物,电解液为溶液.下列说法中正确的是( )
A.放电时,电解质溶液减小
B.放电时,M电极反应为
C.充电时,每转移电子,N电极上有参与反应
D.充电时,M电极与电源正极相连
15.电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法.在化学计量点附近,被测离子浓度发生突跃,指示电极电位()也产生了突跃,进而确定滴定终点的位置.现利用盐酸滴定某溶液中碳酸钠含量,其电位滴定曲线如图所示.下列说法错误的是( )
(注:一表示电极电位曲线图;……表示电极电压曲线图)
A.该滴定过程中不需任何指示剂
B.a点溶液中存在:
C.b点溶液呈酸性
D.a到b之间存在:
二、非选择题:本题共4小题,共55分.
16.(14分)
草酸是化工上常用的还原剂,实验室中可以用浓硝酸在催化下氧化气体来制备,可能用到的仪器如图所示.
已知电石(主要成分为,含少量和等杂质)遇水可以迅速生成,溶液能够吸收气体,浓硝酸氧化时会被还原为.
回答下列问题:
(1)的电子式为____________;与反应制备的化学反应方程式为________.
(2)选择所需的仪器,接口正确的连接顺序为_________.
(3)为便于控制电石与水反应制备,有同学认为宜选取仪器乙,不宜选取甲,该观,点是否正确?请说明原因______________________________________________________________.
(4)制备气体时,常用饱和食盐水代替水的原因是______________________.
(5)装置戊中生成草酸的反应方程式为______________,反应一般控制在左右,若高于,则生成草酸的速率会减慢,原因是_____________________________________________.
(6)三颈烧瓶中液体经过蒸发浓缩、冷却结晶、过滤等操作可得到草酸晶体,设计一个实验证明草酸属于二元弱酸:_______________________________________________________.
17.(13分)
苯并噻二唑类物质能诱导植物产生抗病性,其前驱物苯并噻二唑醛的合成路线如下.
(1)科学技术的发展,一些仪器的出现,人们可以通过_______快速测定有机物分子所含有的官能团种类.A中所含官能团的名称为________.
(2)B的结构简式为_________.
(3)反应、的化学反应类型分别为_______和_______.
(4)的化学反应方程式为___________________________.
(5)A的四元取代芳香族同分异构体中,能发生银镜反应且核磁共振氢谱中有两组峰的分子结构简式为________________.(写出其中一种即可)
18.(14分)
二甲醚是一种重要的化工原料,回答下列问题:
(1)已知:①;
②;
③;
④.
则_______;该反应能够自发进行所采用的有利条件是___________(填“高温”“低温”或“任意温度”).
(2)在恒温恒压条件下,化工生产上利用二甲醚与氧气为原料制备合成气,实际生产过程中常常添加一定量的水蒸气,其目的是________________;研究发现,所得平衡混合气体中的体积分数随变化如图所示,试解释该曲线先变大后减小的原因________________________.
(3)某温度下,在的刚性容器中充入、及,在催化剂作用下仅发生反应,实验测得容器中压强与时间变化如下左图所示.则前内该反应速率_______;该温度下其分压平衡常数______(已知).
(4)二甲醚燃料电池常采用磺酸类质子溶剂,其工作原理如上右图所示,则负极的电极反应式为_______________,若消耗标准状况下,则理论上左右两室溶液质量变化的差值为________g.
19.(14分)
金属钪可用作宇航材料、火箭和飞机的制造材料;氧化钪可提高计算机记忆元件性能.铝土矿(主要成分)经碱初步溶解后得到的赤泥含有丰富的钪元素,另含有、、、等氧化物.一种从赤泥中提取氧化钪的工艺流程如图所示(是一种磷酸酯萃取剂).
回答下列问题:
(1)写出铝土矿经碱初步溶解时所发生的主要离子方程式:______________.
(2)写出赤泥经盐酸处理后所得“浸渣”的一种用途:________________.
(3)萃取浸出液,其浓度、料液温度对萃取率的影响如下所示,萃取时最佳浓度及料液温度分别为_______、_________.
浓度对萃取率的影响
试验编号 浓度/% 分相情况 钪萃取率/% 铁萃取率/%
1-1 1 分相快 90.76 15.82
1-2 2 分相容易 91.53 19.23
1-3 3 分相容易 92.98 13.56
1-4 4 有第三相 90.69 30.12
15 5 轻微乳化 91.74 39.79
(4)常以分子存在,已知分子中各个原子均达到8电子稳定结构,则分子的结构式为___________.
(5)反萃取时,完全沉淀(浓度为)时,反萃液中的为_______________.(已知:,结果保留小数点后2位有效数字)
(6)草酸钪灼烧分解反应方程式为_____________.
(7)在流程中可循环使用的物质有__________.
化学参考答案与评分标准
1.【答案】B
【命题意图】试题紧密联系生活,综合考查化学基础知识在生活、生产中的实际运用,呈现了“科学态度与社会责任”的学科素养.
【解析】淀粉可水解为葡萄糖,葡萄糖在酒化酶的作用下转化为乙醇,而蛋白质不能转化为乙醇,大豆不适宜用来酿酒,A选项错误;“五谷”含有淀粉,属于糖类,“五果”和“五菜”含有维生素,“五禽”含有蛋白质,“蛋白质、油脂、糖类、无机盐、维生素和水统称为人体需要的六大营养素,B选项正确;水中含有的、重金属离子,通常需要加入含硫的化合物形成硫化物沉淀,水中添加明矾,主要是通过其水解形成胶体,吸附水中悬浮的杂质,C选项错误;废充电电池常含有一些重金属,污染土壤、水体等,属于有害垃圾,D选项错误.
2.【答案】C
【命题意图】试题密切联系中国传统文化,考查了物质推断、实验操作及仪器的选取和反应类型判断等学科知识,试题注重立德树人,弘扬中华优秀传统文化,呈现了“科学态度与社会责任”的学科素养.
【解析】该记载过程描述的是性质稳定的氯化钠制作过程,俗称“火碱”,自然界中不能够稳定存在,A选项错误;“作咸”主要涉及“蒸发结晶”过程,不涉及“蒸馏”,B选项错误;“蒸发结晶”过程在实验室完成,一般需要蒸发皿、酒精灯、玻璃棒等仪器,C选项正确;该盐的制备过程无化学变化,D选项错误.
3.【答案】A
【命题意图】试题通过卢瑟福的核实验,考查了原子结构、分子结构及元素周期律的相关知识,注重逻辑推理能力的考查,试题渗透了“宏观辨识与微观探析”“证据推理与模型认知”的学科素养.
【解析】根据题意,X、Y分别为N、O,二者能够形成、,均含有18个电子,A选项正确;Y存在、、多种同位素,不是同素异形体,B选项错误;为,中子数为7,为,中子数为9,C选项错误;X的最高价氧化物的水化物为,属于强酸,若为低价(如),则属于弱酸,D选项错误.
4.【答案】D
【命题意图】试题联系自然界中氮的循环,综合考查了物质的量的相关计算,试题渗透了“宏观辨识与微观探析”的学科素养.
【解析】根据图示,消耗个时可以转移个电子,而生成个时则会转移个电子,它们转移电子数不相同,A选项错误;转化过程中涉及、、三种微粒具体物质的量未知,所以无法计算它们含有电子数的多少,B选项错误;所处的状态未指出,所以无法计算,C选项错误;在硝化细菌作用下,每生成个至少消耗,即有个键断裂,D选项正确.
5.【答案C
【命题意图】试题以学生熟知的、为情景,综合考查了两种分子的空间构型、原子杂化类型及化学键的特点,注重信息的获取与应用,呈现了“证据推理与模型认知”“宏观辨识与微观探析”的学科素养.
【解析】分子中含有极性键但是属于非极性分子,A选项错误;中C原子采用杂化,键角为,分子结构为直线形,中S原子采用杂化,分子为“V”形,由此可以得出A、B、D三选项错误,C选项正确.
6.【答案】A
【命题意图】试题通过有机合成的片段,综合考查了原子结构、氢键及晶体相关知识,呈现了“证据推理与模型认知”等学科素养.
【解析】H原子比碳原子的核外电子距离原子核近,受到原子核的引力大,电离需要消耗更多的能量,所以第一电离能H比C的大,O原子核内质子较多,吸引电子能力更强,第一电离能大于H,A选项正确;基态原子电子排布式为,B选项错误;羟基与羰基处于对位时,分子间易形成氢键,沸点更高,C选项错误;因为晶体与相同,所以最近的有6个,D选项错误.
7.【答案】B
【命题意图】借助化工生产流程,综合考查化学反应原理在现实生产中的应用,试题呈现了“科学态度与社会责任”的学科素养.
【解析】根据冰晶石化学式特点,可以得出该物质中含有离子键也含有共价键,A选项正确;实验室模拟煅烧时应该在坩埚中完成不是蒸发皿,B选项错误;根据元素守恒关系,可以得出煅烧时发生反应后的生成物应该含有难溶解的硅酸钙,C选项正确;“调”时,若过大则会形成沉淀,难以与、形成冰晶石,造成冰晶石的产率降低,D选项正确.
8.【答案】D
【命题意图】试题情景源于化学教材中原电池的装置,综合考查了带有盐桥的装置与无盐桥装置条件下原电池反应原理的区别,试题注重知识的获取与应用,呈现了“证据推理与模型认知”“宏观辨识与微观探析”的学科素养.
【解析】根据题意,图N中,X溶液应该为溶液,Y溶液为溶液,A选项错误;图N中,为负极,阴离子向负极移动,B选项错误;转移电子相同时,参加原电池反应消耗的量相同,但是图M中极上还有析出,所以与图N比较,极质量减少量偏大,C选项错误;图M中,极增重,根据电子守恒,可以得出此时消耗为,另外极还发生反应:,消耗时还生成,根据极减少,可以得出:,,共消耗应为,D选项正确.
9.【答案】B
【命题意图】试题通过和之间异构化反应,综合考查了放热反应、吸热反应与物质能量的关系以及催化剂改变反应速率的原因等学科知识,呈现了“证据推理与模型认知”“变化观念与平衡思想”的学科素养.
【解析】根据图像可以得出所具有的能量小于,所以比稳定,A选项不符合题意;根据和分子结构特点,可以得出分子间能够形成氢键,而分子间无氢键,所以的沸点低于,B选项符合题意;催化剂不仅降低正反应的活化能,也降低逆反应的活化能,但不改变的大小,即催化剂不改变正反应与逆反应活化能的差值,C选项不符合题意;加入催化剂,能够降低反应活化能,所以曲线Ⅱ为有催化剂时的反应,根据曲线,第一步反应活化能大,是慢反应,属于决速反应,D选项不符合题意.
10.【答案】C
【命题意图】试题通过几种弱电解质的电离常数,综合考查了盐类的水解、微粒的共存、离子反应的本质等相关知识点,强化了电离平衡常数的运用,呈现了“证据推理与模型认知”“宏观辨识与微观探析”的学科素养.
【解析】、、三种溶液的浓度未知,无法得出的大小关系,A选项错误;能够氧化,B选项错误;由表中数据可知,酸性:,当少量时,产物为和,C选项正确;常温下,的溶液中,水电离的,D选项错误.
11.【答案】A
【命题意图】试题借助我国科研的一项成果,综合考查了有机物分子的空间构型、同分异构体及官能团结构决定相关性质,呈现了“证据推理与模型认知”“宏观辨识与微观探析”“科学态度与社会责任”的学科素养.
【解析】根据M()中点“*”的碳原子和与其相连的3个碳原子不能共平面,可以得出所有碳原子不可能共平面,A选项错误;苯环上一氯代物可能的位置有如下七种:,B选项正确;M分子中含有碳碳双键,易使酸性高锰酸钾溶液褪色,C选项正确:根据M分子结构特点,结构中含有酯基、羟基官能团,D选项正确.
12.【答案】C
【命题意图】试题通过氯化铁的制备,综合考查了实验仪器的操作、试剂的选取、装置的评价等,呈现了“科学探究与创新意识”的学科素养.
【解析】因为浓盐酸易挥发,若打开分液漏斗上端的玻璃塞,易造成大量盐酸挥发,污染环境,此时操作应该是旋转玻璃塞,使玻璃塞上的凹槽对准分液漏斗上的小孔,然后再慢慢旋转分液漏斗下端的活塞,A选项错误;X和Y试剂分别应该为饱和溶液和浓硫酸,B选项错误;根据试题提供的信息,易升华和凝华,④与⑤之间的细导气管易因为氯化铁凝华发生堵塞,造成安全事故,C选项正确;装置⑥中宜放入碱石灰,不仅可以吸收多余的,还可以有效防止空气中水蒸气进入,导致氯化铁发生水解,D选项错误.
13.【答案】C
【命题意图】试题借助陌生的情景,考查氧化还原反应、离子反应,能力角度考查考生信息的获取与逻辑推理能力,呈现了“证据推理与模型认知”“宏观辨识与微观探析”的学科素养.
【解析】转化为应该在碱性条件进行,正确的离子反应为,A选项错误;滴加氨水有沉淀,该过程钒元素化合价没有改变,V没有被还原,B选项错误;转化为时溶液呈红棕色,离子反应为,C选项正确;消耗反应物的具体量未知,难以得出转移电子数,D选项错误.
14.【答案】B
【命题意图】试题以我国科研工作者的一项科研成果为情景,综合考查了电化学相关知识,体现了“证据推理与模型认知”“宏观辨识与微观探析”的学科素养.
【解析】根据图示,可以得出M为电源的负极,电极反应为,N为电源的正极,电极反应为,放电过程中,浓度不断增大,电解质溶液的会增大,A选项错误;根据电极反应,可以得出B选项正确;充电时,每转移电子,N电极上则会有生成,不是参与反应,C选项错误;充电时,M电极应该与电源负极相连,D选项错误.
15.【答案】D
【命题意图】试题以电位滴定法为情景,综合考查电解质溶液的相关知识,注重信息的获取与推理和应用,体现了“证据推理与模型认知”“宏观辨识与微观探析”的学科素养.
【解析】电位滴定在化学计量点附近,被测离子浓度发生突跃,指示电极电位也产生了突跃,进而确定滴定终点的位置,故滴定时不需指示剂,A项不符合题意;a点为第一个计量点,反应为,此时溶液为、混合液,由溶液中物料守恒可知,B项不符合题意;b点为第二个计量点,反应为,溶液中含有,且为的饱和溶液,故溶液显酸性,C项不符合题意;从a点到b点,溶液由、混合液变为、溶液,故,D项符合题意.
16.(14分)
【答案】(1)(1分) (1分)
(2)(2分)
(3)该观点不正确;因为电石与水反应时变成糊状,堵塞有孔塑料板,乙装置达不到反应随停即止的作用,不便于控制反应速率(2分)
(4)能够减缓反应速率或减缓生成的速率(2分)
(5)(2分) 温度高于,浓硝酸会大量挥发和分解(2分)
(6)测定的草酸溶液,大于1,说明草酸属于弱酸(1分,其他合理说法也可);用标准的溶液滴定草酸溶液,消耗的是草酸的2倍,说明是二元酸(1分,其他合理说法也可)
【命题意图】试题通过草酸的制备为情景,综合考查了实验仪器的选取、反应原理的分析及实验设计等,试题注重实验基本操作能力的考查,呈现了“证据推理与模型认知”“科学探究与创新意识”的学科素养.
【解析】(1)为离子化合物,其结构中含有离子键和共价键,电子式为;与反应制备属于复分解反应,反应为.
(2)制备的气体中常常会含有、气体杂质,通过装置丙洗气瓶可以有效除去中所含有的气体杂质,由此得出各个仪器连接的顺序为.
(3)根据反应原理,生成物易变成糊状,会阻塞有孔塑料板,使液体不能够顺利通过有孔塑料板.乙装置达不到反应随停即止的作用,不便于控制反应速率.
(4)饱和食盐水中食盐能够减少电石与水的接触,从而使反应速率减慢.
(5)根据题意,与浓硝酸反应方程式为反应若进一步提高温度,则根据浓硝酸的特性,浓硝酸会大量挥发和分解,造成硝酸浓度减小,反应速率减慢.
(6)证明一种酸是否属于弱酸,可以通过不同方法证明,如电离理论、平衡理论或盐类水解反推等方法;证明草酸属于二元弱酸,可以通过酸碱反应之间的定量关系推断.
17.(13分)
【答案】(1)红外光谱(1分) 羧基、硝基、氯原子(或碳氯键)(3分,少一个扣1分,扣完为止)
(2)(2分)
(3)取代反应(1分) 还原反应(1分)
(4)(或)(3分)
(5)(2分,任意写出一种即可)
【命题意图】试题综合考查有机化学基础相关知识点,呈现了“证据推理与模型认知”“科学态度与创新意识”的学科素养.
【解析】(1)根据A的结构简式可以得出其含有的官能团为羧基、硝基、氯原子(或碳氯键).
(2)根据题意,可以推理得出B的结构简式为.
(3)根据官能团之间的转化特点,可以得出反应、的化学反应类型分别取代反应、还原反应.
(4)根据官能团决定性质,可以得出的化学反应方程式为或).
(5)根据题意可知A的同分异构体中含有苯环、、、等结构,可以先分析两个结构在苯环的邻间对三个位置,再利用等效氢法依次在苯环上连接和结构.
,共16种.
核磁共振氢谱中有两组峰,其中含有1种,说明苯环上的2个H原子应处于对称位置,故只有和两种.
18.(14分)
【答案】(1)72.4(2分) 高温(1分)
(2)恒压条件下,添加水蒸气,使体积增大,有利于平衡正向移动,提高二甲瞇的转化率(1分,其他合理说法也可)
小于0.5时,随着逐渐增大,反应正向移动,平衡混合气体中的体积分数会随着增大;当大于0.5时,不仅会有剩余,且过量的还可能与发生副反应生成了,造成的体积分数减小(2分,其他合理说法也可)
(3)0.5(2分) 2.55(2分)
(4)(2分) 4.5(2分)
【命题意图】试题综合考查化学反应原理相关知识,呈现了“变化观,点与平衡思想”“证据推理与模型认知”“科学态度与社会责任”的学科素养.
【解析】(1)根据盖斯定律,;根据反应方程式特点,可以得出,反应若能够自发进行,,T选取高温条件有利于反应发生.
(2)因为反应在恒温恒压条件下进行,若混合气体中增加水蒸气,则原混合体系中气体的分压会减小(相当于恒压条件下扩大容积,反应向气体体积增大的方向移动),有利于平衡正向移动,从而提高原料的转化率;根据反应特点,时与反应物的计量数相等,所以当小于0.5时,随着逐渐增大,该反应会正向移动,平衡混合气体中的体积分数会随着增大;当大于0.5时,会有剩余,另外过量的会与发生副反应生成了,的体积分数会减小.
(3)根据三段式法可得:
初始量() 4.0 2.0
转化量() x
平衡量()
根据气体压强之比等于其物质的量之比,可以得出,;所以;各个气体的分压等于总压×各个气体的物质的量分数,将各气体分压代入表达式,可以得出.
(4)标准状况下即为,转移电子为,根据N电极反应,可以得出右极室质量增加了;根据M电极反应,转移电子时,左极室消耗水的物质的量为,质量减少了,左右两室溶液质量变化的差为.
19.(14分)
【答案】(1)(或)(2分)
(2)光导纤维材料、建筑材料等(1分,其他合理说法也可)
(3)3%(1分) (1分)
(4)(写为不扣分,2分)
(5)5.97(3分)
(6)
(7)、(2分)
【命题意图】试题以从赤泥中提取氧化钪的工艺流程为情景,综合考查化学知识在化工生产中的应用,具体体现在反应方程式的书写、物质应用的分析、的计算、图像图表的分析等,体现了“证据推理与模型
认知“宏观辨识与微观探析”的学科素养.
【解析】(1)氧化铝溶解在碱性溶液中,离子反应为(或).
(2)赤泥经盐酸处理后所得“浸渣”为二氧化硅,常常用作光导纤维的材料、建筑材料等.
(3)浓度为3%时,钪萃取率最大,另外钪铁的萃取率差别最大(铁的萃取率最低),且分相容易.
时、的分离系数最大,由此得出答案.
(4)分子中各个原子均达到8电子稳定结构,则分子中有原子提供孤电子对,其结构式应该为或.
(5)完全沉淀时浓度为,,则,,.
(6)根据碳原子化合价变化特点,可以得出反应方程式为.
(7)溶液蒸发结晶、煅烧过程中生成气体,与草酸反应,生成草酸钪和;反萃取后得到的反萃液经盐酸酸化后可得到.
华大新高考联盟2021-2022学年高三下学期2月开学考试
化学
本试题卷共6页.全卷满分100分,考试用时75分钟.
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上.
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑.如需改动,用橡皮擦干净后,再选涂其他答案标号.回答非选择题时,将答案写在答题卡上.写在本试卷上无效.
3.考试结束后,将本试卷和答题卡一并交回.
可能用到的相对原子质量:H 1 C 12 O 16 Ti 48 Cu 64 Zn 65
一、选择题:本题共15小题,每小题3分,共45分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.化学与生活、生产密切相关,下列说法正确的是( )
A.大豆富含蛋白质,适宜用来酿酒
B.《内经》记载“五谷为养、五果为助、五禽为益、五菜为充”,文中涉及糖类、维生素、蛋白质等人体需要的营养素
C.明矾可有效除去水中含有的、重金属离子
D.垃圾宜分类投放,废纸、塑料、废充电电池均为可回收垃圾,图标为
2.《天工开物一作咸篇》有如下记载:“潮波浅被地,不用灰压.候潮一过,明日天晴,半日晒出盐霜,疾趋扫起煎炼.”下列说法正确的是( )
A.“煎炼”所得物质俗称“火碱” B.“作咸”过程涉及“蒸馏”操作
C.“作咸”在实验室完成会用到蒸发皿、酒精灯 D.该记载过程中涉及氧化还原反应和复分解反应
3.1919年,卢瑟福做了用粒子()轰击原子核的实验,实现了原子核的人工转变,发现了质子:,其中Y的某种单质可用作自来水消毒剂.下列说法正确的是( )
A.X与Y均能与氢组成含18电子的化合物 B.Y存在、、多种同素异形体
C.与中子数相同 D.X的氧化物的水化物一定属于强酸
4.研究表明,氮元素可以参与如图所示的自然界中的循环.表示阿伏伽德罗常数的值,下列说法正确的是( )
A.消耗的质量与生成的质量相同时,它们转移电子数相同
B.、与三种微粒均含有个电子
C.在反硝化细菌作用下,每生成至少消耗个
D.在硝化细菌作用下,每生成个至少有个键断裂
5.燃煤燃烧过程中易产生、气体,下列关于、说法正确的是( )
A.均为含有极性键的极性分子 B.空间构型相同
C.分子中键角大于 D.C与S杂化类型相同
6.药物异博定(盐酸维拉帕米)能有效控制血压升高、促进血液循环,其合成路线中有如下转化过程:
已知晶体属晶型,则下列说法正确的是( )
A.Z分子中C、H、O第一电离能大小顺序为
B.Y分子中基态原子电子排布式为
C.X的沸点高于其同分异构体
D.晶体中,与最近的有12个
7.冰晶石是一种重要的助熔剂,化工上常通过如下方法制备:
已知萤石、石英砂、冰晶石均难溶于水.下列说法错误的是( )
A.冰晶石含有离子键和共价键
B.实验室模拟“煅烧”时需要的实验仪器有酒精喷灯、蒸发皿、玻璃棒
C.“水浸”时所得残渣主要成分有
D.“调”时,若过大则冰晶石的产率会降低
8.与置于溶液中可以构成原电池,如图M所示,实验发现电流表指针发生偏转,但是表面仍有红色铜吸附,有同学做出如下改进,如图N所示.下列说法正确的是( )
A.图N中X溶液为溶液
B.图N盐桥中向右池移动
C.图M与图N中,转移电子数日相同时,极质量减少量相同
D.图M中,极增重,极减少,实际消耗应为
9.在无催化剂和有催化剂条件下,和之间发生异构化反应的历程与相对能量变化如上右图所示.下列说法错误的是( )
A.比稳定
B.比沸点高
C.催化剂不改变正反应与逆反应活化能的差值
D.曲线Ⅱ为催化剂条件下的反应历程,其中第一步反应为决速反应
10.室温下,几种酸的电离常数如下表所示:
弱酸
电离平衡常数
下列说法一定正确的是( )
A.、、溶液的逐渐减小
B.、、在溶液中可以大量共存
C.少量气体与溶液反应:
D.常温下,的溶液中,水电离的
11.近年来,我国科学家利用与醛或酮通过环加成反应合成了具有生物活性的多官能团化合物M().下列关于M的说法错误的是( )
A.所有的碳原子有可能处于同一平面 B.苯环上一氯代物共有7种(不考虑立体异构)
C.可使酸性高锰酸钾溶液褪色 D.含有酯基、羟基等官能团
12.的熔点为、沸点为,常用于污水处理、线路板蚀刻等,实验室通过如图所示装置制备.下列说法正确的是( )
A.烧瓶中加入浓盐酸宜先打开分液漏斗上端玻璃塞再旋开下端活塞
B.X、Y试剂分别为饱和溶液、浓硫酸
C.实验进行时存在安全隐患
D.装置⑥中宜放入氯化钙
13.价V在不同下微粒的化学式不同,其微粒与关系如下表所示.
含钒元素的不同微粒
4~6 6~8 8~10 10~12
另外,V价态不同在溶液中颜色不同,如(紫色)、(绿色)、(蓝色)、(黄色)、(无色)、(红棕色)等.下列说法正确的是( )
A.转化为的离子反应为
B.含的溶液中滴加氨水有沉淀产生,该过程V元素被还原
C.酸性滴加烧碱溶液,溶液显红棕色时离子反应为
D.紫色溶液中滴加酸性高锰酸钾溶液,溶液颜色出现绿色→蓝色→黄色,两个过程均失去电子
14.南开大学陈军院士团队研制的一种水性聚合物-空气可充电电池,工作原理如图所示,N电极为尖晶石钴,M电极为碳纳米管上的聚合物,电解液为溶液.下列说法中正确的是( )
A.放电时,电解质溶液减小
B.放电时,M电极反应为
C.充电时,每转移电子,N电极上有参与反应
D.充电时,M电极与电源正极相连
15.电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法.在化学计量点附近,被测离子浓度发生突跃,指示电极电位()也产生了突跃,进而确定滴定终点的位置.现利用盐酸滴定某溶液中碳酸钠含量,其电位滴定曲线如图所示.下列说法错误的是( )
(注:一表示电极电位曲线图;……表示电极电压曲线图)
A.该滴定过程中不需任何指示剂
B.a点溶液中存在:
C.b点溶液呈酸性
D.a到b之间存在:
二、非选择题:本题共4小题,共55分.
16.(14分)
草酸是化工上常用的还原剂,实验室中可以用浓硝酸在催化下氧化气体来制备,可能用到的仪器如图所示.
已知电石(主要成分为,含少量和等杂质)遇水可以迅速生成,溶液能够吸收气体,浓硝酸氧化时会被还原为.
回答下列问题:
(1)的电子式为____________;与反应制备的化学反应方程式为________.
(2)选择所需的仪器,接口正确的连接顺序为_________.
(3)为便于控制电石与水反应制备,有同学认为宜选取仪器乙,不宜选取甲,该观,点是否正确?请说明原因______________________________________________________________.
(4)制备气体时,常用饱和食盐水代替水的原因是______________________.
(5)装置戊中生成草酸的反应方程式为______________,反应一般控制在左右,若高于,则生成草酸的速率会减慢,原因是_____________________________________________.
(6)三颈烧瓶中液体经过蒸发浓缩、冷却结晶、过滤等操作可得到草酸晶体,设计一个实验证明草酸属于二元弱酸:_______________________________________________________.
17.(13分)
苯并噻二唑类物质能诱导植物产生抗病性,其前驱物苯并噻二唑醛的合成路线如下.
(1)科学技术的发展,一些仪器的出现,人们可以通过_______快速测定有机物分子所含有的官能团种类.A中所含官能团的名称为________.
(2)B的结构简式为_________.
(3)反应、的化学反应类型分别为_______和_______.
(4)的化学反应方程式为___________________________.
(5)A的四元取代芳香族同分异构体中,能发生银镜反应且核磁共振氢谱中有两组峰的分子结构简式为________________.(写出其中一种即可)
18.(14分)
二甲醚是一种重要的化工原料,回答下列问题:
(1)已知:①;
②;
③;
④.
则_______;该反应能够自发进行所采用的有利条件是___________(填“高温”“低温”或“任意温度”).
(2)在恒温恒压条件下,化工生产上利用二甲醚与氧气为原料制备合成气,实际生产过程中常常添加一定量的水蒸气,其目的是________________;研究发现,所得平衡混合气体中的体积分数随变化如图所示,试解释该曲线先变大后减小的原因________________________.
(3)某温度下,在的刚性容器中充入、及,在催化剂作用下仅发生反应,实验测得容器中压强与时间变化如下左图所示.则前内该反应速率_______;该温度下其分压平衡常数______(已知).
(4)二甲醚燃料电池常采用磺酸类质子溶剂,其工作原理如上右图所示,则负极的电极反应式为_______________,若消耗标准状况下,则理论上左右两室溶液质量变化的差值为________g.
19.(14分)
金属钪可用作宇航材料、火箭和飞机的制造材料;氧化钪可提高计算机记忆元件性能.铝土矿(主要成分)经碱初步溶解后得到的赤泥含有丰富的钪元素,另含有、、、等氧化物.一种从赤泥中提取氧化钪的工艺流程如图所示(是一种磷酸酯萃取剂).
回答下列问题:
(1)写出铝土矿经碱初步溶解时所发生的主要离子方程式:______________.
(2)写出赤泥经盐酸处理后所得“浸渣”的一种用途:________________.
(3)萃取浸出液,其浓度、料液温度对萃取率的影响如下所示,萃取时最佳浓度及料液温度分别为_______、_________.
浓度对萃取率的影响
试验编号 浓度/% 分相情况 钪萃取率/% 铁萃取率/%
1-1 1 分相快 90.76 15.82
1-2 2 分相容易 91.53 19.23
1-3 3 分相容易 92.98 13.56
1-4 4 有第三相 90.69 30.12
15 5 轻微乳化 91.74 39.79
(4)常以分子存在,已知分子中各个原子均达到8电子稳定结构,则分子的结构式为___________.
(5)反萃取时,完全沉淀(浓度为)时,反萃液中的为_______________.(已知:,结果保留小数点后2位有效数字)
(6)草酸钪灼烧分解反应方程式为_____________.
(7)在流程中可循环使用的物质有__________.
化学参考答案与评分标准
1.【答案】B
【命题意图】试题紧密联系生活,综合考查化学基础知识在生活、生产中的实际运用,呈现了“科学态度与社会责任”的学科素养.
【解析】淀粉可水解为葡萄糖,葡萄糖在酒化酶的作用下转化为乙醇,而蛋白质不能转化为乙醇,大豆不适宜用来酿酒,A选项错误;“五谷”含有淀粉,属于糖类,“五果”和“五菜”含有维生素,“五禽”含有蛋白质,“蛋白质、油脂、糖类、无机盐、维生素和水统称为人体需要的六大营养素,B选项正确;水中含有的、重金属离子,通常需要加入含硫的化合物形成硫化物沉淀,水中添加明矾,主要是通过其水解形成胶体,吸附水中悬浮的杂质,C选项错误;废充电电池常含有一些重金属,污染土壤、水体等,属于有害垃圾,D选项错误.
2.【答案】C
【命题意图】试题密切联系中国传统文化,考查了物质推断、实验操作及仪器的选取和反应类型判断等学科知识,试题注重立德树人,弘扬中华优秀传统文化,呈现了“科学态度与社会责任”的学科素养.
【解析】该记载过程描述的是性质稳定的氯化钠制作过程,俗称“火碱”,自然界中不能够稳定存在,A选项错误;“作咸”主要涉及“蒸发结晶”过程,不涉及“蒸馏”,B选项错误;“蒸发结晶”过程在实验室完成,一般需要蒸发皿、酒精灯、玻璃棒等仪器,C选项正确;该盐的制备过程无化学变化,D选项错误.
3.【答案】A
【命题意图】试题通过卢瑟福的核实验,考查了原子结构、分子结构及元素周期律的相关知识,注重逻辑推理能力的考查,试题渗透了“宏观辨识与微观探析”“证据推理与模型认知”的学科素养.
【解析】根据题意,X、Y分别为N、O,二者能够形成、,均含有18个电子,A选项正确;Y存在、、多种同位素,不是同素异形体,B选项错误;为,中子数为7,为,中子数为9,C选项错误;X的最高价氧化物的水化物为,属于强酸,若为低价(如),则属于弱酸,D选项错误.
4.【答案】D
【命题意图】试题联系自然界中氮的循环,综合考查了物质的量的相关计算,试题渗透了“宏观辨识与微观探析”的学科素养.
【解析】根据图示,消耗个时可以转移个电子,而生成个时则会转移个电子,它们转移电子数不相同,A选项错误;转化过程中涉及、、三种微粒具体物质的量未知,所以无法计算它们含有电子数的多少,B选项错误;所处的状态未指出,所以无法计算,C选项错误;在硝化细菌作用下,每生成个至少消耗,即有个键断裂,D选项正确.
5.【答案C
【命题意图】试题以学生熟知的、为情景,综合考查了两种分子的空间构型、原子杂化类型及化学键的特点,注重信息的获取与应用,呈现了“证据推理与模型认知”“宏观辨识与微观探析”的学科素养.
【解析】分子中含有极性键但是属于非极性分子,A选项错误;中C原子采用杂化,键角为,分子结构为直线形,中S原子采用杂化,分子为“V”形,由此可以得出A、B、D三选项错误,C选项正确.
6.【答案】A
【命题意图】试题通过有机合成的片段,综合考查了原子结构、氢键及晶体相关知识,呈现了“证据推理与模型认知”等学科素养.
【解析】H原子比碳原子的核外电子距离原子核近,受到原子核的引力大,电离需要消耗更多的能量,所以第一电离能H比C的大,O原子核内质子较多,吸引电子能力更强,第一电离能大于H,A选项正确;基态原子电子排布式为,B选项错误;羟基与羰基处于对位时,分子间易形成氢键,沸点更高,C选项错误;因为晶体与相同,所以最近的有6个,D选项错误.
7.【答案】B
【命题意图】借助化工生产流程,综合考查化学反应原理在现实生产中的应用,试题呈现了“科学态度与社会责任”的学科素养.
【解析】根据冰晶石化学式特点,可以得出该物质中含有离子键也含有共价键,A选项正确;实验室模拟煅烧时应该在坩埚中完成不是蒸发皿,B选项错误;根据元素守恒关系,可以得出煅烧时发生反应后的生成物应该含有难溶解的硅酸钙,C选项正确;“调”时,若过大则会形成沉淀,难以与、形成冰晶石,造成冰晶石的产率降低,D选项正确.
8.【答案】D
【命题意图】试题情景源于化学教材中原电池的装置,综合考查了带有盐桥的装置与无盐桥装置条件下原电池反应原理的区别,试题注重知识的获取与应用,呈现了“证据推理与模型认知”“宏观辨识与微观探析”的学科素养.
【解析】根据题意,图N中,X溶液应该为溶液,Y溶液为溶液,A选项错误;图N中,为负极,阴离子向负极移动,B选项错误;转移电子相同时,参加原电池反应消耗的量相同,但是图M中极上还有析出,所以与图N比较,极质量减少量偏大,C选项错误;图M中,极增重,根据电子守恒,可以得出此时消耗为,另外极还发生反应:,消耗时还生成,根据极减少,可以得出:,,共消耗应为,D选项正确.
9.【答案】B
【命题意图】试题通过和之间异构化反应,综合考查了放热反应、吸热反应与物质能量的关系以及催化剂改变反应速率的原因等学科知识,呈现了“证据推理与模型认知”“变化观念与平衡思想”的学科素养.
【解析】根据图像可以得出所具有的能量小于,所以比稳定,A选项不符合题意;根据和分子结构特点,可以得出分子间能够形成氢键,而分子间无氢键,所以的沸点低于,B选项符合题意;催化剂不仅降低正反应的活化能,也降低逆反应的活化能,但不改变的大小,即催化剂不改变正反应与逆反应活化能的差值,C选项不符合题意;加入催化剂,能够降低反应活化能,所以曲线Ⅱ为有催化剂时的反应,根据曲线,第一步反应活化能大,是慢反应,属于决速反应,D选项不符合题意.
10.【答案】C
【命题意图】试题通过几种弱电解质的电离常数,综合考查了盐类的水解、微粒的共存、离子反应的本质等相关知识点,强化了电离平衡常数的运用,呈现了“证据推理与模型认知”“宏观辨识与微观探析”的学科素养.
【解析】、、三种溶液的浓度未知,无法得出的大小关系,A选项错误;能够氧化,B选项错误;由表中数据可知,酸性:,当少量时,产物为和,C选项正确;常温下,的溶液中,水电离的,D选项错误.
11.【答案】A
【命题意图】试题借助我国科研的一项成果,综合考查了有机物分子的空间构型、同分异构体及官能团结构决定相关性质,呈现了“证据推理与模型认知”“宏观辨识与微观探析”“科学态度与社会责任”的学科素养.
【解析】根据M()中点“*”的碳原子和与其相连的3个碳原子不能共平面,可以得出所有碳原子不可能共平面,A选项错误;苯环上一氯代物可能的位置有如下七种:,B选项正确;M分子中含有碳碳双键,易使酸性高锰酸钾溶液褪色,C选项正确:根据M分子结构特点,结构中含有酯基、羟基官能团,D选项正确.
12.【答案】C
【命题意图】试题通过氯化铁的制备,综合考查了实验仪器的操作、试剂的选取、装置的评价等,呈现了“科学探究与创新意识”的学科素养.
【解析】因为浓盐酸易挥发,若打开分液漏斗上端的玻璃塞,易造成大量盐酸挥发,污染环境,此时操作应该是旋转玻璃塞,使玻璃塞上的凹槽对准分液漏斗上的小孔,然后再慢慢旋转分液漏斗下端的活塞,A选项错误;X和Y试剂分别应该为饱和溶液和浓硫酸,B选项错误;根据试题提供的信息,易升华和凝华,④与⑤之间的细导气管易因为氯化铁凝华发生堵塞,造成安全事故,C选项正确;装置⑥中宜放入碱石灰,不仅可以吸收多余的,还可以有效防止空气中水蒸气进入,导致氯化铁发生水解,D选项错误.
13.【答案】C
【命题意图】试题借助陌生的情景,考查氧化还原反应、离子反应,能力角度考查考生信息的获取与逻辑推理能力,呈现了“证据推理与模型认知”“宏观辨识与微观探析”的学科素养.
【解析】转化为应该在碱性条件进行,正确的离子反应为,A选项错误;滴加氨水有沉淀,该过程钒元素化合价没有改变,V没有被还原,B选项错误;转化为时溶液呈红棕色,离子反应为,C选项正确;消耗反应物的具体量未知,难以得出转移电子数,D选项错误.
14.【答案】B
【命题意图】试题以我国科研工作者的一项科研成果为情景,综合考查了电化学相关知识,体现了“证据推理与模型认知”“宏观辨识与微观探析”的学科素养.
【解析】根据图示,可以得出M为电源的负极,电极反应为,N为电源的正极,电极反应为,放电过程中,浓度不断增大,电解质溶液的会增大,A选项错误;根据电极反应,可以得出B选项正确;充电时,每转移电子,N电极上则会有生成,不是参与反应,C选项错误;充电时,M电极应该与电源负极相连,D选项错误.
15.【答案】D
【命题意图】试题以电位滴定法为情景,综合考查电解质溶液的相关知识,注重信息的获取与推理和应用,体现了“证据推理与模型认知”“宏观辨识与微观探析”的学科素养.
【解析】电位滴定在化学计量点附近,被测离子浓度发生突跃,指示电极电位也产生了突跃,进而确定滴定终点的位置,故滴定时不需指示剂,A项不符合题意;a点为第一个计量点,反应为,此时溶液为、混合液,由溶液中物料守恒可知,B项不符合题意;b点为第二个计量点,反应为,溶液中含有,且为的饱和溶液,故溶液显酸性,C项不符合题意;从a点到b点,溶液由、混合液变为、溶液,故,D项符合题意.
16.(14分)
【答案】(1)(1分) (1分)
(2)(2分)
(3)该观点不正确;因为电石与水反应时变成糊状,堵塞有孔塑料板,乙装置达不到反应随停即止的作用,不便于控制反应速率(2分)
(4)能够减缓反应速率或减缓生成的速率(2分)
(5)(2分) 温度高于,浓硝酸会大量挥发和分解(2分)
(6)测定的草酸溶液,大于1,说明草酸属于弱酸(1分,其他合理说法也可);用标准的溶液滴定草酸溶液,消耗的是草酸的2倍,说明是二元酸(1分,其他合理说法也可)
【命题意图】试题通过草酸的制备为情景,综合考查了实验仪器的选取、反应原理的分析及实验设计等,试题注重实验基本操作能力的考查,呈现了“证据推理与模型认知”“科学探究与创新意识”的学科素养.
【解析】(1)为离子化合物,其结构中含有离子键和共价键,电子式为;与反应制备属于复分解反应,反应为.
(2)制备的气体中常常会含有、气体杂质,通过装置丙洗气瓶可以有效除去中所含有的气体杂质,由此得出各个仪器连接的顺序为.
(3)根据反应原理,生成物易变成糊状,会阻塞有孔塑料板,使液体不能够顺利通过有孔塑料板.乙装置达不到反应随停即止的作用,不便于控制反应速率.
(4)饱和食盐水中食盐能够减少电石与水的接触,从而使反应速率减慢.
(5)根据题意,与浓硝酸反应方程式为反应若进一步提高温度,则根据浓硝酸的特性,浓硝酸会大量挥发和分解,造成硝酸浓度减小,反应速率减慢.
(6)证明一种酸是否属于弱酸,可以通过不同方法证明,如电离理论、平衡理论或盐类水解反推等方法;证明草酸属于二元弱酸,可以通过酸碱反应之间的定量关系推断.
17.(13分)
【答案】(1)红外光谱(1分) 羧基、硝基、氯原子(或碳氯键)(3分,少一个扣1分,扣完为止)
(2)(2分)
(3)取代反应(1分) 还原反应(1分)
(4)(或)(3分)
(5)(2分,任意写出一种即可)
【命题意图】试题综合考查有机化学基础相关知识点,呈现了“证据推理与模型认知”“科学态度与创新意识”的学科素养.
【解析】(1)根据A的结构简式可以得出其含有的官能团为羧基、硝基、氯原子(或碳氯键).
(2)根据题意,可以推理得出B的结构简式为.
(3)根据官能团之间的转化特点,可以得出反应、的化学反应类型分别取代反应、还原反应.
(4)根据官能团决定性质,可以得出的化学反应方程式为或).
(5)根据题意可知A的同分异构体中含有苯环、、、等结构,可以先分析两个结构在苯环的邻间对三个位置,再利用等效氢法依次在苯环上连接和结构.
,共16种.
核磁共振氢谱中有两组峰,其中含有1种,说明苯环上的2个H原子应处于对称位置,故只有和两种.
18.(14分)
【答案】(1)72.4(2分) 高温(1分)
(2)恒压条件下,添加水蒸气,使体积增大,有利于平衡正向移动,提高二甲瞇的转化率(1分,其他合理说法也可)
小于0.5时,随着逐渐增大,反应正向移动,平衡混合气体中的体积分数会随着增大;当大于0.5时,不仅会有剩余,且过量的还可能与发生副反应生成了,造成的体积分数减小(2分,其他合理说法也可)
(3)0.5(2分) 2.55(2分)
(4)(2分) 4.5(2分)
【命题意图】试题综合考查化学反应原理相关知识,呈现了“变化观,点与平衡思想”“证据推理与模型认知”“科学态度与社会责任”的学科素养.
【解析】(1)根据盖斯定律,;根据反应方程式特点,可以得出,反应若能够自发进行,,T选取高温条件有利于反应发生.
(2)因为反应在恒温恒压条件下进行,若混合气体中增加水蒸气,则原混合体系中气体的分压会减小(相当于恒压条件下扩大容积,反应向气体体积增大的方向移动),有利于平衡正向移动,从而提高原料的转化率;根据反应特点,时与反应物的计量数相等,所以当小于0.5时,随着逐渐增大,该反应会正向移动,平衡混合气体中的体积分数会随着增大;当大于0.5时,会有剩余,另外过量的会与发生副反应生成了,的体积分数会减小.
(3)根据三段式法可得:
初始量() 4.0 2.0
转化量() x
平衡量()
根据气体压强之比等于其物质的量之比,可以得出,;所以;各个气体的分压等于总压×各个气体的物质的量分数,将各气体分压代入表达式,可以得出.
(4)标准状况下即为,转移电子为,根据N电极反应,可以得出右极室质量增加了;根据M电极反应,转移电子时,左极室消耗水的物质的量为,质量减少了,左右两室溶液质量变化的差为.
19.(14分)
【答案】(1)(或)(2分)
(2)光导纤维材料、建筑材料等(1分,其他合理说法也可)
(3)3%(1分) (1分)
(4)(写为不扣分,2分)
(5)5.97(3分)
(6)
(7)、(2分)
【命题意图】试题以从赤泥中提取氧化钪的工艺流程为情景,综合考查化学知识在化工生产中的应用,具体体现在反应方程式的书写、物质应用的分析、的计算、图像图表的分析等,体现了“证据推理与模型
认知“宏观辨识与微观探析”的学科素养.
【解析】(1)氧化铝溶解在碱性溶液中,离子反应为(或).
(2)赤泥经盐酸处理后所得“浸渣”为二氧化硅,常常用作光导纤维的材料、建筑材料等.
(3)浓度为3%时,钪萃取率最大,另外钪铁的萃取率差别最大(铁的萃取率最低),且分相容易.
时、的分离系数最大,由此得出答案.
(4)分子中各个原子均达到8电子稳定结构,则分子中有原子提供孤电子对,其结构式应该为或.
(5)完全沉淀时浓度为,,则,,.
(6)根据碳原子化合价变化特点,可以得出反应方程式为.
(7)溶液蒸发结晶、煅烧过程中生成气体,与草酸反应,生成草酸钪和;反萃取后得到的反萃液经盐酸酸化后可得到.
同课章节目录
