8.2海水“晒盐”课后练习—2021—2022学年九年级化学鲁教版下册(word版含解析)
文档属性
| 名称 | 8.2海水“晒盐”课后练习—2021—2022学年九年级化学鲁教版下册(word版含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 202.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-22 22:15:47 | ||
图片预览



文档简介
8.2海水“晒盐”
一、选择题(共16题)
1.a、b、c三种不含结晶水的物质的溶解度曲线如图,下列说法正确的是
A.c的饱和溶液由t2℃降温到t1℃,溶液的溶质质量分数不变
B.将a的溶液由t2℃降温到t1℃,一定有晶体析出
C.t2℃时,50g的a溶于50g水,溶液的质量分数为50%
D.a的溶解度大于b的溶解度
2.如图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是
A.甲中含有少量乙,可用冷却热饱和溶液的方法提纯乙
B.t2℃时,甲溶液的溶质质量分数一定等于乙溶液的溶质质量分数
C.t3℃时,等质量的甲、乙两种物质的饱和溶液中含有的溶质的质量可能相等
D.t1℃时,均可通过降低温度的方法将甲、乙的不饱和溶液变成饱和溶液
3.下列关于实验现象的描述正确的是
A.木炭在氧气中燃烧时发出白光,产生黑色固体
B.红磷在空气中燃烧产生大量白雾
C.饱和石灰水降低温度会有晶体析出
D.将二氧化碳通入紫色石蕊溶液中,溶液显红色
4.下列哪种方法不可能用于分离饱和溶液中的溶质和溶剂
A.过滤 B.蒸发
C.蒸馏 D.结晶
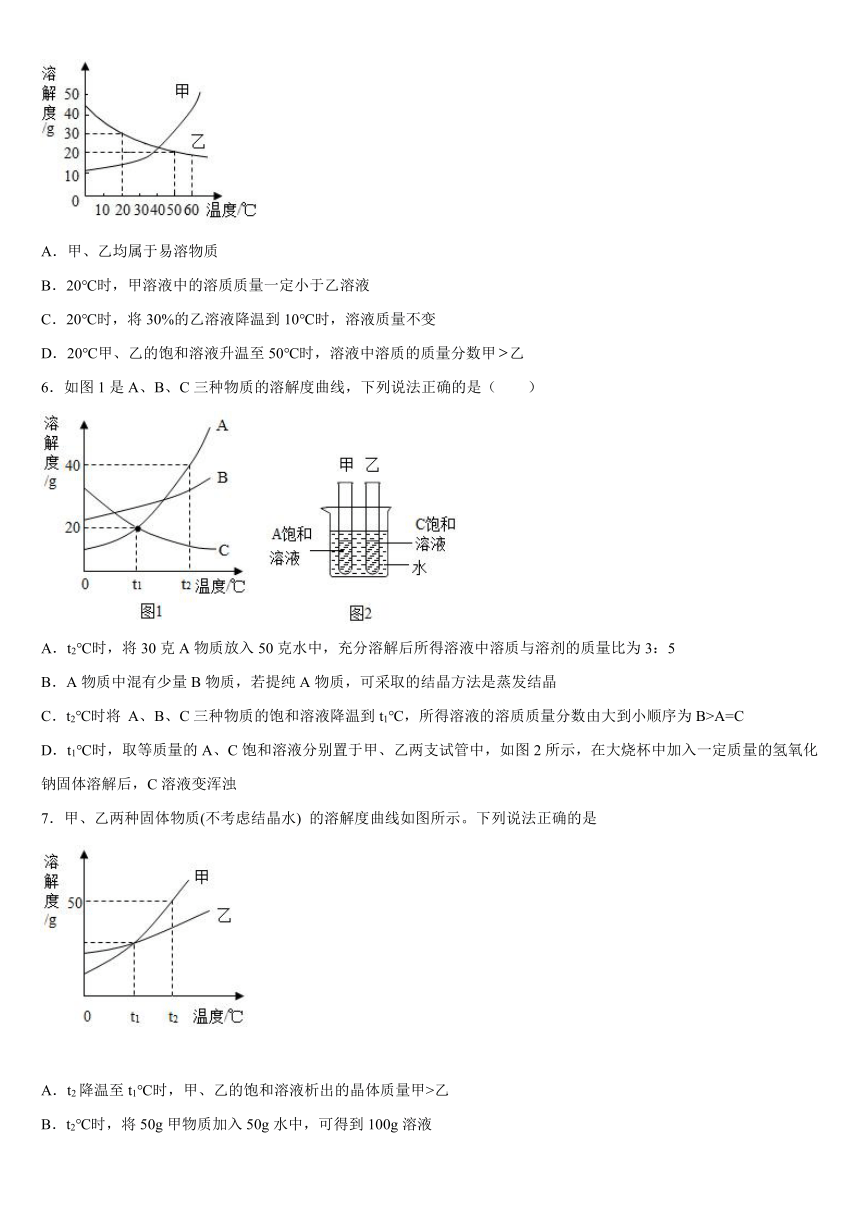
5.甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是
A.甲、乙均属于易溶物质
B.20℃时,甲溶液中的溶质质量一定小于乙溶液
C.20℃时,将30%的乙溶液降温到10℃时,溶液质量不变
D.20℃甲、乙的饱和溶液升温至50℃时,溶液中溶质的质量分数甲乙
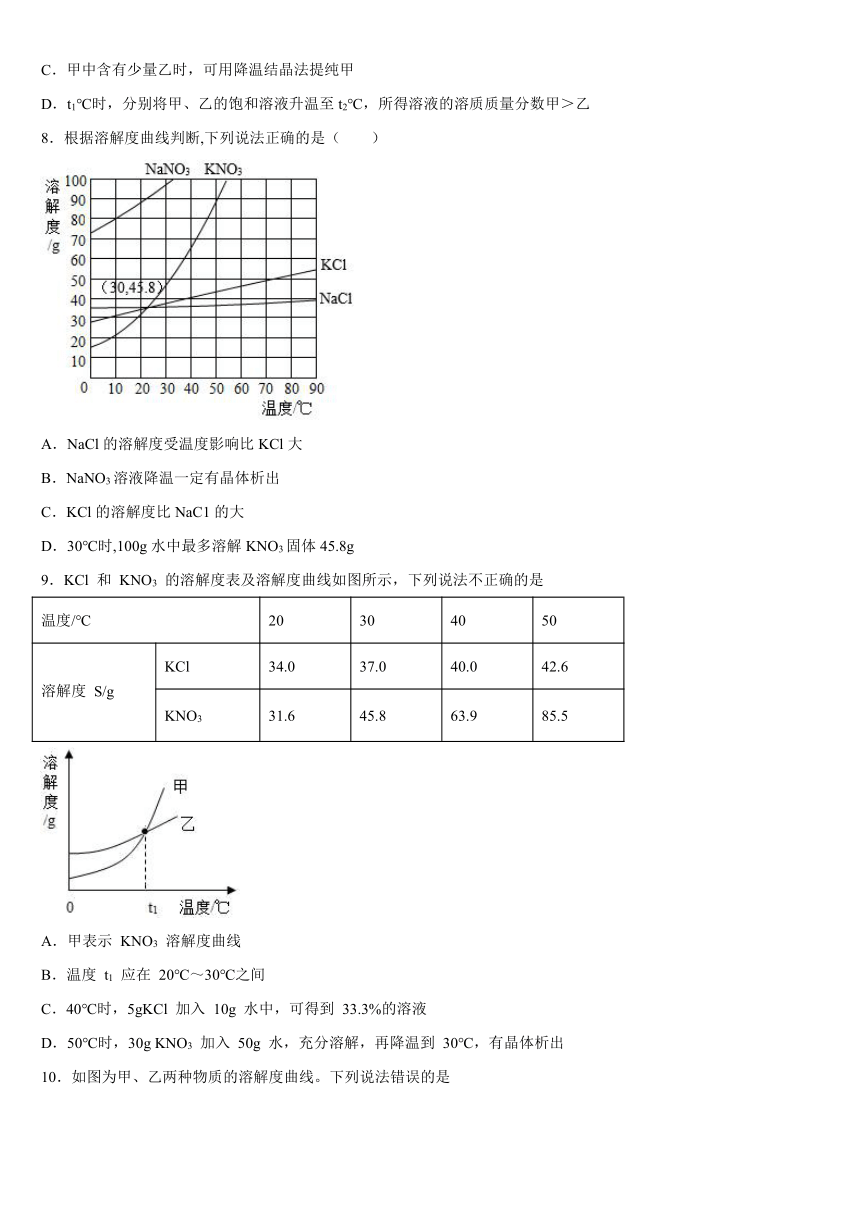
6.如图1是A、B、C三种物质的溶解度曲线,下列说法正确的是( )
A.t2℃时,将30克A物质放入50克水中,充分溶解后所得溶液中溶质与溶剂的质量比为3:5
B.A物质中混有少量B物质,若提纯A物质,可采取的结晶方法是蒸发结晶
C.t2℃时将 A、B、C三种物质的饱和溶液降温到t1℃,所得溶液的溶质质量分数由大到小顺序为B>A=C
D.t1℃时,取等质量的A、C饱和溶液分别置于甲、乙两支试管中,如图2所示,在大烧杯中加入一定质量的氢氧化钠固体溶解后,C溶液变浑浊
7.甲、乙两种固体物质(不考虑结晶水) 的溶解度曲线如图所示。下列说法正确的是
A.t2降温至t1℃时,甲、乙的饱和溶液析出的晶体质量甲>乙
B.t2℃时,将50g甲物质加入50g水中,可得到100g溶液
C.甲中含有少量乙时,可用降温结晶法提纯甲
D.t1℃时,分别将甲、乙的饱和溶液升温至t2℃,所得溶液的溶质质量分数甲>乙
8.根据溶解度曲线判断,下列说法正确的是( )
A.NaCl的溶解度受温度影响比KCl大
B.NaNO3溶液降温一定有晶体析出
C.KCl的溶解度比NaC1的大
D.30℃时,100g水中最多溶解KNO3固体45.8g
9.KCl 和 KNO3 的溶解度表及溶解度曲线如图所示,下列说法不正确的是
温度/℃ 20 30 40 50
溶解度 S/g KCl 34.0 37.0 40.0 42.6
KNO3 31.6 45.8 63.9 85.5
A.甲表示 KNO3 溶解度曲线
B.温度 t1 应在 20℃~30℃之间
C.40℃时,5gKCl 加入 10g 水中,可得到 33.3%的溶液
D.50℃时,30g KNO3 加入 50g 水,充分溶解,再降温到 30℃,有晶体析出
10.如图为甲、乙两种物质的溶解度曲线。下列说法错误的是
A.甲的溶解度受温度影响比乙大
B.10℃时,甲的溶解度小于乙的溶解度
C.20℃时,100g甲的饱和溶液中含有36g甲
D.20℃时,甲、乙的饱和溶液具有相同的溶质质量分数
11.三种不含结晶水的固体物质甲、乙、丙的溶解度曲线如下图,下列说法正确的是( )
A.将t1℃时的三种物质的饱和溶液升温至t2℃时,所得溶液的的溶质质量分数大小顺序是乙>甲>丙
B.在t2℃时,甲、乙两饱和溶液中含的溶质质量一定相等
C.甲、乙、丙三种物质的饱和溶液升温都会转化为不饱和溶液
D.要从含有少量甲的乙溶液中得到较多的乙晶体,通常可采用降温结晶的方法
12.总结归纳是化学学习的一种重要方法。请你判断下列除杂方法正确的是( )
选项 物质 杂质(少量) 除杂方法
A CO CO2 通过灼热的氧化铜
B MnO2 KCl 溶解、过滤、蒸发结晶
C CaCl2溶液 HCl 加入过量碳酸钙,充分反应后过滤
D NaCl溶液 MgCl2 加入适量的Ca(OH)2溶液,充分反应后过滤
A.A B.B C.C D.D
13.下表是氯化钾和碳酸钠在不同温度时的溶解度。下列说法正确的是
温度/°C 10 20 30 40
溶解度/g 氯化钾 31.0 34.0 37.0 40.0
碳酸钠 12.2 21.8 39.7 49.6
A.氯化钾的溶解度随温度的升高而减小
B.20°C时,将30g氯化钾加入100g水中,充分搅拌后得到不饱和溶液
C.30°C时,向139.7g碳酸钠的饱和溶液中加入30g水可得到溶质质量分数为28.4%的溶液
D.氯化钾的溶解度比碳酸钠大
14.图表法是一种常用的数据处理方法,根据所给图表(氢氧化钠、碳酸钠分别在水、酒精中的溶解度如下表所示),下列说法正确的是
氢氧化钠 碳酸钠
20℃ 40℃ 20℃ 40℃
水 109g 129g 21.8g 49g
酒精 17.3g 40g 不溶 不溶
A.上述图象表示碳酸钠的溶解度曲线
B.2℃时,氢氧化钠的溶解度大于碳酸钠
C.40℃时,若将50gNaOH分别投入到100g水和l00g酒精中,都能形成饱和溶液
D.40℃时,将适量CO2通入饱和的NaOH酒精溶液中,观察不到明显的现象
15.取等质量的下列条件下的Ca(OH)2溶液,吸收CO2最多的是
A.10 ℃的不饱和溶液 B.10 ℃的饱和溶液
C.30 ℃的不饱和溶液 D.30 ℃的饱和溶液
16.现有由MgO和MgCO3组成的混合物,其中镁元素的质量分数为48%。取该混合物10g,将其投入适量的稀硫酸中,两者恰好完全反应,则所得溶液中溶质的质量为( )
A.12g B.24g C.36g D.48g
二、综合题(共6题)
17.请回答下列问题:
(1)从 Na,O,C,H,Ca五种元素中选择适当元素,写出符合下列要求的各物质的化学式:
葡萄糖的化学式_______;具有还原性的有毒气体______;常见制氧物质_______改良酸性土壤的碱________;小苏打_______;2个碳酸根离子_________
(2)现有铁、氧化铜、稀盐酸、氢氧化钠溶液、硫酸铜溶液五种物质,两两混合能发生的反应有______个。写出其中一个反应的方程式_________
(3)已知浓硝酸(HNO3)见光会发生分解反应,生成红棕色的NO2气体和一种常见液体以及能供给呼吸的气体,写出该反应的化学方程式___________;
(4)某CaCl2样品中,可能含有KNO3、CuCl2、MgCl2、NaCl 和Na2CO3中的某些物质,取该样品m克溶于适量水中,得到澄清的无色溶液,然后向其中加入足量AgNO3溶液,得到n克白色沉淀,则该样品组成中,肯定没有的是:_______。
(5)粗盐中含有泥沙、CaCl2、MgCl2、Na2SO4杂质,在粗盐提纯过程中,通常先将粗盐溶于水,再依次滴加过量的______(填序号),(可选用的试剂:①Na2CO3溶液,②BaCl2溶液,③NaOH 溶液,)待充分反应后过滤,再向滤液中滴加适量的______,然后蒸发溶剂得到精盐。
(6)下图是甲、乙、丙三种固体物质的溶解度曲线图.
①要从甲的饱和溶液中析出晶体甲,可采用的方法是_____(只填一种).
②取t1℃时甲、乙、丙的饱和溶液分别升温至t2℃,三者所得溶液中溶质的质量分数大小关系为_______(用“>”、“<”或“=”表示)
③分别将t2℃时甲、乙、丙的饱和溶液降温至t1℃,则所得的三种溶液中溶质的质量分数大小关系是________。
18.下表为硝酸钾在不同温度下的溶解度:
温度(℃) 0 10 20 30 40 50 60 70
溶解度(g) 13.3 20.9 31.6 45.8 63.9 85.5 110 138
(1)硝酸钾的溶解随温度的升高而____________(填“增大”或“减小”)
(2)在20℃时,向100g水中加入120g硝酸钾固体,充分混合后所得溶液为____________(填“饱和”或“不饱和”)溶液,溶解度为____________。
19.下图为甲.乙、丙三种物质的溶解度曲线。
(1)20 °C时,三种物质中,溶解度最小的是_____;
(2)20° C时,将40g乙物质加入到50g水中,然后升温至50°C时,该溶液的溶质质量为_____;
(3)将50°C时等质量的甲、乙、丙的饱和溶液降温至10°C,此时三种溶液中溶质的质量关系为_____;(用“>、=”连接)。
20.盐酸是一种重要的酸。
(1)工业上制备盐酸的基础原料是精制食盐。粗盐(含有可溶性杂质主要有MgSO4、CaCl2)精制过程如下:
①加入Ba(OH)2溶液可以同时除去两种杂质离子,写出反应的化学方程式: _____ 。
②检验所加Na2CO3溶液过量的方法是 _____ 。
③向溶液X中加入适量盐酸的目的是 _____ 。
(2)利用中和反应可以测定盐酸的浓度。将40 g 0.8%氢氧化钠溶液逐滴加入到20 g盐酸中,边滴加边搅拌。随着氢氧化钠溶液的滴加,溶液pH变化如图所示。所用盐酸的溶质质量分数为 _____ 。
(3)用盐酸测定某石灰石样品中碳酸钙的质量分数。称取10 g石灰石(杂质不参加反应)放入烧杯中,加入100 g稀盐酸,二者恰好完全反应,反应后烧杯中剩余物质总质量为106.7 g(气体的溶解忽略不计)。请计算该样品中碳酸钙的质量分数 ______________ 。(写出计算过程)
21.水和溶液在生命活动和生产、生活中起着十分重要的作用.
(1)自来水生产过程中先用过滤的方法除去水中不溶性杂质,再进行消毒.X是一种常见的自来水消毒剂,工业上制取X的化学方程式为:Cl2+2NaClO2=2NaCl+2X,则X的化学式是____________,NaClO2中阴离子的化合价为__.
(2)井水中通常含有较多的钙、镁离子,属于硬水.可用加入_____的方法区别井水和蒸馏水.请写出生活中降低井水硬度的一种方法_____________.
(3)下面是水与其他物质之间的转化关系(反应条件及部分反应物已省去).其中属于化合反应的化学方程式为_____________. CH4→H2O→Ca(OH)2→H2O
(4)下列有关水的说法正确的是_____.
A 溶液中有水存在时水一定是溶剂
B 在水蒸发的过程中,水分子分解成氢原子和氧原子
C 水不可以用来鉴别硝酸铵、氢氧化钠、氯化钠、碳酸钙四种固体
D 水分子可以保持水的化学性质
(5)20℃时,将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3。请结合图示回答下列问题:
①图1中一定为饱和溶液的是_____.
②图3中表示乙的溶解度曲线是____;P点表示的含义是____________________________.
③在图4所示的实验中,小烧杯内盛放的是20℃时甲物质的饱和溶液。某同学要使小烧杯内有固体析出时,他应向大烧杯的水中加入下列物质中的____(填字母).
A 氧化钙 B 氯化钠 C 氢氧化钠 D 硝酸铵
参考答案
1.A
【分析】
本题考查溶解度曲线。
【详解】
A、c的饱和溶液由tC降温到t1℃,溶解度增大,溶质、溶剂质量都不变,所以溶液的溶质质量分数不变,故A符合题意;
B、a溶液的状态不能确定,所以将a的溶液由t2℃降温到t1℃,不一定有晶体析出,故B不符合题意;
C、t2℃时,a物质的溶解度是50g,所以50g的a溶于50g水,只能溶解25g的晶体,溶液的质量分数为,故C不符合题意;
D、在比较物质的溶解度时,需要指明温度,温度不能确定,溶解度大小也不能确定,故D不符合题意。
故选:A。
2.D
【分析】
根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
【详解】
A、甲物质的溶解度受温度变化影响较大,所以甲中含有少量乙,可用冷却热饱和溶液的方法提纯甲,故A错误;
B、t2℃时,溶液状态不能确定,所以甲溶液的溶质质量分数不一定等于乙溶液的溶质质量分数,故B错误;
C、t3℃时,甲物质的溶解度大于乙物质的溶解度,所以等质量的甲、乙两种物质的饱和溶液中含有的溶质的质量不可能相等,故C错误;
D、甲、乙物质的溶解度随温度的降低而减小,所以t1℃时,均可通过降低温度的方法将甲、乙的不饱和溶液变成饱和溶液,故D正确。
故选:D。
3.D
【详解】
A、木炭在氧气中燃烧,发出白光,放出大量的热,生成能使澄清石灰水变浑浊的气体,故选项说法错误。
B、红磷在空气中燃烧,产生大量的白烟,放出大量的热,而不是白雾,故选项说法错误。
C、降温时氢氧化钙的溶解度增大,饱和的石灰水因降低温度而变成不饱和的溶液,没有晶体析出,故选项说法错误。
D、由于二氧化碳能与水化合生成碳酸,所以二氧化碳通入紫色石蕊溶液中,紫色石蕊溶液由紫色变为红色,故选项说法正确。
故选:D。
4.A
【详解】
A、过滤只能将没有溶解的固体物质和溶液进行分离,而饱和溶液中溶质是均匀的分布在溶剂中的,不能够分离,选项A错误;
B、饱和的氯化钠溶液随着溶剂的蒸发,固体会逐渐的析出,选项B正确;
C、蒸馏是将水提纯的一个过程,将水分离出来,氯化钠就随之析出了,选项C正确;
D、结晶是将水分蒸发使晶体析出的过程,选项D正确。
故选A。
5.A
【详解】
A、由图可知,20℃时甲、乙的溶解度均大于10g,所以甲、乙均属于易溶物质,选项正确;
B、20℃时,甲的溶解度大于乙的溶解度,则甲的饱和溶液的溶质质量分数大于乙饱和溶液中的溶质质量分数,但溶液中的溶质质量除与溶质质量分数有关,还与溶液中的质量有关,题目中没有指明溶液的质量,所以不能比较两种溶液中溶质质量的多少,选项错误;
C、20℃时,乙的溶解度为30g,其饱和溶液的溶质质量分数为 ×100%≈23.1%<30%,选项错误;
D、20℃甲的溶解度小于20g,所以20℃甲得饱和溶液的溶质质量分数< ×100%≈16.7%,甲的溶解度随温度升高而增大,20℃甲的饱和溶液升温至50℃时,溶液由饱和溶液变为不饱和溶液,溶质质量分数不变,仍小于16.7%,乙的溶解度随温度升高而减小,20℃乙的饱和溶液升温至50℃时,乙仍为饱和溶液,此时乙的溶解度为20g,溶液的溶质质量分数为 ×100%≈16.7%,所以20℃甲、乙的饱和溶液升温至50℃时,溶液中溶质的质量分数甲<乙,选项错误,故选A。
6.D
【详解】
A、℃时,A物质的溶解度为40g,即100g水中最多能溶解40g的A物质,则50g水中最多能溶解A物质20g,故将30克A物质放入50克水中只能溶解20g,故溶液中溶质与溶剂的质量比为2:5,A错误;
B、A物质的溶解度受温度影响比B物质要大,故A物质中混有少量B物质,若提纯A物质应采用降温结晶,B错误;
C、相同温度下的饱和溶液,溶解度越大溶质的质量分数越大,℃时将 A、B、C三种物质的饱和溶液降温到℃,A、B物质的溶液会有晶体析出,仍为饱和溶液,此温度下,A的溶解度小于B的溶解度,故溶质的质量分数B>A,物质C的在降温后溶解度增大,变为饱和溶液,溶质的质量分数不变,仍为 ℃时溶解度对应的质量分数,故降温后物质C的溶液溶质质量分数最小,故降温后所得溶液的溶质质量分数由大到小顺序为B>A>C,C错误;
D、A物质的溶解度随温度的升高而增大,C物质的溶解度随温度的升高而减小,氢氧化钠溶于水放热使溶液温度升高,故在大烧杯中加入一定质量的氢氧化钠固体溶解后,C溶液变浑浊,D正确。
故选D
7.C
【详解】
A、t2℃降温至t1℃时,甲、乙的饱和溶液的质量不能确定,所以析出的晶体质量也不能确定,故A错误;
B、t2℃时,甲物质的溶解度是50g,所以将50g甲物质加入50g水中,只能溶解25g的晶体,可得到75g溶液,故B错误;
C、甲物质的溶解度受温度变化影响较大,所以甲中含有少量乙时,可用降温结晶法提纯甲,故C正确;
D、t1℃时,甲、乙物质的溶解度相等,甲、乙的饱和溶液的质量分数相等,升温至t2℃,溶解度增大,溶质、溶剂质量都不变,所以所得溶液的溶质质量分数甲=乙,故D错误。
故选:C。
8.D
【详解】
A、由图可知,KCl的溶解度曲线比NaCl的溶解度曲线陡,说明NaCl的溶解度受温度影响比KCl小,选项错误;
B、NaNO3的溶解度随温度的降低而减小,硝酸钠的饱和溶液降温一定有晶体析出,但是未注明溶液的状态,无法判断是否有晶体析出,选项错误;
C. 溶解度受温度影响,温度不同,溶解度不同,不指明温度,不能比较不同物质的溶解度的大小,选项错误;
D、由图可知,30℃时,硝酸钾的溶解度为45.8g,即30℃时,100g水中最多溶解KNO3固体的质量为45.8g,选项正确,故选D。
9.C
【分析】
由图可知,甲的溶解度受温度的影响变化大,乙的溶解度受温度的影响变化小。
【详解】
A、甲表示 KNO3 溶解度曲线正确,因为硝酸钾的溶解度受温度的影响变化大,A正确,故A不符合题意;
B、温度 t1 应在 20℃~30℃之间正确,正确但不符合题意,故B不符合题意;
C、40℃时,KCl的溶解度为40g,5gKCl 加入10g水中,溶解的质量为则可得到溶液的质量分数,C不正确,但符合题意;
D、50℃时,硝酸钾的溶解度为85.5g,所以30gKNO3 加入 50g水,充分溶解能得到不饱和溶液,再降温到 30℃,硝酸钾的溶解度只有45.8g,50g水中只能溶解22.9g,所以会有晶体析出正确,故D正确,但不符合题意。故选C。
10.C
【详解】
A、由图可知甲溶解度受温度影响较大,A正确。
B、由图可知,10℃时,甲的溶解度小于乙的溶解度,B正确。
C、20℃时,100g甲的饱和溶液中含有甲,C错误。
D、20℃时,甲、乙的溶解度相同,故饱和溶液具有相同的溶质质量分数,D正确。
故选:C。
11.A
【详解】
A、从溶解度曲线图看,t1℃时,甲、乙、丙的溶解度大小关系:乙>甲>丙,物质甲、乙的溶解度都随温度的升高而增大,所以升温,它们由饱和溶液变为不饱和溶液,但溶液中的溶质和溶剂质量不变,而丙的溶解度随温度的升高而减少,这样溶质析出,所以所得溶液的溶质质量分数大小顺序是乙>甲>丙,故A正确;
B、在t2℃时,甲、乙的溶解度相等,等质量甲、乙两饱和溶液中含的溶质质量一定相等,故B不正确;
C、丙的溶解度随温度的升高而减少,故丙物质的饱和溶液升温,会有晶体析出,溶液仍然饱和,故C不正确;
D、乙的溶解度随温度的升高变化不大,所以要从含有少量甲的乙溶液中得到较多的乙晶体,应采用蒸发结晶的方法,故D不正确。故选A。
12.C
【详解】
A、CO能与灼热的氧化铜反应生成铜和二氧化碳,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
B、KCl易溶于水,MnO2难溶于水,可采取加水溶解、过滤、洗涤、干燥的方法进行分离除杂,故选项所采取的方法错误。
C、HCl能与过量的碳酸钙反应生成氯化钙、水和二氧化碳,再过滤除去过量的碳酸钙,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
D、MgCl2能与适量的Ca(OH)2溶液反应生成氢氧化镁沉淀和氯化钙,能除去杂质但引入了新的杂质氯化钙,不符合除杂原则,故选项所采取的方法错误。
故选:C。
13.B
【详解】
A、由表中数据可知,氯化钾的溶解度随温度的升高而增大,故A错误;
B、20 °C时,氯化钾的溶解度为34.0g,所以该温度下将30 g氯化钾加入100 g水中所得溶液属于不饱和溶液,故B正确;
C、30 °C时碳酸钠的溶解度为39. 7 g,所以该温度下139.7 g碳酸钠的饱和溶液中碳酸钠的质量为39.7 g,向该溶液中加入30g水后,所得溶液的溶质质量分数为,故C错误;
D、未指明温度,
不能比较氯化钾和碳酸钠的溶解度大小,故 D错误。
故选:B。
14.B
【详解】
A、20℃时,碳酸钠在酒精中不溶,溶解度为零,所以上述图象表示氢氧化钠的溶解度曲线,错误;B、通过分析溶解度表中的数据可知,20℃时,氢氧化钠的溶解度大于碳酸钠;C、40℃时,氢氧化钠在水中的溶解度是129g,在酒精中的溶解度是40g,所以将50gNaOH分别投入到100g水和100g酒精中,能形成饱和溶液的是酒精,错误;D、二氧化碳和氢氧化钠反应生成碳酸钠和水,40℃时,碳酸钠不溶,所以再将CO2通入所得NaOH的酒精溶液中,观察到的现象为出现浑浊,错误。故选B。
15.B
【分析】
从氢氧化钙能和二氧化碳反应生成碳酸钙和水,氢氧化钙的溶解度随温度升高而减小,
相同温度下,物质的饱和溶液中溶质质量分数比不饱和溶液中溶质质量分数高。
【详解】
氢氧化钙的溶解度随温度的升高而减小,等质量10℃的饱和溶液比30℃的饱和溶液所含溶质质量多;同一温度下等质量的饱和溶液比不饱和溶液所含溶质的质量大,故等质量的上述溶液中,10℃的饱和溶液所含氢氧化钙的质量最多,吸收CO2最多。故选B。
16.B
【详解】
根据化学方程式Mg(OH)2+H2SO4═MgSO4+2H2O,MgO+H2SO4═MgSO4+H2O可知,混合物恰好完全反应,则混合物中镁元素的质量等于MgSO4中镁元素的质量。
设反应后溶液中的溶质MgSO4的质量为x,则
解得x=24g
故选B。
17.C6H12O6 :CO; H2O2; Ca(OH)2; NaHCO3; 2CO32-; 5 Fe+2HCl==FeCl2+H2↑ 4HNO3NO2+2H2O+O2↑ CuCl2、Na2CO3 ②①③ 稀盐酸 降温结晶法 乙>甲>丙 乙>甲>丙
【详解】
(1)葡萄糖的化学式为:C6H12O6,故填:C6H12O6;
具有还原性的有毒气体:CO,故填:CO;
常见制氧物质:H2O2,故填:H2O2;
改良酸性土壤的碱:Ca(OH)2,故填:Ca(OH)2;
小苏打主要成分:NaHCO3,故填:NaHCO3;
碳酸根离子:CO32-,故填:2CO32-;
(2)现有铁、氧化铜、稀盐酸、氢氧化钠溶液、硫酸铜溶液五种物质,两两混合能发生的反应有:铁+稀盐酸、铁+硫酸铜溶液、氧化铜+稀盐酸、稀盐酸+氢氧化钠溶液、氢氧化钠溶液+硫酸铜溶液,共5个,故填:5;其中一个反应的方程式:Fe+2HCl==FeCl2+H2↑,故填:Fe+2HCl==FeCl2+H2↑。
(3)已知浓硝酸(HNO3)见光会发生分解反应的化学方程式为:4HNO34NO2+2H2O+O2↑,故填:4HNO3 NO2+2H2O+O2↑。
(4)CaCl2样品溶于适量水中,得到澄清的无色溶液可知样品中无CuCl2(溶于水有色)和Na2CO3(与CaCl2不共存)。故填:CuCl2、Na2CO3。
(5)除去CaCl2、MgCl2、Na2SO4分别加入①Na2CO3溶液,③NaOH 溶液,②BaCl2溶液,但加入碳酸钠的作用还有除去过量的BaCl2,故②要在①前,故填:②①③。过量的氢氧化钠和碳酸钠可以用稀盐酸除去,故填:稀盐酸。
(6)①甲物质的溶解度随温度升高而增大,且变化幅度较大,故可用降温结晶法从甲的饱和溶液中析出晶体甲,故填:降温结晶法;
②t1℃时甲、乙、丙的饱和溶液分别升温至 t2℃,甲、乙溶液为不饱和溶液,溶质质量分数乙>甲,丙溶液为过饱和溶液,溶质质量分数最小,三者所得溶液中溶质的质量分数大小关系为乙>甲>丙,故填:乙>甲>丙。
③分别将t2℃时甲、乙、丙的饱和溶液降温至t1℃,甲、乙溶液为饱和溶液,溶质质量分数乙>甲,丙溶液为不饱和溶液,溶质质量分数小于甲,故填:乙>甲>丙。
18.增大 饱和 31.6g
【详解】
(1)根据表格提供的数据可以看出,硝酸钾的溶解度受温度的升高而增大;
(2)20℃,硝酸钾的溶解度是31.6g,故将120g硝酸钾与100g水混合,溶解后有剩余,形成的是饱和溶液。
19.丙 20g 乙>甲>丙
【详解】
(1)通过分析溶解度曲线可知,20℃时,三种物质中溶解度最小的是丙;
(2)20℃时,将40g乙物质加入到50g水中,然后升温至50℃,50℃时乙物质的溶解度是40g,根据溶解度概念可知,乙物质只能溶解20g,所以该溶液的溶质质量是20g;
(3)将50℃时甲、乙、丙三种物质的饱和溶液降温到10℃时,甲、乙的溶解度减小,丙的溶解度随温度的降低而增大,甲、乙有晶体析出,质量分数变小,溶液仍为饱和溶液,丙没有晶体析出,质量分数不变,一定温度下饱和溶液的溶质分数=,溶解度越大,质量分数越大,10℃时B的溶解度大于A的溶解度大于50℃时C的溶解度,所以10℃时三种物质的溶质质量分数由大到小的顺序是乙>甲>丙。
20.Ba(OH)2+MgSO4=BaSO4↓+Mg(OH)2↓ 继续往溶液中加入Na2CO3溶液,如果没有沉淀生成,则Na2CO3溶液已过量 除去过量的碳酸钠和调节溶液的pH 0.73% 75%
【详解】
(1)①氢氧化钡和硫酸镁反应生成碳酸钡和氢氧化镁,反应的化学方程式为:Ba(OH)2+MgSO4=BaSO4↓+Mg(OH)2↓;
②继续往溶液中加入Na2CO3溶液,如果没有沉淀生成,则Na2CO3溶液已过量;
③向溶液X中加入适量盐酸的目的是除去过量的碳酸钠和调节溶液的pH;
(2)由题意可知,当氢氧化钠溶液加入20g时和盐酸恰好完全反应。
20g0.8%的氢氧化钠溶液中含氢氧化钠的质量为:
20g×0.8%=0.16g
设20g盐酸中含溶质的质量为x
x=0.146g
所用盐酸的溶质质量分数为:×100%=0.73%
(3)生成二氧化碳的质量为:
10g+100g-106.7g=3.3g
设生成3.3g二氧化碳需要碳酸钙的质量为y
y=7.5g
该样品中碳酸钙的质量分数为:×100%=75%
答:该样品中碳酸钙的质量分数为75%。
故答案为
(1)①Ba(OH)2+MgSO4=BaSO4↓+Mg(OH)2↓;
②继续往溶液中加入Na2CO3溶液,如果没有沉淀生成,则Na2CO3溶液已过量;
③除去过量的碳酸钠和调节溶液的pH;
(2)0.73%;
(3)75%
21.ClO2 -1 肥皂水 煮沸 CaO+H2O═Ca(OH)2 AD 甲 N 30℃时甲和乙(或M和N)的溶解度相等 D
【详解】
(1)由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式,反应前氯、钠、氧原子个数分别为4、2、4,反应后的生成物中氯、钠、氧子个数分别为2、2、0,根据反应前后原子种类、数目不变,则2X中含有2个氯原子和4个氧原子,则每个X分子由1个氯原子和2个氧原子构成,则物质X的化学式为,中钠显+1价,氧显 2价,根据化合物中正负化合价代数和为零可知的化合价为+3价;
(2)硬水加肥皂后,产生的泡沫很少,还会形成白色垢状物;而软水则形成较多泡沫,把水煮沸能使水中钙、镁粒子沉淀,煮沸是常用的硬水转化为软水的方法;
(3)甲烷在氧气中燃烧生成水和二氧化碳,不属于化合反应;水和氧化钙反应生成氢氧化钙,属于化合反应;氢氧化钙和盐酸反应生成氯化钙和水,属于复分解反应;所以水和氧化钙反应生成氢氧化钙的反应属于化合反应,方程式是;
(4)A.溶液中有水存在时水一定是溶剂,故正确。
B. 在水蒸发的过程中,水分子结构不变,只是由液态变为气态,故错误。
C. 硝酸铵溶于水溶液温度降低,氢氧化钠溶于水溶液温度升高,氯化钠溶于水溶液温度基本不变,碳酸钙不溶于水,故水可以用来鉴别硝酸铵、氢氧化钠、氯化钠、碳酸钙四种固体,故错误。
D. 分子是保持物质化学性质的最小粒子,水分子可以保持水的化学性质,故正确。
(5)①从图1中可以知道甲没有完全溶解,则说明甲中形成的溶液为饱和溶液;
②根据图1中信息可以知道20℃时甲的溶解度小于乙的溶解度,而图3中在20℃时,N曲线的溶解度大于M曲线的溶解度,故N表示的是乙物质的溶解度曲线;根据溶解度曲线的意义可以知道:P点表示30℃时,甲、乙两种固体物质的溶解度相等;
③小烧杯内盛放的是20℃时甲物质的饱和溶液,某同学要使小烧杯内有固体析出时,则应降低温度;而氧化钙、氢氧化钠溶于水升温,氯化钠溶于水温度不变,硝酸铵溶于水温度降低,故向大烧杯的水中加入硝酸铵。
一、选择题(共16题)
1.a、b、c三种不含结晶水的物质的溶解度曲线如图,下列说法正确的是
A.c的饱和溶液由t2℃降温到t1℃,溶液的溶质质量分数不变
B.将a的溶液由t2℃降温到t1℃,一定有晶体析出
C.t2℃时,50g的a溶于50g水,溶液的质量分数为50%
D.a的溶解度大于b的溶解度
2.如图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是
A.甲中含有少量乙,可用冷却热饱和溶液的方法提纯乙
B.t2℃时,甲溶液的溶质质量分数一定等于乙溶液的溶质质量分数
C.t3℃时,等质量的甲、乙两种物质的饱和溶液中含有的溶质的质量可能相等
D.t1℃时,均可通过降低温度的方法将甲、乙的不饱和溶液变成饱和溶液
3.下列关于实验现象的描述正确的是
A.木炭在氧气中燃烧时发出白光,产生黑色固体
B.红磷在空气中燃烧产生大量白雾
C.饱和石灰水降低温度会有晶体析出
D.将二氧化碳通入紫色石蕊溶液中,溶液显红色
4.下列哪种方法不可能用于分离饱和溶液中的溶质和溶剂
A.过滤 B.蒸发
C.蒸馏 D.结晶
5.甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是
A.甲、乙均属于易溶物质
B.20℃时,甲溶液中的溶质质量一定小于乙溶液
C.20℃时,将30%的乙溶液降温到10℃时,溶液质量不变
D.20℃甲、乙的饱和溶液升温至50℃时,溶液中溶质的质量分数甲乙
6.如图1是A、B、C三种物质的溶解度曲线,下列说法正确的是( )
A.t2℃时,将30克A物质放入50克水中,充分溶解后所得溶液中溶质与溶剂的质量比为3:5
B.A物质中混有少量B物质,若提纯A物质,可采取的结晶方法是蒸发结晶
C.t2℃时将 A、B、C三种物质的饱和溶液降温到t1℃,所得溶液的溶质质量分数由大到小顺序为B>A=C
D.t1℃时,取等质量的A、C饱和溶液分别置于甲、乙两支试管中,如图2所示,在大烧杯中加入一定质量的氢氧化钠固体溶解后,C溶液变浑浊
7.甲、乙两种固体物质(不考虑结晶水) 的溶解度曲线如图所示。下列说法正确的是
A.t2降温至t1℃时,甲、乙的饱和溶液析出的晶体质量甲>乙
B.t2℃时,将50g甲物质加入50g水中,可得到100g溶液
C.甲中含有少量乙时,可用降温结晶法提纯甲
D.t1℃时,分别将甲、乙的饱和溶液升温至t2℃,所得溶液的溶质质量分数甲>乙
8.根据溶解度曲线判断,下列说法正确的是( )
A.NaCl的溶解度受温度影响比KCl大
B.NaNO3溶液降温一定有晶体析出
C.KCl的溶解度比NaC1的大
D.30℃时,100g水中最多溶解KNO3固体45.8g
9.KCl 和 KNO3 的溶解度表及溶解度曲线如图所示,下列说法不正确的是
温度/℃ 20 30 40 50
溶解度 S/g KCl 34.0 37.0 40.0 42.6
KNO3 31.6 45.8 63.9 85.5
A.甲表示 KNO3 溶解度曲线
B.温度 t1 应在 20℃~30℃之间
C.40℃时,5gKCl 加入 10g 水中,可得到 33.3%的溶液
D.50℃时,30g KNO3 加入 50g 水,充分溶解,再降温到 30℃,有晶体析出
10.如图为甲、乙两种物质的溶解度曲线。下列说法错误的是
A.甲的溶解度受温度影响比乙大
B.10℃时,甲的溶解度小于乙的溶解度
C.20℃时,100g甲的饱和溶液中含有36g甲
D.20℃时,甲、乙的饱和溶液具有相同的溶质质量分数
11.三种不含结晶水的固体物质甲、乙、丙的溶解度曲线如下图,下列说法正确的是( )
A.将t1℃时的三种物质的饱和溶液升温至t2℃时,所得溶液的的溶质质量分数大小顺序是乙>甲>丙
B.在t2℃时,甲、乙两饱和溶液中含的溶质质量一定相等
C.甲、乙、丙三种物质的饱和溶液升温都会转化为不饱和溶液
D.要从含有少量甲的乙溶液中得到较多的乙晶体,通常可采用降温结晶的方法
12.总结归纳是化学学习的一种重要方法。请你判断下列除杂方法正确的是( )
选项 物质 杂质(少量) 除杂方法
A CO CO2 通过灼热的氧化铜
B MnO2 KCl 溶解、过滤、蒸发结晶
C CaCl2溶液 HCl 加入过量碳酸钙,充分反应后过滤
D NaCl溶液 MgCl2 加入适量的Ca(OH)2溶液,充分反应后过滤
A.A B.B C.C D.D
13.下表是氯化钾和碳酸钠在不同温度时的溶解度。下列说法正确的是
温度/°C 10 20 30 40
溶解度/g 氯化钾 31.0 34.0 37.0 40.0
碳酸钠 12.2 21.8 39.7 49.6
A.氯化钾的溶解度随温度的升高而减小
B.20°C时,将30g氯化钾加入100g水中,充分搅拌后得到不饱和溶液
C.30°C时,向139.7g碳酸钠的饱和溶液中加入30g水可得到溶质质量分数为28.4%的溶液
D.氯化钾的溶解度比碳酸钠大
14.图表法是一种常用的数据处理方法,根据所给图表(氢氧化钠、碳酸钠分别在水、酒精中的溶解度如下表所示),下列说法正确的是
氢氧化钠 碳酸钠
20℃ 40℃ 20℃ 40℃
水 109g 129g 21.8g 49g
酒精 17.3g 40g 不溶 不溶
A.上述图象表示碳酸钠的溶解度曲线
B.2℃时,氢氧化钠的溶解度大于碳酸钠
C.40℃时,若将50gNaOH分别投入到100g水和l00g酒精中,都能形成饱和溶液
D.40℃时,将适量CO2通入饱和的NaOH酒精溶液中,观察不到明显的现象
15.取等质量的下列条件下的Ca(OH)2溶液,吸收CO2最多的是
A.10 ℃的不饱和溶液 B.10 ℃的饱和溶液
C.30 ℃的不饱和溶液 D.30 ℃的饱和溶液
16.现有由MgO和MgCO3组成的混合物,其中镁元素的质量分数为48%。取该混合物10g,将其投入适量的稀硫酸中,两者恰好完全反应,则所得溶液中溶质的质量为( )
A.12g B.24g C.36g D.48g
二、综合题(共6题)
17.请回答下列问题:
(1)从 Na,O,C,H,Ca五种元素中选择适当元素,写出符合下列要求的各物质的化学式:
葡萄糖的化学式_______;具有还原性的有毒气体______;常见制氧物质_______改良酸性土壤的碱________;小苏打_______;2个碳酸根离子_________
(2)现有铁、氧化铜、稀盐酸、氢氧化钠溶液、硫酸铜溶液五种物质,两两混合能发生的反应有______个。写出其中一个反应的方程式_________
(3)已知浓硝酸(HNO3)见光会发生分解反应,生成红棕色的NO2气体和一种常见液体以及能供给呼吸的气体,写出该反应的化学方程式___________;
(4)某CaCl2样品中,可能含有KNO3、CuCl2、MgCl2、NaCl 和Na2CO3中的某些物质,取该样品m克溶于适量水中,得到澄清的无色溶液,然后向其中加入足量AgNO3溶液,得到n克白色沉淀,则该样品组成中,肯定没有的是:_______。
(5)粗盐中含有泥沙、CaCl2、MgCl2、Na2SO4杂质,在粗盐提纯过程中,通常先将粗盐溶于水,再依次滴加过量的______(填序号),(可选用的试剂:①Na2CO3溶液,②BaCl2溶液,③NaOH 溶液,)待充分反应后过滤,再向滤液中滴加适量的______,然后蒸发溶剂得到精盐。
(6)下图是甲、乙、丙三种固体物质的溶解度曲线图.
①要从甲的饱和溶液中析出晶体甲,可采用的方法是_____(只填一种).
②取t1℃时甲、乙、丙的饱和溶液分别升温至t2℃,三者所得溶液中溶质的质量分数大小关系为_______(用“>”、“<”或“=”表示)
③分别将t2℃时甲、乙、丙的饱和溶液降温至t1℃,则所得的三种溶液中溶质的质量分数大小关系是________。
18.下表为硝酸钾在不同温度下的溶解度:
温度(℃) 0 10 20 30 40 50 60 70
溶解度(g) 13.3 20.9 31.6 45.8 63.9 85.5 110 138
(1)硝酸钾的溶解随温度的升高而____________(填“增大”或“减小”)
(2)在20℃时,向100g水中加入120g硝酸钾固体,充分混合后所得溶液为____________(填“饱和”或“不饱和”)溶液,溶解度为____________。
19.下图为甲.乙、丙三种物质的溶解度曲线。
(1)20 °C时,三种物质中,溶解度最小的是_____;
(2)20° C时,将40g乙物质加入到50g水中,然后升温至50°C时,该溶液的溶质质量为_____;
(3)将50°C时等质量的甲、乙、丙的饱和溶液降温至10°C,此时三种溶液中溶质的质量关系为_____;(用“>、=”连接)。
20.盐酸是一种重要的酸。
(1)工业上制备盐酸的基础原料是精制食盐。粗盐(含有可溶性杂质主要有MgSO4、CaCl2)精制过程如下:
①加入Ba(OH)2溶液可以同时除去两种杂质离子,写出反应的化学方程式: _____ 。
②检验所加Na2CO3溶液过量的方法是 _____ 。
③向溶液X中加入适量盐酸的目的是 _____ 。
(2)利用中和反应可以测定盐酸的浓度。将40 g 0.8%氢氧化钠溶液逐滴加入到20 g盐酸中,边滴加边搅拌。随着氢氧化钠溶液的滴加,溶液pH变化如图所示。所用盐酸的溶质质量分数为 _____ 。
(3)用盐酸测定某石灰石样品中碳酸钙的质量分数。称取10 g石灰石(杂质不参加反应)放入烧杯中,加入100 g稀盐酸,二者恰好完全反应,反应后烧杯中剩余物质总质量为106.7 g(气体的溶解忽略不计)。请计算该样品中碳酸钙的质量分数 ______________ 。(写出计算过程)
21.水和溶液在生命活动和生产、生活中起着十分重要的作用.
(1)自来水生产过程中先用过滤的方法除去水中不溶性杂质,再进行消毒.X是一种常见的自来水消毒剂,工业上制取X的化学方程式为:Cl2+2NaClO2=2NaCl+2X,则X的化学式是____________,NaClO2中阴离子的化合价为__.
(2)井水中通常含有较多的钙、镁离子,属于硬水.可用加入_____的方法区别井水和蒸馏水.请写出生活中降低井水硬度的一种方法_____________.
(3)下面是水与其他物质之间的转化关系(反应条件及部分反应物已省去).其中属于化合反应的化学方程式为_____________. CH4→H2O→Ca(OH)2→H2O
(4)下列有关水的说法正确的是_____.
A 溶液中有水存在时水一定是溶剂
B 在水蒸发的过程中,水分子分解成氢原子和氧原子
C 水不可以用来鉴别硝酸铵、氢氧化钠、氯化钠、碳酸钙四种固体
D 水分子可以保持水的化学性质
(5)20℃时,将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3。请结合图示回答下列问题:
①图1中一定为饱和溶液的是_____.
②图3中表示乙的溶解度曲线是____;P点表示的含义是____________________________.
③在图4所示的实验中,小烧杯内盛放的是20℃时甲物质的饱和溶液。某同学要使小烧杯内有固体析出时,他应向大烧杯的水中加入下列物质中的____(填字母).
A 氧化钙 B 氯化钠 C 氢氧化钠 D 硝酸铵
参考答案
1.A
【分析】
本题考查溶解度曲线。
【详解】
A、c的饱和溶液由tC降温到t1℃,溶解度增大,溶质、溶剂质量都不变,所以溶液的溶质质量分数不变,故A符合题意;
B、a溶液的状态不能确定,所以将a的溶液由t2℃降温到t1℃,不一定有晶体析出,故B不符合题意;
C、t2℃时,a物质的溶解度是50g,所以50g的a溶于50g水,只能溶解25g的晶体,溶液的质量分数为,故C不符合题意;
D、在比较物质的溶解度时,需要指明温度,温度不能确定,溶解度大小也不能确定,故D不符合题意。
故选:A。
2.D
【分析】
根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
【详解】
A、甲物质的溶解度受温度变化影响较大,所以甲中含有少量乙,可用冷却热饱和溶液的方法提纯甲,故A错误;
B、t2℃时,溶液状态不能确定,所以甲溶液的溶质质量分数不一定等于乙溶液的溶质质量分数,故B错误;
C、t3℃时,甲物质的溶解度大于乙物质的溶解度,所以等质量的甲、乙两种物质的饱和溶液中含有的溶质的质量不可能相等,故C错误;
D、甲、乙物质的溶解度随温度的降低而减小,所以t1℃时,均可通过降低温度的方法将甲、乙的不饱和溶液变成饱和溶液,故D正确。
故选:D。
3.D
【详解】
A、木炭在氧气中燃烧,发出白光,放出大量的热,生成能使澄清石灰水变浑浊的气体,故选项说法错误。
B、红磷在空气中燃烧,产生大量的白烟,放出大量的热,而不是白雾,故选项说法错误。
C、降温时氢氧化钙的溶解度增大,饱和的石灰水因降低温度而变成不饱和的溶液,没有晶体析出,故选项说法错误。
D、由于二氧化碳能与水化合生成碳酸,所以二氧化碳通入紫色石蕊溶液中,紫色石蕊溶液由紫色变为红色,故选项说法正确。
故选:D。
4.A
【详解】
A、过滤只能将没有溶解的固体物质和溶液进行分离,而饱和溶液中溶质是均匀的分布在溶剂中的,不能够分离,选项A错误;
B、饱和的氯化钠溶液随着溶剂的蒸发,固体会逐渐的析出,选项B正确;
C、蒸馏是将水提纯的一个过程,将水分离出来,氯化钠就随之析出了,选项C正确;
D、结晶是将水分蒸发使晶体析出的过程,选项D正确。
故选A。
5.A
【详解】
A、由图可知,20℃时甲、乙的溶解度均大于10g,所以甲、乙均属于易溶物质,选项正确;
B、20℃时,甲的溶解度大于乙的溶解度,则甲的饱和溶液的溶质质量分数大于乙饱和溶液中的溶质质量分数,但溶液中的溶质质量除与溶质质量分数有关,还与溶液中的质量有关,题目中没有指明溶液的质量,所以不能比较两种溶液中溶质质量的多少,选项错误;
C、20℃时,乙的溶解度为30g,其饱和溶液的溶质质量分数为 ×100%≈23.1%<30%,选项错误;
D、20℃甲的溶解度小于20g,所以20℃甲得饱和溶液的溶质质量分数< ×100%≈16.7%,甲的溶解度随温度升高而增大,20℃甲的饱和溶液升温至50℃时,溶液由饱和溶液变为不饱和溶液,溶质质量分数不变,仍小于16.7%,乙的溶解度随温度升高而减小,20℃乙的饱和溶液升温至50℃时,乙仍为饱和溶液,此时乙的溶解度为20g,溶液的溶质质量分数为 ×100%≈16.7%,所以20℃甲、乙的饱和溶液升温至50℃时,溶液中溶质的质量分数甲<乙,选项错误,故选A。
6.D
【详解】
A、℃时,A物质的溶解度为40g,即100g水中最多能溶解40g的A物质,则50g水中最多能溶解A物质20g,故将30克A物质放入50克水中只能溶解20g,故溶液中溶质与溶剂的质量比为2:5,A错误;
B、A物质的溶解度受温度影响比B物质要大,故A物质中混有少量B物质,若提纯A物质应采用降温结晶,B错误;
C、相同温度下的饱和溶液,溶解度越大溶质的质量分数越大,℃时将 A、B、C三种物质的饱和溶液降温到℃,A、B物质的溶液会有晶体析出,仍为饱和溶液,此温度下,A的溶解度小于B的溶解度,故溶质的质量分数B>A,物质C的在降温后溶解度增大,变为饱和溶液,溶质的质量分数不变,仍为 ℃时溶解度对应的质量分数,故降温后物质C的溶液溶质质量分数最小,故降温后所得溶液的溶质质量分数由大到小顺序为B>A>C,C错误;
D、A物质的溶解度随温度的升高而增大,C物质的溶解度随温度的升高而减小,氢氧化钠溶于水放热使溶液温度升高,故在大烧杯中加入一定质量的氢氧化钠固体溶解后,C溶液变浑浊,D正确。
故选D
7.C
【详解】
A、t2℃降温至t1℃时,甲、乙的饱和溶液的质量不能确定,所以析出的晶体质量也不能确定,故A错误;
B、t2℃时,甲物质的溶解度是50g,所以将50g甲物质加入50g水中,只能溶解25g的晶体,可得到75g溶液,故B错误;
C、甲物质的溶解度受温度变化影响较大,所以甲中含有少量乙时,可用降温结晶法提纯甲,故C正确;
D、t1℃时,甲、乙物质的溶解度相等,甲、乙的饱和溶液的质量分数相等,升温至t2℃,溶解度增大,溶质、溶剂质量都不变,所以所得溶液的溶质质量分数甲=乙,故D错误。
故选:C。
8.D
【详解】
A、由图可知,KCl的溶解度曲线比NaCl的溶解度曲线陡,说明NaCl的溶解度受温度影响比KCl小,选项错误;
B、NaNO3的溶解度随温度的降低而减小,硝酸钠的饱和溶液降温一定有晶体析出,但是未注明溶液的状态,无法判断是否有晶体析出,选项错误;
C. 溶解度受温度影响,温度不同,溶解度不同,不指明温度,不能比较不同物质的溶解度的大小,选项错误;
D、由图可知,30℃时,硝酸钾的溶解度为45.8g,即30℃时,100g水中最多溶解KNO3固体的质量为45.8g,选项正确,故选D。
9.C
【分析】
由图可知,甲的溶解度受温度的影响变化大,乙的溶解度受温度的影响变化小。
【详解】
A、甲表示 KNO3 溶解度曲线正确,因为硝酸钾的溶解度受温度的影响变化大,A正确,故A不符合题意;
B、温度 t1 应在 20℃~30℃之间正确,正确但不符合题意,故B不符合题意;
C、40℃时,KCl的溶解度为40g,5gKCl 加入10g水中,溶解的质量为则可得到溶液的质量分数,C不正确,但符合题意;
D、50℃时,硝酸钾的溶解度为85.5g,所以30gKNO3 加入 50g水,充分溶解能得到不饱和溶液,再降温到 30℃,硝酸钾的溶解度只有45.8g,50g水中只能溶解22.9g,所以会有晶体析出正确,故D正确,但不符合题意。故选C。
10.C
【详解】
A、由图可知甲溶解度受温度影响较大,A正确。
B、由图可知,10℃时,甲的溶解度小于乙的溶解度,B正确。
C、20℃时,100g甲的饱和溶液中含有甲,C错误。
D、20℃时,甲、乙的溶解度相同,故饱和溶液具有相同的溶质质量分数,D正确。
故选:C。
11.A
【详解】
A、从溶解度曲线图看,t1℃时,甲、乙、丙的溶解度大小关系:乙>甲>丙,物质甲、乙的溶解度都随温度的升高而增大,所以升温,它们由饱和溶液变为不饱和溶液,但溶液中的溶质和溶剂质量不变,而丙的溶解度随温度的升高而减少,这样溶质析出,所以所得溶液的溶质质量分数大小顺序是乙>甲>丙,故A正确;
B、在t2℃时,甲、乙的溶解度相等,等质量甲、乙两饱和溶液中含的溶质质量一定相等,故B不正确;
C、丙的溶解度随温度的升高而减少,故丙物质的饱和溶液升温,会有晶体析出,溶液仍然饱和,故C不正确;
D、乙的溶解度随温度的升高变化不大,所以要从含有少量甲的乙溶液中得到较多的乙晶体,应采用蒸发结晶的方法,故D不正确。故选A。
12.C
【详解】
A、CO能与灼热的氧化铜反应生成铜和二氧化碳,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
B、KCl易溶于水,MnO2难溶于水,可采取加水溶解、过滤、洗涤、干燥的方法进行分离除杂,故选项所采取的方法错误。
C、HCl能与过量的碳酸钙反应生成氯化钙、水和二氧化碳,再过滤除去过量的碳酸钙,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
D、MgCl2能与适量的Ca(OH)2溶液反应生成氢氧化镁沉淀和氯化钙,能除去杂质但引入了新的杂质氯化钙,不符合除杂原则,故选项所采取的方法错误。
故选:C。
13.B
【详解】
A、由表中数据可知,氯化钾的溶解度随温度的升高而增大,故A错误;
B、20 °C时,氯化钾的溶解度为34.0g,所以该温度下将30 g氯化钾加入100 g水中所得溶液属于不饱和溶液,故B正确;
C、30 °C时碳酸钠的溶解度为39. 7 g,所以该温度下139.7 g碳酸钠的饱和溶液中碳酸钠的质量为39.7 g,向该溶液中加入30g水后,所得溶液的溶质质量分数为,故C错误;
D、未指明温度,
不能比较氯化钾和碳酸钠的溶解度大小,故 D错误。
故选:B。
14.B
【详解】
A、20℃时,碳酸钠在酒精中不溶,溶解度为零,所以上述图象表示氢氧化钠的溶解度曲线,错误;B、通过分析溶解度表中的数据可知,20℃时,氢氧化钠的溶解度大于碳酸钠;C、40℃时,氢氧化钠在水中的溶解度是129g,在酒精中的溶解度是40g,所以将50gNaOH分别投入到100g水和100g酒精中,能形成饱和溶液的是酒精,错误;D、二氧化碳和氢氧化钠反应生成碳酸钠和水,40℃时,碳酸钠不溶,所以再将CO2通入所得NaOH的酒精溶液中,观察到的现象为出现浑浊,错误。故选B。
15.B
【分析】
从氢氧化钙能和二氧化碳反应生成碳酸钙和水,氢氧化钙的溶解度随温度升高而减小,
相同温度下,物质的饱和溶液中溶质质量分数比不饱和溶液中溶质质量分数高。
【详解】
氢氧化钙的溶解度随温度的升高而减小,等质量10℃的饱和溶液比30℃的饱和溶液所含溶质质量多;同一温度下等质量的饱和溶液比不饱和溶液所含溶质的质量大,故等质量的上述溶液中,10℃的饱和溶液所含氢氧化钙的质量最多,吸收CO2最多。故选B。
16.B
【详解】
根据化学方程式Mg(OH)2+H2SO4═MgSO4+2H2O,MgO+H2SO4═MgSO4+H2O可知,混合物恰好完全反应,则混合物中镁元素的质量等于MgSO4中镁元素的质量。
设反应后溶液中的溶质MgSO4的质量为x,则
解得x=24g
故选B。
17.C6H12O6 :CO; H2O2; Ca(OH)2; NaHCO3; 2CO32-; 5 Fe+2HCl==FeCl2+H2↑ 4HNO3NO2+2H2O+O2↑ CuCl2、Na2CO3 ②①③ 稀盐酸 降温结晶法 乙>甲>丙 乙>甲>丙
【详解】
(1)葡萄糖的化学式为:C6H12O6,故填:C6H12O6;
具有还原性的有毒气体:CO,故填:CO;
常见制氧物质:H2O2,故填:H2O2;
改良酸性土壤的碱:Ca(OH)2,故填:Ca(OH)2;
小苏打主要成分:NaHCO3,故填:NaHCO3;
碳酸根离子:CO32-,故填:2CO32-;
(2)现有铁、氧化铜、稀盐酸、氢氧化钠溶液、硫酸铜溶液五种物质,两两混合能发生的反应有:铁+稀盐酸、铁+硫酸铜溶液、氧化铜+稀盐酸、稀盐酸+氢氧化钠溶液、氢氧化钠溶液+硫酸铜溶液,共5个,故填:5;其中一个反应的方程式:Fe+2HCl==FeCl2+H2↑,故填:Fe+2HCl==FeCl2+H2↑。
(3)已知浓硝酸(HNO3)见光会发生分解反应的化学方程式为:4HNO34NO2+2H2O+O2↑,故填:4HNO3 NO2+2H2O+O2↑。
(4)CaCl2样品溶于适量水中,得到澄清的无色溶液可知样品中无CuCl2(溶于水有色)和Na2CO3(与CaCl2不共存)。故填:CuCl2、Na2CO3。
(5)除去CaCl2、MgCl2、Na2SO4分别加入①Na2CO3溶液,③NaOH 溶液,②BaCl2溶液,但加入碳酸钠的作用还有除去过量的BaCl2,故②要在①前,故填:②①③。过量的氢氧化钠和碳酸钠可以用稀盐酸除去,故填:稀盐酸。
(6)①甲物质的溶解度随温度升高而增大,且变化幅度较大,故可用降温结晶法从甲的饱和溶液中析出晶体甲,故填:降温结晶法;
②t1℃时甲、乙、丙的饱和溶液分别升温至 t2℃,甲、乙溶液为不饱和溶液,溶质质量分数乙>甲,丙溶液为过饱和溶液,溶质质量分数最小,三者所得溶液中溶质的质量分数大小关系为乙>甲>丙,故填:乙>甲>丙。
③分别将t2℃时甲、乙、丙的饱和溶液降温至t1℃,甲、乙溶液为饱和溶液,溶质质量分数乙>甲,丙溶液为不饱和溶液,溶质质量分数小于甲,故填:乙>甲>丙。
18.增大 饱和 31.6g
【详解】
(1)根据表格提供的数据可以看出,硝酸钾的溶解度受温度的升高而增大;
(2)20℃,硝酸钾的溶解度是31.6g,故将120g硝酸钾与100g水混合,溶解后有剩余,形成的是饱和溶液。
19.丙 20g 乙>甲>丙
【详解】
(1)通过分析溶解度曲线可知,20℃时,三种物质中溶解度最小的是丙;
(2)20℃时,将40g乙物质加入到50g水中,然后升温至50℃,50℃时乙物质的溶解度是40g,根据溶解度概念可知,乙物质只能溶解20g,所以该溶液的溶质质量是20g;
(3)将50℃时甲、乙、丙三种物质的饱和溶液降温到10℃时,甲、乙的溶解度减小,丙的溶解度随温度的降低而增大,甲、乙有晶体析出,质量分数变小,溶液仍为饱和溶液,丙没有晶体析出,质量分数不变,一定温度下饱和溶液的溶质分数=,溶解度越大,质量分数越大,10℃时B的溶解度大于A的溶解度大于50℃时C的溶解度,所以10℃时三种物质的溶质质量分数由大到小的顺序是乙>甲>丙。
20.Ba(OH)2+MgSO4=BaSO4↓+Mg(OH)2↓ 继续往溶液中加入Na2CO3溶液,如果没有沉淀生成,则Na2CO3溶液已过量 除去过量的碳酸钠和调节溶液的pH 0.73% 75%
【详解】
(1)①氢氧化钡和硫酸镁反应生成碳酸钡和氢氧化镁,反应的化学方程式为:Ba(OH)2+MgSO4=BaSO4↓+Mg(OH)2↓;
②继续往溶液中加入Na2CO3溶液,如果没有沉淀生成,则Na2CO3溶液已过量;
③向溶液X中加入适量盐酸的目的是除去过量的碳酸钠和调节溶液的pH;
(2)由题意可知,当氢氧化钠溶液加入20g时和盐酸恰好完全反应。
20g0.8%的氢氧化钠溶液中含氢氧化钠的质量为:
20g×0.8%=0.16g
设20g盐酸中含溶质的质量为x
x=0.146g
所用盐酸的溶质质量分数为:×100%=0.73%
(3)生成二氧化碳的质量为:
10g+100g-106.7g=3.3g
设生成3.3g二氧化碳需要碳酸钙的质量为y
y=7.5g
该样品中碳酸钙的质量分数为:×100%=75%
答:该样品中碳酸钙的质量分数为75%。
故答案为
(1)①Ba(OH)2+MgSO4=BaSO4↓+Mg(OH)2↓;
②继续往溶液中加入Na2CO3溶液,如果没有沉淀生成,则Na2CO3溶液已过量;
③除去过量的碳酸钠和调节溶液的pH;
(2)0.73%;
(3)75%
21.ClO2 -1 肥皂水 煮沸 CaO+H2O═Ca(OH)2 AD 甲 N 30℃时甲和乙(或M和N)的溶解度相等 D
【详解】
(1)由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式,反应前氯、钠、氧原子个数分别为4、2、4,反应后的生成物中氯、钠、氧子个数分别为2、2、0,根据反应前后原子种类、数目不变,则2X中含有2个氯原子和4个氧原子,则每个X分子由1个氯原子和2个氧原子构成,则物质X的化学式为,中钠显+1价,氧显 2价,根据化合物中正负化合价代数和为零可知的化合价为+3价;
(2)硬水加肥皂后,产生的泡沫很少,还会形成白色垢状物;而软水则形成较多泡沫,把水煮沸能使水中钙、镁粒子沉淀,煮沸是常用的硬水转化为软水的方法;
(3)甲烷在氧气中燃烧生成水和二氧化碳,不属于化合反应;水和氧化钙反应生成氢氧化钙,属于化合反应;氢氧化钙和盐酸反应生成氯化钙和水,属于复分解反应;所以水和氧化钙反应生成氢氧化钙的反应属于化合反应,方程式是;
(4)A.溶液中有水存在时水一定是溶剂,故正确。
B. 在水蒸发的过程中,水分子结构不变,只是由液态变为气态,故错误。
C. 硝酸铵溶于水溶液温度降低,氢氧化钠溶于水溶液温度升高,氯化钠溶于水溶液温度基本不变,碳酸钙不溶于水,故水可以用来鉴别硝酸铵、氢氧化钠、氯化钠、碳酸钙四种固体,故错误。
D. 分子是保持物质化学性质的最小粒子,水分子可以保持水的化学性质,故正确。
(5)①从图1中可以知道甲没有完全溶解,则说明甲中形成的溶液为饱和溶液;
②根据图1中信息可以知道20℃时甲的溶解度小于乙的溶解度,而图3中在20℃时,N曲线的溶解度大于M曲线的溶解度,故N表示的是乙物质的溶解度曲线;根据溶解度曲线的意义可以知道:P点表示30℃时,甲、乙两种固体物质的溶解度相等;
③小烧杯内盛放的是20℃时甲物质的饱和溶液,某同学要使小烧杯内有固体析出时,则应降低温度;而氧化钙、氢氧化钠溶于水升温,氯化钠溶于水温度不变,硝酸铵溶于水温度降低,故向大烧杯的水中加入硝酸铵。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
