浙江省丽水市高中发展共同体2021-2022学年高二下学期(2月)返校考试化学试题(Word版含答案)
文档属性
| 名称 | 浙江省丽水市高中发展共同体2021-2022学年高二下学期(2月)返校考试化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 269.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-24 16:32:53 | ||
图片预览



文档简介
丽水市高中发展共同体2021-2022学年高二下学期(2月)返校考试
化学试卷
可能用到的相对原子质量: H 1 Li 7 C12 N14 O16 Na23 Cl35.5 Ca 40 Fe 56 Cu 64
一、选择题(本大题共25小题,每小题2分,共50分。每个小题列出的四个备选项中只有一个是符合题
目要求的,不选、多选、错选均不得分)
1.下列物质的水溶液因水解而呈酸性的是
A. NaHSO4 B. NH4Cl C. SO2 D. H2SO4
2.下列物质属于弱电解质的是
A. CH3COOH B. H2SO4 C. NaCl D. NaOH
3.下列有关化学用语的表述正确的是
A.次氯酸的电子式为
B.基态铜原子的价电子轨道表示式为
C.基态氧原子的电子排布式为1s22s22p4
D. F- 的结构示意图为
4.下列各组元素中,电负性依次减小的是
A.F、N、O B.Cl、C、F C.As、N、H D. Cl、S、As
5.下列水溶液中的电离方程式正确的是
A. HCO3- +H2O= H3O+ +CO32-
B. NaHSO4 Na++H++ SO42-
C. CH3COOH =CH3COO-+ H+
D. KMnO4K+ + Mn7++ 4O2-
6.下列反应在任何温度下均能自发进行的是
A.2C(s)+ O2(g) 2CO(g) ΔH<0
B.2Mg(s)+CO2(g) = C(s) +2MgO(S) ΔH<0
C.2SO2 (g)+ O2(g) 2SO3(g) ΔH<0
D.2NH4Cl(s)+ Ba(OH)2 ·8H2O(s)= BaCl2(s)+ 2NH3(g)+ 10H2O(1) ΔH>0
7.蒸干含有下列溶质的溶液,能得到原溶质的是
A. NaClO B. CuSO4 C. Fe(NO3)3 D. NH4HCO3
8.常温下,下列溶液中由水电离出的c(OH-)为10-2 mol/L的是
A.0.01mol/L氨水 B.0.01mol/L 的NaOH溶液
C. pH= 2的硫酸氢铵 D. pH= 12的醋酸钠
9.四种短周期主族元素在周期表中的相对位置如图所示(已略去过渡元素),已知元素X的原子核外电子数是M的2倍。下列说法不正确的是
A. X元素位于第三周期IIIA族,属于s区
B.Y元素的基态原子核外有7种不同能量的电子
C. M元素的基态原子核外电子有4种空间运动状态
D.四种元素中,N元素的基态原子未成对电子数最多,电负性最大
10.下列说法正确的是
A.原电池的正极和电解池的阳极均发生失去电子的氧化反应
B.盐桥可以把负极区的阳离子转移到正极区,把正极区的阴离子转移到负极区
C.电镀池中电解液必须含镀层金属阳离子,且电镀时浓度保持不变
D.电解精炼铜时,阳极为粗铜,阴极为纯铜,电解液中c(Cu2+)保持不变
11.在恒温恒容条件下,发生反应A(s)+2B(g) 3X(g), c(B)随时间的变化如图中曲线甲所示。下列说法
正确的是
A.从a、c两点坐标可求得a、c两点该化学反应的速率
B. a、b、c三点的速率大小为: v 正( b)> v逆(a)>v 正(c)
C.若提高反应温度,则c(B)随时间变化关系如图中曲线乙所示。
D.反应达到平衡时一定存在关系: 3v(B)=2v(X)
12.以下现象与电化学腐蚀无关的是
A.纯银手镯表面变暗
B.白铁皮比马口铁更耐用
C.铁质器件附有铜质配件,在接触处铁易生锈
D.黄铜(铜锌合金)制作的铜锣不易产生铜绿
13.在平衡体系Ca(OH)2(s) Ca2+ (aq)+2OH- (aq) ΔH<0中, 能使c(Ca2+)减小,而使c(OH-)增大的是
A.加入少量CuCl2固体 B.加入少量K2CO3固体
C.升高体系温度 D.加入少量NaCl固体
14.常温下,下列有关醋酸溶液的叙述中不正确的是
A.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和,则a+b<14
B. pH=5.6 的CH3COOH与CH3COONa混合溶液中: c(Na+ )C.将pH=a的醋酸稀释为pH= a+1的过程中, 减小
D.向等体积pH均为2的醋酸和硫酸中分别加入足量锌粒,产生气体的量前者大于后者
15.设NA为阿伏伽德罗常数的值,下列说法正确的是
A.室温下,1L pH=l3的NaOH溶液中,由水电离的OH-离子数目为0.1 NA
B.FeCl3溶液中若lmolFe3+水解可生成NA个氢氧化铁胶粒
C.常温下,1mol氯气通入足量水中发生反应转移的电子数为NA
D.100mL 0.1mol·L-1 Na2CO3溶液中含有的阴离子数目大于0.01 NA
16.苯乙烯与溴苯在一定条件下发生Heck反应:++HBr,
某实验小组在原料及催化剂钯用量等均相同的条件下进行多组实验,测得如下数据:
反应温度/°C 100 100 100 100 120 140 160
反应时间/h 10 12 14 16 14 14 14
产率% 81.2 84.4 86.6 86.6 93.5 96.6 96.0
下列说法不正确的是
A.该反应为吸热反应
B.由表中数据推测最佳反应条件为140°C、14h
C.在100°C时、反应时间10-14h内,产率增加的原因是反应速率增大
D.从140°C到160°C,相同时间产率下降的原因可能是催化剂活性降低
17.下列热化学方程式中,正确的是
A.已知P(白磷,s)=P(红磷,s) △H=-17.6 kJ·mol-1,由此推知白磷更稳定
B.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+ 2O2(g)= CO2(g)+ 2H2O(1) △H = -890.3 kJ·mol -1
C.500°C、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3kJ,
其热化学方程式为: 3H2+N2 2NH3 △H=- 38.6 kJ·mol-1
D.用CH3COOH溶液和NaOH溶液反应测定中和热:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(1) △H < -57.3 kJ·mol-1
18.燃烧电池能量转化率高,以下是氢氧燃料电池结构示意图:
下列说法正确的是
A.电极室a为正极室,电极室b为负极室
B.燃烧电池的能量转化率可以达到100%
C.碱性电解液的氢氧燃料电池,氧化生成的水在O2侧产生;酸性电解液电池,水在H2侧产生
D.多孔隔膜既是电解液的仓库,也是反应产物H2O的通道,电解液除KOH外也可用H2SO4
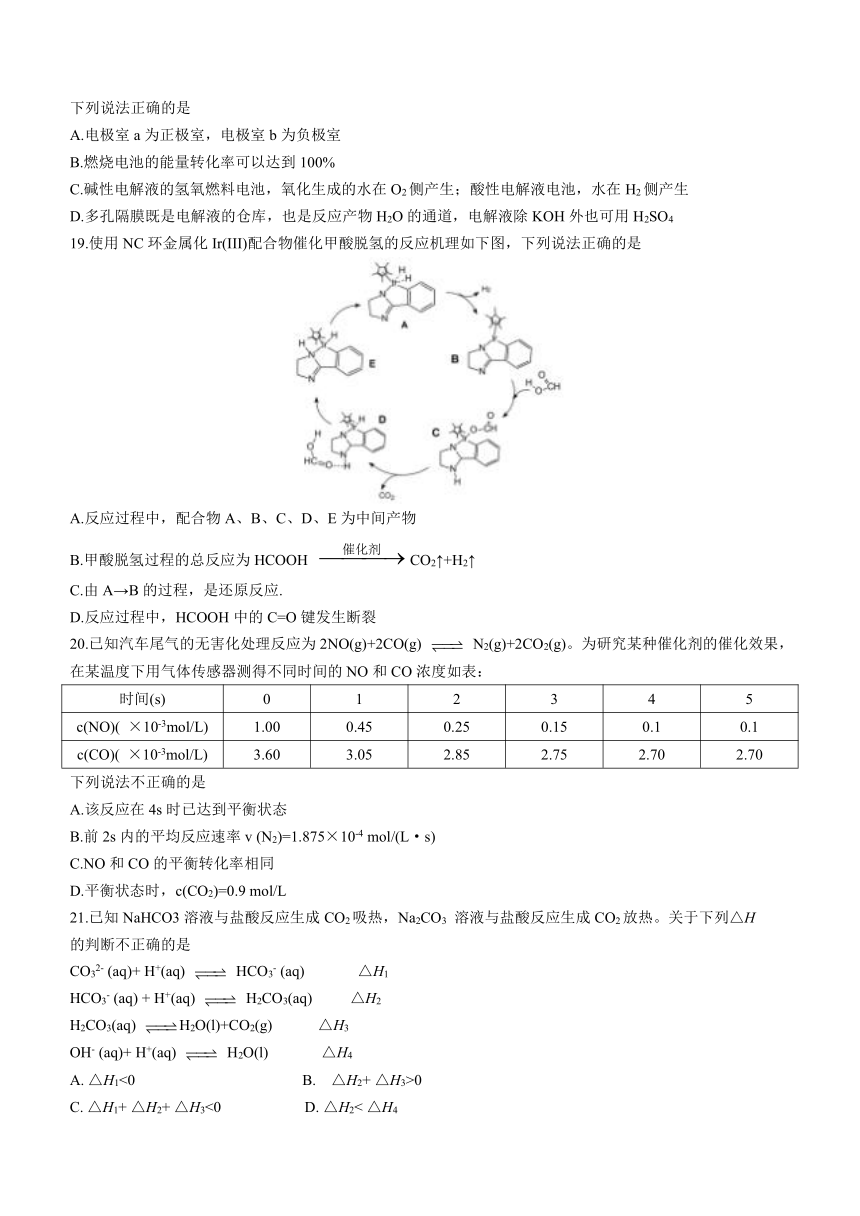
19.使用NC环金属化Ir(III)配合物催化甲酸脱氢的反应机理如下图,下列说法正确的是
A.反应过程中,配合物A、B、C、D、E为中间产物
B.甲酸脱氢过程的总反应为HCOOH CO2↑+H2↑
C.由A→B的过程,是还原反应.
D.反应过程中,HCOOH中的C=O键发生断裂
20.已知汽车尾气的无害化处理反应为2NO(g)+2CO(g) N2(g)+2CO2(g)。为研究某种催化剂的催化效果,
在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间(s) 0 1 2 3 4 5
c(NO)( ×10-3mol/L) 1.00 0.45 0.25 0.15 0.1 0.1
c(CO)( ×10-3mol/L) 3.60 3.05 2.85 2.75 2.70 2.70
下列说法不正确的是
A.该反应在4s时已达到平衡状态
B.前2s内的平均反应速率v (N2)=1.875×10-4 mol/(L·s)
C.NO和CO的平衡转化率相同
D.平衡状态时,c(CO2)=0.9 mol/L
21.已知NaHCO3溶液与盐酸反应生成CO2吸热,Na2CO3 溶液与盐酸反应生成CO2放热。关于下列△H
的判断不正确的是
CO32- (aq)+ H+(aq) HCO3- (aq) △H1
HCO3- (aq) + H+(aq) H2CO3(aq) △H2
H2CO3(aq) H2O(l)+CO2(g) △H3
OH- (aq)+ H+(aq) H2O(l) △H4
A. △H1<0 B. △H2+ △H3>0
C. △H1+ △H2+ △H3<0 D. △H2< △H4
22.近年来国家大力扶持新能源项目建设。图1是太阳能电池工作示意图,可与图2石墨烯锂电池联合使
用。已知石墨烯锂电池的反应式: LixC6+Li1-xMO2 C6+LiMO2 (M=Mn、 Co、Ni),下列说法
正确的是
A.给石墨烯锂电池充电时,Y接太阳能电池的N电极
B.石墨烯锂电池放电时,正极反应为: Li1-xMnO2+ xLi+ =LiMnO2
C.石墨烯锂电池放电时,负极反应为: LixC6-xe- =xLi+ +C6
D.石墨烯锂电池充电时,每转移lmol电子,图2中x极质量减少7g
23.断开1 mol化学键所吸收的能量,叫做该化学键的键能,某些 化学键的键能如下表所示:
化学键 H-Cl Cl- Cl C- H C- Cl
键能/(kJ ·mol) 43 l 243 414 x
已知: CH4(g)+ 2Cl2(g)=CH2Cl2(g)+ 2HCl(g) ΔH= -226 kJ·mol-1,则表中x为
A.150 B.276 C.339 D.356
24.氧化石墨烯的结构片段如图所示。一种新的制备方法是用 Pt电极,在稀硫酸中对石墨进行电解氧化。电解水产生的大量高活性氧自由基(如: ·OH)与石墨反应生成了氧化石墨烯。下列说法正确的是
A.石墨烯应该与电源的负极相连
B.电解过程中阴极反应式: 2H2O + 2e- = H2↑+2OH -
C.可用稀盐酸代替稀硫酸进行电解
D.生成“·OH”的电极反应式: H2O-e-=OH-+ H+
25.常温下,向20 mL 0.1 mol·L-1 Na2CO3溶液中滴加0.1 mo·L-1 CaCl2溶液,CO32-浓度与CaCl2溶液体积
的关系如图所示。已知: pC= -lg c(CO32-),Ksp(CdCO3)=1.0 ×10-l2, Ksp(CaCO3)= 3.6 ×10-9。下列说法
正确的是
A. a点溶液: c(OH- ) < 2c(HCO3-)+2c(H2CO3)
B.图像中V0=20, m=5
C.水的电离程度: aD.若用CdCl2溶液替代CaCl2溶液,则n点向b点方向迁移
二、非选择题(本大题共5小题,共50分)
26.(10分)随着能源技术的发展,科学家们将目光聚焦于锂的开发与研究。
(1)基态Li原子中电子占据最高能级的符号是 ,占据该能级电子的电子云轮廓图的形状为
形。
(2)在周期表中,与Li元素的化学性质最相似的邻族元素是 _ ( 填元素符号)。
(3)部分元素的第一电离能(I1)如表所示。
元素 Li Be Na K
I1(kJ·mol-1) 520 900 496 419
①碱金属的第一电离能与碱金属的金属性的联系是 。
②Be的第一电离能比Li的大,从原子结构角度分析其原因是_ 。
27. (10 分)亚磷酸(H3PO3)为二元弱酸,是重要的化工原料,可作尼龙增白剂、农药中间体等。
25°C时,H3PO3电离常数Ka1=8.4 ×10-3、Ka2=2.9×10-7。
(1)Na2HPO3为 (填“ 正盐”或“酸式盐”),其溶液显 (填“酸性”、 “中性”、“碱性”或“无法判断");
(2)写出NaH2PO3水解的离子方程式_ ;
25°C时,NaH2PO3 水解常数K= (结 果保留两位有效数字);
(3) 25°C时,CH3COOH电离常数Ka=1.8 ×10-5,写出CH3COOH溶液中与少量Na2HPO3溶液反应的离子方
程式_ 。
28.(6分)为探究难溶性盐X(仅含三种元素)的组成和性质,设计并完成如下实验:
已知:气体甲和气体乙组成元素相同,请回答:
(1)气体乙的摩尔质量是_ ;
(2)X的化学式是_ ;
(3)写出X在隔绝空气条件下加热分解的化学方程式 。
29. (12 分)某实验小组用100mL 0.50mol·L-1 NaOH溶液与60mL 0.50mo·L -1硫酸溶液进行中和热的测定,
装置如图所示。回答下列问题:
(1)若实验共需要400mLNaOH溶液,实验室在配制该溶液时,则需要称量NaOH固体 g。
(2)图中玻璃搅拌棒“环形”的目的是 。
(3)测量终止温度的方法是 。
(4)请填写表中的平均温度差:
实验 序号 起始温度t1/°C 终止温度 t2/°C 平均温度差 (t2-t1)/ °C
H2SO4 NaOH 平均值
1 26.2 26.0 26.1 30.1
2 27.0 27.4 27.2 31.2
3 25.9 25.9 25.9 29.8
4 26.4 26.2 26.3 30.4
(5)近似认为0.50mol·L-1 NaOH溶液与0.50mol·L-1硫酸溶液的密度都是lg·cm-3 ,中和后生成溶液的比热
容c=4.2J·g-1 ·°C-1,则上述实验测得的中和热ΔH=_ (结果保留至小数点后一位)。
(6)上述实验测得中和热的数值小于57.3kJ·mol-1,产生偏差的原因可能是_ 。
A.量取NaOH溶液时俯视读数 B.配制NaOH溶液定容时俯视
C.实验装置保温隔热效果差 D.向酸溶液中一次性加入碱溶液
30. (12 分)碘在生活和科研中有重要的应用。
(1)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。
先将一定量的碘溶于过量氢氧化钾溶液,发生反应: 3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为 。 电解过程中b电极附近溶液的pH ( 填“增大”或“减小”)
(2)已知:①I2(aq) I2(CCl4) K1=85
②I2(aq)+I-(aq) I3-(aq) K2≈ 1000
③I2(g)+H2(g) 2HI(g) ΔH= -9.48kJ ·mol-1
④W(s)+I2(g) WI2(g) ΔH<0
常温下,把溶解在H2O的I2提取到CCl4中的方法叫萃取,①正向移动,碘单质在水和CCl4混合液中存在①的溶解平衡,萃取时通常采用“少量多次”的目的是 。
(3)常温下,10mL0.1mol·L-1KI水溶液加入一定量的碘单质,加入10mLCCl4进行萃取,静置分层(实验过程中不考虑体积变化)。已知:I-和I3-不溶于CCl4,实验测得CCl4层液体中c(I2)=0.085mol·L-1,则水层中c(I-)=__ _ mol·L-1。
(4)反应③在一定条件下速率方程: v 正=K c(I2)c(H2),K为速率常数,下列说法正确的是 。
A.反应③的ΔS=0
B.反应③I2平衡转化率随温度升高变大
C.升高温度速率常数k变大
D.混合气体颜色不变时,反应已达到平衡状态
(5)在碘钨灯灯泡内封存少量的碘可以延长钨丝寿命,发生反应④,为模拟上述反应,取0.004mol碘和0.004mol钨放置在50.0mL密闭容器中反应,在450°C, n(WI2)随时 间变化图像如图所示,t1时,将温度升高到530°C, t2时达到平衡(530°C平衡常数k= )。请在图中画出n(WI2)从t1~t3随时间变化图像。
丽水市高中发展共同体2021-2022学年高二下学期(2月)返校考试
化学答案
一、选择题(本大题共25小题,每小题2分,共50分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13
答案 B A C D A A B D B C D A B
题号 14 15 16 17 18 19 20 21 22 23 24 25
答案 A D C B D B C D C C D A
二、非选择题(本大题共5小题,每空2分,共50分)
26.(1)①2s ②球 (2)Mg
(3)①从上到下,第一电离能越小,金属性越强
②基态Be原子的核外电子排布式为1s22s2,2s2为全满结构、原子的能量较低,较稳定
27.(1)正盐 碱性
(2) H2PO3 +H2O H3PO3+OH 1.210-12
(3) CH3COOH + HPO32 == H2PO3 + CH3COO
28.(1)28 g·mol-1 (2)FeC2O4
(3)FeC2O4FeO+CO↑+CO2↑
29. (1)10.0 (2)防止搅拌时碰撞温度计水银球
(3)温度不再升高时读出读数(或读出反应溶液最高温度)。
(4)4.0 (5)-53.8kJ·mol 1 (6)AC
30.(1) I--6e-+6OH-=IO3-+3H2O 增大
(2) 减小I2在CCl4中的溶解度,使①正向移动,提高碘的萃取率
(3)0.05 (4) CD
(5) (2分)
化学试卷
可能用到的相对原子质量: H 1 Li 7 C12 N14 O16 Na23 Cl35.5 Ca 40 Fe 56 Cu 64
一、选择题(本大题共25小题,每小题2分,共50分。每个小题列出的四个备选项中只有一个是符合题
目要求的,不选、多选、错选均不得分)
1.下列物质的水溶液因水解而呈酸性的是
A. NaHSO4 B. NH4Cl C. SO2 D. H2SO4
2.下列物质属于弱电解质的是
A. CH3COOH B. H2SO4 C. NaCl D. NaOH
3.下列有关化学用语的表述正确的是
A.次氯酸的电子式为
B.基态铜原子的价电子轨道表示式为
C.基态氧原子的电子排布式为1s22s22p4
D. F- 的结构示意图为
4.下列各组元素中,电负性依次减小的是
A.F、N、O B.Cl、C、F C.As、N、H D. Cl、S、As
5.下列水溶液中的电离方程式正确的是
A. HCO3- +H2O= H3O+ +CO32-
B. NaHSO4 Na++H++ SO42-
C. CH3COOH =CH3COO-+ H+
D. KMnO4K+ + Mn7++ 4O2-
6.下列反应在任何温度下均能自发进行的是
A.2C(s)+ O2(g) 2CO(g) ΔH<0
B.2Mg(s)+CO2(g) = C(s) +2MgO(S) ΔH<0
C.2SO2 (g)+ O2(g) 2SO3(g) ΔH<0
D.2NH4Cl(s)+ Ba(OH)2 ·8H2O(s)= BaCl2(s)+ 2NH3(g)+ 10H2O(1) ΔH>0
7.蒸干含有下列溶质的溶液,能得到原溶质的是
A. NaClO B. CuSO4 C. Fe(NO3)3 D. NH4HCO3
8.常温下,下列溶液中由水电离出的c(OH-)为10-2 mol/L的是
A.0.01mol/L氨水 B.0.01mol/L 的NaOH溶液
C. pH= 2的硫酸氢铵 D. pH= 12的醋酸钠
9.四种短周期主族元素在周期表中的相对位置如图所示(已略去过渡元素),已知元素X的原子核外电子数是M的2倍。下列说法不正确的是
A. X元素位于第三周期IIIA族,属于s区
B.Y元素的基态原子核外有7种不同能量的电子
C. M元素的基态原子核外电子有4种空间运动状态
D.四种元素中,N元素的基态原子未成对电子数最多,电负性最大
10.下列说法正确的是
A.原电池的正极和电解池的阳极均发生失去电子的氧化反应
B.盐桥可以把负极区的阳离子转移到正极区,把正极区的阴离子转移到负极区
C.电镀池中电解液必须含镀层金属阳离子,且电镀时浓度保持不变
D.电解精炼铜时,阳极为粗铜,阴极为纯铜,电解液中c(Cu2+)保持不变
11.在恒温恒容条件下,发生反应A(s)+2B(g) 3X(g), c(B)随时间的变化如图中曲线甲所示。下列说法
正确的是
A.从a、c两点坐标可求得a、c两点该化学反应的速率
B. a、b、c三点的速率大小为: v 正( b)> v逆(a)>v 正(c)
C.若提高反应温度,则c(B)随时间变化关系如图中曲线乙所示。
D.反应达到平衡时一定存在关系: 3v(B)=2v(X)
12.以下现象与电化学腐蚀无关的是
A.纯银手镯表面变暗
B.白铁皮比马口铁更耐用
C.铁质器件附有铜质配件,在接触处铁易生锈
D.黄铜(铜锌合金)制作的铜锣不易产生铜绿
13.在平衡体系Ca(OH)2(s) Ca2+ (aq)+2OH- (aq) ΔH<0中, 能使c(Ca2+)减小,而使c(OH-)增大的是
A.加入少量CuCl2固体 B.加入少量K2CO3固体
C.升高体系温度 D.加入少量NaCl固体
14.常温下,下列有关醋酸溶液的叙述中不正确的是
A.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和,则a+b<14
B. pH=5.6 的CH3COOH与CH3COONa混合溶液中: c(Na+ )
D.向等体积pH均为2的醋酸和硫酸中分别加入足量锌粒,产生气体的量前者大于后者
15.设NA为阿伏伽德罗常数的值,下列说法正确的是
A.室温下,1L pH=l3的NaOH溶液中,由水电离的OH-离子数目为0.1 NA
B.FeCl3溶液中若lmolFe3+水解可生成NA个氢氧化铁胶粒
C.常温下,1mol氯气通入足量水中发生反应转移的电子数为NA
D.100mL 0.1mol·L-1 Na2CO3溶液中含有的阴离子数目大于0.01 NA
16.苯乙烯与溴苯在一定条件下发生Heck反应:++HBr,
某实验小组在原料及催化剂钯用量等均相同的条件下进行多组实验,测得如下数据:
反应温度/°C 100 100 100 100 120 140 160
反应时间/h 10 12 14 16 14 14 14
产率% 81.2 84.4 86.6 86.6 93.5 96.6 96.0
下列说法不正确的是
A.该反应为吸热反应
B.由表中数据推测最佳反应条件为140°C、14h
C.在100°C时、反应时间10-14h内,产率增加的原因是反应速率增大
D.从140°C到160°C,相同时间产率下降的原因可能是催化剂活性降低
17.下列热化学方程式中,正确的是
A.已知P(白磷,s)=P(红磷,s) △H=-17.6 kJ·mol-1,由此推知白磷更稳定
B.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+ 2O2(g)= CO2(g)+ 2H2O(1) △H = -890.3 kJ·mol -1
C.500°C、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3kJ,
其热化学方程式为: 3H2+N2 2NH3 △H=- 38.6 kJ·mol-1
D.用CH3COOH溶液和NaOH溶液反应测定中和热:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(1) △H < -57.3 kJ·mol-1
18.燃烧电池能量转化率高,以下是氢氧燃料电池结构示意图:
下列说法正确的是
A.电极室a为正极室,电极室b为负极室
B.燃烧电池的能量转化率可以达到100%
C.碱性电解液的氢氧燃料电池,氧化生成的水在O2侧产生;酸性电解液电池,水在H2侧产生
D.多孔隔膜既是电解液的仓库,也是反应产物H2O的通道,电解液除KOH外也可用H2SO4
19.使用NC环金属化Ir(III)配合物催化甲酸脱氢的反应机理如下图,下列说法正确的是
A.反应过程中,配合物A、B、C、D、E为中间产物
B.甲酸脱氢过程的总反应为HCOOH CO2↑+H2↑
C.由A→B的过程,是还原反应.
D.反应过程中,HCOOH中的C=O键发生断裂
20.已知汽车尾气的无害化处理反应为2NO(g)+2CO(g) N2(g)+2CO2(g)。为研究某种催化剂的催化效果,
在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间(s) 0 1 2 3 4 5
c(NO)( ×10-3mol/L) 1.00 0.45 0.25 0.15 0.1 0.1
c(CO)( ×10-3mol/L) 3.60 3.05 2.85 2.75 2.70 2.70
下列说法不正确的是
A.该反应在4s时已达到平衡状态
B.前2s内的平均反应速率v (N2)=1.875×10-4 mol/(L·s)
C.NO和CO的平衡转化率相同
D.平衡状态时,c(CO2)=0.9 mol/L
21.已知NaHCO3溶液与盐酸反应生成CO2吸热,Na2CO3 溶液与盐酸反应生成CO2放热。关于下列△H
的判断不正确的是
CO32- (aq)+ H+(aq) HCO3- (aq) △H1
HCO3- (aq) + H+(aq) H2CO3(aq) △H2
H2CO3(aq) H2O(l)+CO2(g) △H3
OH- (aq)+ H+(aq) H2O(l) △H4
A. △H1<0 B. △H2+ △H3>0
C. △H1+ △H2+ △H3<0 D. △H2< △H4
22.近年来国家大力扶持新能源项目建设。图1是太阳能电池工作示意图,可与图2石墨烯锂电池联合使
用。已知石墨烯锂电池的反应式: LixC6+Li1-xMO2 C6+LiMO2 (M=Mn、 Co、Ni),下列说法
正确的是
A.给石墨烯锂电池充电时,Y接太阳能电池的N电极
B.石墨烯锂电池放电时,正极反应为: Li1-xMnO2+ xLi+ =LiMnO2
C.石墨烯锂电池放电时,负极反应为: LixC6-xe- =xLi+ +C6
D.石墨烯锂电池充电时,每转移lmol电子,图2中x极质量减少7g
23.断开1 mol化学键所吸收的能量,叫做该化学键的键能,某些 化学键的键能如下表所示:
化学键 H-Cl Cl- Cl C- H C- Cl
键能/(kJ ·mol) 43 l 243 414 x
已知: CH4(g)+ 2Cl2(g)=CH2Cl2(g)+ 2HCl(g) ΔH= -226 kJ·mol-1,则表中x为
A.150 B.276 C.339 D.356
24.氧化石墨烯的结构片段如图所示。一种新的制备方法是用 Pt电极,在稀硫酸中对石墨进行电解氧化。电解水产生的大量高活性氧自由基(如: ·OH)与石墨反应生成了氧化石墨烯。下列说法正确的是
A.石墨烯应该与电源的负极相连
B.电解过程中阴极反应式: 2H2O + 2e- = H2↑+2OH -
C.可用稀盐酸代替稀硫酸进行电解
D.生成“·OH”的电极反应式: H2O-e-=OH-+ H+
25.常温下,向20 mL 0.1 mol·L-1 Na2CO3溶液中滴加0.1 mo·L-1 CaCl2溶液,CO32-浓度与CaCl2溶液体积
的关系如图所示。已知: pC= -lg c(CO32-),Ksp(CdCO3)=1.0 ×10-l2, Ksp(CaCO3)= 3.6 ×10-9。下列说法
正确的是
A. a点溶液: c(OH- ) < 2c(HCO3-)+2c(H2CO3)
B.图像中V0=20, m=5
C.水的电离程度: a
二、非选择题(本大题共5小题,共50分)
26.(10分)随着能源技术的发展,科学家们将目光聚焦于锂的开发与研究。
(1)基态Li原子中电子占据最高能级的符号是 ,占据该能级电子的电子云轮廓图的形状为
形。
(2)在周期表中,与Li元素的化学性质最相似的邻族元素是 _ ( 填元素符号)。
(3)部分元素的第一电离能(I1)如表所示。
元素 Li Be Na K
I1(kJ·mol-1) 520 900 496 419
①碱金属的第一电离能与碱金属的金属性的联系是 。
②Be的第一电离能比Li的大,从原子结构角度分析其原因是_ 。
27. (10 分)亚磷酸(H3PO3)为二元弱酸,是重要的化工原料,可作尼龙增白剂、农药中间体等。
25°C时,H3PO3电离常数Ka1=8.4 ×10-3、Ka2=2.9×10-7。
(1)Na2HPO3为 (填“ 正盐”或“酸式盐”),其溶液显 (填“酸性”、 “中性”、“碱性”或“无法判断");
(2)写出NaH2PO3水解的离子方程式_ ;
25°C时,NaH2PO3 水解常数K= (结 果保留两位有效数字);
(3) 25°C时,CH3COOH电离常数Ka=1.8 ×10-5,写出CH3COOH溶液中与少量Na2HPO3溶液反应的离子方
程式_ 。
28.(6分)为探究难溶性盐X(仅含三种元素)的组成和性质,设计并完成如下实验:
已知:气体甲和气体乙组成元素相同,请回答:
(1)气体乙的摩尔质量是_ ;
(2)X的化学式是_ ;
(3)写出X在隔绝空气条件下加热分解的化学方程式 。
29. (12 分)某实验小组用100mL 0.50mol·L-1 NaOH溶液与60mL 0.50mo·L -1硫酸溶液进行中和热的测定,
装置如图所示。回答下列问题:
(1)若实验共需要400mLNaOH溶液,实验室在配制该溶液时,则需要称量NaOH固体 g。
(2)图中玻璃搅拌棒“环形”的目的是 。
(3)测量终止温度的方法是 。
(4)请填写表中的平均温度差:
实验 序号 起始温度t1/°C 终止温度 t2/°C 平均温度差 (t2-t1)/ °C
H2SO4 NaOH 平均值
1 26.2 26.0 26.1 30.1
2 27.0 27.4 27.2 31.2
3 25.9 25.9 25.9 29.8
4 26.4 26.2 26.3 30.4
(5)近似认为0.50mol·L-1 NaOH溶液与0.50mol·L-1硫酸溶液的密度都是lg·cm-3 ,中和后生成溶液的比热
容c=4.2J·g-1 ·°C-1,则上述实验测得的中和热ΔH=_ (结果保留至小数点后一位)。
(6)上述实验测得中和热的数值小于57.3kJ·mol-1,产生偏差的原因可能是_ 。
A.量取NaOH溶液时俯视读数 B.配制NaOH溶液定容时俯视
C.实验装置保温隔热效果差 D.向酸溶液中一次性加入碱溶液
30. (12 分)碘在生活和科研中有重要的应用。
(1)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。
先将一定量的碘溶于过量氢氧化钾溶液,发生反应: 3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为 。 电解过程中b电极附近溶液的pH ( 填“增大”或“减小”)
(2)已知:①I2(aq) I2(CCl4) K1=85
②I2(aq)+I-(aq) I3-(aq) K2≈ 1000
③I2(g)+H2(g) 2HI(g) ΔH= -9.48kJ ·mol-1
④W(s)+I2(g) WI2(g) ΔH<0
常温下,把溶解在H2O的I2提取到CCl4中的方法叫萃取,①正向移动,碘单质在水和CCl4混合液中存在①的溶解平衡,萃取时通常采用“少量多次”的目的是 。
(3)常温下,10mL0.1mol·L-1KI水溶液加入一定量的碘单质,加入10mLCCl4进行萃取,静置分层(实验过程中不考虑体积变化)。已知:I-和I3-不溶于CCl4,实验测得CCl4层液体中c(I2)=0.085mol·L-1,则水层中c(I-)=__ _ mol·L-1。
(4)反应③在一定条件下速率方程: v 正=K c(I2)c(H2),K为速率常数,下列说法正确的是 。
A.反应③的ΔS=0
B.反应③I2平衡转化率随温度升高变大
C.升高温度速率常数k变大
D.混合气体颜色不变时,反应已达到平衡状态
(5)在碘钨灯灯泡内封存少量的碘可以延长钨丝寿命,发生反应④,为模拟上述反应,取0.004mol碘和0.004mol钨放置在50.0mL密闭容器中反应,在450°C, n(WI2)随时 间变化图像如图所示,t1时,将温度升高到530°C, t2时达到平衡(530°C平衡常数k= )。请在图中画出n(WI2)从t1~t3随时间变化图像。
丽水市高中发展共同体2021-2022学年高二下学期(2月)返校考试
化学答案
一、选择题(本大题共25小题,每小题2分,共50分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13
答案 B A C D A A B D B C D A B
题号 14 15 16 17 18 19 20 21 22 23 24 25
答案 A D C B D B C D C C D A
二、非选择题(本大题共5小题,每空2分,共50分)
26.(1)①2s ②球 (2)Mg
(3)①从上到下,第一电离能越小,金属性越强
②基态Be原子的核外电子排布式为1s22s2,2s2为全满结构、原子的能量较低,较稳定
27.(1)正盐 碱性
(2) H2PO3 +H2O H3PO3+OH 1.210-12
(3) CH3COOH + HPO32 == H2PO3 + CH3COO
28.(1)28 g·mol-1 (2)FeC2O4
(3)FeC2O4FeO+CO↑+CO2↑
29. (1)10.0 (2)防止搅拌时碰撞温度计水银球
(3)温度不再升高时读出读数(或读出反应溶液最高温度)。
(4)4.0 (5)-53.8kJ·mol 1 (6)AC
30.(1) I--6e-+6OH-=IO3-+3H2O 增大
(2) 减小I2在CCl4中的溶解度,使①正向移动,提高碘的萃取率
(3)0.05 (4) CD
(5) (2分)
同课章节目录
