2021-2022学年高中化学新鲁科版选择性必修2 第1章 第1节原子结构模型 课件(62张)
文档属性
| 名称 | 2021-2022学年高中化学新鲁科版选择性必修2 第1章 第1节原子结构模型 课件(62张) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-24 17:12:26 | ||
图片预览








文档简介
(共62张PPT)
第1章 原子结构与元素性质
第1节 原子结构模型
必备知识·自主学习
一、氢原子光谱和玻尔的原子结构模型
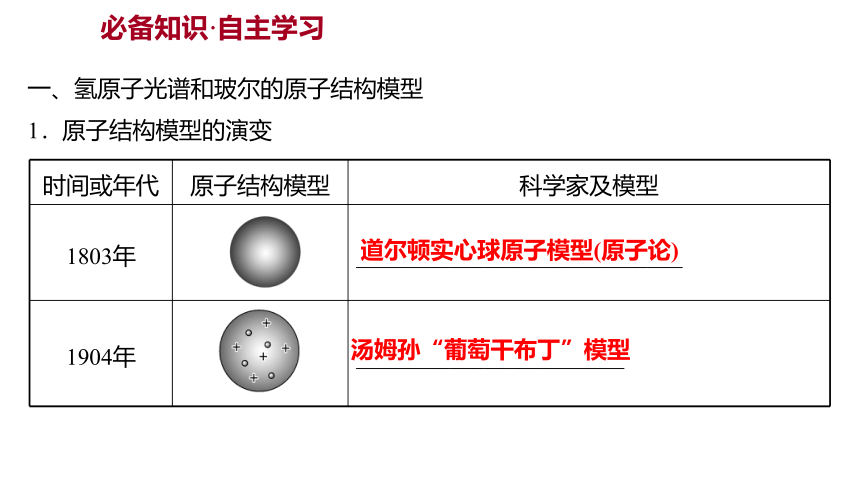
1.原子结构模型的演变
时间或年代 原子结构模型 科学家及模型
1803年 ____________________________
1904年 _______________________
道尔顿实心球原子模型(原子论)
汤姆孙“葡萄干布丁”模型
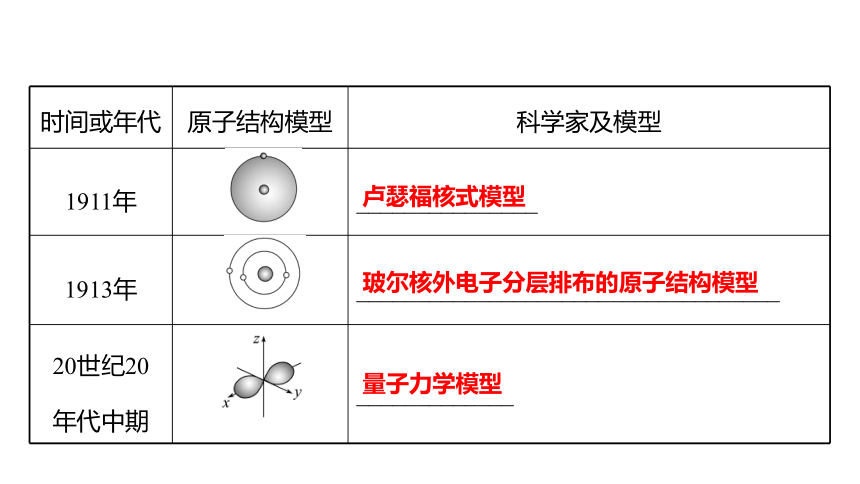
时间或年代 原子结构模型 科学家及模型
1911年 _______________
1913年 ___________________________________
20世纪20
年代中期 _____________
卢瑟福核式模型
玻尔核外电子分层排布的原子结构模型
量子力学模型
2.光谱及氢原子光谱
(1)光谱
①含义:利用原子光谱仪将物质_________或_________的频率(或波长)和强度
分布记录下来的谱线。
②形成原因:电子在不同轨道间_____时,会辐射或吸收能量。
(2)氢原子光谱属于线状光谱。
吸收的光
发射的光
跃迁
3.玻尔的原子结构模型
(1)基本观点
运动轨迹 原子中的电子在具有确定半径的圆周轨道上绕_______运动,
并且不辐射能量
能量分布 在不同轨道上运动的电子具有_____的能量,而且能量值是
_______的。轨道能量依n(量子数)值(1、2、3…)的增大而_____
电子跃迁 对氢原子而言,电子处在n=1的轨道时能量最低,这种状态称为
_____;能量高于基态能量的状态,称为_______。电子在能量不
同的轨道之间跃迁时,辐射或吸收的能量以光的形式表现出来并
被记录下来,就形成了_____
原子核
不同
不连续
升高
基态
激发态
光谱
(2)贡献
①成功地解释了氢原子光谱是_________的实验事实。
②阐明了原子光谱源自核外电子在能量不同的轨道之间的跃迁,而电子所处的
轨道的能量是_______的。
线状光谱
量子化
【自主探索】
1.判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)氢原子核外只有一个电子,故氢原子光谱只有一条谱线。( )
提示:电子发生跃迁,能产生很多谱线。
(2)基态氢原子转变成激发态氢原子时释放能量。( )
提示:基态氢原子转变成激发态氢原子时需要吸收能量。
(3)玻尔理论不能解释在有外加磁场时氢原子光谱有多条谱线。( )
提示:在外加磁场时,氢原子有多条谱线,玻尔的原子结构模型已无法解释这
一现象,必须借助量子力学加以解释。
×
×
√
2.能级
当n相同时,电子所具有的能量可能_____,即同一电子层可分成不同的
_____,当n=x时,有__个能级,分别用符号__________等表示。
不同
能级
x
s、p、d、f
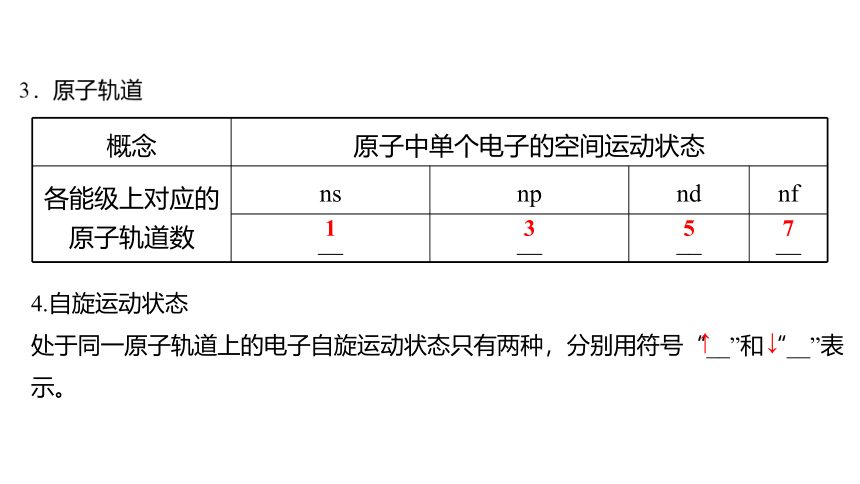
概念 原子中单个电子的空间运动状态
各能级上对应的原子轨道数 ns np nd nf
__ __ __ __
4.自旋运动状态
处于同一原子轨道上的电子自旋运动状态只有两种,分别用符号“__”和“__”表
示。
1
3
5
7
↑
↓
s轨道 呈球形,具有___对称性
p轨道 相对于x、y、z___对称,呈哑铃形(∞)
球
轴
2.电子云图
(1)概念:描述电子在原子核外空间某处单位体积内的_____分布的图形。
(2)含义:用单位体积内小点的疏密程度表示电子在原子核外某处单位体积内
出现_____的大小。
概率
概率
关键能力·合作学习
n(电子层) 能级 原子轨道 最多容纳
电子数
取值 符号 符号 符号 数目 合计
1 K _ __ 1 __ __
2 L _ __ 1 __ __
__ _____________ 3
s
1s
1
2
s
2s
p
2px、2py、2pz
4
8
n(电子层) 能级 原子轨道 最多容纳
电子数
取值 符号 符号 符号 数目 合计
3 M _ __ 1 __ ___
__ _____________ 3
__ ___ 5
4 N _ __ 1 ___ ___
__ _____________ 3
__ ___ 5
_ __ 7
n …… __ ___
s
3s
p
3px、3py、3pz
d
3d
9
18
s
4s
p
4px、4py、4pz
d
4d
f
4f
16
32
n2
2n2
课堂检测·素养达标
电子层数 预测各能级上的电子数目 预测依据
3 s
p
d
4 s
p
d
f
电子层数 预测各能级上的电子数目 预测依据
3 s 2 同一电子层上的原子轨道的能量高低为nsp 6
d 7
4 s 2
p 0
d 0
f 0
第1章 原子结构与元素性质
第1节 原子结构模型
必备知识·自主学习
一、氢原子光谱和玻尔的原子结构模型
1.原子结构模型的演变
时间或年代 原子结构模型 科学家及模型
1803年 ____________________________
1904年 _______________________
道尔顿实心球原子模型(原子论)
汤姆孙“葡萄干布丁”模型
时间或年代 原子结构模型 科学家及模型
1911年 _______________
1913年 ___________________________________
20世纪20
年代中期 _____________
卢瑟福核式模型
玻尔核外电子分层排布的原子结构模型
量子力学模型
2.光谱及氢原子光谱
(1)光谱
①含义:利用原子光谱仪将物质_________或_________的频率(或波长)和强度
分布记录下来的谱线。
②形成原因:电子在不同轨道间_____时,会辐射或吸收能量。
(2)氢原子光谱属于线状光谱。
吸收的光
发射的光
跃迁
3.玻尔的原子结构模型
(1)基本观点
运动轨迹 原子中的电子在具有确定半径的圆周轨道上绕_______运动,
并且不辐射能量
能量分布 在不同轨道上运动的电子具有_____的能量,而且能量值是
_______的。轨道能量依n(量子数)值(1、2、3…)的增大而_____
电子跃迁 对氢原子而言,电子处在n=1的轨道时能量最低,这种状态称为
_____;能量高于基态能量的状态,称为_______。电子在能量不
同的轨道之间跃迁时,辐射或吸收的能量以光的形式表现出来并
被记录下来,就形成了_____
原子核
不同
不连续
升高
基态
激发态
光谱
(2)贡献
①成功地解释了氢原子光谱是_________的实验事实。
②阐明了原子光谱源自核外电子在能量不同的轨道之间的跃迁,而电子所处的
轨道的能量是_______的。
线状光谱
量子化
【自主探索】
1.判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)氢原子核外只有一个电子,故氢原子光谱只有一条谱线。( )
提示:电子发生跃迁,能产生很多谱线。
(2)基态氢原子转变成激发态氢原子时释放能量。( )
提示:基态氢原子转变成激发态氢原子时需要吸收能量。
(3)玻尔理论不能解释在有外加磁场时氢原子光谱有多条谱线。( )
提示:在外加磁场时,氢原子有多条谱线,玻尔的原子结构模型已无法解释这
一现象,必须借助量子力学加以解释。
×
×
√
2.能级
当n相同时,电子所具有的能量可能_____,即同一电子层可分成不同的
_____,当n=x时,有__个能级,分别用符号__________等表示。
不同
能级
x
s、p、d、f
概念 原子中单个电子的空间运动状态
各能级上对应的原子轨道数 ns np nd nf
__ __ __ __
4.自旋运动状态
处于同一原子轨道上的电子自旋运动状态只有两种,分别用符号“__”和“__”表
示。
1
3
5
7
↑
↓
s轨道 呈球形,具有___对称性
p轨道 相对于x、y、z___对称,呈哑铃形(∞)
球
轴
2.电子云图
(1)概念:描述电子在原子核外空间某处单位体积内的_____分布的图形。
(2)含义:用单位体积内小点的疏密程度表示电子在原子核外某处单位体积内
出现_____的大小。
概率
概率
关键能力·合作学习
n(电子层) 能级 原子轨道 最多容纳
电子数
取值 符号 符号 符号 数目 合计
1 K _ __ 1 __ __
2 L _ __ 1 __ __
__ _____________ 3
s
1s
1
2
s
2s
p
2px、2py、2pz
4
8
n(电子层) 能级 原子轨道 最多容纳
电子数
取值 符号 符号 符号 数目 合计
3 M _ __ 1 __ ___
__ _____________ 3
__ ___ 5
4 N _ __ 1 ___ ___
__ _____________ 3
__ ___ 5
_ __ 7
n …… __ ___
s
3s
p
3px、3py、3pz
d
3d
9
18
s
4s
p
4px、4py、4pz
d
4d
f
4f
16
32
n2
2n2
课堂检测·素养达标
电子层数 预测各能级上的电子数目 预测依据
3 s
p
d
4 s
p
d
f
电子层数 预测各能级上的电子数目 预测依据
3 s 2 同一电子层上的原子轨道的能量高低为ns
d 7
4 s 2
p 0
d 0
f 0
