四川省南充市阆中市2021-2022学年高二下学期开学考试化学试题(Word版含答案)
文档属性
| 名称 | 四川省南充市阆中市2021-2022学年高二下学期开学考试化学试题(Word版含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 309.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-24 23:15:51 | ||
图片预览

文档简介
阆中市2021-2022学年高二下学期开学考试
化 学
(满分:100分 时间:50分钟)
可能用到的原子量:H—1,C—12,N—14,O—16,Na—23,Mg—24,P-31,Cl—35.5,
Fe—56,Cu—64,S—32,Mn—55,Cr—52
第Ⅰ卷(选择题,共50分)
一、选择题(本题包括10小题,每小题5分,共50分)
1. 电影《厉害了,我的国》通过镜头将我国在改革开放和社会主义现代化建设上所取
得的历史性成就,进行了全方位、多层次的展现。下列说法错误的是
大型客机C919机身表面含有耐紫外线的物质PMMA(聚甲基丙烯酸甲酯),PMMA
属于有机高分子化合物
中国天眼为我国探索宇宙提供了有力的保障,其中的防腐蚀材料磷酸钡属于强电
解质
DF﹣5弹道导弹是国之利器,其含有金属钐(Sm),钐的活动性介于钠与铝之间,
工业上可通过电解法制备衫
D.“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐
2. 下列关于2-环己基丙烯()和2-苯基丙烯()的说法中正确
的是
A. 二者均为芳香烃
B. 2-苯基丙烯分子中所有碳原子一定共平面
C. 二者均可发生加聚反应和氧化反应
D. 2-苯基丙烯的一氯代产物只有3种
3. 设NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,2.24LHF和NH3分子所含电子数目均为NA
B. KIO3与HI溶液反应时生成0.1molI2转移的电子数为0.2NA
C. 142gNa2SO4和Na2HPO4固体混合物中,阴、阳离子总数为3NA
D. 3.6g重水中含有的中子数为2NA
4. 配位化合物[Cu(NH3)4]SO4中,不含有的化学键是
A.离子键 B.极性键 C.非极性键 D.配位键
5. X、Y、Z、M是短周期元素,它们的原子序数依次增大。X原子的最外层电子数是内层电子数的2倍,Z与X同周期且原子的未成对电子数与X相同,M与Z不同周期,其电负性在同周期元素中最大,下列说法错误的是
A. 第一电离能:Z>Y B. 原子半径:Y>Z
C. 简单氢化物的沸点:Z> X D. 最高价氧化物的水化物的酸性:M> X
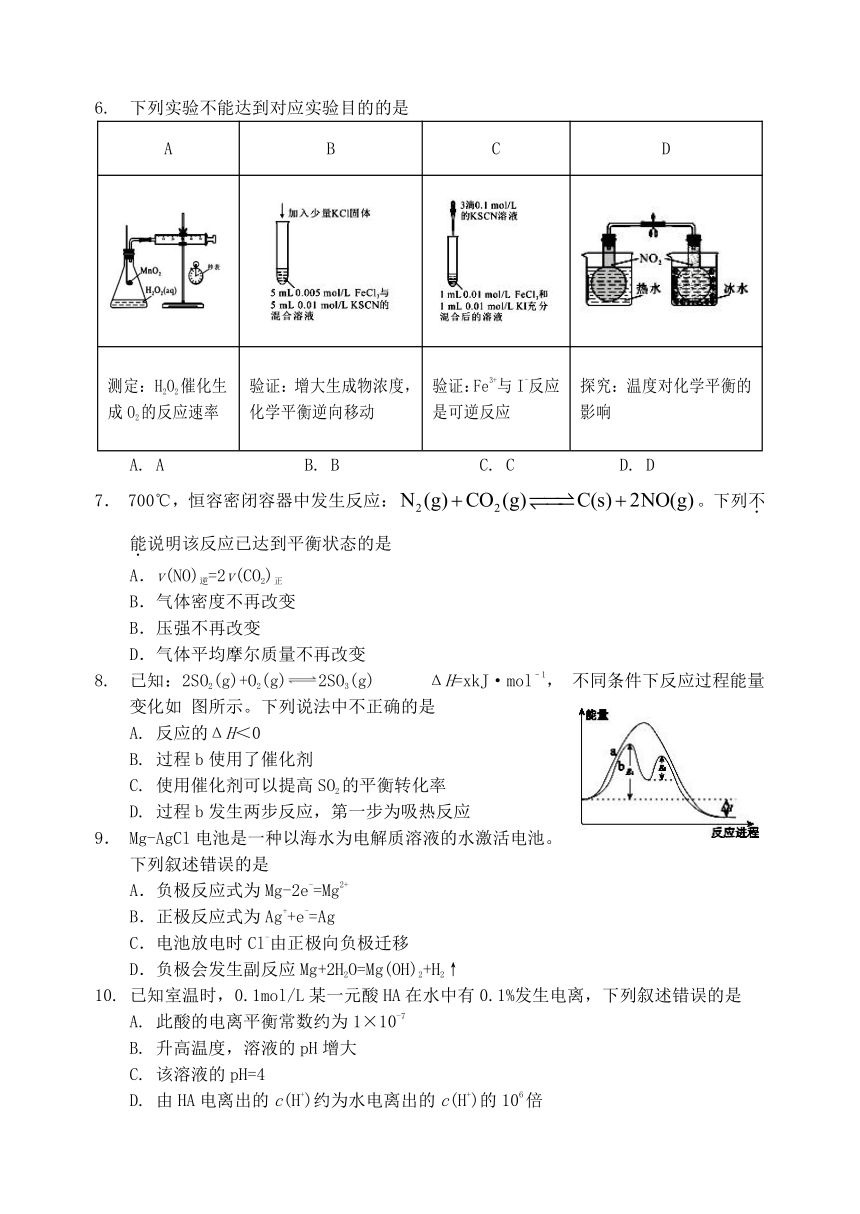
6. 下列实验不能达到对应实验目的的是
A B C D
测定:H2O2催化生成O2的反应速率 验证:增大生成物浓度,化学平衡逆向移动 验证:Fe3+与I-反应是可逆反应 探究:温度对化学平衡的影响
A. A B. B C. C D. D
7. 700℃,恒容密闭容器中发生反应:。下列不
能说明该反应已达到平衡状态的是
v(NO)逆=2v(CO2)正
B.气体密度不再改变
压强不再改变
D.气体平均摩尔质量不再改变
8. 已知:2SO2(g)+O2(g)2SO3(g) ΔH=xkJ·mol–1, 不同条件下反应过程能量
变化如 图所示。下列说法中不正确的是
A. 反应的ΔH<0
B. 过程b使用了催化剂
C. 使用催化剂可以提高SO2的平衡转化率
D. 过程b发生两步反应,第一步为吸热反应
9. Mg-AgCl电池是一种以海水为电解质溶液的水激活电池。
下列叙述错误的是
A.负极反应式为Mg-2e-=Mg2+
B.正极反应式为Ag++e-=Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑
10. 已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A. 此酸的电离平衡常数约为1×10-7
B. 升高温度,溶液的pH增大
C. 该溶液的pH=4
D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
第Ⅱ卷(非选择题 共50分)
二、非选择题(共50分)
11.(10分)某实验小组利用下图装置制备Na2S2O3(夹持装置略去)。
已知:。回答下列问题:
(1)仪器a的名称为 。
(2)开始时,将分液漏斗中的液体放入仪器a,放液的正确操作是
。
(3)装置A中发生反应的化学方程式是 。
(4)装置C中NaOH溶液的作用是 。
(5)该装置存在缺陷,提出改进措施 (答出
一点即可)。
12.(12分)三氧化二钴(Co2O3)是重要的化工原料。以含钴废料(主要成分为Co2O3,
含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3的流程如下图:
已知:“滤液1”中含有的阳离子有H+、Co2+、Fe3+、Ni2+。
(1)“滤渣1”的主要成分是 (写化学式)。
(2)“酸浸”时,H2O2可将Co2O3还原为Co2+,离子方程式是 。
(3)加有机萃取剂的目的是为了除去 (填离子符号)。
(4)“调pH”时,常温下,为保证Fe3+完全沉淀,需调节“滤液1”的pH最小值为
。(已知:Ksp[Fe(OH)3]=1.0×10-38,当溶液中
时,认为沉淀完全)
(5)由“滤液2”可得到的主要副产品是 (写化学式)。
(6)“沉钴”过程中,生成Co2(OH)2CO3的离子方程式是 。
13. (12分)用CO2制备甲醇的反应原理为:。
该反应进程可通过如下图所示的两步反应实
现。
回答下列问题:
(1)反应I的化学方程式是 。
(2)由图可知,反应 (填“I”或
“II”)为慢反应。
(3)反应II: 0(填“>”“<”
或“=”)。
在容积可变的密闭容器中投入0.5molCO和1molH2,发生反应:,测得平衡时CH3OH的物质的量随温度、压强变化如下图所示。
①P总1 P总2(填“>”“<”或“=”),判断理
由是 。
②若P总1=0.25MPa,则500K时该反应的平衡常数
KP= 。
(16分)2022年北京冬季奥运会场馆使用了大量不锈钢材
质,不锈钢属于合金钢,其基体是铁碳合金,常用的不锈钢中含铬(Cr) 18%、含镍(Ni)
8%。回答下列问题:
碳的价电子层的电子排布式为_______;石墨烯(即单层石墨)是一种碳原子构
成的单 层二维蜂窝状晶格结构的新材料,其中碳原子采取_______杂化。
铁氯化物FeCl3蒸汽状态下以双聚分子形式存在(如右
图),其中Fe的配位数为______,双聚分子中存在配位键,
提供空轨道的是______原子。
(3)甘氨酸亚铁[(H2NCH2COO)2Fe]中非金属元素的电负性由大到
小的顺序是 。甘氨酸(H2NCH2COOH)比其同分异构体硝基乙烷
(C2H5NO2)熔沸点高,其原因主要是 。
(4)FeCO3的阴离子的空间构型为 ,写出一种与该阴离子互为
等电子体的分子的化学式 。
(5) 金属铬属于体心立方晶体(如右图),已知其密度为7.2g/cm3,
阿伏加德罗常数的值为NA,则晶体中铬原子的半径为
cm(用含NA的表达式表示)。
阆中市2021-2022学年高二下学期开学考试
化学参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 D C C C A B C C B B
(10分)
(1)圆底烧瓶(2分)
(2)先打开分液漏斗顶部的玻璃塞(或塞子凹槽对准分液漏斗上口的小孔),再打开中部的活塞,放液后及时关闭活塞。(2分)
(3)(2分)
(4)吸收SO2等有害尾气,防止污染空气(2分)
(5)A、B之间增加防倒吸的安全瓶或B、C之间增加防倒吸的安全瓶(2分)
12.(12分)
(1)MnO2(2分) (2)(2分)
(3)Ni2+(2分) (4)3或3.0(2分) (5)(NH4)2SO4(2分)
(6)(2分)
13.(12分)
(1)(2分) (2)I(2分) (3)<(2分)
(4)① >(2分) 该反应是气体分子数减小的反应,其他条件相同时,增大压强,平衡正移,甲醇的物质的量增大。(2分) ②64(2分)
14.( 16分)
(1) 2s22p2( 1分) ; sp2 ( 1分) ;
(2) 4 ( 2分) ; Fe ( 2分) ;
(3) O>N>C>H (2分) ; 甘氨酸分子间能形成氢键 (2分) ;
(4) 平面三角形 (2分) ; BF3或SO3 (2分) ;
(5)或(2分)
化 学
(满分:100分 时间:50分钟)
可能用到的原子量:H—1,C—12,N—14,O—16,Na—23,Mg—24,P-31,Cl—35.5,
Fe—56,Cu—64,S—32,Mn—55,Cr—52
第Ⅰ卷(选择题,共50分)
一、选择题(本题包括10小题,每小题5分,共50分)
1. 电影《厉害了,我的国》通过镜头将我国在改革开放和社会主义现代化建设上所取
得的历史性成就,进行了全方位、多层次的展现。下列说法错误的是
大型客机C919机身表面含有耐紫外线的物质PMMA(聚甲基丙烯酸甲酯),PMMA
属于有机高分子化合物
中国天眼为我国探索宇宙提供了有力的保障,其中的防腐蚀材料磷酸钡属于强电
解质
DF﹣5弹道导弹是国之利器,其含有金属钐(Sm),钐的活动性介于钠与铝之间,
工业上可通过电解法制备衫
D.“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐
2. 下列关于2-环己基丙烯()和2-苯基丙烯()的说法中正确
的是
A. 二者均为芳香烃
B. 2-苯基丙烯分子中所有碳原子一定共平面
C. 二者均可发生加聚反应和氧化反应
D. 2-苯基丙烯的一氯代产物只有3种
3. 设NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,2.24LHF和NH3分子所含电子数目均为NA
B. KIO3与HI溶液反应时生成0.1molI2转移的电子数为0.2NA
C. 142gNa2SO4和Na2HPO4固体混合物中,阴、阳离子总数为3NA
D. 3.6g重水中含有的中子数为2NA
4. 配位化合物[Cu(NH3)4]SO4中,不含有的化学键是
A.离子键 B.极性键 C.非极性键 D.配位键
5. X、Y、Z、M是短周期元素,它们的原子序数依次增大。X原子的最外层电子数是内层电子数的2倍,Z与X同周期且原子的未成对电子数与X相同,M与Z不同周期,其电负性在同周期元素中最大,下列说法错误的是
A. 第一电离能:Z>Y B. 原子半径:Y>Z
C. 简单氢化物的沸点:Z> X D. 最高价氧化物的水化物的酸性:M> X
6. 下列实验不能达到对应实验目的的是
A B C D
测定:H2O2催化生成O2的反应速率 验证:增大生成物浓度,化学平衡逆向移动 验证:Fe3+与I-反应是可逆反应 探究:温度对化学平衡的影响
A. A B. B C. C D. D
7. 700℃,恒容密闭容器中发生反应:。下列不
能说明该反应已达到平衡状态的是
v(NO)逆=2v(CO2)正
B.气体密度不再改变
压强不再改变
D.气体平均摩尔质量不再改变
8. 已知:2SO2(g)+O2(g)2SO3(g) ΔH=xkJ·mol–1, 不同条件下反应过程能量
变化如 图所示。下列说法中不正确的是
A. 反应的ΔH<0
B. 过程b使用了催化剂
C. 使用催化剂可以提高SO2的平衡转化率
D. 过程b发生两步反应,第一步为吸热反应
9. Mg-AgCl电池是一种以海水为电解质溶液的水激活电池。
下列叙述错误的是
A.负极反应式为Mg-2e-=Mg2+
B.正极反应式为Ag++e-=Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑
10. 已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A. 此酸的电离平衡常数约为1×10-7
B. 升高温度,溶液的pH增大
C. 该溶液的pH=4
D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
第Ⅱ卷(非选择题 共50分)
二、非选择题(共50分)
11.(10分)某实验小组利用下图装置制备Na2S2O3(夹持装置略去)。
已知:。回答下列问题:
(1)仪器a的名称为 。
(2)开始时,将分液漏斗中的液体放入仪器a,放液的正确操作是
。
(3)装置A中发生反应的化学方程式是 。
(4)装置C中NaOH溶液的作用是 。
(5)该装置存在缺陷,提出改进措施 (答出
一点即可)。
12.(12分)三氧化二钴(Co2O3)是重要的化工原料。以含钴废料(主要成分为Co2O3,
含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3的流程如下图:
已知:“滤液1”中含有的阳离子有H+、Co2+、Fe3+、Ni2+。
(1)“滤渣1”的主要成分是 (写化学式)。
(2)“酸浸”时,H2O2可将Co2O3还原为Co2+,离子方程式是 。
(3)加有机萃取剂的目的是为了除去 (填离子符号)。
(4)“调pH”时,常温下,为保证Fe3+完全沉淀,需调节“滤液1”的pH最小值为
。(已知:Ksp[Fe(OH)3]=1.0×10-38,当溶液中
时,认为沉淀完全)
(5)由“滤液2”可得到的主要副产品是 (写化学式)。
(6)“沉钴”过程中,生成Co2(OH)2CO3的离子方程式是 。
13. (12分)用CO2制备甲醇的反应原理为:。
该反应进程可通过如下图所示的两步反应实
现。
回答下列问题:
(1)反应I的化学方程式是 。
(2)由图可知,反应 (填“I”或
“II”)为慢反应。
(3)反应II: 0(填“>”“<”
或“=”)。
在容积可变的密闭容器中投入0.5molCO和1molH2,发生反应:,测得平衡时CH3OH的物质的量随温度、压强变化如下图所示。
①P总1 P总2(填“>”“<”或“=”),判断理
由是 。
②若P总1=0.25MPa,则500K时该反应的平衡常数
KP= 。
(16分)2022年北京冬季奥运会场馆使用了大量不锈钢材
质,不锈钢属于合金钢,其基体是铁碳合金,常用的不锈钢中含铬(Cr) 18%、含镍(Ni)
8%。回答下列问题:
碳的价电子层的电子排布式为_______;石墨烯(即单层石墨)是一种碳原子构
成的单 层二维蜂窝状晶格结构的新材料,其中碳原子采取_______杂化。
铁氯化物FeCl3蒸汽状态下以双聚分子形式存在(如右
图),其中Fe的配位数为______,双聚分子中存在配位键,
提供空轨道的是______原子。
(3)甘氨酸亚铁[(H2NCH2COO)2Fe]中非金属元素的电负性由大到
小的顺序是 。甘氨酸(H2NCH2COOH)比其同分异构体硝基乙烷
(C2H5NO2)熔沸点高,其原因主要是 。
(4)FeCO3的阴离子的空间构型为 ,写出一种与该阴离子互为
等电子体的分子的化学式 。
(5) 金属铬属于体心立方晶体(如右图),已知其密度为7.2g/cm3,
阿伏加德罗常数的值为NA,则晶体中铬原子的半径为
cm(用含NA的表达式表示)。
阆中市2021-2022学年高二下学期开学考试
化学参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 D C C C A B C C B B
(10分)
(1)圆底烧瓶(2分)
(2)先打开分液漏斗顶部的玻璃塞(或塞子凹槽对准分液漏斗上口的小孔),再打开中部的活塞,放液后及时关闭活塞。(2分)
(3)(2分)
(4)吸收SO2等有害尾气,防止污染空气(2分)
(5)A、B之间增加防倒吸的安全瓶或B、C之间增加防倒吸的安全瓶(2分)
12.(12分)
(1)MnO2(2分) (2)(2分)
(3)Ni2+(2分) (4)3或3.0(2分) (5)(NH4)2SO4(2分)
(6)(2分)
13.(12分)
(1)(2分) (2)I(2分) (3)<(2分)
(4)① >(2分) 该反应是气体分子数减小的反应,其他条件相同时,增大压强,平衡正移,甲醇的物质的量增大。(2分) ②64(2分)
14.( 16分)
(1) 2s22p2( 1分) ; sp2 ( 1分) ;
(2) 4 ( 2分) ; Fe ( 2分) ;
(3) O>N>C>H (2分) ; 甘氨酸分子间能形成氢键 (2分) ;
(4) 平面三角形 (2分) ; BF3或SO3 (2分) ;
(5)或(2分)
同课章节目录
