2021—2022学年九年级化学人教版下册第九单元溶液单元复习与测试(word版 含解析)
文档属性
| 名称 | 2021—2022学年九年级化学人教版下册第九单元溶液单元复习与测试(word版 含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 147.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-23 10:30:44 | ||
图片预览



文档简介
第九单元 溶液 单元复习与测试2021-2022学年九年级化学下册(人教版)
一、单选题,共13小题
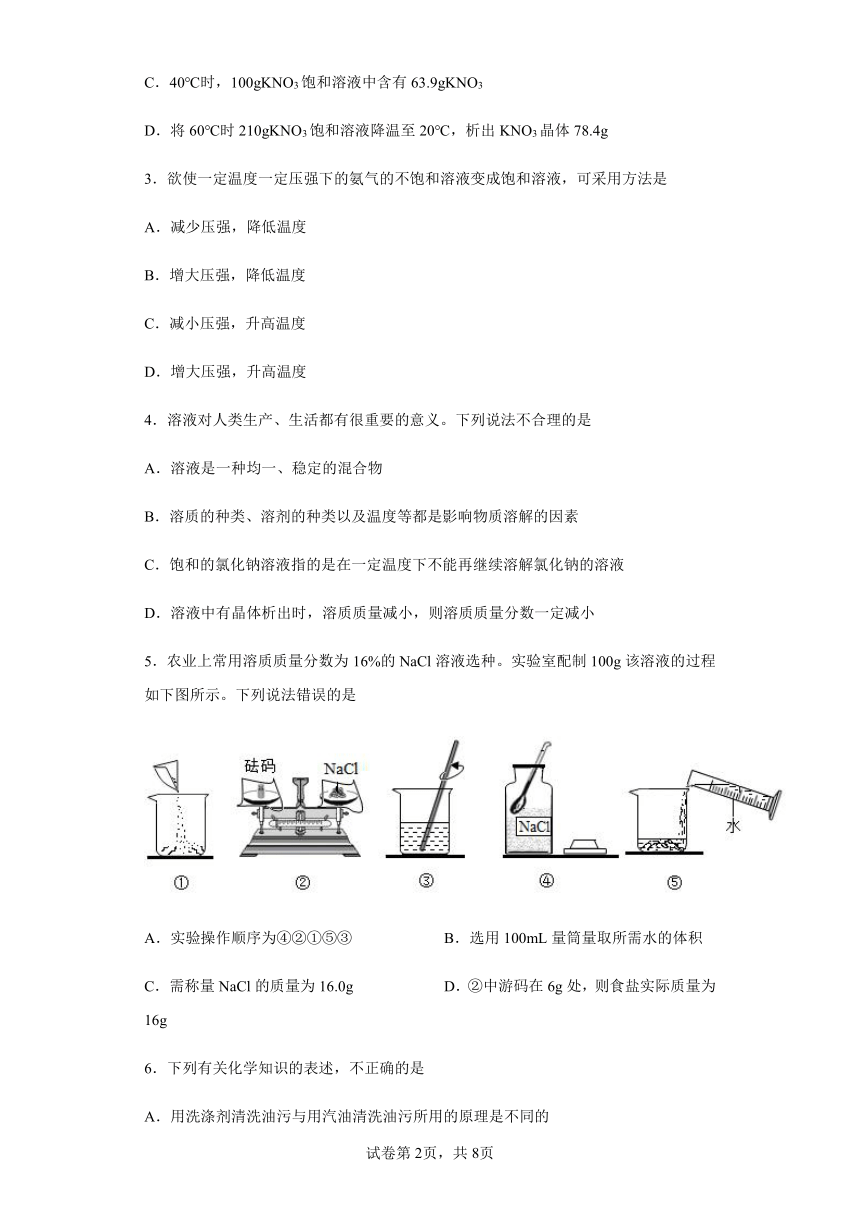
1.甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线如图所示,下列说法不正确的是
A.甲、乙物质是易溶物质
B.t1℃时,甲和丙的饱和溶液中所含溶质质量相等
C.将接近饱和的丙溶液变成该温度下的饱和溶液,可采用加入丙物质的方法
D.若将t2℃时三种物质等质量的饱和溶液分别降温到t1℃,则析出晶体质量关系是甲>乙>丙
2.NaCl和KNO3的溶解度曲线如图所示,下列说法正确的是
A.NaCl的溶解度一定大于KNO3
B.NaCl的溶解度受温度影响的程度比KNO3大
C.40℃时,100gKNO3饱和溶液中含有63.9gKNO3
D.将60℃时210gKNO3饱和溶液降温至20℃,析出KNO3晶体78.4g
3.欲使一定温度一定压强下的氨气的不饱和溶液变成饱和溶液,可采用方法是
A.减少压强,降低温度
B.增大压强,降低温度
C.减小压强,升高温度
D.增大压强,升高温度
4.溶液对人类生产、生活都有很重要的意义。下列说法不合理的是
A.溶液是一种均一、稳定的混合物
B.溶质的种类、溶剂的种类以及温度等都是影响物质溶解的因素
C.饱和的氯化钠溶液指的是在一定温度下不能再继续溶解氯化钠的溶液
D.溶液中有晶体析出时,溶质质量减小,则溶质质量分数一定减小
5.农业上常用溶质质量分数为16%的NaCl溶液选种。实验室配制100g该溶液的过程如下图所示。下列说法错误的是
A.实验操作顺序为④②①⑤③ B.选用100mL量筒量取所需水的体积
C.需称量NaCl的质量为16.0g D.②中游码在6g处,则食盐实际质量为16g
6.下列有关化学知识的表述,不正确的是
A.用洗涤剂清洗油污与用汽油清洗油污所用的原理是不同的
B.用水分别溶解测温的方法可以区分氢氧化钠 氯化钠 硝酸铵三种白色固体
C.过滤可以使硬水转化为软水
D.不同种元素之间最本质的不同是质子数不同
7.如图为KC1和Na2CO3的溶解度曲线,下列说法错误的是
A.T2℃时,Na2CO3饱和溶液质量分数为49.0%
B.将两物质的饱和溶液由T1℃升温至T4℃,均无固体析出
C.T4℃时,分别将等质量的KC1和Na2CO3溶于水配成饱和溶液,所得溶液的质量前者小于后者
D.若KCl溶液中含有少量Na2CO3,可采取蒸发浓缩控制温度T3℃以上降温结晶、过滤等操作提纯
8.如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀。表中液体X和固体Y的组合,符合题意的是
① ② ③ ④
X 稀盐酸 水 水 水
Y 锌粒 氯化钠 氢氧化钠 硝酸铵
A.①② B.①③ C.①③④ D.②③④
9.泡菜具有独特的风味,适合制作泡菜的食盐水浓度是4%.在配制4%的食盐水时,会导致溶液浓度偏小的是
①称量好的食盐倒入烧杯时,有少许洒出
②量水的体积时,俯视量筒
③溶解食盐的烧杯内壁是潮湿的
④用4g食盐和100g水配制溶液
A.②③ B.①③④ C.①②③ D.①②③④
10.下列有关溶液的说法不正确的是
A.氯化钠溶于水就是钠离子和氯离子在水分子作用下均匀扩散到水中的过程
B.搅拌和升温能加快溶质的溶解,是因为加快了微粒的运动速率
C.把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数为10%
D.同种溶质的饱和溶液与不饱和溶液通过改变条件可以相互转化
11.某温度下,ag硝酸钾放入到bg水中,得到硝酸钾溶液的质量(m)是
A.m=(a+b)g B.m>(a+b)g C.m<(a+b)g D.A与C可能,B不可能
12.下列有关溶液的说法中,正确的是
A.饱和溶液一定比不饱和溶液所含的溶质多
B.不饱和溶液转化为饱和溶液,溶液中溶质的质量分数一定增大
C.将某物质加入水中,所得溶液中溶质的质量分数一定是
D.将一定质量某物质的饱和溶液降温析出晶体后,所得溶液中溶质的质量一定减小
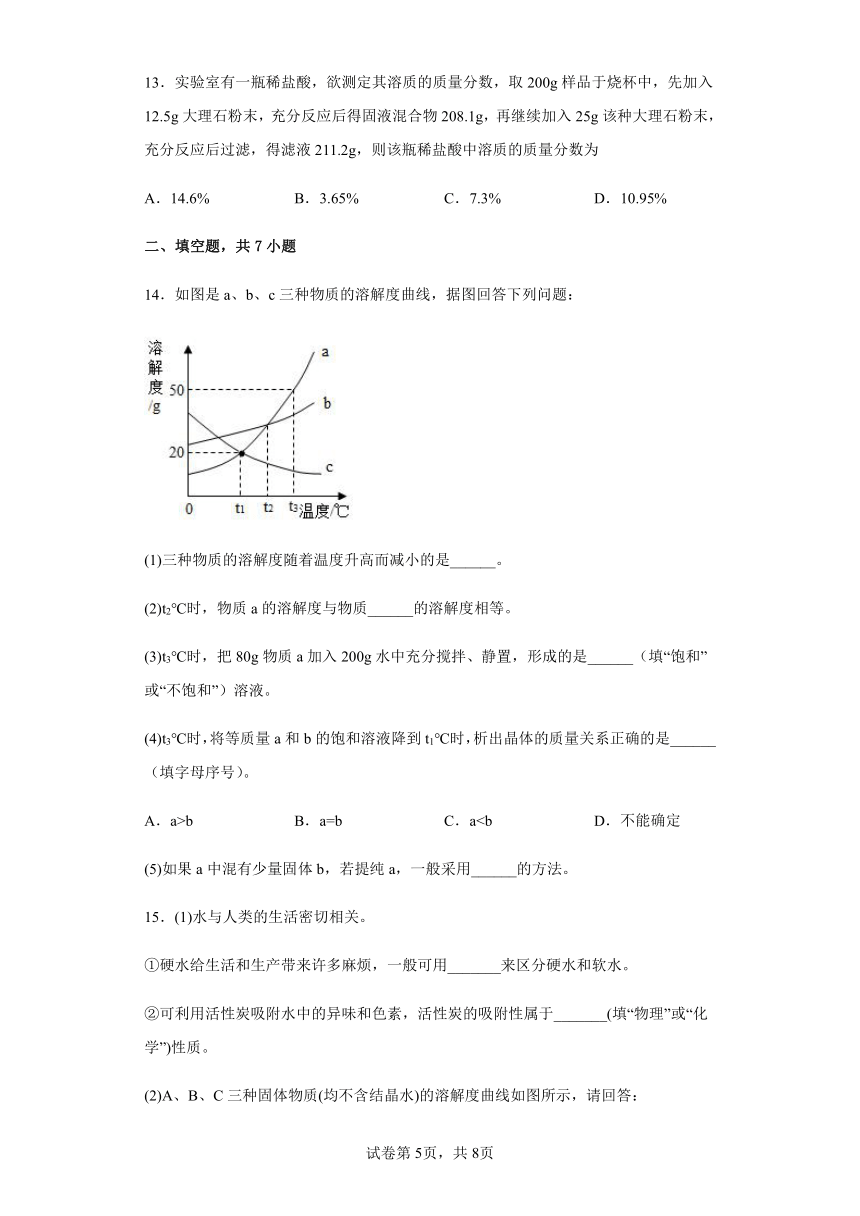
13.实验室有一瓶稀盐酸,欲测定其溶质的质量分数,取200g样品于烧杯中,先加入12.5g大理石粉末,充分反应后得固液混合物208.1g,再继续加入25g该种大理石粉末,充分反应后过滤,得滤液211.2g,则该瓶稀盐酸中溶质的质量分数为
A.14.6% B.3.65% C.7.3% D.10.95%
二、填空题,共7小题
14.如图是a、b、c三种物质的溶解度曲线,据图回答下列问题:
(1)三种物质的溶解度随着温度升高而减小的是______。
(2)t2℃时,物质a的溶解度与物质______的溶解度相等。
(3)t3℃时,把80g物质a加入200g水中充分搅拌、静置,形成的是______(填“饱和”或“不饱和”)溶液。
(4)t3℃时,将等质量a和b的饱和溶液降到t1℃时,析出晶体的质量关系正确的是______(填字母序号)。
A.a>b B.a=b C.a(5)如果a中混有少量固体b,若提纯a,一般采用______的方法。
15.(1)水与人类的生活密切相关。
①硬水给生活和生产带来许多麻烦,一般可用_______来区分硬水和软水。
②可利用活性炭吸附水中的异味和色素,活性炭的吸附性属于_______(填“物理”或“化学”)性质。
(2)A、B、C三种固体物质(均不含结晶水)的溶解度曲线如图所示,请回答:
①t1℃时,A、B、C三种物质的溶解度由大到小的顺序是_______。
②当温度在t2~t3℃之间时,A物质与B物质____(填“能”或“不能”)配制溶质质量分数相同的饱和溶液。
③将A、B、C三种物质的饱和溶液分别由t2℃升温到t3℃,所得溶液中溶质的质量分数最大的物质是__。
④t3℃时将75gA的饱和溶液稀释成20%的溶液需加____g水。
⑤如图,向烧杯中加入一定量的硝酸铵固体,此时试管中氢氧化钙溶液的溶质质量分数将____(填“变大”“不变”或“变小”)。
16.大连复州湾盐场是我国四大海盐场之一,利用传统的海水晒盐工艺,可得到氯化钠和氯化镁等物质,下图是氯化钠和氯化镁的溶解度曲线。
(1)两种物质中,______的溶解度受温度的影响较大。
(2)t℃时,氯化镁饱和溶液中溶质与溶剂的质量比为_______。
(3)将接近饱和的氯化钠溶液变为饱和溶液,可采用的一种方法是_______。
(4)海水晒盐是利用________的方法获得晶体。
17.将30g固体物质X(不含结晶水)投入盛有20g水的烧杯中,搅拌,测得0℃、t1℃、t2℃、t3℃时烧杯中溶液的质量分别如图中A、B、C、D点所示。
回答下列问题:
(1)A、B两点对应的溶液中溶质的质量分数较大的是____________(填字母编号)。
(2)0℃时,物质X的溶解度是____________。
(3)A、B、C、D四点对应的溶液中,一定属于饱和溶液的是____________(填字母编号)。
(4)下列说法正确的是_____________(填序号)。
①t1℃时,若向B点对应的烧杯中再加入30g水,搅拌,所得溶液为不饱和溶液
②若要从D点对应的溶液中得到全部固体X,可采用降温结晶的方法
③t2℃时,将物质X的饱和溶液变为不饱和溶液,溶质的质量可能增大
18.如图是甲、乙、丙三种物质的溶解度曲线。请根据图中信息回答下列问题:
(1)甲、乙两种物质在_____℃时溶解度相等;
(2)t3℃时,把30克甲充分溶解在50克水中,所得溶液质量是_____g。
(3)t3℃时,甲、乙、丙三种物质的等质量饱和溶液中,所含溶剂质量最多的是_____。
(4)若甲中混有少量乙,要得到纯净的甲,常用的提纯方法是_____。
19.概念:_____与_____之比是_____,是溶液组成的定量表示
20.浓、稀溶液与饱和不饱和溶液之间的关系
①浓溶液_____是饱和溶液
②稀溶液_____是不饱和溶液,如20℃时,100g中溶解0.17gCa(OH)2就不能再溶解了,溶液中的溶质含量很少,是稀溶液,但却是饱和溶液。
③在一定温度时,同种溶质的同一溶剂的_____要比它的_____浓。
试卷第1页,共3页
试卷第8页,共8页
参考答案:
1.B
【详解】
A、20℃时,溶解度在10g以上的为易溶物质。A正确。
B、t1℃时,甲和丙的溶解度相等,饱和溶液中溶质质量分数相等,溶质不一定相等。B错。
C、将接近饱和的溶液变成该温度下的饱和溶液,最可靠的方法是加溶质。所以将接近饱和的丙溶液变成该温度下的饱和溶液,可采用加入丙物质的方法正确。
D、丙的溶解度随温度升高而减小,降温不会析出晶体。甲的溶解度受温度变化影响很大;乙的溶解度受温度变化影响不大。所以若将t2℃时三种物质等质量的饱和溶液分别降温到t1℃,则析出晶体质量关系是甲>乙>丙。D正确。
综上所述:选择B。
2.D
【详解】
A、从图示中可以看出,在不同温度范围内,硝酸钾和氯化钠的溶解度大小关系不同,因此没有指明温度,不能比较氯化钠与硝酸钾溶解度的大小,故A选项错误;
B、由两条曲线从左到右的上升趋势可知,NaCl的溶解度受温度影响的程度比KNO3的小,故B选项错误;
C、40℃时,KNO3硝酸钾的溶解度为63.9g,即在40℃时,100g水中最多溶解63.9gKNO3,形成163.9g饱和溶液,即在该温度下,163.9gKNO3饱和溶解中含有63.9gKNO3,因此在40℃时,100gKNO3饱和溶液中含有KNO3的质量小于63.9g,故C选项错误;
D、60℃时,硝酸钾的溶解度为110.0g,即在60℃时,100g水中溶解110.0g硝酸钾形成210.0g饱和溶液;20℃,硝酸钾的溶解度为31.6g,即20℃时,100g水中溶解31.6g硝酸钾形成131.6g饱和溶液,所以将60℃时210gKNO3饱和溶液降温至20℃,析出KNO3晶体的质量为:,故D选项正确;
故选D。
3.C
【详解】
气体的溶解度随温度的升高而减小,随压强的增大而增大。所以使一定温度,一定压强下的氨气不饱和溶液转变为饱和溶液,可采用减小压强,升高温度。
故选C。
4.D
【详解】
A、溶液是由溶质和溶剂组成的均一、稳定的混合物,不符合题意;
B、溶质的种类、溶剂的种类以及温度等都是影响物质溶解的因素,说法正确,不符合题意;
C、饱和的氯化钠溶液,指的是在一定温度下不能再继续溶解氯化钠的溶液, 说法正确,不符合题意;
D、溶液中有晶体析出时,溶质质量减小,溶质质量分数不一定减小,如氯化钠饱和溶液恒温蒸发溶剂,有溶质析出,还是饱和溶液,温度不变,溶解度不变,饱和溶液的溶质质量分数不变,符合题意。
故选D。
5.D
【详解】
A、实验室配制溶液的顺序为计算、称量、量取、溶解,即④②①⑤③,A正确;
B、配制该溶液需要水的质量为100g-100g×16%=84g,需要水的体积为84mL,可选用100mL量筒量取所需水的体积,B正确;
C、需称量NaCl的质量为100g×16%=16.0g,C正确;
D、②中游码在6g处,由于砝码和药品放反,故盐实际质量为10g-6g=4g,D错误。
故选D。
6.C
【详解】
A、用洗涤剂清洗油污属于乳化,用汽油清洗油污属于溶解,所用的原理是不同的,正确。
B、氢氧化钠溶解放热,硝酸铵溶解吸热,氯化钠溶解不吸热,也不放热,用水分别溶解测温的方法可以区分氢氧化钠 氯化钠 硝酸铵三种白色固体,正确。
C、过滤不能去除钙镁离子,不可以使硬水转化为软水,错误。
D、不同种元素之间最本质的不同是质子数不同,正确。
故选:C。
7.A
【详解】
A、由图可知,T2℃时,Na2CO3的溶解度为49g,则此时Na2CO3饱和溶液质量分数=×100%≈32.9%<49%,选项错误;
B、由图可知,T4℃时,两种物质的溶解度都大于T1℃时的溶解度,将两物质的饱和溶液由T1℃升温至T4℃,两种物的溶解度都变大,饱和溶液变为不饱和溶液,均无固体析出,选项正确;
C、由图可知,T4℃时氯化钾的溶解度大于碳酸钠的溶解度,即T4℃时氯化钾饱和溶液的溶质质量分数大于碳酸钠饱和溶液的溶质质量分数,则T4℃时,分别将等质量的KC1和Na2CO3溶于水配成饱和溶液,所得溶液的质量前者小于后者,选项正确;
D、由图可知,温度在T3℃以上时,两种物质的溶解度都随温度升高而增大,且氯化钾的溶解度受温度影响比碳酸钠大,所以KCl溶液中含有少量Na2CO3,可采取蒸发浓缩控制温度T3℃以上降温结晶、过滤等操作提纯,选项正确;
故选A。
8.B
【详解】
要使气球逐渐膨胀,则瓶中的气压一定增大,即有气体生成或者是放热
①反应会产生气体,符合题意;
②氯化钠溶于水不会放出气体和放热,不符合题意;
③氢氧化钠溶于水会放出热量,故符合题意;
④硝酸铵溶于水吸收热量,温度会降低,不符合题意;
故符合题意的是①③,故选择B。
9.B
【详解】
①称量好的食盐倒入烧杯时,有少许洒出,会造成实际所取的氯化钠的质量偏小,则使溶质质量分数偏小;
②量水的体积时,俯视量筒,读数比实际液体体积大,会造成实际量取的水的体积偏小,则配得溶液的溶质质量分数偏大;
③溶解食盐的烧杯内壁是潮湿的,会造成实际量取的水的体积偏大,则配得溶液的溶质质量分数偏小;
④用4g食盐和100g水配制溶液,所得溶液中溶质质量分数为 ;
故①③④会导致溶液浓度偏小。
故选B。
10.C
【详解】
A、氯化钠溶于水就是钠离子和氯离子在水分子作用下均匀扩散到水中的过程,说法正确;
B、搅拌和升温能加快分子的运动速率,可以加速溶解,说法正确;
C、溶液具有均一性,把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数仍为20%,说法错误;
D、同种溶质的饱和溶液与不饱和溶液通过改变条件可以相互转化,如改变温度、添加或减少溶剂、添加或减少溶质均可实现饱和溶液与不饱和溶液的相互转化,故说法正确。
故选:C。
11.D
【详解】
ag硝酸钾放入到bg水中,混合物为(a+b)g,当硝酸钾为完全溶解时,m=(a+b)g,当硝酸钾不完全溶解时m<(a+b)g,故选D。
12.D
略
13.C
【详解】
设200g稀盐酸样品中氯化氢的质量为
该瓶稀盐酸中溶质的质量分数=
答:该瓶稀盐酸中溶质的质量分数为7.3%。
14.(1)c
(2)b
(3)不饱和
(4)A
(5)降温结晶
(1)
通过分析溶解度曲线可知,三种物质的溶解度随着温度升高而减小的是c,故填:c。
(2)
由图可知,t2℃时,a、b的溶解度曲线相交,说明该温度下,物质a的溶解度与物质b的溶解度相等,故填:b。
(3)
t3℃时,a物质的溶解度是50g,即该温度下,100g水中最多能溶解度50ga物质,200g水可以溶解a物质100g,所以把80g物质a加入到200g水中充分搅拌、静置,形成溶液的质量是280g,形成的是不饱和溶液,故填:不饱和。
(4)
t3℃时,a物质的溶解度大于b,将等质量a和b的饱和溶液降到t1℃时,a物质的溶解度小于b,所以析出晶体的质量关系正确的是a>b,故选A。
(5)
a物质溶解度随温度变化较大,如果a中混有少量固体b,若提纯a,一般采用降温结晶的方法,故填:降温结晶。
15. 肥皂水 物理 C>B>A 能 B 50 不变
【详解】
(1)①硬水给生活和生产带来许多麻烦,一般可用肥皂水来区分硬水和软水,遇肥皂水产生泡沫少的是硬水,遇肥皂水产生泡沫多的是软水。
②可利用活性炭吸附水中的异味和色素,活性炭的吸附性不需要经过化学变化来表现,属于物理性质。
(2)①由图可知,t1℃时,A、B、C三种物质的溶解度由大到小的顺序是C>B>A。
②当温度在t1~t3℃之间时,A物质与B物质的溶解度可能相等,因此能配制溶质质量分数相同的饱和溶液。
③将A、B、C三种物质的饱和溶液分别由t2℃升温到t3℃,AB变成不饱和溶液,质量分数都不变,C仍然是饱和溶液,质量分数减小,由于t2℃时B的溶解度大于A,所得溶液中溶质的质量分数最大的物质是B。
④t3℃时A溶解度是50g,将75gA的饱和溶液稀释成20%的溶液需加水的质量:
⑤向烧杯中加入一定量的硝酸铵固体,硝酸铵溶于水溶液温度降低,氢氧化钙的溶解度随温度的降低而增大,溶液由饱和变不饱和,此时试管中氢氧化钙溶液的溶质质量分数将不变。
16. 氯化镁 7:10 增加溶质(或其它合理答案) 蒸发结晶
【详解】
(1)根据图示可知,氯化镁的溶解度随温度的变化趋势较大,而氯化钠较小。故答案为:氯化镁;
(2)t℃时,氯化镁的溶解度为70g,表示在t℃时,100g的水中,最多能溶解氯化镁70g。则饱和溶液中,溶质和溶剂的质量比为:70g:100g=7:10。故答案为:7:10;
(3)将接近饱和的氯化钠溶液变为饱和溶液,可以向溶液中增加溶质、恒温蒸发溶剂、降低温度。故答案为:增加溶质(答案合理即可);
(4)海水晒盐的过程中,通过自然光的温度将水分蒸发,从而溶液中逐渐的析出氯化钠晶体。该过程属于蒸发结晶的过程。故答案为:蒸发结晶。
17. B 20g A、B ③
【详解】
(1)将30g固体物质X(不含结晶水)投入盛有20g水的烧杯中,溶液中溶剂的质量都是20g,A点溶质质量是4g,B点溶质质量为12g,溶质的质量分数较大的是 B;
(2)由图可知,0℃时,物质X在20g水中最多能溶解4g,则在100g水中最多溶解20g,溶解度是20g;
(3)A、B、C、D四点对应的溶液中,A、B两点对应的溶液都是与剩余固体共存的溶液,一定属于饱和溶液,C点溶液可能饱和也可能不饱和,D点溶液一定不饱和;
(4)①t1℃时,20g水中最多能溶12gX,则30g中最多能溶18g,若向B点对应的烧杯中再加入30g水,搅拌,所得溶液恰好是饱和溶液,选项错误;
②若要从D点对应的溶液中得到全部固体X,可采用蒸发结晶的方法,选项错误;
③如果采用升高温度并加入溶质的方法将t2℃时的物质X的饱和溶液变为高温条件下的不饱和溶液,溶质的质量会增大;如果只是增加溶剂,则溶质的质量分数减小;如果只是升温变成高温条件下不饱和溶液,溶质的质量分数不变。
18. t2 75 丙 冷却热饱和溶液
【详解】
(1)在t2°C 时,甲与丙的溶解度曲线交于一点,表示该温度下二者的溶解度相等。
(2)在t3°C 时甲的溶解度是50g,即100g水中最多溶解50g的甲,所以把30g甲溶解于50g水中最多溶解25g,得到75g溶液。
(3)t3℃时,有甲、乙、丙三种物质的等质量饱和溶液,由于此温度下溶解度甲>乙>丙,因此溶质的质量分数甲>乙>丙,溶质的质量甲>乙>丙。溶液的质量=溶质的质量+溶剂的质量,此时溶液的质量相等,溶剂的质量应为:丙>乙>甲。
(4)由甲、乙物质的溶解度曲线可以知道,甲物质的溶解度随温度的升高而明显增大,乙物质的溶解度随温度的升高变化不大,所以若在混有少量乙的甲中提纯甲,应采用冷却热饱和溶液的方法。
19. 溶质质量 溶液质量 溶质的质量分数
【详解】
表示溶液浓度的方法很多,其中一种是溶质的质量分数,溶质质量与溶液质量之比,是溶质的质量分数,这是溶液组成的定量表示。
20. 不一定 不一定 饱和溶液 不饱和溶液
【详解】
①浓溶液不一定是饱和溶液;
②稀溶液不一定是不饱和溶液,如氢氧化钙微溶于水,溶液中的溶质含量很少,是稀溶液,但却是饱和溶液;
③在一定温度时,同种溶质的同一溶剂的饱和溶液要比它的不饱和溶液浓。因为同一温度下、同一溶剂中,饱和溶液中溶质质量分数大。
答案第1页,共2页
答案第10页,共10页
一、单选题,共13小题
1.甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线如图所示,下列说法不正确的是
A.甲、乙物质是易溶物质
B.t1℃时,甲和丙的饱和溶液中所含溶质质量相等
C.将接近饱和的丙溶液变成该温度下的饱和溶液,可采用加入丙物质的方法
D.若将t2℃时三种物质等质量的饱和溶液分别降温到t1℃,则析出晶体质量关系是甲>乙>丙
2.NaCl和KNO3的溶解度曲线如图所示,下列说法正确的是
A.NaCl的溶解度一定大于KNO3
B.NaCl的溶解度受温度影响的程度比KNO3大
C.40℃时,100gKNO3饱和溶液中含有63.9gKNO3
D.将60℃时210gKNO3饱和溶液降温至20℃,析出KNO3晶体78.4g
3.欲使一定温度一定压强下的氨气的不饱和溶液变成饱和溶液,可采用方法是
A.减少压强,降低温度
B.增大压强,降低温度
C.减小压强,升高温度
D.增大压强,升高温度
4.溶液对人类生产、生活都有很重要的意义。下列说法不合理的是
A.溶液是一种均一、稳定的混合物
B.溶质的种类、溶剂的种类以及温度等都是影响物质溶解的因素
C.饱和的氯化钠溶液指的是在一定温度下不能再继续溶解氯化钠的溶液
D.溶液中有晶体析出时,溶质质量减小,则溶质质量分数一定减小
5.农业上常用溶质质量分数为16%的NaCl溶液选种。实验室配制100g该溶液的过程如下图所示。下列说法错误的是
A.实验操作顺序为④②①⑤③ B.选用100mL量筒量取所需水的体积
C.需称量NaCl的质量为16.0g D.②中游码在6g处,则食盐实际质量为16g
6.下列有关化学知识的表述,不正确的是
A.用洗涤剂清洗油污与用汽油清洗油污所用的原理是不同的
B.用水分别溶解测温的方法可以区分氢氧化钠 氯化钠 硝酸铵三种白色固体
C.过滤可以使硬水转化为软水
D.不同种元素之间最本质的不同是质子数不同
7.如图为KC1和Na2CO3的溶解度曲线,下列说法错误的是
A.T2℃时,Na2CO3饱和溶液质量分数为49.0%
B.将两物质的饱和溶液由T1℃升温至T4℃,均无固体析出
C.T4℃时,分别将等质量的KC1和Na2CO3溶于水配成饱和溶液,所得溶液的质量前者小于后者
D.若KCl溶液中含有少量Na2CO3,可采取蒸发浓缩控制温度T3℃以上降温结晶、过滤等操作提纯
8.如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀。表中液体X和固体Y的组合,符合题意的是
① ② ③ ④
X 稀盐酸 水 水 水
Y 锌粒 氯化钠 氢氧化钠 硝酸铵
A.①② B.①③ C.①③④ D.②③④
9.泡菜具有独特的风味,适合制作泡菜的食盐水浓度是4%.在配制4%的食盐水时,会导致溶液浓度偏小的是
①称量好的食盐倒入烧杯时,有少许洒出
②量水的体积时,俯视量筒
③溶解食盐的烧杯内壁是潮湿的
④用4g食盐和100g水配制溶液
A.②③ B.①③④ C.①②③ D.①②③④
10.下列有关溶液的说法不正确的是
A.氯化钠溶于水就是钠离子和氯离子在水分子作用下均匀扩散到水中的过程
B.搅拌和升温能加快溶质的溶解,是因为加快了微粒的运动速率
C.把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数为10%
D.同种溶质的饱和溶液与不饱和溶液通过改变条件可以相互转化
11.某温度下,ag硝酸钾放入到bg水中,得到硝酸钾溶液的质量(m)是
A.m=(a+b)g B.m>(a+b)g C.m<(a+b)g D.A与C可能,B不可能
12.下列有关溶液的说法中,正确的是
A.饱和溶液一定比不饱和溶液所含的溶质多
B.不饱和溶液转化为饱和溶液,溶液中溶质的质量分数一定增大
C.将某物质加入水中,所得溶液中溶质的质量分数一定是
D.将一定质量某物质的饱和溶液降温析出晶体后,所得溶液中溶质的质量一定减小
13.实验室有一瓶稀盐酸,欲测定其溶质的质量分数,取200g样品于烧杯中,先加入12.5g大理石粉末,充分反应后得固液混合物208.1g,再继续加入25g该种大理石粉末,充分反应后过滤,得滤液211.2g,则该瓶稀盐酸中溶质的质量分数为
A.14.6% B.3.65% C.7.3% D.10.95%
二、填空题,共7小题
14.如图是a、b、c三种物质的溶解度曲线,据图回答下列问题:
(1)三种物质的溶解度随着温度升高而减小的是______。
(2)t2℃时,物质a的溶解度与物质______的溶解度相等。
(3)t3℃时,把80g物质a加入200g水中充分搅拌、静置,形成的是______(填“饱和”或“不饱和”)溶液。
(4)t3℃时,将等质量a和b的饱和溶液降到t1℃时,析出晶体的质量关系正确的是______(填字母序号)。
A.a>b B.a=b C.a(5)如果a中混有少量固体b,若提纯a,一般采用______的方法。
15.(1)水与人类的生活密切相关。
①硬水给生活和生产带来许多麻烦,一般可用_______来区分硬水和软水。
②可利用活性炭吸附水中的异味和色素,活性炭的吸附性属于_______(填“物理”或“化学”)性质。
(2)A、B、C三种固体物质(均不含结晶水)的溶解度曲线如图所示,请回答:
①t1℃时,A、B、C三种物质的溶解度由大到小的顺序是_______。
②当温度在t2~t3℃之间时,A物质与B物质____(填“能”或“不能”)配制溶质质量分数相同的饱和溶液。
③将A、B、C三种物质的饱和溶液分别由t2℃升温到t3℃,所得溶液中溶质的质量分数最大的物质是__。
④t3℃时将75gA的饱和溶液稀释成20%的溶液需加____g水。
⑤如图,向烧杯中加入一定量的硝酸铵固体,此时试管中氢氧化钙溶液的溶质质量分数将____(填“变大”“不变”或“变小”)。
16.大连复州湾盐场是我国四大海盐场之一,利用传统的海水晒盐工艺,可得到氯化钠和氯化镁等物质,下图是氯化钠和氯化镁的溶解度曲线。
(1)两种物质中,______的溶解度受温度的影响较大。
(2)t℃时,氯化镁饱和溶液中溶质与溶剂的质量比为_______。
(3)将接近饱和的氯化钠溶液变为饱和溶液,可采用的一种方法是_______。
(4)海水晒盐是利用________的方法获得晶体。
17.将30g固体物质X(不含结晶水)投入盛有20g水的烧杯中,搅拌,测得0℃、t1℃、t2℃、t3℃时烧杯中溶液的质量分别如图中A、B、C、D点所示。
回答下列问题:
(1)A、B两点对应的溶液中溶质的质量分数较大的是____________(填字母编号)。
(2)0℃时,物质X的溶解度是____________。
(3)A、B、C、D四点对应的溶液中,一定属于饱和溶液的是____________(填字母编号)。
(4)下列说法正确的是_____________(填序号)。
①t1℃时,若向B点对应的烧杯中再加入30g水,搅拌,所得溶液为不饱和溶液
②若要从D点对应的溶液中得到全部固体X,可采用降温结晶的方法
③t2℃时,将物质X的饱和溶液变为不饱和溶液,溶质的质量可能增大
18.如图是甲、乙、丙三种物质的溶解度曲线。请根据图中信息回答下列问题:
(1)甲、乙两种物质在_____℃时溶解度相等;
(2)t3℃时,把30克甲充分溶解在50克水中,所得溶液质量是_____g。
(3)t3℃时,甲、乙、丙三种物质的等质量饱和溶液中,所含溶剂质量最多的是_____。
(4)若甲中混有少量乙,要得到纯净的甲,常用的提纯方法是_____。
19.概念:_____与_____之比是_____,是溶液组成的定量表示
20.浓、稀溶液与饱和不饱和溶液之间的关系
①浓溶液_____是饱和溶液
②稀溶液_____是不饱和溶液,如20℃时,100g中溶解0.17gCa(OH)2就不能再溶解了,溶液中的溶质含量很少,是稀溶液,但却是饱和溶液。
③在一定温度时,同种溶质的同一溶剂的_____要比它的_____浓。
试卷第1页,共3页
试卷第8页,共8页
参考答案:
1.B
【详解】
A、20℃时,溶解度在10g以上的为易溶物质。A正确。
B、t1℃时,甲和丙的溶解度相等,饱和溶液中溶质质量分数相等,溶质不一定相等。B错。
C、将接近饱和的溶液变成该温度下的饱和溶液,最可靠的方法是加溶质。所以将接近饱和的丙溶液变成该温度下的饱和溶液,可采用加入丙物质的方法正确。
D、丙的溶解度随温度升高而减小,降温不会析出晶体。甲的溶解度受温度变化影响很大;乙的溶解度受温度变化影响不大。所以若将t2℃时三种物质等质量的饱和溶液分别降温到t1℃,则析出晶体质量关系是甲>乙>丙。D正确。
综上所述:选择B。
2.D
【详解】
A、从图示中可以看出,在不同温度范围内,硝酸钾和氯化钠的溶解度大小关系不同,因此没有指明温度,不能比较氯化钠与硝酸钾溶解度的大小,故A选项错误;
B、由两条曲线从左到右的上升趋势可知,NaCl的溶解度受温度影响的程度比KNO3的小,故B选项错误;
C、40℃时,KNO3硝酸钾的溶解度为63.9g,即在40℃时,100g水中最多溶解63.9gKNO3,形成163.9g饱和溶液,即在该温度下,163.9gKNO3饱和溶解中含有63.9gKNO3,因此在40℃时,100gKNO3饱和溶液中含有KNO3的质量小于63.9g,故C选项错误;
D、60℃时,硝酸钾的溶解度为110.0g,即在60℃时,100g水中溶解110.0g硝酸钾形成210.0g饱和溶液;20℃,硝酸钾的溶解度为31.6g,即20℃时,100g水中溶解31.6g硝酸钾形成131.6g饱和溶液,所以将60℃时210gKNO3饱和溶液降温至20℃,析出KNO3晶体的质量为:,故D选项正确;
故选D。
3.C
【详解】
气体的溶解度随温度的升高而减小,随压强的增大而增大。所以使一定温度,一定压强下的氨气不饱和溶液转变为饱和溶液,可采用减小压强,升高温度。
故选C。
4.D
【详解】
A、溶液是由溶质和溶剂组成的均一、稳定的混合物,不符合题意;
B、溶质的种类、溶剂的种类以及温度等都是影响物质溶解的因素,说法正确,不符合题意;
C、饱和的氯化钠溶液,指的是在一定温度下不能再继续溶解氯化钠的溶液, 说法正确,不符合题意;
D、溶液中有晶体析出时,溶质质量减小,溶质质量分数不一定减小,如氯化钠饱和溶液恒温蒸发溶剂,有溶质析出,还是饱和溶液,温度不变,溶解度不变,饱和溶液的溶质质量分数不变,符合题意。
故选D。
5.D
【详解】
A、实验室配制溶液的顺序为计算、称量、量取、溶解,即④②①⑤③,A正确;
B、配制该溶液需要水的质量为100g-100g×16%=84g,需要水的体积为84mL,可选用100mL量筒量取所需水的体积,B正确;
C、需称量NaCl的质量为100g×16%=16.0g,C正确;
D、②中游码在6g处,由于砝码和药品放反,故盐实际质量为10g-6g=4g,D错误。
故选D。
6.C
【详解】
A、用洗涤剂清洗油污属于乳化,用汽油清洗油污属于溶解,所用的原理是不同的,正确。
B、氢氧化钠溶解放热,硝酸铵溶解吸热,氯化钠溶解不吸热,也不放热,用水分别溶解测温的方法可以区分氢氧化钠 氯化钠 硝酸铵三种白色固体,正确。
C、过滤不能去除钙镁离子,不可以使硬水转化为软水,错误。
D、不同种元素之间最本质的不同是质子数不同,正确。
故选:C。
7.A
【详解】
A、由图可知,T2℃时,Na2CO3的溶解度为49g,则此时Na2CO3饱和溶液质量分数=×100%≈32.9%<49%,选项错误;
B、由图可知,T4℃时,两种物质的溶解度都大于T1℃时的溶解度,将两物质的饱和溶液由T1℃升温至T4℃,两种物的溶解度都变大,饱和溶液变为不饱和溶液,均无固体析出,选项正确;
C、由图可知,T4℃时氯化钾的溶解度大于碳酸钠的溶解度,即T4℃时氯化钾饱和溶液的溶质质量分数大于碳酸钠饱和溶液的溶质质量分数,则T4℃时,分别将等质量的KC1和Na2CO3溶于水配成饱和溶液,所得溶液的质量前者小于后者,选项正确;
D、由图可知,温度在T3℃以上时,两种物质的溶解度都随温度升高而增大,且氯化钾的溶解度受温度影响比碳酸钠大,所以KCl溶液中含有少量Na2CO3,可采取蒸发浓缩控制温度T3℃以上降温结晶、过滤等操作提纯,选项正确;
故选A。
8.B
【详解】
要使气球逐渐膨胀,则瓶中的气压一定增大,即有气体生成或者是放热
①反应会产生气体,符合题意;
②氯化钠溶于水不会放出气体和放热,不符合题意;
③氢氧化钠溶于水会放出热量,故符合题意;
④硝酸铵溶于水吸收热量,温度会降低,不符合题意;
故符合题意的是①③,故选择B。
9.B
【详解】
①称量好的食盐倒入烧杯时,有少许洒出,会造成实际所取的氯化钠的质量偏小,则使溶质质量分数偏小;
②量水的体积时,俯视量筒,读数比实际液体体积大,会造成实际量取的水的体积偏小,则配得溶液的溶质质量分数偏大;
③溶解食盐的烧杯内壁是潮湿的,会造成实际量取的水的体积偏大,则配得溶液的溶质质量分数偏小;
④用4g食盐和100g水配制溶液,所得溶液中溶质质量分数为 ;
故①③④会导致溶液浓度偏小。
故选B。
10.C
【详解】
A、氯化钠溶于水就是钠离子和氯离子在水分子作用下均匀扩散到水中的过程,说法正确;
B、搅拌和升温能加快分子的运动速率,可以加速溶解,说法正确;
C、溶液具有均一性,把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数仍为20%,说法错误;
D、同种溶质的饱和溶液与不饱和溶液通过改变条件可以相互转化,如改变温度、添加或减少溶剂、添加或减少溶质均可实现饱和溶液与不饱和溶液的相互转化,故说法正确。
故选:C。
11.D
【详解】
ag硝酸钾放入到bg水中,混合物为(a+b)g,当硝酸钾为完全溶解时,m=(a+b)g,当硝酸钾不完全溶解时m<(a+b)g,故选D。
12.D
略
13.C
【详解】
设200g稀盐酸样品中氯化氢的质量为
该瓶稀盐酸中溶质的质量分数=
答:该瓶稀盐酸中溶质的质量分数为7.3%。
14.(1)c
(2)b
(3)不饱和
(4)A
(5)降温结晶
(1)
通过分析溶解度曲线可知,三种物质的溶解度随着温度升高而减小的是c,故填:c。
(2)
由图可知,t2℃时,a、b的溶解度曲线相交,说明该温度下,物质a的溶解度与物质b的溶解度相等,故填:b。
(3)
t3℃时,a物质的溶解度是50g,即该温度下,100g水中最多能溶解度50ga物质,200g水可以溶解a物质100g,所以把80g物质a加入到200g水中充分搅拌、静置,形成溶液的质量是280g,形成的是不饱和溶液,故填:不饱和。
(4)
t3℃时,a物质的溶解度大于b,将等质量a和b的饱和溶液降到t1℃时,a物质的溶解度小于b,所以析出晶体的质量关系正确的是a>b,故选A。
(5)
a物质溶解度随温度变化较大,如果a中混有少量固体b,若提纯a,一般采用降温结晶的方法,故填:降温结晶。
15. 肥皂水 物理 C>B>A 能 B 50 不变
【详解】
(1)①硬水给生活和生产带来许多麻烦,一般可用肥皂水来区分硬水和软水,遇肥皂水产生泡沫少的是硬水,遇肥皂水产生泡沫多的是软水。
②可利用活性炭吸附水中的异味和色素,活性炭的吸附性不需要经过化学变化来表现,属于物理性质。
(2)①由图可知,t1℃时,A、B、C三种物质的溶解度由大到小的顺序是C>B>A。
②当温度在t1~t3℃之间时,A物质与B物质的溶解度可能相等,因此能配制溶质质量分数相同的饱和溶液。
③将A、B、C三种物质的饱和溶液分别由t2℃升温到t3℃,AB变成不饱和溶液,质量分数都不变,C仍然是饱和溶液,质量分数减小,由于t2℃时B的溶解度大于A,所得溶液中溶质的质量分数最大的物质是B。
④t3℃时A溶解度是50g,将75gA的饱和溶液稀释成20%的溶液需加水的质量:
⑤向烧杯中加入一定量的硝酸铵固体,硝酸铵溶于水溶液温度降低,氢氧化钙的溶解度随温度的降低而增大,溶液由饱和变不饱和,此时试管中氢氧化钙溶液的溶质质量分数将不变。
16. 氯化镁 7:10 增加溶质(或其它合理答案) 蒸发结晶
【详解】
(1)根据图示可知,氯化镁的溶解度随温度的变化趋势较大,而氯化钠较小。故答案为:氯化镁;
(2)t℃时,氯化镁的溶解度为70g,表示在t℃时,100g的水中,最多能溶解氯化镁70g。则饱和溶液中,溶质和溶剂的质量比为:70g:100g=7:10。故答案为:7:10;
(3)将接近饱和的氯化钠溶液变为饱和溶液,可以向溶液中增加溶质、恒温蒸发溶剂、降低温度。故答案为:增加溶质(答案合理即可);
(4)海水晒盐的过程中,通过自然光的温度将水分蒸发,从而溶液中逐渐的析出氯化钠晶体。该过程属于蒸发结晶的过程。故答案为:蒸发结晶。
17. B 20g A、B ③
【详解】
(1)将30g固体物质X(不含结晶水)投入盛有20g水的烧杯中,溶液中溶剂的质量都是20g,A点溶质质量是4g,B点溶质质量为12g,溶质的质量分数较大的是 B;
(2)由图可知,0℃时,物质X在20g水中最多能溶解4g,则在100g水中最多溶解20g,溶解度是20g;
(3)A、B、C、D四点对应的溶液中,A、B两点对应的溶液都是与剩余固体共存的溶液,一定属于饱和溶液,C点溶液可能饱和也可能不饱和,D点溶液一定不饱和;
(4)①t1℃时,20g水中最多能溶12gX,则30g中最多能溶18g,若向B点对应的烧杯中再加入30g水,搅拌,所得溶液恰好是饱和溶液,选项错误;
②若要从D点对应的溶液中得到全部固体X,可采用蒸发结晶的方法,选项错误;
③如果采用升高温度并加入溶质的方法将t2℃时的物质X的饱和溶液变为高温条件下的不饱和溶液,溶质的质量会增大;如果只是增加溶剂,则溶质的质量分数减小;如果只是升温变成高温条件下不饱和溶液,溶质的质量分数不变。
18. t2 75 丙 冷却热饱和溶液
【详解】
(1)在t2°C 时,甲与丙的溶解度曲线交于一点,表示该温度下二者的溶解度相等。
(2)在t3°C 时甲的溶解度是50g,即100g水中最多溶解50g的甲,所以把30g甲溶解于50g水中最多溶解25g,得到75g溶液。
(3)t3℃时,有甲、乙、丙三种物质的等质量饱和溶液,由于此温度下溶解度甲>乙>丙,因此溶质的质量分数甲>乙>丙,溶质的质量甲>乙>丙。溶液的质量=溶质的质量+溶剂的质量,此时溶液的质量相等,溶剂的质量应为:丙>乙>甲。
(4)由甲、乙物质的溶解度曲线可以知道,甲物质的溶解度随温度的升高而明显增大,乙物质的溶解度随温度的升高变化不大,所以若在混有少量乙的甲中提纯甲,应采用冷却热饱和溶液的方法。
19. 溶质质量 溶液质量 溶质的质量分数
【详解】
表示溶液浓度的方法很多,其中一种是溶质的质量分数,溶质质量与溶液质量之比,是溶质的质量分数,这是溶液组成的定量表示。
20. 不一定 不一定 饱和溶液 不饱和溶液
【详解】
①浓溶液不一定是饱和溶液;
②稀溶液不一定是不饱和溶液,如氢氧化钙微溶于水,溶液中的溶质含量很少,是稀溶液,但却是饱和溶液;
③在一定温度时,同种溶质的同一溶剂的饱和溶液要比它的不饱和溶液浓。因为同一温度下、同一溶剂中,饱和溶液中溶质质量分数大。
答案第1页,共2页
答案第10页,共10页
同课章节目录
