8.2金属活动性顺序专题-2021-2022学年九年级化学人教版下册(30张PPT)
文档属性
| 名称 | 8.2金属活动性顺序专题-2021-2022学年九年级化学人教版下册(30张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 302.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-23 11:06:09 | ||
图片预览






文档简介
(共30张PPT)
金属活动性顺序专题
a、判断金属与酸的置换反应能否发生
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
在金属活动性顺序中:位于氢前面的金属能置换出盐酸、稀硫酸中的氢
例:可由金属和稀硫酸直接反应制取的化合物是:( )
A、CuSO4 B、Ag2SO4 C、Fe2(SO4)3 D、MgSO4
Cu和Ag与酸不反应
铁与酸反应,生成亚铁盐
D
1、金属与酸的反应
练一练
2、废旧计算机的某些零件含有锌、铁、铜、银、铂、金与足量稀盐酸反应后,过滤,剩余的固体中不可能有:( )
A、铜、银 B、铁、锌 C、铂、铜 D、银、金
1、下列物质可通过金属与稀盐酸反应直接得到的是( )A.CuCl2 B.AgCl C.ZnCl2 D.FeCl3
3、手机的某些部件里含有Mg、Al、Cu、Ag等金属,将废旧手机的部件粉碎并浸入足量稀硫酸中充分反应后,所得溶液中含有的金属离子是( )A.Mg2+、Al3+ B.Cu2+、Ag+ C.Al3+、Cu2+ D.Mg2+、Ag+
A
B
C
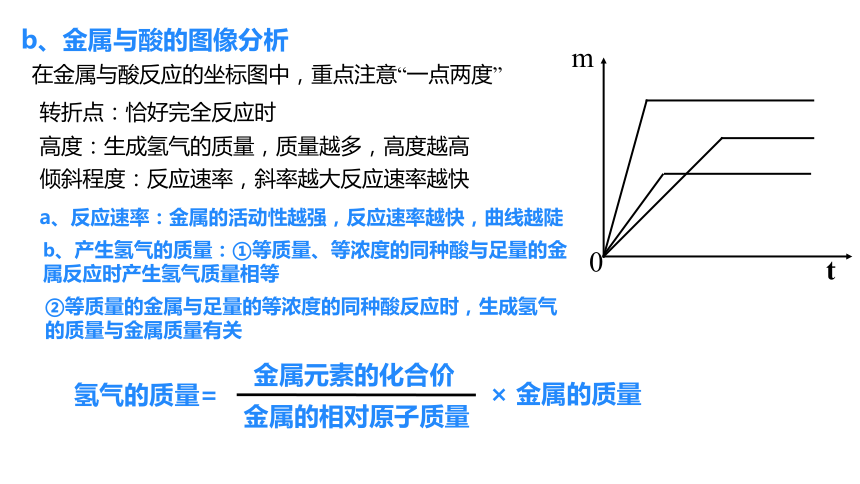
b、金属与酸的图像分析
在金属与酸反应的坐标图中,重点注意“一点两度”
转折点:恰好完全反应时
高度:生成氢气的质量,质量越多,高度越高
倾斜程度:反应速率,斜率越大反应速率越快
b、产生氢气的质量:①等质量、等浓度的同种酸与足量的金属反应时产生氢气质量相等
a、反应速率:金属的活动性越强,反应速率越快,曲线越陡
氢气的质量=
金属元素的化合价
× 金属的质量
金属的相对原子质量
m
t
0
②等质量的金属与足量的等浓度的同种酸反应时,生成氢气的质量与金属质量有关
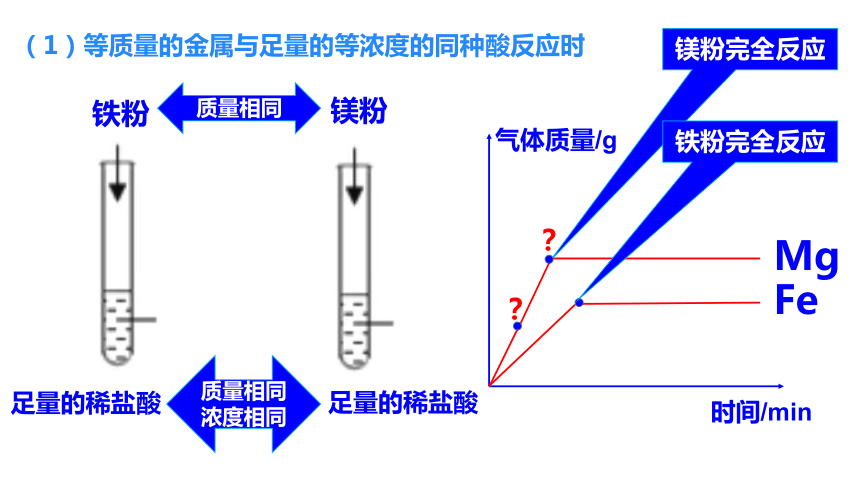
镁粉完全反应
铁粉
足量的稀盐酸
镁粉
足量的稀盐酸
时间/min
气体质量/g
铁粉完全反应
质量相同
质量相同
浓度相同
?
?
Fe
Mg
(1)等质量的金属与足量的等浓度的同种酸反应时
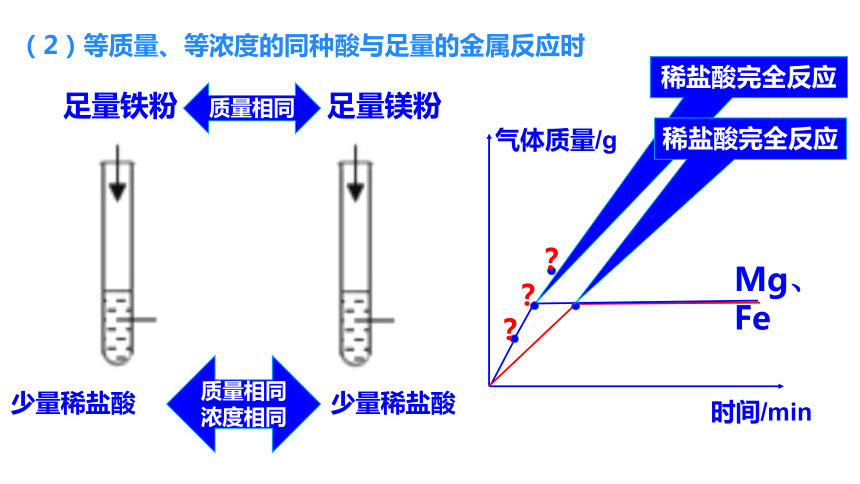
稀盐酸完全反应
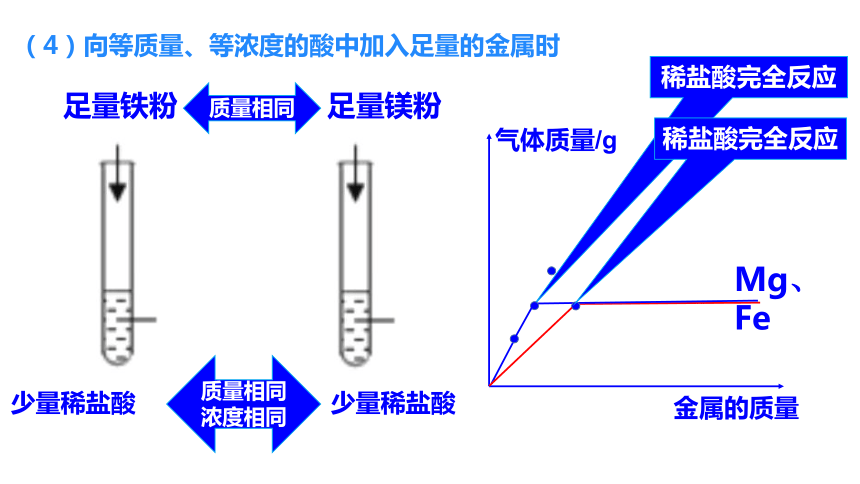
足量铁粉
少量稀盐酸
足量镁粉
少量稀盐酸
时间/min
气体质量/g
稀盐酸完全反应
质量相同
质量相同
浓度相同
?
?
Mg、Fe
?
(2)等质量、等浓度的同种酸与足量的金属反应时
镁完全反应
少量铁粉
少量镁粉
稀盐酸质量/g
气体质量/g
铁完全反应
质量相同
浓度相同
Fe
滴加
足量稀盐酸
滴加
足量稀盐酸
Mg
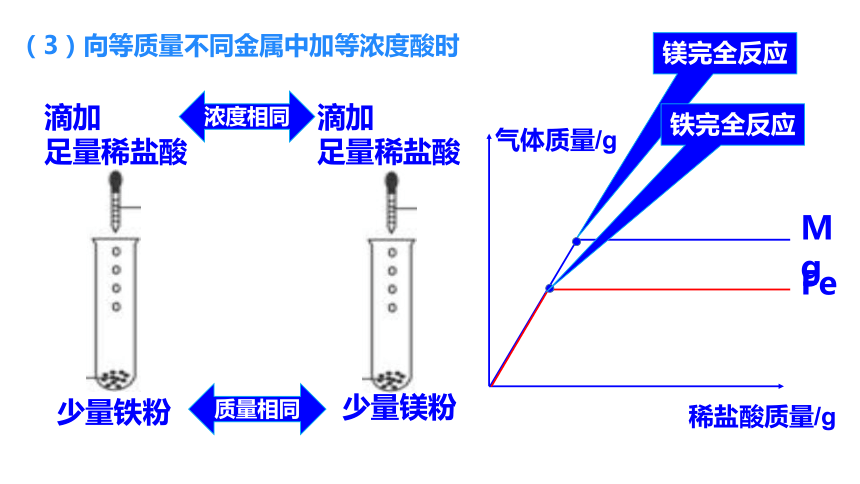
(3)向等质量不同金属中加等浓度酸时
稀盐酸完全反应
足量铁粉
少量稀盐酸
足量镁粉
少量稀盐酸
金属的质量
气体质量/g
稀盐酸完全反应
质量相同
质量相同
浓度相同
Mg、Fe
(4)向等质量、等浓度的酸中加入足量的金属时
练一练
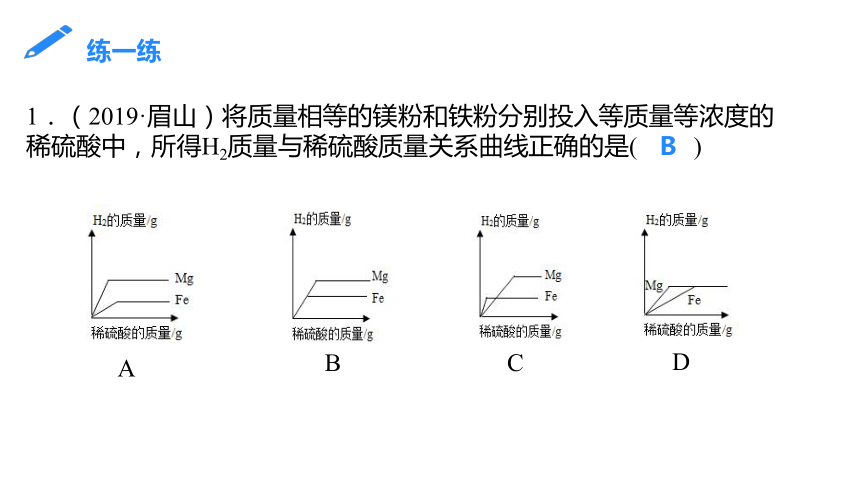
1.(2019·眉山)将质量相等的镁粉和铁粉分别投入等质量等浓度的稀硫酸中,所得H2质量与稀硫酸质量关系曲线正确的是( )
A
B
C
D
B
2.相同质量的Mg、Fe、Zn三种金属,分别与足量的、质量相同、质量分数相同的稀H2SO4充分反应,生成氢气与消耗稀H2SO4的质量关系见图,分析图像所得的结论中,不正确的是 ( )
A.三种金属的活动性顺序:Mg>Fe>Zn
B.三种金属的相对原子质量:Mg<Fe<Zn
C.三种金属消耗稀H2SO4的质量:Mg>Fe>Zn
D.三种金属与稀H2SO4反应后溶液的质量:
Mg<Fe<Zn
A
3.现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中均显+2价)。则下列说法错误的是 ( )
A. 完全反应所需时间:丙>甲>乙 B. 生成氢气的质量:甲>乙>丙C. 相对原子质量:乙>丙>甲 D. 消耗硫酸的质量:甲>乙>丙
C
a、判断金属与金属化合物的溶液的置换反应能否发生
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
在金属活动性顺序中:位于前面的金属能把位于后面的金属从它们化合
物的溶液里置换出来
例:下列在盐溶液里的置换反应能发生的是( )
A.Mg+CuSO4 B.Fe+AgCl
C.Cu+FeCl2 D.Hg+Cu(NO3)2
A
2、金属与盐溶液反应后滤液、滤渣成分的判断
练一练
1、 下列置换反应的化学方程式正确的是 ( )
A.2Fe+3CuCl2 = 2FeCl3 +3Cu B. 2Na+CuSO4 = Cu+Na2SO4
C. Zn +2AgNO3 =2Ag + Zn(NO3)2 D. Cu+ 2AgCl= CuCl2 + 2Ag
C
2、锡(sn)是五金之一,它的金属活动性顺序位于铁和铜之间,则下列反应一定不会发生的是 ( )
A.Zn+Sn(N03)2=Zn(N03)2+Sn B.Sn+2HCl=SnCl2+H2↑C.Sn+2AgN03=Sn(NO3)2+2Ag D.Sn+MgS04=SnS04+Mg
D
写出如图所示反应的化学方程式
Zn粉
CuSO4溶液
Fe粉
CuSO4溶液
Fe+CuSO4= FeSO4+Cu
Zn+CuSO4=ZnSO4+Cu
b、原则:最活泼的金属单质先置换最不活泼的金属离子即“远距离优先置换”
Zn粉和Fe粉的
混 合 物
足量CuSO4溶 液
先
后
Fe+CuSO4= FeSO4+Cu
Zn+CuSO4=ZnSO4+Cu
远
近
?
?
Zn和Fe都比Cu,但Zn比Fe更活泼
判断反应顺序
足量Zn粉
FeSO4 、CuSO4
的 混 合 溶 液
Zn+CuSO4=ZnSO4+Cu
Zn+FeSO4=ZnSO4+Fe
先
后
?
?
先远后近
谁弱谁挨打
金属1、金属2
金属3的化合物溶液
金属1、金属2>金属3
先远后近
谁强谁先上
远
金属1、金属2
金属3的化合物溶液
金属2的化合物、金属3的化合物的溶液
金属1
金属1、金属2>金属3
金属1 > 金属2、金属3
反应顺序
先
后
近
c、金属与盐溶液反应后滤液、滤渣成分的判断
1、两种金属与一种盐溶液反应,如Zn、Cu放入AgNO3溶液中
第一步:写出反应的化学方程式
Zn+2AgNO3=Zn(NO3)2+2Ag
Cu+2AgNO3=Cu(NO3)2+2Ag
第二步:根据AgNO3的量分析滤液、滤渣的成分
AgNO3的量(由少到多) 滤液的成分 滤渣的成分
AgNO3反应完、Zn过量
AgNO3和Zn恰好反应
AgNO3反应完、Cu部分反应
AgNO3和Cu恰好反应
AgNO3过量
Zn(NO3)2
Zn(NO3)2
Zn(NO3)2 Cu(NO3)2
Zn(NO3)2 Cu(NO3)2
Zn(NO3)2 Cu(NO3)2 AgNO3
Ag、Zn、Cu
Ag、Cu
Ag、Cu
Ag
Ag
2、一种金属与两种盐溶液反应,如Zn放入 Cu(NO3)2、AgNO3混合溶液中
第一步:写出反应的化学方程式
Zn+2AgNO3=Zn(NO3)2+2Ag
Zn+Cu(NO3)2=Zn(NO3)2+Cu
第二步:根据Zn量分析滤液、滤渣的成分
Zn的量(由少到多) 滤液的成分 滤渣的成分
Zn反应完、AgNO3过量
Zn和AgNO3恰好反应
Zn反应完、Cu(NO3)2部分反应
Zn和Cu(NO3)2恰好反应
Zn过量
Zn(NO3)2
Zn(NO3)2
Zn(NO3)2 Cu(NO3)2
Zn(NO3)2 Cu(NO3)2
Zn(NO3)2 Cu(NO3)2 AgNO3
Ag、Zn、Cu
Ag、Cu
Ag、Cu
Ag
Ag
归纳:滤液中一定有活动性最强的金属离子,滤渣中一定有活动性最弱的金属单质
练一练
1、在CuCl2和ZnCl2的混合溶液中加入铁粉,充分反应后过滤,所得滤渣与盐酸反应放出气体。则所得滤液中含有的溶质是( )
A.CuCl2 ZnCl2 FeCl2 B.CuCl2 FeCl2
C.FeCl2 ZnCl2 D.CuCl2 ZnCl2
C
2、将一定质量的铁粉加入到Mg(NO3)2、AgNO3的混合溶液中,充分反应后过滤,得到滤液和滤渣。向滤液中加入稀盐酸,无明显现象。下列叙述正确的是( )A.滤液中一定含有Mg2+和Fe3+ B.滤液中含有Mg2+和Ag+
C.滤渣中一定含有Ag D.滤渣中可能含有Mg
C
3 、 向含AgNO3、 Cu(NO3)2、Mg(NO3)2 的混合溶液中,加入过量的锌粉,充分反应后过滤,则滤出的固体中一定有 ( )
A. Ag、Cu和Mg B. Cu、Mg和Zn
C. Ag、Cu和Zn D. Ag 、Mg和Zn
C
4、向含AgNO3、 Cu(NO3)2、Mg(NO3)2 的混合溶液中,加入适量的锌粉,充分反应后过滤,则滤出的固体中一定有 ( )
A. Ag B. Cu
C. Zn D. Mg
A
5.实验课上,小明同学把一包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到固体和蓝色滤液。下列判断中正确的是( )
A.滤出的固体中一定含有银,可能含有铜
B.滤出的固体中一定含有银和铜,一定不含锌
C.滤液中一定含有硝酸铜,一定没有硝酸锌和硝酸银
D.滤液中一定含有硝酸锌,可能含有硝酸银和硝酸铜
6.在硝酸银和硝酸铜的混合溶液中,加入一定量的锌粉,充分反应后有少量金属析出,过滤后往滤液里滴加盐酸,有白色沉淀生成,则析出的少量金属是( )
A.Ag B.Zn和Ag C.Cu和Ag D.Zn和Cu
A
A
7、向氯化亚铁、氯化铜混合溶液中加入锌粉,以下对反应完成后的某些说法中不正确的是( )
A、若锌有剩余,则溶液中有Zn2+,无Cu2+,可能有Fe2+
B、若锌有剩余,则溶液中有Zn2+,没有Cu2+和 Fe2+
C、锌无剩余时,溶液若有Zn2+,无Cu2+,则一定有Fe2+
D、锌无剩余时,溶液中若无Cu2+,则可能有Zn2+ 和Fe2+
C
3、金属活动性的比较
a、判断常见金属活泼性的方法
① 金属与氧气反应的难易程度(金属越活泼,反应越容易,越剧烈)
② 金属与酸反应的剧烈程度。氢前金属+盐酸(稀硫酸)(置换反应)(金属越活泼,反应越容易,越剧烈)金属与酸不能反应(排在氢后面)
③ 金属能否与金属化合物的溶液反应。(位于前面的金属把位于后面的金属从它的化合物的溶液中置换出来)
2.现有X、Y、Z三种金属,已知:①X+YCl2==XCl2+Y;②把Y、Z两种金属分别放入稀硫酸中,只有Y和稀硫酸反应。这三种金属的活动性由强到弱的顺序是( ) A.X>Z>Y B.Z>Y>X C.Y>Z>X D.X>Y>Z
1.有甲、乙、丙、丁四种金属,只有丙在自然界能以单质形态存在。含甲化合物的水溶液不能用乙制的容器盛放。将甲和丁分别放入硝酸铜溶液中,在甲表面有铜析出,而丁没有变化。这四种金属活动性顺序由弱到强的是( )A. 丙<丁<甲<乙 B. 乙<甲<丁<丙 C. 丁<甲<乙<丙 D. 丙< 乙<甲<丁
练一练
A
D
b、金属活动性顺序的实验验证方法
(1)两种金属的验证方法
B、将两种金属分别与稀盐酸或稀硫酸反应,观察是否能发生反应,能反应则比较反应的剧烈程度(速度快慢)
A、将两种金属中的一种金属变成盐溶液,与另一种金属单质反应
(2)三种金属的验证方法
A、将三种金属分别与稀盐酸或稀硫酸反应
注意:如果两种金属的活动性都在氢后面则不能用该方法
如:比较镁、铁、铜三种金属的活动性强弱。
方法:将三种金属分别与稀盐酸或稀硫酸反应,观察是否能发生反应,能反应则比较反应的剧烈程度(速度快慢)
思考:铁、铜、银三种金属的活动性强弱,可以用上述方法吗?
如:比较铁、铜、银三种金属的活动性强弱。
第一步:排序 Fe Cu Ag
第二步:将两头的金属变成盐溶液,中间的金属不变FeSO4 Cu AgNO3
第三步:将铜片放入硫酸亚铁溶液中 不反应说明活动性 Fe大于Cu
第四步: 将铜片放入硝酸银溶液中 铜片表面有银白色物质生成 反应说明活动性 Cu大于Ag Cu + 2AgNO3 == 2Ag + Cu( NO3)2
B、先将三种金属的活动顺序排出来,然后将两头的金属变成盐溶液,中间的金属不变。 “两头变,中间不变”
结论:Fe > Cu> Ag
归纳:“两头变,中间不变”即“两盐夹一金”
C、先将三种金属的活动顺序排出来,然后将两头的金属不变,中间的金属变成盐溶液。 “两头不变,中间变”。
如:比较铁、铜、银三种金属的活动性强弱。
第一步:排序 Fe Cu Ag
第二步:将两头的金属变成盐溶液,中间的金属不变 Fe CuSO4 Ag
第三步: 将铁片加入硫酸铜溶液 铁丝表面有红色的物质生成 反应说明活动性:
Fe大于Cu Fe + CuSO4 == FeSO4 + Cu
第四步: 将银片加入硫酸铜溶液无现象 不反应说明活动性:Cu大于Ag
活动性: 即 Fe大于Cu Cu大于Ag
结论:Fe > Cu> Ag
归纳:“两头不变,中间变”即“两金夹一盐”
2.把金属X放入AgNO3溶液中,X表面有银白色固体析出;若放入FeSO4溶液中,无明显现象。则X、Ag、Fe三种金属活动性由强到弱的顺序正确的是( )A. Fe、X、Ag B. X、Fe、Ag C. Fe、Ag、X D. Ag、X、Fe
1.(2020·昆明)为验证Mg、Cu、Sn的金属活动性顺序,不可选用的一组物质是( )A. MgCl2溶液、Cu、SnB. Mg、Cu、SnCl2溶液C. Mg、Sn、Cu、盐酸D. MgCl2溶液、Sn、CuCl2溶液
练一练
A
A
3.(2020·金昌)某同学为验证铁、铜、银三种金属的活动性顺序,他设计了以下四种实验方案,其中能达到目的是( )A. 将Fe、Cu分别加入AgNO3溶液中B. 将Fe、Cu、Ag分别加入稀盐酸中C. 将Fe分别加入CuSO4、AgNO3溶液中D. 将Fe、Ag分别加入CuSO4溶液中
4、要验证Mg、Fe、Cu三种金属的活动性顺序,不可选用下列的一组物质是:( )
A、Fe、Cu、MgCl2溶液
B、MgCl2溶液、 Fe、 CuCl2溶液
C、Mg、 FeCl2溶液 、 Cu
D、Mg、Fe、Cu、硫酸溶液
A
D
金属活动性顺序专题
a、判断金属与酸的置换反应能否发生
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
在金属活动性顺序中:位于氢前面的金属能置换出盐酸、稀硫酸中的氢
例:可由金属和稀硫酸直接反应制取的化合物是:( )
A、CuSO4 B、Ag2SO4 C、Fe2(SO4)3 D、MgSO4
Cu和Ag与酸不反应
铁与酸反应,生成亚铁盐
D
1、金属与酸的反应
练一练
2、废旧计算机的某些零件含有锌、铁、铜、银、铂、金与足量稀盐酸反应后,过滤,剩余的固体中不可能有:( )
A、铜、银 B、铁、锌 C、铂、铜 D、银、金
1、下列物质可通过金属与稀盐酸反应直接得到的是( )A.CuCl2 B.AgCl C.ZnCl2 D.FeCl3
3、手机的某些部件里含有Mg、Al、Cu、Ag等金属,将废旧手机的部件粉碎并浸入足量稀硫酸中充分反应后,所得溶液中含有的金属离子是( )A.Mg2+、Al3+ B.Cu2+、Ag+ C.Al3+、Cu2+ D.Mg2+、Ag+
A
B
C
b、金属与酸的图像分析
在金属与酸反应的坐标图中,重点注意“一点两度”
转折点:恰好完全反应时
高度:生成氢气的质量,质量越多,高度越高
倾斜程度:反应速率,斜率越大反应速率越快
b、产生氢气的质量:①等质量、等浓度的同种酸与足量的金属反应时产生氢气质量相等
a、反应速率:金属的活动性越强,反应速率越快,曲线越陡
氢气的质量=
金属元素的化合价
× 金属的质量
金属的相对原子质量
m
t
0
②等质量的金属与足量的等浓度的同种酸反应时,生成氢气的质量与金属质量有关
镁粉完全反应
铁粉
足量的稀盐酸
镁粉
足量的稀盐酸
时间/min
气体质量/g
铁粉完全反应
质量相同
质量相同
浓度相同
?
?
Fe
Mg
(1)等质量的金属与足量的等浓度的同种酸反应时
稀盐酸完全反应
足量铁粉
少量稀盐酸
足量镁粉
少量稀盐酸
时间/min
气体质量/g
稀盐酸完全反应
质量相同
质量相同
浓度相同
?
?
Mg、Fe
?
(2)等质量、等浓度的同种酸与足量的金属反应时
镁完全反应
少量铁粉
少量镁粉
稀盐酸质量/g
气体质量/g
铁完全反应
质量相同
浓度相同
Fe
滴加
足量稀盐酸
滴加
足量稀盐酸
Mg
(3)向等质量不同金属中加等浓度酸时
稀盐酸完全反应
足量铁粉
少量稀盐酸
足量镁粉
少量稀盐酸
金属的质量
气体质量/g
稀盐酸完全反应
质量相同
质量相同
浓度相同
Mg、Fe
(4)向等质量、等浓度的酸中加入足量的金属时
练一练
1.(2019·眉山)将质量相等的镁粉和铁粉分别投入等质量等浓度的稀硫酸中,所得H2质量与稀硫酸质量关系曲线正确的是( )
A
B
C
D
B
2.相同质量的Mg、Fe、Zn三种金属,分别与足量的、质量相同、质量分数相同的稀H2SO4充分反应,生成氢气与消耗稀H2SO4的质量关系见图,分析图像所得的结论中,不正确的是 ( )
A.三种金属的活动性顺序:Mg>Fe>Zn
B.三种金属的相对原子质量:Mg<Fe<Zn
C.三种金属消耗稀H2SO4的质量:Mg>Fe>Zn
D.三种金属与稀H2SO4反应后溶液的质量:
Mg<Fe<Zn
A
3.现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中均显+2价)。则下列说法错误的是 ( )
A. 完全反应所需时间:丙>甲>乙 B. 生成氢气的质量:甲>乙>丙C. 相对原子质量:乙>丙>甲 D. 消耗硫酸的质量:甲>乙>丙
C
a、判断金属与金属化合物的溶液的置换反应能否发生
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
在金属活动性顺序中:位于前面的金属能把位于后面的金属从它们化合
物的溶液里置换出来
例:下列在盐溶液里的置换反应能发生的是( )
A.Mg+CuSO4 B.Fe+AgCl
C.Cu+FeCl2 D.Hg+Cu(NO3)2
A
2、金属与盐溶液反应后滤液、滤渣成分的判断
练一练
1、 下列置换反应的化学方程式正确的是 ( )
A.2Fe+3CuCl2 = 2FeCl3 +3Cu B. 2Na+CuSO4 = Cu+Na2SO4
C. Zn +2AgNO3 =2Ag + Zn(NO3)2 D. Cu+ 2AgCl= CuCl2 + 2Ag
C
2、锡(sn)是五金之一,它的金属活动性顺序位于铁和铜之间,则下列反应一定不会发生的是 ( )
A.Zn+Sn(N03)2=Zn(N03)2+Sn B.Sn+2HCl=SnCl2+H2↑C.Sn+2AgN03=Sn(NO3)2+2Ag D.Sn+MgS04=SnS04+Mg
D
写出如图所示反应的化学方程式
Zn粉
CuSO4溶液
Fe粉
CuSO4溶液
Fe+CuSO4= FeSO4+Cu
Zn+CuSO4=ZnSO4+Cu
b、原则:最活泼的金属单质先置换最不活泼的金属离子即“远距离优先置换”
Zn粉和Fe粉的
混 合 物
足量CuSO4溶 液
先
后
Fe+CuSO4= FeSO4+Cu
Zn+CuSO4=ZnSO4+Cu
远
近
?
?
Zn和Fe都比Cu,但Zn比Fe更活泼
判断反应顺序
足量Zn粉
FeSO4 、CuSO4
的 混 合 溶 液
Zn+CuSO4=ZnSO4+Cu
Zn+FeSO4=ZnSO4+Fe
先
后
?
?
先远后近
谁弱谁挨打
金属1、金属2
金属3的化合物溶液
金属1、金属2>金属3
先远后近
谁强谁先上
远
金属1、金属2
金属3的化合物溶液
金属2的化合物、金属3的化合物的溶液
金属1
金属1、金属2>金属3
金属1 > 金属2、金属3
反应顺序
先
后
近
c、金属与盐溶液反应后滤液、滤渣成分的判断
1、两种金属与一种盐溶液反应,如Zn、Cu放入AgNO3溶液中
第一步:写出反应的化学方程式
Zn+2AgNO3=Zn(NO3)2+2Ag
Cu+2AgNO3=Cu(NO3)2+2Ag
第二步:根据AgNO3的量分析滤液、滤渣的成分
AgNO3的量(由少到多) 滤液的成分 滤渣的成分
AgNO3反应完、Zn过量
AgNO3和Zn恰好反应
AgNO3反应完、Cu部分反应
AgNO3和Cu恰好反应
AgNO3过量
Zn(NO3)2
Zn(NO3)2
Zn(NO3)2 Cu(NO3)2
Zn(NO3)2 Cu(NO3)2
Zn(NO3)2 Cu(NO3)2 AgNO3
Ag、Zn、Cu
Ag、Cu
Ag、Cu
Ag
Ag
2、一种金属与两种盐溶液反应,如Zn放入 Cu(NO3)2、AgNO3混合溶液中
第一步:写出反应的化学方程式
Zn+2AgNO3=Zn(NO3)2+2Ag
Zn+Cu(NO3)2=Zn(NO3)2+Cu
第二步:根据Zn量分析滤液、滤渣的成分
Zn的量(由少到多) 滤液的成分 滤渣的成分
Zn反应完、AgNO3过量
Zn和AgNO3恰好反应
Zn反应完、Cu(NO3)2部分反应
Zn和Cu(NO3)2恰好反应
Zn过量
Zn(NO3)2
Zn(NO3)2
Zn(NO3)2 Cu(NO3)2
Zn(NO3)2 Cu(NO3)2
Zn(NO3)2 Cu(NO3)2 AgNO3
Ag、Zn、Cu
Ag、Cu
Ag、Cu
Ag
Ag
归纳:滤液中一定有活动性最强的金属离子,滤渣中一定有活动性最弱的金属单质
练一练
1、在CuCl2和ZnCl2的混合溶液中加入铁粉,充分反应后过滤,所得滤渣与盐酸反应放出气体。则所得滤液中含有的溶质是( )
A.CuCl2 ZnCl2 FeCl2 B.CuCl2 FeCl2
C.FeCl2 ZnCl2 D.CuCl2 ZnCl2
C
2、将一定质量的铁粉加入到Mg(NO3)2、AgNO3的混合溶液中,充分反应后过滤,得到滤液和滤渣。向滤液中加入稀盐酸,无明显现象。下列叙述正确的是( )A.滤液中一定含有Mg2+和Fe3+ B.滤液中含有Mg2+和Ag+
C.滤渣中一定含有Ag D.滤渣中可能含有Mg
C
3 、 向含AgNO3、 Cu(NO3)2、Mg(NO3)2 的混合溶液中,加入过量的锌粉,充分反应后过滤,则滤出的固体中一定有 ( )
A. Ag、Cu和Mg B. Cu、Mg和Zn
C. Ag、Cu和Zn D. Ag 、Mg和Zn
C
4、向含AgNO3、 Cu(NO3)2、Mg(NO3)2 的混合溶液中,加入适量的锌粉,充分反应后过滤,则滤出的固体中一定有 ( )
A. Ag B. Cu
C. Zn D. Mg
A
5.实验课上,小明同学把一包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到固体和蓝色滤液。下列判断中正确的是( )
A.滤出的固体中一定含有银,可能含有铜
B.滤出的固体中一定含有银和铜,一定不含锌
C.滤液中一定含有硝酸铜,一定没有硝酸锌和硝酸银
D.滤液中一定含有硝酸锌,可能含有硝酸银和硝酸铜
6.在硝酸银和硝酸铜的混合溶液中,加入一定量的锌粉,充分反应后有少量金属析出,过滤后往滤液里滴加盐酸,有白色沉淀生成,则析出的少量金属是( )
A.Ag B.Zn和Ag C.Cu和Ag D.Zn和Cu
A
A
7、向氯化亚铁、氯化铜混合溶液中加入锌粉,以下对反应完成后的某些说法中不正确的是( )
A、若锌有剩余,则溶液中有Zn2+,无Cu2+,可能有Fe2+
B、若锌有剩余,则溶液中有Zn2+,没有Cu2+和 Fe2+
C、锌无剩余时,溶液若有Zn2+,无Cu2+,则一定有Fe2+
D、锌无剩余时,溶液中若无Cu2+,则可能有Zn2+ 和Fe2+
C
3、金属活动性的比较
a、判断常见金属活泼性的方法
① 金属与氧气反应的难易程度(金属越活泼,反应越容易,越剧烈)
② 金属与酸反应的剧烈程度。氢前金属+盐酸(稀硫酸)(置换反应)(金属越活泼,反应越容易,越剧烈)金属与酸不能反应(排在氢后面)
③ 金属能否与金属化合物的溶液反应。(位于前面的金属把位于后面的金属从它的化合物的溶液中置换出来)
2.现有X、Y、Z三种金属,已知:①X+YCl2==XCl2+Y;②把Y、Z两种金属分别放入稀硫酸中,只有Y和稀硫酸反应。这三种金属的活动性由强到弱的顺序是( ) A.X>Z>Y B.Z>Y>X C.Y>Z>X D.X>Y>Z
1.有甲、乙、丙、丁四种金属,只有丙在自然界能以单质形态存在。含甲化合物的水溶液不能用乙制的容器盛放。将甲和丁分别放入硝酸铜溶液中,在甲表面有铜析出,而丁没有变化。这四种金属活动性顺序由弱到强的是( )A. 丙<丁<甲<乙 B. 乙<甲<丁<丙 C. 丁<甲<乙<丙 D. 丙< 乙<甲<丁
练一练
A
D
b、金属活动性顺序的实验验证方法
(1)两种金属的验证方法
B、将两种金属分别与稀盐酸或稀硫酸反应,观察是否能发生反应,能反应则比较反应的剧烈程度(速度快慢)
A、将两种金属中的一种金属变成盐溶液,与另一种金属单质反应
(2)三种金属的验证方法
A、将三种金属分别与稀盐酸或稀硫酸反应
注意:如果两种金属的活动性都在氢后面则不能用该方法
如:比较镁、铁、铜三种金属的活动性强弱。
方法:将三种金属分别与稀盐酸或稀硫酸反应,观察是否能发生反应,能反应则比较反应的剧烈程度(速度快慢)
思考:铁、铜、银三种金属的活动性强弱,可以用上述方法吗?
如:比较铁、铜、银三种金属的活动性强弱。
第一步:排序 Fe Cu Ag
第二步:将两头的金属变成盐溶液,中间的金属不变FeSO4 Cu AgNO3
第三步:将铜片放入硫酸亚铁溶液中 不反应说明活动性 Fe大于Cu
第四步: 将铜片放入硝酸银溶液中 铜片表面有银白色物质生成 反应说明活动性 Cu大于Ag Cu + 2AgNO3 == 2Ag + Cu( NO3)2
B、先将三种金属的活动顺序排出来,然后将两头的金属变成盐溶液,中间的金属不变。 “两头变,中间不变”
结论:Fe > Cu> Ag
归纳:“两头变,中间不变”即“两盐夹一金”
C、先将三种金属的活动顺序排出来,然后将两头的金属不变,中间的金属变成盐溶液。 “两头不变,中间变”。
如:比较铁、铜、银三种金属的活动性强弱。
第一步:排序 Fe Cu Ag
第二步:将两头的金属变成盐溶液,中间的金属不变 Fe CuSO4 Ag
第三步: 将铁片加入硫酸铜溶液 铁丝表面有红色的物质生成 反应说明活动性:
Fe大于Cu Fe + CuSO4 == FeSO4 + Cu
第四步: 将银片加入硫酸铜溶液无现象 不反应说明活动性:Cu大于Ag
活动性: 即 Fe大于Cu Cu大于Ag
结论:Fe > Cu> Ag
归纳:“两头不变,中间变”即“两金夹一盐”
2.把金属X放入AgNO3溶液中,X表面有银白色固体析出;若放入FeSO4溶液中,无明显现象。则X、Ag、Fe三种金属活动性由强到弱的顺序正确的是( )A. Fe、X、Ag B. X、Fe、Ag C. Fe、Ag、X D. Ag、X、Fe
1.(2020·昆明)为验证Mg、Cu、Sn的金属活动性顺序,不可选用的一组物质是( )A. MgCl2溶液、Cu、SnB. Mg、Cu、SnCl2溶液C. Mg、Sn、Cu、盐酸D. MgCl2溶液、Sn、CuCl2溶液
练一练
A
A
3.(2020·金昌)某同学为验证铁、铜、银三种金属的活动性顺序,他设计了以下四种实验方案,其中能达到目的是( )A. 将Fe、Cu分别加入AgNO3溶液中B. 将Fe、Cu、Ag分别加入稀盐酸中C. 将Fe分别加入CuSO4、AgNO3溶液中D. 将Fe、Ag分别加入CuSO4溶液中
4、要验证Mg、Fe、Cu三种金属的活动性顺序,不可选用下列的一组物质是:( )
A、Fe、Cu、MgCl2溶液
B、MgCl2溶液、 Fe、 CuCl2溶液
C、Mg、 FeCl2溶液 、 Cu
D、Mg、Fe、Cu、硫酸溶液
A
D
同课章节目录
