第八单元课题2金属的化学性质-2021-2022学年九年级化学人教版下册(38张PPT)
文档属性
| 名称 | 第八单元课题2金属的化学性质-2021-2022学年九年级化学人教版下册(38张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-23 11:11:58 | ||
图片预览










文档简介
(共38张PPT)
第八单元 金属和金属材料
课题2 金属的化学性质
导入新课
黄铜(铜、锌合金)外观和黄金极为相似,有些不法分子常以黄铜冒充黄金进行诈骗。我们可以用什么方法鉴别真假黄金呢
1.镁与氧气反应
2Mg + O2 2MgO
点燃
常温下打磨的镁在空气中变暗,在空气中剧烈燃烧,发出耀眼的白光,放出热量,生成白色固体
一、金属与氧气反应
2.铝与氧气反应
在常温下,铝和氧气能发生反应,在铝表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化,所以铝具有很好的抗腐蚀性。
4Al + 3O2 2Al2O3
思考与交流
铝的化学性质很活泼,在常温下能与氧气反应,那么我们用的铝制餐具
是怎么回事呢?为什么却很耐腐蚀?
铝在常温下发生缓慢氧化:4Al+3O2=2Al2O3 铝制品表面形成一层致密的氧化物薄膜,从而阻止铝的进一步氧化,因而铝具有较好的抗腐蚀性
为何不宜用钢刷来擦洗铝制餐具呢?
若用钢刷擦洗铝制品,容易把氧化薄膜除掉,从而起不到保护作用。
3.铁与氧气反应
铁在空气中加热时出现红热现象但不燃烧。铁在氧气中剧烈燃烧,火星四射,放出热量,生成黑色固体。
3Fe + 2O2 Fe3O4
点燃
4.铜与氧气反应
铜在加热条件下与氧气反应,生成黑色固体。
Cu + O2 2CuO
△
金属铜
思考与交流
“真金不怕火炼” 这句话蕴含什么化学原理
金的化学性质很不活泼,即使在高温条件下也不与氧气发生反应。
小结
1.大多数金属都能与氧气发生反应,但反应的难易和剧烈程度不同。由此可在一定意义上反映金属的活泼程度。
2.判断金属活动性的方法一:
可根据金属与氧气反应的难易程度或者相同条件下反应现象的剧烈程度进行判断。
金属的活动性顺序:Mg>Al>Fe>Cu>Au。
金属 + 氧气 金属氧化物
练一练
1.已知甲、乙、丙三种不同金属,甲在空气中加热后仍保持原金属光泽,乙在空气中会缓慢氧化而腐蚀,丙在空气中会迅速氧化,需保存在煤油中,则甲、乙、丙三种金属的活动性大小关系为( )
A.甲>乙>丙 B.乙>丙>甲
C.丙>甲>乙 D.丙>乙>甲
D
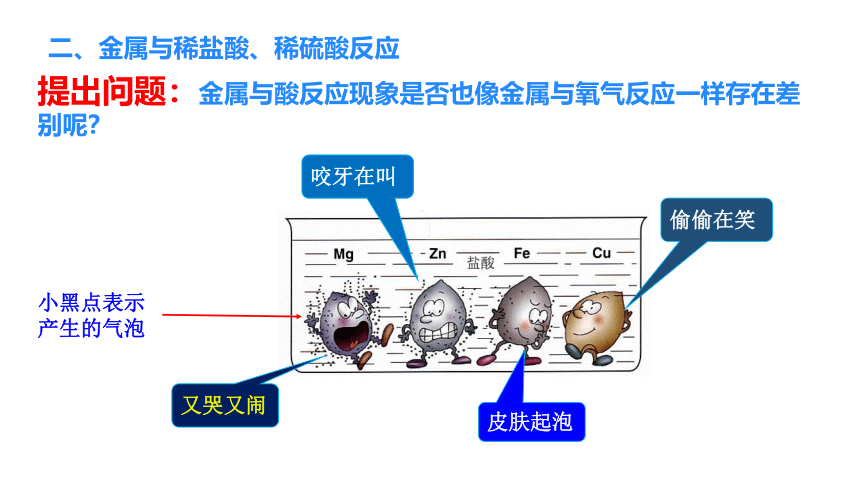
二、金属与稀盐酸、稀硫酸反应
提出问题:金属与酸反应现象是否也像金属与氧气反应一样存在差别呢?
小黑点表示产生的气泡
又哭又闹
咬牙在叫
皮肤起泡
偷偷在笑
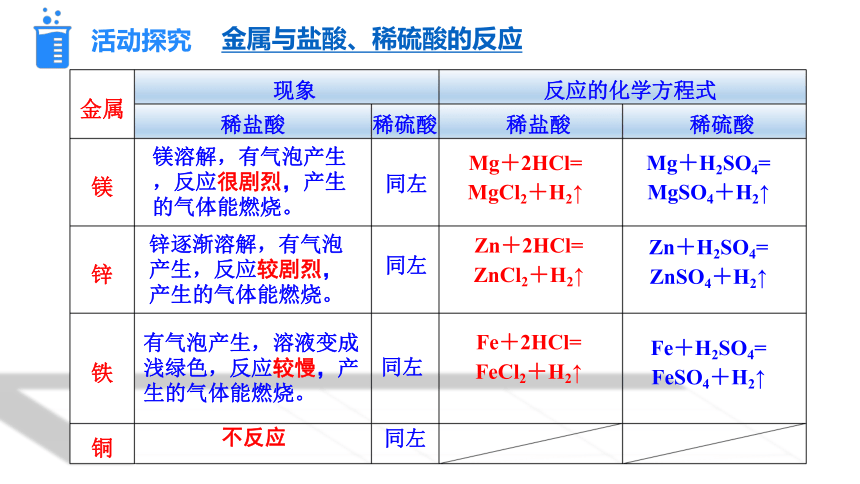
金属 现象 反应的化学方程式 稀盐酸 稀硫酸 稀盐酸 稀硫酸
镁
锌
铁
铜
镁溶解,有气泡产生,反应很剧烈,产生的气体能燃烧。
锌逐渐溶解,有气泡产生,反应较剧烈,产生的气体能燃烧。
有气泡产生,溶液变成浅绿色,反应较慢,产生的气体能燃烧。
不反应
同左
同左
同左
同左
Mg+2HCl=
MgCl2+H2↑
Zn+2HCl=
ZnCl2+H2↑
Fe+2HCl=
FeCl2+H2↑
Mg+H2SO4=
MgSO4+H2↑
Zn+H2SO4=
ZnSO4+H2↑
Fe+H2SO4=
FeSO4+H2↑
活动探究
金属与盐酸、稀硫酸的反应
小结
1.大多数金属都能与盐酸或稀硫酸发生反应,生成氢气,但反应的剧烈程度不同,由此可判断金属的活动性。
2.判断金属活动性的方法二:
可根据金属是否与盐酸或稀硫酸反应,或反应的剧烈程度判断金属的活动性强弱。
Mg > Zn > Fe > (H)> Cu
金属 + 酸 金属化合物 + H2
观察下列化学方程式有何特点。
Mg + H2SO4 == MgSO4 + H2↑
Fe + H2SO4 == FeSO4 + H2↑
Zn + H2SO4 == ZnSO4 + H2↑
2Al + 3H2SO4 == Al2(SO4)3 + 3H2↑
Mg + 2HCl == MgCl2 + H2↑
Fe + 2HCl == FeCl2 + H2↑
Zn + 2HCl == ZnCl2 + H2↑
单质
化合物
化合物
单质
由一种单质与一种化合物反应,生成另一种单质与另一种化合物
思考与交流
1. 概念
由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应叫置换反应。
2.表达式
3.特征
“一”换 ”一”
三、置换反应
A+BC===B+AC
思考与交流
下列学过的反应中有置换反应吗?
H2 + CuO Cu + H2O
△
CO + CuO Cu + CO2 ↑
△
C + 2CuO 2Cu + CO2 ↑
△
CaCO3+2HCl CaCl2+H2O+CO2↑
金属与氧气、酸的反应
金属与氧气反应
2Mg + O2 2MgO
点燃
4Al + 3O2 2Al2O3
3Fe + 2O2 Fe3O4
点燃
Cu + O2 2CuO
△
金属与酸反应
Mg +2HCl ===MgCl2 + H2↑
Zn + 2HCl ===ZnCl2 + H2↑
Fe + 2HCl ===FeCl2 + H2↑
置换反应
A+BC===B+AC
课堂小结
1.下列关于金属与氧气反应的观点中正确的是( )
A.所有的金属在常温下都能与氧气反应
B.镁只有在高温下才能与空气中的氧气反应
C.“真金不怕火炼”说明即使高温下金也不与氧气反应
D.金属与氧气反应都必须点燃或加热
C
随堂训练
2.关于置换反应说法一定正确的是( )
A.置换反应一定在溶液中进行
B.置换反应发生时一定有元素化合价的改变
C.有单质和化合物生成的反应一定是置换反应
D.元素存在形态发生改变的反应一定是置换反应
B
3.下列化合物中,不能通过金属与盐酸或者稀硫酸反应得到的是( )
A.MgSO4 B.FeCl3 C.AlCl3 D.ZnSO4
B
4.镁、锌、铁三种金属各30g,分别与足量盐酸反应。
(1)生成氢气的质量各是多少?
4.镁、锌、铁三种金属各30g,分别与足量盐酸反应。
(2)如果反应后各生成氢气30g,则需要这三种金属的质量各是多少?
导入新课
除了通过金属与氧气、盐酸、稀硫酸反应的难易程度和剧烈程度比较金属的活动性之外,还有其它证明金属活动性强弱的方法吗
思考与交流
将铁钉投入到硫酸铜溶液中有何现象?
Fe + CuSO4==== Cu + FeSO4
蓝色
溶液
红色
浅绿色
溶液
活动性强的金属可以把活动性弱的金属从它的化合物溶液中置换出来。
四、金属与金属化合物的溶液反应
思考与交流
铝、铜、银三种金属的活动性顺序的强弱如何证明?
方法:把一种单质浸入另一种金属化合物溶液中
1、铝丝浸入硫酸铜溶液中, 2、铜线浸入硝酸银溶液中, 3、铜丝浸入硫酸铝溶液中。
实验探究 金属活动性顺序
实验 现象 化学方程式 活动性
铝丝浸入硫 酸铜溶液中
铜丝浸入硝 酸银溶液中
铜丝浸入硫 酸铝溶液中
浸入溶液中的铝丝表面覆盖一层红色物质,溶液由蓝色逐渐变为无色
2Al+3CuSO4=== Al2(SO4)3+3Cu
Al>Cu
浸入溶液中的铜丝表面覆盖一层银白色物质,溶液由无色逐渐变为蓝色
Cu+2AgNO3===
Cu(NO3)2+2Ag
Cu>Ag
无明显现象
Al>Cu
思考与交流
1.上述能发生反应的化学方程式的特点是什么?属于哪种反应类型?
都是由一种单质与一种化合物反应,生成另一种单质和另一种化合物,属于置换反应。
2.通过上述实验,你能得出锌、铜、银的金属活动性顺序吗?
Zn Cu Ag
金属活动性: 强 弱
1、部分金属能与金属化合物的溶液反应;由此可判断金属的活动性。
金属 + 金属化合物 新金属 + 新金属化合物
2、判断金属活动性的方法三:
可根据金属能不能把另一种金属从金属化合物的溶液中置换出来,判断金属活动性的强弱。
小结
Al > Cu> Ag
3.金属活动性顺序
人们通过大量的实验,归纳总结出了常见金属在溶液中的活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
在金属活动性顺序中:金属的位置越靠前,它的活动性越强;位于氢前面的金属能置换出盐酸、稀硫酸中的氢;位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。(氢前可换氢,前金换后金、化合物可溶,钾、钙、钠除外、铁与酸发生置换反应,生成亚铁盐)
4.金属活动性顺序的应用
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
在金属活动性顺序中:金属的位置越靠前,它的活动性越强
判断金属活动性强弱:
判断金属是否能与酸发生置换反应放出氢气:
在金属活动性顺序中:位于氢前面的金属能置换出盐酸、稀硫酸中的氢
判断金属是否能与化合物的溶液发生置换反应:
在金属活动性顺序中:位于前面的金属能把位于后面的金属从它们化合
物的溶液里置换出来
思考与交流
波尔多液是一种农业上常用的杀菌剂,它由硫酸铜、生石灰加水配制而成。为什么不能用铁制容器来配制波尔多液?
Fe +CuSO4====Cu+FeSO4
练一练
1.判断下列各组物质能否发生反应?
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
(1)铜和硫酸锌溶液
(2)锌和硫酸铜溶液
(3)金和硫酸铜溶液
(4)铁和氯化银
不反应
反应
不反应
不反应,氯化银不可溶
练一练
2.有X、 Y 、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y的表面有银析出,而Z无变化。根据以上事实,判断X 、Y、 Z的金属活动顺序。
金属活动性顺序 X>Y>Z。
课堂小结
金属活动性顺序
内容
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
应用
在金属活动性顺序中,金属的位置越靠前,它的活动性越强
在金属活动性顺序中,位于氢前面的金属能置换出盐酸、稀硫酸中的氢
在金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来
1.下列事实不能证明金属甲的金属活动性比金属乙强的是
( )
A.自然界中甲元素只以化合物形式存在,乙元素存在单质形式
B.甲能与盐酸反应生成氢气而乙不能
C.甲能从乙的盐溶液中置换出乙
D.甲的抗腐蚀能力比乙强
D
随堂训练
2. 验证Zn、Fe、Cu金属的活动性强弱,下列的试剂组合实验方案不能达到实验目的是( )
A. FeCl2 溶液、Zn、Cu
B. ZnSO4溶液、稀盐酸溶液,Fe、Cu
C. ZnSO4溶液、CuSO4溶液、Fe
D. CuCl2溶液、Zn、Fe
D
3.有X、Y、Z三种金属,其金属活动性由强到弱的顺序可排列为Z、X、Y,则下列方程式一定正确的是( )
A.Y+Z(NO3)2══Y(NO3)2+Z
B.X+H2SO4══XSO4+H2↑
C.X+Y(NO3)2══X(NO3)2+Y
D.Z+2HCl══ZCl2+H2↑
C
4.填写下列表格(“混合物”栏中括号内为杂质)。
混合物 除去杂质的化学方程式 主要操作步骤
铜粉 (Fe)
FeCl2 溶液(CuCl2)
加适量稀盐酸至无气泡产生,过滤、洗涤、干燥
加适量无锈铁钉或铁粉,过滤
Fe+2HCl===FeCl2+H2↑
Fe+CuCl2===FeCl2+Cu
第八单元 金属和金属材料
课题2 金属的化学性质
导入新课
黄铜(铜、锌合金)外观和黄金极为相似,有些不法分子常以黄铜冒充黄金进行诈骗。我们可以用什么方法鉴别真假黄金呢
1.镁与氧气反应
2Mg + O2 2MgO
点燃
常温下打磨的镁在空气中变暗,在空气中剧烈燃烧,发出耀眼的白光,放出热量,生成白色固体
一、金属与氧气反应
2.铝与氧气反应
在常温下,铝和氧气能发生反应,在铝表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化,所以铝具有很好的抗腐蚀性。
4Al + 3O2 2Al2O3
思考与交流
铝的化学性质很活泼,在常温下能与氧气反应,那么我们用的铝制餐具
是怎么回事呢?为什么却很耐腐蚀?
铝在常温下发生缓慢氧化:4Al+3O2=2Al2O3 铝制品表面形成一层致密的氧化物薄膜,从而阻止铝的进一步氧化,因而铝具有较好的抗腐蚀性
为何不宜用钢刷来擦洗铝制餐具呢?
若用钢刷擦洗铝制品,容易把氧化薄膜除掉,从而起不到保护作用。
3.铁与氧气反应
铁在空气中加热时出现红热现象但不燃烧。铁在氧气中剧烈燃烧,火星四射,放出热量,生成黑色固体。
3Fe + 2O2 Fe3O4
点燃
4.铜与氧气反应
铜在加热条件下与氧气反应,生成黑色固体。
Cu + O2 2CuO
△
金属铜
思考与交流
“真金不怕火炼” 这句话蕴含什么化学原理
金的化学性质很不活泼,即使在高温条件下也不与氧气发生反应。
小结
1.大多数金属都能与氧气发生反应,但反应的难易和剧烈程度不同。由此可在一定意义上反映金属的活泼程度。
2.判断金属活动性的方法一:
可根据金属与氧气反应的难易程度或者相同条件下反应现象的剧烈程度进行判断。
金属的活动性顺序:Mg>Al>Fe>Cu>Au。
金属 + 氧气 金属氧化物
练一练
1.已知甲、乙、丙三种不同金属,甲在空气中加热后仍保持原金属光泽,乙在空气中会缓慢氧化而腐蚀,丙在空气中会迅速氧化,需保存在煤油中,则甲、乙、丙三种金属的活动性大小关系为( )
A.甲>乙>丙 B.乙>丙>甲
C.丙>甲>乙 D.丙>乙>甲
D
二、金属与稀盐酸、稀硫酸反应
提出问题:金属与酸反应现象是否也像金属与氧气反应一样存在差别呢?
小黑点表示产生的气泡
又哭又闹
咬牙在叫
皮肤起泡
偷偷在笑
金属 现象 反应的化学方程式 稀盐酸 稀硫酸 稀盐酸 稀硫酸
镁
锌
铁
铜
镁溶解,有气泡产生,反应很剧烈,产生的气体能燃烧。
锌逐渐溶解,有气泡产生,反应较剧烈,产生的气体能燃烧。
有气泡产生,溶液变成浅绿色,反应较慢,产生的气体能燃烧。
不反应
同左
同左
同左
同左
Mg+2HCl=
MgCl2+H2↑
Zn+2HCl=
ZnCl2+H2↑
Fe+2HCl=
FeCl2+H2↑
Mg+H2SO4=
MgSO4+H2↑
Zn+H2SO4=
ZnSO4+H2↑
Fe+H2SO4=
FeSO4+H2↑
活动探究
金属与盐酸、稀硫酸的反应
小结
1.大多数金属都能与盐酸或稀硫酸发生反应,生成氢气,但反应的剧烈程度不同,由此可判断金属的活动性。
2.判断金属活动性的方法二:
可根据金属是否与盐酸或稀硫酸反应,或反应的剧烈程度判断金属的活动性强弱。
Mg > Zn > Fe > (H)> Cu
金属 + 酸 金属化合物 + H2
观察下列化学方程式有何特点。
Mg + H2SO4 == MgSO4 + H2↑
Fe + H2SO4 == FeSO4 + H2↑
Zn + H2SO4 == ZnSO4 + H2↑
2Al + 3H2SO4 == Al2(SO4)3 + 3H2↑
Mg + 2HCl == MgCl2 + H2↑
Fe + 2HCl == FeCl2 + H2↑
Zn + 2HCl == ZnCl2 + H2↑
单质
化合物
化合物
单质
由一种单质与一种化合物反应,生成另一种单质与另一种化合物
思考与交流
1. 概念
由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应叫置换反应。
2.表达式
3.特征
“一”换 ”一”
三、置换反应
A+BC===B+AC
思考与交流
下列学过的反应中有置换反应吗?
H2 + CuO Cu + H2O
△
CO + CuO Cu + CO2 ↑
△
C + 2CuO 2Cu + CO2 ↑
△
CaCO3+2HCl CaCl2+H2O+CO2↑
金属与氧气、酸的反应
金属与氧气反应
2Mg + O2 2MgO
点燃
4Al + 3O2 2Al2O3
3Fe + 2O2 Fe3O4
点燃
Cu + O2 2CuO
△
金属与酸反应
Mg +2HCl ===MgCl2 + H2↑
Zn + 2HCl ===ZnCl2 + H2↑
Fe + 2HCl ===FeCl2 + H2↑
置换反应
A+BC===B+AC
课堂小结
1.下列关于金属与氧气反应的观点中正确的是( )
A.所有的金属在常温下都能与氧气反应
B.镁只有在高温下才能与空气中的氧气反应
C.“真金不怕火炼”说明即使高温下金也不与氧气反应
D.金属与氧气反应都必须点燃或加热
C
随堂训练
2.关于置换反应说法一定正确的是( )
A.置换反应一定在溶液中进行
B.置换反应发生时一定有元素化合价的改变
C.有单质和化合物生成的反应一定是置换反应
D.元素存在形态发生改变的反应一定是置换反应
B
3.下列化合物中,不能通过金属与盐酸或者稀硫酸反应得到的是( )
A.MgSO4 B.FeCl3 C.AlCl3 D.ZnSO4
B
4.镁、锌、铁三种金属各30g,分别与足量盐酸反应。
(1)生成氢气的质量各是多少?
4.镁、锌、铁三种金属各30g,分别与足量盐酸反应。
(2)如果反应后各生成氢气30g,则需要这三种金属的质量各是多少?
导入新课
除了通过金属与氧气、盐酸、稀硫酸反应的难易程度和剧烈程度比较金属的活动性之外,还有其它证明金属活动性强弱的方法吗
思考与交流
将铁钉投入到硫酸铜溶液中有何现象?
Fe + CuSO4==== Cu + FeSO4
蓝色
溶液
红色
浅绿色
溶液
活动性强的金属可以把活动性弱的金属从它的化合物溶液中置换出来。
四、金属与金属化合物的溶液反应
思考与交流
铝、铜、银三种金属的活动性顺序的强弱如何证明?
方法:把一种单质浸入另一种金属化合物溶液中
1、铝丝浸入硫酸铜溶液中, 2、铜线浸入硝酸银溶液中, 3、铜丝浸入硫酸铝溶液中。
实验探究 金属活动性顺序
实验 现象 化学方程式 活动性
铝丝浸入硫 酸铜溶液中
铜丝浸入硝 酸银溶液中
铜丝浸入硫 酸铝溶液中
浸入溶液中的铝丝表面覆盖一层红色物质,溶液由蓝色逐渐变为无色
2Al+3CuSO4=== Al2(SO4)3+3Cu
Al>Cu
浸入溶液中的铜丝表面覆盖一层银白色物质,溶液由无色逐渐变为蓝色
Cu+2AgNO3===
Cu(NO3)2+2Ag
Cu>Ag
无明显现象
Al>Cu
思考与交流
1.上述能发生反应的化学方程式的特点是什么?属于哪种反应类型?
都是由一种单质与一种化合物反应,生成另一种单质和另一种化合物,属于置换反应。
2.通过上述实验,你能得出锌、铜、银的金属活动性顺序吗?
Zn Cu Ag
金属活动性: 强 弱
1、部分金属能与金属化合物的溶液反应;由此可判断金属的活动性。
金属 + 金属化合物 新金属 + 新金属化合物
2、判断金属活动性的方法三:
可根据金属能不能把另一种金属从金属化合物的溶液中置换出来,判断金属活动性的强弱。
小结
Al > Cu> Ag
3.金属活动性顺序
人们通过大量的实验,归纳总结出了常见金属在溶液中的活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
在金属活动性顺序中:金属的位置越靠前,它的活动性越强;位于氢前面的金属能置换出盐酸、稀硫酸中的氢;位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。(氢前可换氢,前金换后金、化合物可溶,钾、钙、钠除外、铁与酸发生置换反应,生成亚铁盐)
4.金属活动性顺序的应用
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
在金属活动性顺序中:金属的位置越靠前,它的活动性越强
判断金属活动性强弱:
判断金属是否能与酸发生置换反应放出氢气:
在金属活动性顺序中:位于氢前面的金属能置换出盐酸、稀硫酸中的氢
判断金属是否能与化合物的溶液发生置换反应:
在金属活动性顺序中:位于前面的金属能把位于后面的金属从它们化合
物的溶液里置换出来
思考与交流
波尔多液是一种农业上常用的杀菌剂,它由硫酸铜、生石灰加水配制而成。为什么不能用铁制容器来配制波尔多液?
Fe +CuSO4====Cu+FeSO4
练一练
1.判断下列各组物质能否发生反应?
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
(1)铜和硫酸锌溶液
(2)锌和硫酸铜溶液
(3)金和硫酸铜溶液
(4)铁和氯化银
不反应
反应
不反应
不反应,氯化银不可溶
练一练
2.有X、 Y 、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y的表面有银析出,而Z无变化。根据以上事实,判断X 、Y、 Z的金属活动顺序。
金属活动性顺序 X>Y>Z。
课堂小结
金属活动性顺序
内容
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
应用
在金属活动性顺序中,金属的位置越靠前,它的活动性越强
在金属活动性顺序中,位于氢前面的金属能置换出盐酸、稀硫酸中的氢
在金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来
1.下列事实不能证明金属甲的金属活动性比金属乙强的是
( )
A.自然界中甲元素只以化合物形式存在,乙元素存在单质形式
B.甲能与盐酸反应生成氢气而乙不能
C.甲能从乙的盐溶液中置换出乙
D.甲的抗腐蚀能力比乙强
D
随堂训练
2. 验证Zn、Fe、Cu金属的活动性强弱,下列的试剂组合实验方案不能达到实验目的是( )
A. FeCl2 溶液、Zn、Cu
B. ZnSO4溶液、稀盐酸溶液,Fe、Cu
C. ZnSO4溶液、CuSO4溶液、Fe
D. CuCl2溶液、Zn、Fe
D
3.有X、Y、Z三种金属,其金属活动性由强到弱的顺序可排列为Z、X、Y,则下列方程式一定正确的是( )
A.Y+Z(NO3)2══Y(NO3)2+Z
B.X+H2SO4══XSO4+H2↑
C.X+Y(NO3)2══X(NO3)2+Y
D.Z+2HCl══ZCl2+H2↑
C
4.填写下列表格(“混合物”栏中括号内为杂质)。
混合物 除去杂质的化学方程式 主要操作步骤
铜粉 (Fe)
FeCl2 溶液(CuCl2)
加适量稀盐酸至无气泡产生,过滤、洗涤、干燥
加适量无锈铁钉或铁粉,过滤
Fe+2HCl===FeCl2+H2↑
Fe+CuCl2===FeCl2+Cu
同课章节目录
