海南省海口嘉勋高级中学2021-2022学年高一下学期2月开学校考检测化学试题(Word版含答案)
文档属性
| 名称 | 海南省海口嘉勋高级中学2021-2022学年高一下学期2月开学校考检测化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 203.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-25 23:29:35 | ||
图片预览




文档简介
海口嘉勋高级中学2021-2022学年高一下学期2月开学校考检测
化学试卷
(考试时间:90分钟 满分:100分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 Fe-56
一、选择题(本大题共8小题,每小题2分,共16分。在每题给出的选项中,只有一项是符合题目要求的)
1.下列有关硫酸的性质说法正确的是( )
A.在工业上用铁槽车或者铝槽车运输浓硫酸,是因为铝或铁与浓硫酸不反应
B.蔗糖与浓硫酸混合后会变黑,这说明浓硫酸具有很强的脱水性
C.实验室常用稀硫酸和金属锌反应制得氢气,说明稀硫酸比盐酸的酸性要强一些
D.向盐酸中加入浓硫酸时会有白雾生成,说明浓硫酸具有强氧化性
2.下列有关焰色反应实验操作注意事项的说法中正确的是( )
①钾的火焰颜色要透过蓝色钴玻璃观察
②先将铂丝灼烧到与原来火焰的颜色相同,再蘸取被检验的物质
③每次实验后,要将铂丝用盐酸洗净
④钠的焰色反应为黄色
⑤没有铂丝时,也可以用玻璃棒代替
A.仅有③不正确 B.仅有④不正确 C.仅有⑤不正确 D.全对
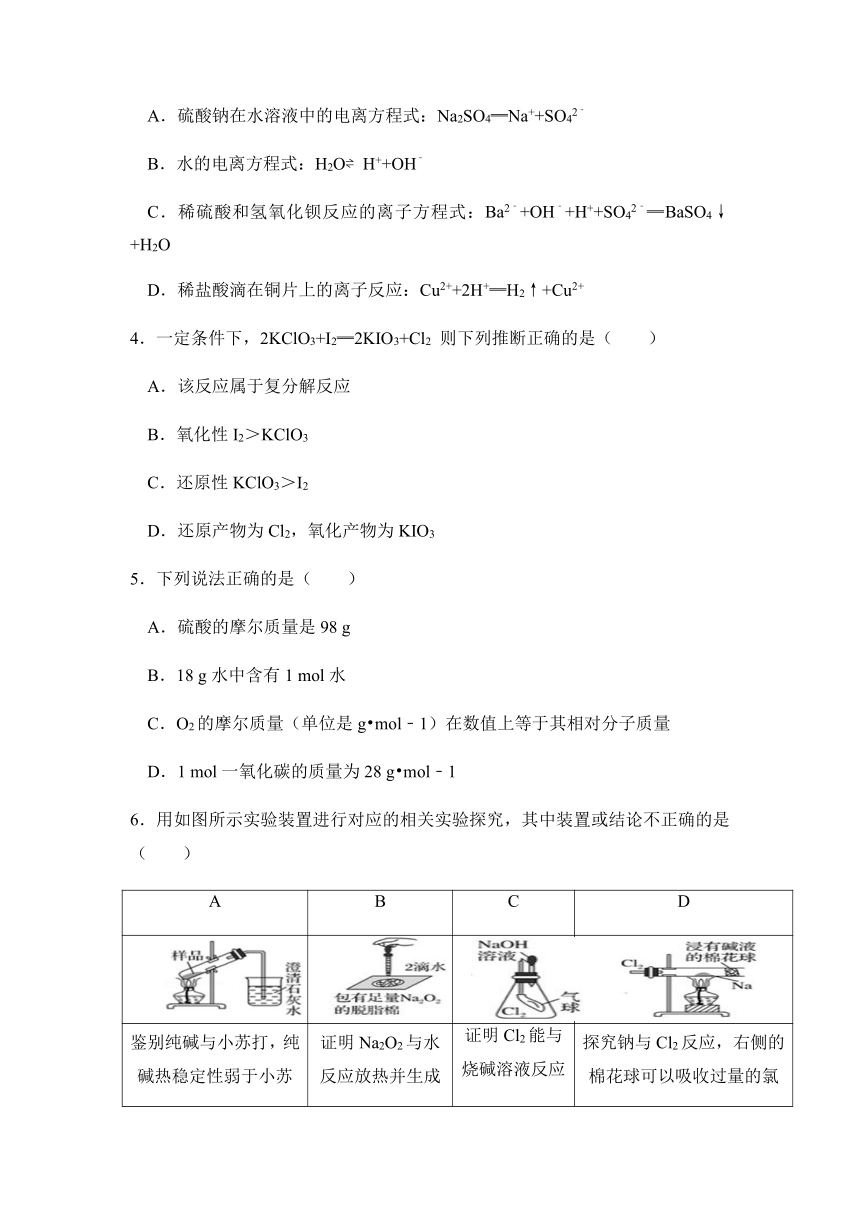
3.下列化学用语表达正确的是( )
A.硫酸钠在水溶液中的电离方程式:Na2SO4═Na++SO42﹣
B.水的电离方程式:H2O H++OH﹣
C.稀硫酸和氢氧化钡反应的离子方程式:Ba2﹣+OH﹣+H++SO42﹣═BaSO4↓+H2O
D.稀盐酸滴在铜片上的离子反应:Cu2++2H+═H2↑+Cu2+
4.一定条件下,2KClO3+I2═2KIO3+Cl2 则下列推断正确的是( )
A.该反应属于复分解反应
B.氧化性I2>KClO3
C.还原性KClO3>I2
D.还原产物为Cl2,氧化产物为KIO3
5.下列说法正确的是( )
A.硫酸的摩尔质量是98 g
B.18 g水中含有1 mol水
C.O2的摩尔质量(单位是g mol﹣1)在数值上等于其相对分子质量
D.1 mol一氧化碳的质量为28 g mol﹣1
6.用如图所示实验装置进行对应的相关实验探究,其中装置或结论不正确的是( )
A B C D
鉴别纯碱与小苏打,纯碱热稳定性弱于小苏打 证明Na2O2与水反应放热并生成O2 证明Cl2能与烧碱溶液反应 探究钠与Cl2反应,右侧的棉花球可以吸收过量的氯气
7.如表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法不正确的是( )
A.W的单质能稳定存在是因为分子内部的共价键很难破坏
B.原子半径:X>Y>Z>W
C.Y的最高价氧化物对应的水化物是强酸
D.X的最高价氧化物对应的水化物能溶于NaOH,不溶于氨水
8.国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。某含氯消毒液的主要成分为NaClO,还含有一定量的NaOH。下列用来解释事实的方程式中,不合理的是( )
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH﹣═ClO﹣+Cl﹣+H2O
B.该消毒液的与二氧化硫混用漂白性增强
C.该消毒液与洁厕灵(主要成分HCl)混用,产生有毒的Cl2:2H++Cl﹣+ClO﹣═Cl2↑+H2O
D.该消毒液加白醋生成HClO,可增强漂白性:CH3COOH+ClO﹣═HClO+CH3COO﹣
二、不定项选择题(本题包括6小题,每小题4分,共24分,每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题就为0分)
9.常温下,下列各组离子在指定的溶液中,一定能大量共存的是( )
A.使pH试纸显红色的溶液:K+、Na+、Cl﹣、HSO3﹣
B.在无色透明的溶液中:Na+、K+、SO42﹣、MnO4﹣
C.pH大于7的溶液中:CO32﹣、NH4+、SO42﹣、Cl﹣
D.pH小于7的溶液:Na+、Ba2+、NO3﹣、Cl﹣
10.下列有关表述错误的是( )
A.IBr的电子式:
B.HClO的结构式:H﹣Cl﹣O
C.HIO各原子最外层都满足8电子结构
D.MgO的形成过程可以表示为:
11.X、Y、Z是3种短周期元素,其中X、Y位于同一族,Y、Z处于同一周期,X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y少1,下列说法正确的是( )
A.元素非金属性由弱到强的顺序为Z<X<Y
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.三种元素的气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小的顺序为Z>Y>X
12.下列反应的离子方程式书写正确的是( )
A.铜与氯化铁溶液反应:Cu+2Fe3+═Cu2++2Fe2+
B.少量碳酸氢铵溶液与足量烧碱溶液混合加热:NH4++OH﹣ NH3↑+H2O
C.碳酸钙与醋酸反应:CO32﹣+2H+=CO2↑+H2O
D.铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑
13.以下关于铜跟浓、稀HNO3反应的说法中错误的是( )
A.1mol浓HNO3被还原转移2mol电子
B.Cu与浓HNO3反应剧烈,故氧化性浓HNO3强于稀HNO3
C.Cu与浓、稀HNO3反应都不需加热
D.生成等量的Cu(NO3)2,消耗浓HNO3的量多
14.某研究性学习小组从腐蚀印刷电路板的废液(含有FeCl2、FeCl3、CuCl2)中回收铜并制备氯化铁晶体,设计流程如图。下列说法正确的是( )
A.试剂a是铁粉、试剂b是稀硫酸
B.操作Ⅰ、Ⅱ、Ⅲ都用到玻璃棒
C.操作Ⅲ包含的步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D.可用KSCN溶液和新制氯水检验溶液W 中是否含有Fe2+
三、非选择题(本题5小题,共60分)
15.已知A、B、C均为含铁化合物,请根据以下四种物质的转化过程回答相关问题:
FeABC
(1)反应①、②、③中属于氧化还原反应的是 。(填序号)
(2)向B的溶液中滴入几滴KSCN溶液后,可观察到的现象是 。
(3)C的化学式为 。
(4)写出反应②的离子方程式: 。
16.室温下,A是常见的金属单质、单质B是黄绿色气体、单质C是无色气体。在合适反应条件下,它们可以按下面框图进行反应;E溶液是无色溶液,F是淡绿色溶液。B和C反应发出苍白色火焰。请回答:
(1)A是 ,B是 ;C是 ;D是 ;(请填写化学式)
(2)反应①的化学方程式 ;
(3)反应③的离子方程式 ;
17.用如图所示装置进行实验,证明过氧化钠(Na2O2)可在呼吸面具和潜水艇中做供氧剂。
请回答:
(1)装置A中盛放稀盐酸的仪器名称是 。
(2)装置B的作用是 。
(3)装置C中过氧化钠与二氧化碳反应的化学方程式是 。
(4)装置D中盛放的试剂是 。
(5)当装置内气流平稳后开始用试管收集气体,该气体能 ,证明过氧化钠可做供氧剂。
18.NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如图所示。
请回答下列问题:
(1)NaClO2中Cl元素的化合价为 。
(2)“电解”所用食盐水由粗盐水精制而成。精制时,为除去Mg2+和Ca2+,要加入的试剂分别为 、 。
(3)“尾气吸收”发生2NaOH+H2O2+2ClO2═2NaClO2+O2+2H2O反应,氧化剂与还原剂的质量之比为 。
19.配制480mL 0.2mol L﹣1的FeSO4溶液,为完成此配制实验,
(1)除了量筒、烧杯、玻璃棒外还需要的常见的玻璃仪器有 。
(2)实验室用绿矾(FeSO4 7H2O)来配制该溶液,用托盘天平称量绿矾 g。
(3)由于错误操作,使得实际浓度比所要求的偏小的是 (填写编号)。
A.称量绿矾时,左码右物
B.使用容量瓶配制溶液时,俯视液面定容
C.未用蒸馏水洗涤烧杯2~3次
D.容量瓶刚用蒸馏水洗净,没有干燥
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
F.把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
(4)定容时,若加蒸馏水时不慎超过刻度线,处理方法是 。
参考答案及评分细则
1.B
2.C
3.B
4.D
5.C
6.A
7.C
8.B
9.D
10.BC
11.D
12.A
13.A
14.BC
15.(12分)
(1)①②;(4分)
(2)溶液由无色变为红色;(2分)(答案合理即可给分)
(3)Fe(OH)3;(2分)
(4)2Fe2++Cl2=2Fe3++2Cl-(4分)(写出物质给2分,配平给1分,符号给1分。)
16.(16分)
(1)Fe(2分);Cl2(2分);H2(2分);FeCl3(2分);
(2)2Fe+3Cl22FeCl3;(4分)(写出物质给2分,配平给1分,符号给1分。)
(3)Fe+2H+=Fe2++H2↑;(4分)(写出物质给2分,配平给1分,符号给1分。)
17、(12分)
(1)分液漏斗;(2分)
(2)除去CO2中的HCl;(2分)(答案合理即可给分)
(3)2Na2O2+2CO2=2Na2CO3+O2;(4分)(写出物质给2分,配平给1分,符号给1分。)
(4)NaOH溶液;(2分)(答案合理即可给分)
(5)使带火星的木条复燃。(2分)(答案合理即可给分)
18、(8分)
(1)+3;(2分)
(2)NaOH(2分);Na2CO3;(2分)
(3)135:34(2分)
19、(12分)
(1)500mL容量瓶(2分)、胶头滴管(2分);
(2)27.8;(2分)
(3)ACEF;(4分)
(4)重新配制。(2分)
化学试卷
(考试时间:90分钟 满分:100分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 Fe-56
一、选择题(本大题共8小题,每小题2分,共16分。在每题给出的选项中,只有一项是符合题目要求的)
1.下列有关硫酸的性质说法正确的是( )
A.在工业上用铁槽车或者铝槽车运输浓硫酸,是因为铝或铁与浓硫酸不反应
B.蔗糖与浓硫酸混合后会变黑,这说明浓硫酸具有很强的脱水性
C.实验室常用稀硫酸和金属锌反应制得氢气,说明稀硫酸比盐酸的酸性要强一些
D.向盐酸中加入浓硫酸时会有白雾生成,说明浓硫酸具有强氧化性
2.下列有关焰色反应实验操作注意事项的说法中正确的是( )
①钾的火焰颜色要透过蓝色钴玻璃观察
②先将铂丝灼烧到与原来火焰的颜色相同,再蘸取被检验的物质
③每次实验后,要将铂丝用盐酸洗净
④钠的焰色反应为黄色
⑤没有铂丝时,也可以用玻璃棒代替
A.仅有③不正确 B.仅有④不正确 C.仅有⑤不正确 D.全对
3.下列化学用语表达正确的是( )
A.硫酸钠在水溶液中的电离方程式:Na2SO4═Na++SO42﹣
B.水的电离方程式:H2O H++OH﹣
C.稀硫酸和氢氧化钡反应的离子方程式:Ba2﹣+OH﹣+H++SO42﹣═BaSO4↓+H2O
D.稀盐酸滴在铜片上的离子反应:Cu2++2H+═H2↑+Cu2+
4.一定条件下,2KClO3+I2═2KIO3+Cl2 则下列推断正确的是( )
A.该反应属于复分解反应
B.氧化性I2>KClO3
C.还原性KClO3>I2
D.还原产物为Cl2,氧化产物为KIO3
5.下列说法正确的是( )
A.硫酸的摩尔质量是98 g
B.18 g水中含有1 mol水
C.O2的摩尔质量(单位是g mol﹣1)在数值上等于其相对分子质量
D.1 mol一氧化碳的质量为28 g mol﹣1
6.用如图所示实验装置进行对应的相关实验探究,其中装置或结论不正确的是( )
A B C D
鉴别纯碱与小苏打,纯碱热稳定性弱于小苏打 证明Na2O2与水反应放热并生成O2 证明Cl2能与烧碱溶液反应 探究钠与Cl2反应,右侧的棉花球可以吸收过量的氯气
7.如表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法不正确的是( )
A.W的单质能稳定存在是因为分子内部的共价键很难破坏
B.原子半径:X>Y>Z>W
C.Y的最高价氧化物对应的水化物是强酸
D.X的最高价氧化物对应的水化物能溶于NaOH,不溶于氨水
8.国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。某含氯消毒液的主要成分为NaClO,还含有一定量的NaOH。下列用来解释事实的方程式中,不合理的是( )
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH﹣═ClO﹣+Cl﹣+H2O
B.该消毒液的与二氧化硫混用漂白性增强
C.该消毒液与洁厕灵(主要成分HCl)混用,产生有毒的Cl2:2H++Cl﹣+ClO﹣═Cl2↑+H2O
D.该消毒液加白醋生成HClO,可增强漂白性:CH3COOH+ClO﹣═HClO+CH3COO﹣
二、不定项选择题(本题包括6小题,每小题4分,共24分,每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题就为0分)
9.常温下,下列各组离子在指定的溶液中,一定能大量共存的是( )
A.使pH试纸显红色的溶液:K+、Na+、Cl﹣、HSO3﹣
B.在无色透明的溶液中:Na+、K+、SO42﹣、MnO4﹣
C.pH大于7的溶液中:CO32﹣、NH4+、SO42﹣、Cl﹣
D.pH小于7的溶液:Na+、Ba2+、NO3﹣、Cl﹣
10.下列有关表述错误的是( )
A.IBr的电子式:
B.HClO的结构式:H﹣Cl﹣O
C.HIO各原子最外层都满足8电子结构
D.MgO的形成过程可以表示为:
11.X、Y、Z是3种短周期元素,其中X、Y位于同一族,Y、Z处于同一周期,X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y少1,下列说法正确的是( )
A.元素非金属性由弱到强的顺序为Z<X<Y
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.三种元素的气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小的顺序为Z>Y>X
12.下列反应的离子方程式书写正确的是( )
A.铜与氯化铁溶液反应:Cu+2Fe3+═Cu2++2Fe2+
B.少量碳酸氢铵溶液与足量烧碱溶液混合加热:NH4++OH﹣ NH3↑+H2O
C.碳酸钙与醋酸反应:CO32﹣+2H+=CO2↑+H2O
D.铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑
13.以下关于铜跟浓、稀HNO3反应的说法中错误的是( )
A.1mol浓HNO3被还原转移2mol电子
B.Cu与浓HNO3反应剧烈,故氧化性浓HNO3强于稀HNO3
C.Cu与浓、稀HNO3反应都不需加热
D.生成等量的Cu(NO3)2,消耗浓HNO3的量多
14.某研究性学习小组从腐蚀印刷电路板的废液(含有FeCl2、FeCl3、CuCl2)中回收铜并制备氯化铁晶体,设计流程如图。下列说法正确的是( )
A.试剂a是铁粉、试剂b是稀硫酸
B.操作Ⅰ、Ⅱ、Ⅲ都用到玻璃棒
C.操作Ⅲ包含的步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D.可用KSCN溶液和新制氯水检验溶液W 中是否含有Fe2+
三、非选择题(本题5小题,共60分)
15.已知A、B、C均为含铁化合物,请根据以下四种物质的转化过程回答相关问题:
FeABC
(1)反应①、②、③中属于氧化还原反应的是 。(填序号)
(2)向B的溶液中滴入几滴KSCN溶液后,可观察到的现象是 。
(3)C的化学式为 。
(4)写出反应②的离子方程式: 。
16.室温下,A是常见的金属单质、单质B是黄绿色气体、单质C是无色气体。在合适反应条件下,它们可以按下面框图进行反应;E溶液是无色溶液,F是淡绿色溶液。B和C反应发出苍白色火焰。请回答:
(1)A是 ,B是 ;C是 ;D是 ;(请填写化学式)
(2)反应①的化学方程式 ;
(3)反应③的离子方程式 ;
17.用如图所示装置进行实验,证明过氧化钠(Na2O2)可在呼吸面具和潜水艇中做供氧剂。
请回答:
(1)装置A中盛放稀盐酸的仪器名称是 。
(2)装置B的作用是 。
(3)装置C中过氧化钠与二氧化碳反应的化学方程式是 。
(4)装置D中盛放的试剂是 。
(5)当装置内气流平稳后开始用试管收集气体,该气体能 ,证明过氧化钠可做供氧剂。
18.NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如图所示。
请回答下列问题:
(1)NaClO2中Cl元素的化合价为 。
(2)“电解”所用食盐水由粗盐水精制而成。精制时,为除去Mg2+和Ca2+,要加入的试剂分别为 、 。
(3)“尾气吸收”发生2NaOH+H2O2+2ClO2═2NaClO2+O2+2H2O反应,氧化剂与还原剂的质量之比为 。
19.配制480mL 0.2mol L﹣1的FeSO4溶液,为完成此配制实验,
(1)除了量筒、烧杯、玻璃棒外还需要的常见的玻璃仪器有 。
(2)实验室用绿矾(FeSO4 7H2O)来配制该溶液,用托盘天平称量绿矾 g。
(3)由于错误操作,使得实际浓度比所要求的偏小的是 (填写编号)。
A.称量绿矾时,左码右物
B.使用容量瓶配制溶液时,俯视液面定容
C.未用蒸馏水洗涤烧杯2~3次
D.容量瓶刚用蒸馏水洗净,没有干燥
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
F.把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
(4)定容时,若加蒸馏水时不慎超过刻度线,处理方法是 。
参考答案及评分细则
1.B
2.C
3.B
4.D
5.C
6.A
7.C
8.B
9.D
10.BC
11.D
12.A
13.A
14.BC
15.(12分)
(1)①②;(4分)
(2)溶液由无色变为红色;(2分)(答案合理即可给分)
(3)Fe(OH)3;(2分)
(4)2Fe2++Cl2=2Fe3++2Cl-(4分)(写出物质给2分,配平给1分,符号给1分。)
16.(16分)
(1)Fe(2分);Cl2(2分);H2(2分);FeCl3(2分);
(2)2Fe+3Cl22FeCl3;(4分)(写出物质给2分,配平给1分,符号给1分。)
(3)Fe+2H+=Fe2++H2↑;(4分)(写出物质给2分,配平给1分,符号给1分。)
17、(12分)
(1)分液漏斗;(2分)
(2)除去CO2中的HCl;(2分)(答案合理即可给分)
(3)2Na2O2+2CO2=2Na2CO3+O2;(4分)(写出物质给2分,配平给1分,符号给1分。)
(4)NaOH溶液;(2分)(答案合理即可给分)
(5)使带火星的木条复燃。(2分)(答案合理即可给分)
18、(8分)
(1)+3;(2分)
(2)NaOH(2分);Na2CO3;(2分)
(3)135:34(2分)
19、(12分)
(1)500mL容量瓶(2分)、胶头滴管(2分);
(2)27.8;(2分)
(3)ACEF;(4分)
(4)重新配制。(2分)
同课章节目录
