2022年广东省广州市中考之科学探究题专练(word版 含答案)
文档属性
| 名称 | 2022年广东省广州市中考之科学探究题专练(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 143.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-25 08:05:46 | ||
图片预览




文档简介
2022年广州中考之科学探究题专练
1.84消毒液是一种无色或者淡黄色具有刺激性气味的含氯消毒剂,有效成分为次氯酸钠(NaClO),广泛用于医院、宾馆、旅游、家庭等的卫生消毒。某化学兴趣小组对该消毒液进行了如下系列探究。
【查阅资料】I.84消毒液不稳定,其杀菌作用主要依靠有效氯,有效氯越高杀菌效果越好。
Ⅱ.消毒杀菌就是使病毒蛋白质变性,鸡蛋中蛋白质发生变性反应时变成白色固体。
探究一:84消毒液中有效氯含量的稳定性。
0.5%的84消毒液在不同温度、不同存放时间下的有效氯含量:
存放时间(小时) 不同温度下,有效氯存留率
60℃ 70℃ 80℃ 90℃
0(对照) 100% 100% 100% 100%
3.0 …………… ……….. 94.66% 88.05%
6.0 ……………. 96.66% 89.67% 74.69%
12.0 ………….. 93.32% 82.62% ………….
20.0 94.75% ……….. ………. ………..
30.0 92.99% ………. ………. …………
【解释与结论】
(1)次氯酸钠(NaClO)中Cl元素的化合价为_______。
(2)综合分析探究一中数据,在其他条件不变时,0.5%的84消毒液有效氯存留率受温度和时间的影响,其影响的变化趋势是_________。因此保存84消毒液应注意的问题是___________。
探究二:不同浓度84消毒液的杀菌效果
在四只试管中各加入鸡蛋液2mL,分别加入不同浓度的消毒液,静置15分钟后,记录如下:
序号 2—1 2—2 2—3 2—4
实验操作 加入0.5mL消毒原液 加入0.5mL消毒原液,12.5mL水 加入0.5mL消毒原液,50mL水 加入0.5mL消毒原液,100mL水
现象 液体表面产生气泡,无其他现象 液体中产生大量白色固体 液体中产生少量白色固体 液体中产生极少量白色固体
【解释与结论】
(3)探究二中杀菌效果最好的一组实验为________(填序号)。
(4)洁厕灵主要成分是盐酸,与84消毒液混合会产生有毒气体Cl2,完成反应的化学方程式:___________。
2.某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。
(1)请写出镁条与氧气反应的化学方程式:______。
(2)某兴趣小组实验时,发现镁条完全燃烧后,称量石棉网上的燃烧产物质量比反应前镁条质量大,小霖认为此实验不符合质量守恒定律,我______(选填“同意”或“不同意”)她的观点,我的理由是______。
(3)由此实验可知,如反应过程中有气体参加或生成,需要在______容器中进行。
【改进实验】兴趣小组按如图1装置改进实验,验证了质量守恒定律,却发现产物中还有一些黄色固体。
【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁(化学式为 Mg3N2)固体;
③氮化镁可与水反应生成氨气,氨气极易溶于水形成氨水;
④氨水能使酚酞试液变红。
【作出猜想】黄色固体为氮化镁。
【实验探究】实验操作:如图2,取燃烧产物于烧杯中,加入适量水, 然后用大烧杯罩住。
(4)实验现象:______。
实验结论:黄色固体为氮化镁。
【反思交流】
(5)根据你所学过的知识,写出镁与氮气燃烧生成Mg3N2的化学方程式:______。
(6)空气中N2与O2的体积比大约是______,而镁条在空气中燃烧生成的MgO 却远多于 Mg3N2,可见镁更容易和氧气反应。作出合理的解释:______。
(7)如果用图1装置(气密性良好)和药品(足量)测定空气中氧气含量,该实验所测得的氧气体积分数______ 。(选填“大于”“小于”或“等于”)
【拓展延伸】
(8)人们对燃烧的认识是不断发展的,通过镁在空气中的燃烧实验,你对于燃烧的条件又有什么新的认识?______。
3.M是生活中常见的金属,MSO4溶液是无色液体,某化学兴趣小组的同学欲探究M与铜、铝的活动性顺序,请你和他们一起进行以下探究活动.
【提出问题】M、铜、铝的金属活动性顺序是怎样的?
【猜想与假设】小敏的猜想是Al>Cu>M;小强的猜想是Al>M>Cu;你的猜想是 ______ .
【设计与实验一】小莉取M丝、铜丝、铝丝和编号为①、②、③的3支试管,进行如表的实验(试管中均盛有体积相同、溶质质量分数也相同的稀盐酸);
实验操作 M丝插入试管①中 铜丝插入试管②中 铝丝插入试管③中 实验结论
刚开始的现象 有少量气泡产生 无气泡 无气泡 M>Cu: ______
几分钟后的现象 有少量气泡产生 无气泡 有大量气泡产生 ______
【交流与表达】同学们对同一实验得出两种不同结论的现象进行了讨论,明白了实验刚开始时试管③中无气泡产生的原因,该原因是 ____________________ 。
【设计与实验二】为了进一步探究三种金属的活动性顺序,同学们取粗细相同,打磨干净的M丝、铝丝及相关溶液,又进行了如图所示的实验:
(1)试管乙中观察到的现象是 _________________________ 。
(2)试管丙中反应的化学方程式为 _______________ 。
【交流与表达】同学们经讨论后认为该实验可以优化,去掉试管 __ (填试管编号)中的实验,也可以得出正确的结论.
【解释与结论】通过以上实验,同学们得出了三种金属的活动性顺序.
【评价与反思】实验结束后,同学们对实验过程进行了如下反思:
(1)影响金属与酸反应速率快慢的因素,除了相互反应的金属和酸的性质外,还有 ______________ (任写一种)。
(2)探究金属活动性顺序时,除了上述实验中已经用到的两种方法外,还可以根据 _______ 进行判断(任写一种)。
4.生活中所用“免洗液”中含有一定量的乙醇(C2H5OH),工业生产无水乙醇的方法是在工业酒精(含有一定量水的乙醇)中加足量的生石灰后蒸馏。
(1)生石灰与水反应的化学方程式为___________。
(2)无水乙醇与金属钠反应时有气体产生。以下是某化学兴趣小组对该反应产生的气体进行的探究,请你填答相关问题。
【提出问题】无水乙醇和金属钠反应产生的气体是什么?
【查阅资料】无水乙醇和金属钠反应能生成一种常见的可燃性气体。
【提出假设】对气体提出以下假设
假设I:CO;假设Ⅱ:CH4;假设Ⅲ:H2;假设Ⅳ:CO2。
以上假设中,假设___________不成立,理由是___________。
【实验探究】
实验操作 实验现象 结论
a.向盛无水乙醇的试管中加入金属钠。迅速塞上带尖嘴导管的胶塞(如图),在导管口用一支小试管收集并检验气体的纯度 验纯时发出___________ 说明气体不纯
b.点燃气体,在火焰上方罩一个干冷烧杯 烧杯内壁有白雾 假设___________不成立
c.将烧杯迅速倒转,向其中注入适量的___________,充分振荡 ___________ 假设Ⅲ成立
【反思评价】根据实验结果,操作b反应的化学方程式为___________。
5.某同学在博物馆看到一些铜制文物上有绿色的锈迹后,对绿色锈迹产生了探究兴趣。该同学查阅资料得知:
Ⅰ、绿色锈迹是碱式碳酸铜【Cu2(OH)2CO3】,受热易分解。
Ⅱ、无水硫酸铜为白色粉末,遇水变蓝。
Ⅲ、碱石灰是CaO和NaOH的固体混合物,NaOH与CO2反应生成碳酸钠和水。
Ⅳ、氧化铜与稀硫酸反应生成蓝色溶液,碳粉不与稀硫酸反应也不溶解在稀硫酸中。
查阅资料后,该同学将少量碱式碳酸铜放入试管中加热,发现试管中的固体由绿色变成黑色,同时试管壁上有无色液滴生成。为了进一步确定碱式碳酸铜受热分解的产物,进行了如下猜想与探究:
(1)该黑色固体可能是①碳粉;②氧化铜:③___________。
请帮助该同学完成下述实验方案设计与记录。
实验操作 现象 实验结论
将少量黑色固体放入试管中,加入___________,充分振荡 ___________ 猜想②正确
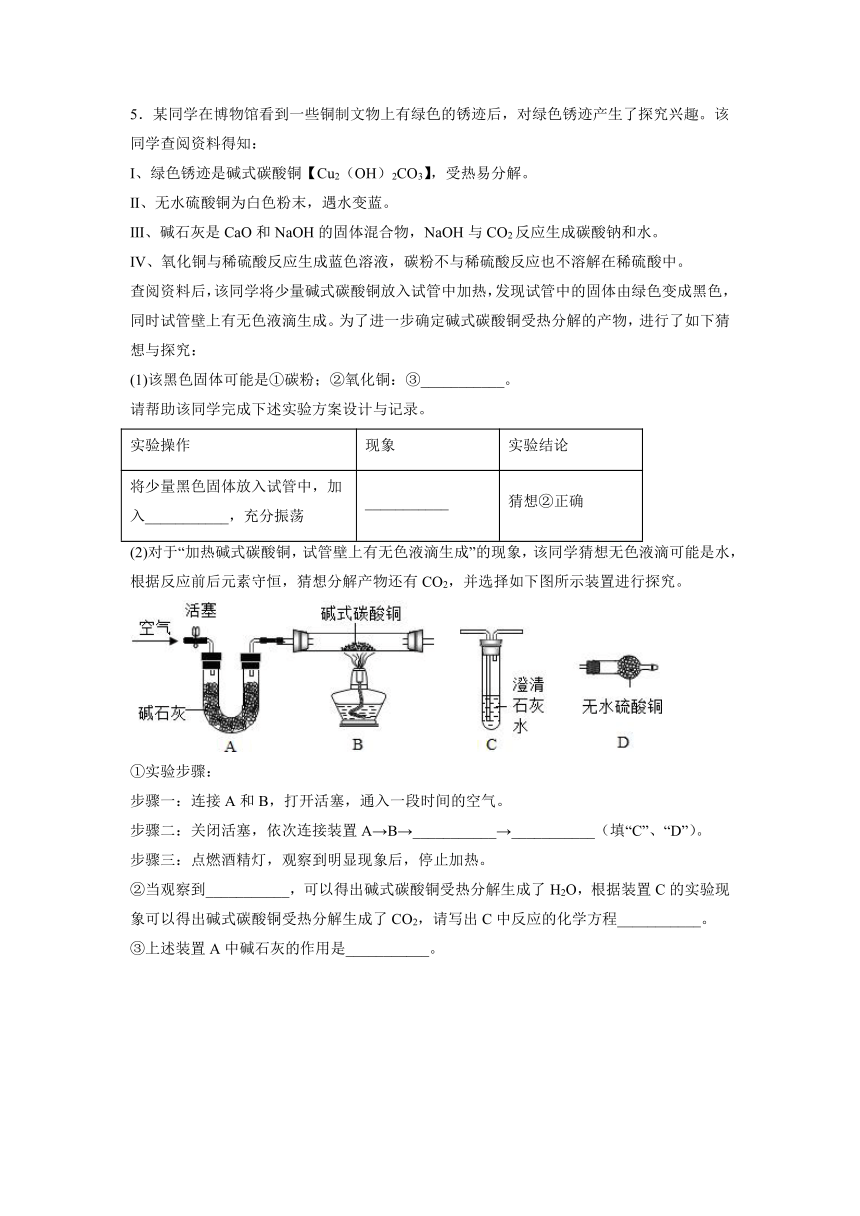
(2)对于“加热碱式碳酸铜,试管壁上有无色液滴生成”的现象,该同学猜想无色液滴可能是水,根据反应前后元素守恒,猜想分解产物还有CO2,并选择如下图所示装置进行探究。
①实验步骤:
步骤一:连接A和B,打开活塞,通入一段时间的空气。
步骤二:关闭活塞,依次连接装置A→B→___________→___________(填“C”、“D”)。
步骤三:点燃酒精灯,观察到明显现象后,停止加热。
②当观察到___________,可以得出碱式碳酸铜受热分解生成了H2O,根据装置C的实验现象可以得出碱式碳酸铜受热分解生成了CO2,请写出C中反应的化学方程___________。
③上述装置A中碱石灰的作用是___________。
6.科学探究
(1)课外小组同学进一步研究铁与氧气的反应。
【提出问题】铁丝燃烧时为什么会有“火星四射”的现象?
【查阅资料】铁丝燃烧时“火星四射”现象与铁丝含碳量有关。
【进行实验】探究铁丝在氧气燃烧时“火星四射”的现象与其含碳量的关系。
实验 现象 解释与结论
实验1:取直径0.20mm,含碳0.1%的铁丝,在氧气中燃烧 零星的火星四射 ①铁燃烧的化学方程式是_____ ②0.20mm的铁丝在氧气中燃烧“火星四射”与其含碳量的关系为_____
实验2:取直径0.20mm,含碳0.32%的铁丝,在氧气中燃烧 较明显的火星四射
实验3:取直径0.20mm,含碳0.52%的铁丝,在氧气中燃烧 ①_____
【实验拓展】
(2)同学们认为燃烧的现象还与氧气的浓度有关,想收集不同浓度的氧气进行相关实验。
①若用排水集气法收集一瓶体积分数约为80%的氧气,预先应向容积为360mL的集气瓶中加水,水的体积约为_____mL(取整数)。
②观察并记录现象,列入下表:
集气瓶号 1 2 3 4 5
收集O2的体积分数(%) 31 33 35 37 39
空气的体积分数(%) 69 67 65 63 61
总O2体积分数(%) 45.5 47.1 48.7 50.2 51.8
木条火星的状况 很亮 很亮 很亮 复燃 _____
结论:当氧气浓度达到_____%左右时,带火星的木条即可复燃。用这种方法检验集气瓶中是否集满氧气是_____(填“可靠”或“不可靠”)的。
7.物质燃烧的剧烈程度与很多因素有关。进行铁丝燃烧实验时,某小组发现实验现象与预期的不同。
【查阅资料】铁丝根据用途不同,成分也有差异,通常含碳和其它元素(本题不考虑其它元素)。
【提出问题】铁丝燃烧的剧烈程度与什么因素有关?
【作出猜想】猜想一:______
猜想二:氧气含量
猜想三:铁丝的含碳量
【进行实验】
实验编号 氧气含量 铁丝情况 燃烧现象
1 21% 铁丝 不能燃烧
2 21% 铁粉 剧烈燃烧,火星四射
3 60% 铁丝 燃烧,轻微火星四射
4 100% 铁丝 燃烧,火星四射明显
5 X 含碳0.2%的铁丝 剧烈燃烧,少量火星四射
6 100% 含碳0.6%的铁丝 剧烈燃烧,火星四射
【实验分析】①铁丝燃烧的化学方程式为:______;
②实验1和______对比,说明猜想一正确,实验3和4对比,说明猜想______正确;
③实验5与实验6对比,X的值为______,对比说明铁丝的含碳量越高,______的现象越明显;
④铁丝易生锈,实验前需用砂纸打磨,由此推测还有______会影响铁丝燃烧情况,若要验证此猜想,需要控制的变量有:______。
A氧气的含量 B铁丝的含碳量 C反应物的接触面积
8.焦炭与水蒸气在高温下反应,产物是一种俗称水煤气的气体燃料(其中不含甲烷),为确定水煤气的成分,某实验小组进行了如下探究:
【查阅资料】新鲜的鸡血遇一氧化碳变为樱桃红色。
【提出猜想】
小组成员对水煤气的成分提出以下四种猜想:
猜想1:H2、CO2;
猜想2:H2、CO;
猜想3:CO、CO2;
猜想4:H2、CO、CO2。
请你说明猜想3不能成立的理由:__________。
【实验探究】小组设计了下图所示的实验装置进行探究。
【实验现象】通入水煤气后,澄清石灰水不变浑浊,新鲜鸡血变樱桃红色。
(1)由此可知,水煤气中不含__________,含有__________。(填化学式)。
【继续实验】在B处点燃气体,然后用一个干冷的烧杯罩在火焰上方。
(1)气体通过A后再在B处点燃时,观察到火焰呈__________色,所罩烧杯的内壁__________,由此证明水煤气中含有H2,猜想__________成立。
(2)由探究结果可知,焦炭与水蒸气在高温下反应的化学方程式为_____________。
9.我国可燃冰试采创造了“产气总量、日均产气量”的世界纪录,可燃冰的主要成份是甲烷水合物。某同学设计如下实验探究甲烷燃烧产物的成分。
【提出问题】甲烷燃烧后生成哪些物质?
【查阅资料】① 含碳元素的物质完全燃烧生成CO2,不完全燃烧生成CO;② 白色无水硫酸铜粉末遇水变为蓝色;③ CO与人体内的血红蛋白结合,会造成人缺氧中毒。
【猜想与假设】猜想一: CO2、H2O 猜想二:CO、H2O 猜想三:______________。
【实验探究】将甲烷在一定量的纯净空气中燃烧的产物依次通过A→F 装置(部分夹持、固定装置略)进行验证:
(1)实验时,装置A中现象为__________________________,装置B、E中澄清石灰水均变浑浊原因是_______________________________(用化学方程式表示),装置D中现象为___________________________________,由此推断猜想_________成立。
(2)装置C的作用是______________________,装置F的作用是________________。
【反思与交流】生活中,使用含碳燃料一定要注意__________,防止_________中毒。
10.小明对灭火器的种类及其使用注意事项特别感兴趣,并对“制镁企业不能使用CO2灭火器”的问题进行探究。
小明将点燃的镁条插入盛满CO2的集气瓶内,镁条继续剧烈燃烧,生成白色固体并有黑色物质附着于集气瓶内壁。小明对镁与CO2反应的产物进行探究。
【提出猜想】
猜想Ⅰ:产物是MgO和C;
猜想Ⅱ:产物是MgO、MgC2和C。
提出以上猜想的依据是___________;
【查阅资料】
,Mg(OH)2在热水中的溶解能力增大;
。
【实验操作与分析】为探究固体的成分,兴趣小组同学进行了如下实验:
(1)取少量反应后的固体混合物放入试管中,并加入足量热水,观察到无气体放出,说明猜想___________不正确;
(2)为了进一步验证产物中的固体成分,兴趣小组同学进行如上图所示的实验,观察到烧杯B中的实验现象为___________,说明固体成分中含有___________(写名称),请写出B中反应的化学方程式___________。
(3)依据实验分析,请写出Mg跟CO2发生的化学反应方程式________,此反应的反应类型是_______(填“基本反应类型”)。
【实验反思】通过本实验,对“制镁企业不能使用CO2灭火器”和“CO2不助燃”,你有什么新的认识:___________。
11.某实验小组将少量氢化钙(CaH2)溶于水,形成了无色透明的溶液,再向其中加入碳酸钠溶液,有沉淀产生,经过滤后得到滤渣和滤液。然后进行了滤渣验证和滤液溶质成分的探究。
(1)【查阅资料】氢化钙在常温下能与水反应生成氢氧化钙和氢气,写出该反应的化学方程式______________。
(2)【交流验证】滤渣只能是碳酸钙,用盐酸验证此滤渣的化学方程式为______________。
(3)【提出问题】滤液中溶质的成分是什么?
(4)【猜想假设】猜想一:NaOH
猜想二:NaOH和Na2CO3
猜想三:NaOH和________。
猜想四:NaOH、Na2CO3和Ca(OH)2
(5)【讨论分析】经过讨论认为最不合理的是猜想____,原因是______________。
(6)【实验与结论】
实验步骤 现象 结论
步骤I:取少量滤液,向其中加入足量盐酸溶液 ________ 猜想二不成立
步骤Ⅱ:另取少量滤液,向其中滴入适量Na2CO3溶液 产生白色沉淀 猜想____成立
(7)【拓展延伸】在分析反应后所得物质的成分时,除考虑生成物外,还需考虑___________。
12.过氧化钠(Na2O2)是一种常用的供氧剂,空气中的水和二氧化碳均能与其发生反应生成氧气:2Na2O2+2H2O=4NaOH+O2,2Na2O2+2CO2=2Na2CO3+O2.
为了探究久置空气中的过氧化钠的成分,兴趣小组中的小琪同学设计了如下的实验方案:
【实验1】探究固体中是否存在过氧化钠:
实验操作 实验现象 小琪的结论
取部分固体于烧杯中,加入足量的_________ __________ 固体中存在过氧化钠
【实验2】探究固体中是否存在碳酸钠:
实验操作 实验现象 小琪的结论
取少量实验1所得溶液于试管中,加入足量的_______ 有气泡产生 固体中存在碳酸钠。
【实验3】探究固体中是否存在氢氧化钠:
实验操作 实验现象 小琪的结论
取少量实验1所得溶液于试管中,加入_______ 产生白色沉淀 固体中存在氢氧化钠。
________ ________
但小明认为小琪设计的【实验3】无法确定原固体药品中是否含有氢氧化钠。他的理由是:________
2022年广州中考之科学探究题专练
1.84消毒液是一种无色或者淡黄色具有刺激性气味的含氯消毒剂,有效成分为次氯酸钠(NaClO),广泛用于医院、宾馆、旅游、家庭等的卫生消毒。某化学兴趣小组对该消毒液进行了如下系列探究。
【查阅资料】I.84消毒液不稳定,其杀菌作用主要依靠有效氯,有效氯越高杀菌效果越好。
Ⅱ.消毒杀菌就是使病毒蛋白质变性,鸡蛋中蛋白质发生变性反应时变成白色固体。
探究一:84消毒液中有效氯含量的稳定性。
0.5%的84消毒液在不同温度、不同存放时间下的有效氯含量:
存放时间(小时) 不同温度下,有效氯存留率
60℃ 70℃ 80℃ 90℃
0(对照) 100% 100% 100% 100%
3.0 …………… ……….. 94.66% 88.05%
6.0 ……………. 96.66% 89.67% 74.69%
12.0 ………….. 93.32% 82.62% ………….
20.0 94.75% ……….. ………. ………..
30.0 92.99% ………. ………. …………
【解释与结论】
(1)次氯酸钠(NaClO)中Cl元素的化合价为_______。
(2)综合分析探究一中数据,在其他条件不变时,0.5%的84消毒液有效氯存留率受温度和时间的影响,其影响的变化趋势是_________。因此保存84消毒液应注意的问题是___________。
探究二:不同浓度84消毒液的杀菌效果
在四只试管中各加入鸡蛋液2mL,分别加入不同浓度的消毒液,静置15分钟后,记录如下:
序号 2—1 2—2 2—3 2—4
实验操作 加入0.5mL消毒原液 加入0.5mL消毒原液,12.5mL水 加入0.5mL消毒原液,50mL水 加入0.5mL消毒原液,100mL水
现象 液体表面产生气泡,无其他现象 液体中产生大量白色固体 液体中产生少量白色固体 液体中产生极少量白色固体
【解释与结论】
(3)探究二中杀菌效果最好的一组实验为________(填序号)。
(4)洁厕灵主要成分是盐酸,与84消毒液混合会产生有毒气体Cl2,完成反应的化学方程式:___________。
【答案】 +1 在实验研究范围内,在其它条件下不变时,随着温度升高、存放时间延长,有效氯存留率减小 阴暗、低温处存放,不能长久存放 2-2 NaCl
2.某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。
(1)请写出镁条与氧气反应的化学方程式:______。
(2)某兴趣小组实验时,发现镁条完全燃烧后,称量石棉网上的燃烧产物质量比反应前镁条质量大,小霖认为此实验不符合质量守恒定律,我______(选填“同意”或“不同意”)她的观点,我的理由是______。
(3)由此实验可知,如反应过程中有气体参加或生成,需要在______容器中进行。
【改进实验】兴趣小组按如图1装置改进实验,验证了质量守恒定律,却发现产物中还有一些黄色固体。
【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁(化学式为 Mg3N2)固体;
③氮化镁可与水反应生成氨气,氨气极易溶于水形成氨水;
④氨水能使酚酞试液变红。
【作出猜想】黄色固体为氮化镁。
【实验探究】实验操作:如图2,取燃烧产物于烧杯中,加入适量水, 然后用大烧杯罩住。
(4)实验现象:______。
实验结论:黄色固体为氮化镁。
【反思交流】
(5)根据你所学过的知识,写出镁与氮气燃烧生成Mg3N2的化学方程式:______。
(6)空气中N2与O2的体积比大约是______,而镁条在空气中燃烧生成的MgO 却远多于 Mg3N2,可见镁更容易和氧气反应。作出合理的解释:______。
(7)如果用图1装置(气密性良好)和药品(足量)测定空气中氧气含量,该实验所测得的氧气体积分数______ 。(选填“大于”“小于”或“等于”)
【拓展延伸】
(8)人们对燃烧的认识是不断发展的,通过镁在空气中的燃烧实验,你对于燃烧的条件又有什么新的认识?______。
【答案】 不同意 参加反应的氧气没有测量 密闭 脱脂棉变红 4:1 氧气化学性质比氮气活泼 大于 燃烧不一定需要氧气
3.M是生活中常见的金属,MSO4溶液是无色液体,某化学兴趣小组的同学欲探究M与铜、铝的活动性顺序,请你和他们一起进行以下探究活动.
【提出问题】M、铜、铝的金属活动性顺序是怎样的?
【猜想与假设】小敏的猜想是Al>Cu>M;小强的猜想是Al>M>Cu;你的猜想是 ______ .
【设计与实验一】小莉取M丝、铜丝、铝丝和编号为①、②、③的3支试管,进行如表的实验(试管中均盛有体积相同、溶质质量分数也相同的稀盐酸);
实验操作 M丝插入试管①中 铜丝插入试管②中 铝丝插入试管③中 实验结论
刚开始的现象 有少量气泡产生 无气泡 无气泡 M>Cu: ______
几分钟后的现象 有少量气泡产生 无气泡 有大量气泡产生 ______
【交流与表达】同学们对同一实验得出两种不同结论的现象进行了讨论,明白了实验刚开始时试管③中无气泡产生的原因,该原因是 ____________________ 。
【设计与实验二】为了进一步探究三种金属的活动性顺序,同学们取粗细相同,打磨干净的M丝、铝丝及相关溶液,又进行了如图所示的实验:
(1)试管乙中观察到的现象是 _________________________ 。
(2)试管丙中反应的化学方程式为 _______________ 。
【交流与表达】同学们经讨论后认为该实验可以优化,去掉试管 __ (填试管编号)中的实验,也可以得出正确的结论.
【解释与结论】通过以上实验,同学们得出了三种金属的活动性顺序.
【评价与反思】实验结束后,同学们对实验过程进行了如下反思:
(1)影响金属与酸反应速率快慢的因素,除了相互反应的金属和酸的性质外,还有 ______________ (任写一种)。
(2)探究金属活动性顺序时,除了上述实验中已经用到的两种方法外,还可以根据 _______ 进行判断(任写一种)。
【答案】 M>Al>Cu M>Al Al>M>Cu 铝表面有一层氧化膜 M表面出现一层红色物质 2Al+3CuSO4=Al2(SO4)3+3Cu 丙 反应物接触面积、温度等 与氧气反应的剧烈程度
4.生活中所用“免洗液”中含有一定量的乙醇(C2H5OH),工业生产无水乙醇的方法是在工业酒精(含有一定量水的乙醇)中加足量的生石灰后蒸馏。
(1)生石灰与水反应的化学方程式为___________。
(2)无水乙醇与金属钠反应时有气体产生。以下是某化学兴趣小组对该反应产生的气体进行的探究,请你填答相关问题。
【提出问题】无水乙醇和金属钠反应产生的气体是什么?
【查阅资料】无水乙醇和金属钠反应能生成一种常见的可燃性气体。
【提出假设】对气体提出以下假设
假设I:CO;假设Ⅱ:CH4;假设Ⅲ:H2;假设Ⅳ:CO2。
以上假设中,假设___________不成立,理由是___________。
【实验探究】
实验操作 实验现象 结论
a.向盛无水乙醇的试管中加入金属钠。迅速塞上带尖嘴导管的胶塞(如图),在导管口用一支小试管收集并检验气体的纯度 验纯时发出___________ 说明气体不纯
b.点燃气体,在火焰上方罩一个干冷烧杯 烧杯内壁有白雾 假设___________不成立
c.将烧杯迅速倒转,向其中注入适量的___________,充分振荡 ___________ 假设Ⅲ成立
【反思评价】根据实验结果,操作b反应的化学方程式为___________。
【答案】(1)
(2) Ⅳ 二氧化碳没有可燃性 尖锐的爆鸣声 I 澄清石灰水 石灰水不变浑浊
5.某同学在博物馆看到一些铜制文物上有绿色的锈迹后,对绿色锈迹产生了探究兴趣。该同学查阅资料得知:
Ⅰ、绿色锈迹是碱式碳酸铜【Cu2(OH)2CO3】,受热易分解。
Ⅱ、无水硫酸铜为白色粉末,遇水变蓝。
Ⅲ、碱石灰是CaO和NaOH的固体混合物,NaOH与CO2反应生成碳酸钠和水。
Ⅳ、氧化铜与稀硫酸反应生成蓝色溶液,碳粉不与稀硫酸反应也不溶解在稀硫酸中。
查阅资料后,该同学将少量碱式碳酸铜放入试管中加热,发现试管中的固体由绿色变成黑色,同时试管壁上有无色液滴生成。为了进一步确定碱式碳酸铜受热分解的产物,进行了如下猜想与探究:
(1)该黑色固体可能是①碳粉;②氧化铜:③___________。
请帮助该同学完成下述实验方案设计与记录。
实验操作 现象 实验结论
将少量黑色固体放入试管中,加入___________,充分振荡 ___________ 猜想②正确
(2)对于“加热碱式碳酸铜,试管壁上有无色液滴生成”的现象,该同学猜想无色液滴可能是水,根据反应前后元素守恒,猜想分解产物还有CO2,并选择如下图所示装置进行探究。
①实验步骤:
步骤一:连接A和B,打开活塞,通入一段时间的空气。
步骤二:关闭活塞,依次连接装置A→B→___________→___________(填“C”、“D”)。
步骤三:点燃酒精灯,观察到明显现象后,停止加热。
②当观察到___________,可以得出碱式碳酸铜受热分解生成了H2O,根据装置C的实验现象可以得出碱式碳酸铜受热分解生成了CO2,请写出C中反应的化学方程___________。
③上述装置A中碱石灰的作用是___________。
【答案】(1) 碳和氧化铜的混合物 足量稀硫酸 黑色固体完全溶解,溶液变为蓝色
(2) D C 无水硫酸铜变蓝 除去空气中的二氧化碳和水蒸气
6.科学探究
(1)课外小组同学进一步研究铁与氧气的反应。
【提出问题】铁丝燃烧时为什么会有“火星四射”的现象?
【查阅资料】铁丝燃烧时“火星四射”现象与铁丝含碳量有关。
【进行实验】探究铁丝在氧气燃烧时“火星四射”的现象与其含碳量的关系。
实验 现象 解释与结论
实验1:取直径0.20mm,含碳0.1%的铁丝,在氧气中燃烧 零星的火星四射 ①铁燃烧的化学方程式是_____ ②0.20mm的铁丝在氧气中燃烧“火星四射”与其含碳量的关系为_____
实验2:取直径0.20mm,含碳0.32%的铁丝,在氧气中燃烧 较明显的火星四射
实验3:取直径0.20mm,含碳0.52%的铁丝,在氧气中燃烧 ①_____
【实验拓展】
(2)同学们认为燃烧的现象还与氧气的浓度有关,想收集不同浓度的氧气进行相关实验。
①若用排水集气法收集一瓶体积分数约为80%的氧气,预先应向容积为360mL的集气瓶中加水,水的体积约为_____mL(取整数)。
②观察并记录现象,列入下表:
集气瓶号 1 2 3 4 5
收集O2的体积分数(%) 31 33 35 37 39
空气的体积分数(%) 69 67 65 63 61
总O2体积分数(%) 45.5 47.1 48.7 50.2 51.8
木条火星的状况 很亮 很亮 很亮 复燃 _____
结论:当氧气浓度达到_____%左右时,带火星的木条即可复燃。用这种方法检验集气瓶中是否集满氧气是_____(填“可靠”或“不可靠”)的。
【答案】 0.20mm的铁丝含碳量越高,在氧气中燃烧“火星四射”的现象越明显 剧烈燃烧,火星四射 270 复燃 50.2 不可靠
7.物质燃烧的剧烈程度与很多因素有关。进行铁丝燃烧实验时,某小组发现实验现象与预期的不同。
【查阅资料】铁丝根据用途不同,成分也有差异,通常含碳和其它元素(本题不考虑其它元素)。
【提出问题】铁丝燃烧的剧烈程度与什么因素有关?
【作出猜想】猜想一:______
猜想二:氧气含量
猜想三:铁丝的含碳量
【进行实验】
实验编号 氧气含量 铁丝情况 燃烧现象
1 21% 铁丝 不能燃烧
2 21% 铁粉 剧烈燃烧,火星四射
3 60% 铁丝 燃烧,轻微火星四射
4 100% 铁丝 燃烧,火星四射明显
5 X 含碳0.2%的铁丝 剧烈燃烧,少量火星四射
6 100% 含碳0.6%的铁丝 剧烈燃烧,火星四射
【实验分析】①铁丝燃烧的化学方程式为:______;
②实验1和______对比,说明猜想一正确,实验3和4对比,说明猜想______正确;
③实验5与实验6对比,X的值为______,对比说明铁丝的含碳量越高,______的现象越明显;
④铁丝易生锈,实验前需用砂纸打磨,由此推测还有______会影响铁丝燃烧情况,若要验证此猜想,需要控制的变量有:______。
A氧气的含量 B铁丝的含碳量 C反应物的接触面积
【答案】 反应物的接触面积 2 二 100% 火星四射 铁锈 ABC
8.焦炭与水蒸气在高温下反应,产物是一种俗称水煤气的气体燃料(其中不含甲烷),为确定水煤气的成分,某实验小组进行了如下探究:
【查阅资料】新鲜的鸡血遇一氧化碳变为樱桃红色。
【提出猜想】
小组成员对水煤气的成分提出以下四种猜想:
猜想1:H2、CO2;
猜想2:H2、CO;
猜想3:CO、CO2;
猜想4:H2、CO、CO2。
请你说明猜想3不能成立的理由:__________。
【实验探究】小组设计了下图所示的实验装置进行探究。
【实验现象】通入水煤气后,澄清石灰水不变浑浊,新鲜鸡血变樱桃红色。
(1)由此可知,水煤气中不含__________,含有__________。(填化学式)。
【继续实验】在B处点燃气体,然后用一个干冷的烧杯罩在火焰上方。
(1)气体通过A后再在B处点燃时,观察到火焰呈__________色,所罩烧杯的内壁__________,由此证明水煤气中含有H2,猜想__________成立。
(2)由探究结果可知,焦炭与水蒸气在高温下反应的化学方程式为_____________。
【答案】 不符合质量守恒定律 CO2 CO 淡蓝 出现水雾 2 C +H2OCO+H2
9.我国可燃冰试采创造了“产气总量、日均产气量”的世界纪录,可燃冰的主要成份是甲烷水合物。某同学设计如下实验探究甲烷燃烧产物的成分。
【提出问题】甲烷燃烧后生成哪些物质?
【查阅资料】① 含碳元素的物质完全燃烧生成CO2,不完全燃烧生成CO;② 白色无水硫酸铜粉末遇水变为蓝色;③ CO与人体内的血红蛋白结合,会造成人缺氧中毒。
【猜想与假设】猜想一: CO2、H2O 猜想二:CO、H2O 猜想三:______________。
【实验探究】将甲烷在一定量的纯净空气中燃烧的产物依次通过A→F 装置(部分夹持、固定装置略)进行验证:
(1)实验时,装置A中现象为__________________________,装置B、E中澄清石灰水均变浑浊原因是_______________________________(用化学方程式表示),装置D中现象为___________________________________,由此推断猜想_________成立。
(2)装置C的作用是______________________,装置F的作用是________________。
【反思与交流】生活中,使用含碳燃料一定要注意__________,防止_________中毒。
【答案】 CO2、CO、H2O 白色粉末变为蓝色 CO2 + Ca(OH)2 = CaCO3↓+ H2O 黑色粉末变成红色 三 吸收过量的CO2,防止对后续实验造成干扰 收集尾气CO,防止其逸散到空气中,污染环境 通风 CO或一氧化碳
10.小明对灭火器的种类及其使用注意事项特别感兴趣,并对“制镁企业不能使用CO2灭火器”的问题进行探究。
小明将点燃的镁条插入盛满CO2的集气瓶内,镁条继续剧烈燃烧,生成白色固体并有黑色物质附着于集气瓶内壁。小明对镁与CO2反应的产物进行探究。
【提出猜想】
猜想Ⅰ:产物是MgO和C;
猜想Ⅱ:产物是MgO、MgC2和C。
提出以上猜想的依据是___________;
【查阅资料】
,Mg(OH)2在热水中的溶解能力增大;
。
【实验操作与分析】为探究固体的成分,兴趣小组同学进行了如下实验:
(1)取少量反应后的固体混合物放入试管中,并加入足量热水,观察到无气体放出,说明猜想___________不正确;
(2)为了进一步验证产物中的固体成分,兴趣小组同学进行如上图所示的实验,观察到烧杯B中的实验现象为___________,说明固体成分中含有___________(写名称),请写出B中反应的化学方程式___________。
(3)依据实验分析,请写出Mg跟CO2发生的化学反应方程式________,此反应的反应类型是_______(填“基本反应类型”)。
【实验反思】通过本实验,对“制镁企业不能使用CO2灭火器”和“CO2不助燃”,你有什么新的认识:___________。
【答案】 化学反应前后元素种类不变(或质量守恒定律) Ⅱ 澄清石灰水变浑浊 碳 置换反应 二氧化碳灭火器不适用于扑灭如钾、钠、镁等金属燃烧形成的火灾;二氧化碳不助燃是相对的,应辩证地认识物质的性质
11.某实验小组将少量氢化钙(CaH2)溶于水,形成了无色透明的溶液,再向其中加入碳酸钠溶液,有沉淀产生,经过滤后得到滤渣和滤液。然后进行了滤渣验证和滤液溶质成分的探究。
(1)【查阅资料】氢化钙在常温下能与水反应生成氢氧化钙和氢气,写出该反应的化学方程式______________。
(2)【交流验证】滤渣只能是碳酸钙,用盐酸验证此滤渣的化学方程式为______________。
(3)【提出问题】滤液中溶质的成分是什么?
(4)【猜想假设】猜想一:NaOH
猜想二:NaOH和Na2CO3
猜想三:NaOH和________。
猜想四:NaOH、Na2CO3和Ca(OH)2
(5)【讨论分析】经过讨论认为最不合理的是猜想____,原因是______________。
(6)【实验与结论】
实验步骤 现象 结论
步骤I:取少量滤液,向其中加入足量盐酸溶液 ________ 猜想二不成立
步骤Ⅱ:另取少量滤液,向其中滴入适量Na2CO3溶液 产生白色沉淀 猜想____成立
(7)【拓展延伸】在分析反应后所得物质的成分时,除考虑生成物外,还需考虑___________。
【答案】 Ca(OH)2 四 (或“氢氧化钙能与碳酸钠能反应生成了碳酸钙沉淀和氢氧化钠”) 没有气泡产生 三 反应物是否过量
12.过氧化钠(Na2O2)是一种常用的供氧剂,空气中的水和二氧化碳均能与其发生反应生成氧气:2Na2O2+2H2O=4NaOH+O2,2Na2O2+2CO2=2Na2CO3+O2.
为了探究久置空气中的过氧化钠的成分,兴趣小组中的小琪同学设计了如下的实验方案:
【实验1】探究固体中是否存在过氧化钠:
实验操作 实验现象 小琪的结论
取部分固体于烧杯中,加入足量的_________ __________ 固体中存在过氧化钠
【实验2】探究固体中是否存在碳酸钠:
实验操作 实验现象 小琪的结论
取少量实验1所得溶液于试管中,加入足量的_______ 有气泡产生 固体中存在碳酸钠。
【实验3】探究固体中是否存在氢氧化钠:
实验操作 实验现象 小琪的结论
取少量实验1所得溶液于试管中,加入_______ 产生白色沉淀 固体中存在氢氧化钠。
________ ________
但小明认为小琪设计的【实验3】无法确定原固体药品中是否含有氢氧化钠。他的理由是:________
【答案】 水 产生气泡 稀盐酸 足量的氯化钙溶液 静置,取上层清液少量于试管中,滴加酚酞试液 溶液变红 步骤一中过氧化钠反应生成了氢氧化钠
1.84消毒液是一种无色或者淡黄色具有刺激性气味的含氯消毒剂,有效成分为次氯酸钠(NaClO),广泛用于医院、宾馆、旅游、家庭等的卫生消毒。某化学兴趣小组对该消毒液进行了如下系列探究。
【查阅资料】I.84消毒液不稳定,其杀菌作用主要依靠有效氯,有效氯越高杀菌效果越好。
Ⅱ.消毒杀菌就是使病毒蛋白质变性,鸡蛋中蛋白质发生变性反应时变成白色固体。
探究一:84消毒液中有效氯含量的稳定性。
0.5%的84消毒液在不同温度、不同存放时间下的有效氯含量:
存放时间(小时) 不同温度下,有效氯存留率
60℃ 70℃ 80℃ 90℃
0(对照) 100% 100% 100% 100%
3.0 …………… ……….. 94.66% 88.05%
6.0 ……………. 96.66% 89.67% 74.69%
12.0 ………….. 93.32% 82.62% ………….
20.0 94.75% ……….. ………. ………..
30.0 92.99% ………. ………. …………
【解释与结论】
(1)次氯酸钠(NaClO)中Cl元素的化合价为_______。
(2)综合分析探究一中数据,在其他条件不变时,0.5%的84消毒液有效氯存留率受温度和时间的影响,其影响的变化趋势是_________。因此保存84消毒液应注意的问题是___________。
探究二:不同浓度84消毒液的杀菌效果
在四只试管中各加入鸡蛋液2mL,分别加入不同浓度的消毒液,静置15分钟后,记录如下:
序号 2—1 2—2 2—3 2—4
实验操作 加入0.5mL消毒原液 加入0.5mL消毒原液,12.5mL水 加入0.5mL消毒原液,50mL水 加入0.5mL消毒原液,100mL水
现象 液体表面产生气泡,无其他现象 液体中产生大量白色固体 液体中产生少量白色固体 液体中产生极少量白色固体
【解释与结论】
(3)探究二中杀菌效果最好的一组实验为________(填序号)。
(4)洁厕灵主要成分是盐酸,与84消毒液混合会产生有毒气体Cl2,完成反应的化学方程式:___________。
2.某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。
(1)请写出镁条与氧气反应的化学方程式:______。
(2)某兴趣小组实验时,发现镁条完全燃烧后,称量石棉网上的燃烧产物质量比反应前镁条质量大,小霖认为此实验不符合质量守恒定律,我______(选填“同意”或“不同意”)她的观点,我的理由是______。
(3)由此实验可知,如反应过程中有气体参加或生成,需要在______容器中进行。
【改进实验】兴趣小组按如图1装置改进实验,验证了质量守恒定律,却发现产物中还有一些黄色固体。
【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁(化学式为 Mg3N2)固体;
③氮化镁可与水反应生成氨气,氨气极易溶于水形成氨水;
④氨水能使酚酞试液变红。
【作出猜想】黄色固体为氮化镁。
【实验探究】实验操作:如图2,取燃烧产物于烧杯中,加入适量水, 然后用大烧杯罩住。
(4)实验现象:______。
实验结论:黄色固体为氮化镁。
【反思交流】
(5)根据你所学过的知识,写出镁与氮气燃烧生成Mg3N2的化学方程式:______。
(6)空气中N2与O2的体积比大约是______,而镁条在空气中燃烧生成的MgO 却远多于 Mg3N2,可见镁更容易和氧气反应。作出合理的解释:______。
(7)如果用图1装置(气密性良好)和药品(足量)测定空气中氧气含量,该实验所测得的氧气体积分数______ 。(选填“大于”“小于”或“等于”)
【拓展延伸】
(8)人们对燃烧的认识是不断发展的,通过镁在空气中的燃烧实验,你对于燃烧的条件又有什么新的认识?______。
3.M是生活中常见的金属,MSO4溶液是无色液体,某化学兴趣小组的同学欲探究M与铜、铝的活动性顺序,请你和他们一起进行以下探究活动.
【提出问题】M、铜、铝的金属活动性顺序是怎样的?
【猜想与假设】小敏的猜想是Al>Cu>M;小强的猜想是Al>M>Cu;你的猜想是 ______ .
【设计与实验一】小莉取M丝、铜丝、铝丝和编号为①、②、③的3支试管,进行如表的实验(试管中均盛有体积相同、溶质质量分数也相同的稀盐酸);
实验操作 M丝插入试管①中 铜丝插入试管②中 铝丝插入试管③中 实验结论
刚开始的现象 有少量气泡产生 无气泡 无气泡 M>Cu: ______
几分钟后的现象 有少量气泡产生 无气泡 有大量气泡产生 ______
【交流与表达】同学们对同一实验得出两种不同结论的现象进行了讨论,明白了实验刚开始时试管③中无气泡产生的原因,该原因是 ____________________ 。
【设计与实验二】为了进一步探究三种金属的活动性顺序,同学们取粗细相同,打磨干净的M丝、铝丝及相关溶液,又进行了如图所示的实验:
(1)试管乙中观察到的现象是 _________________________ 。
(2)试管丙中反应的化学方程式为 _______________ 。
【交流与表达】同学们经讨论后认为该实验可以优化,去掉试管 __ (填试管编号)中的实验,也可以得出正确的结论.
【解释与结论】通过以上实验,同学们得出了三种金属的活动性顺序.
【评价与反思】实验结束后,同学们对实验过程进行了如下反思:
(1)影响金属与酸反应速率快慢的因素,除了相互反应的金属和酸的性质外,还有 ______________ (任写一种)。
(2)探究金属活动性顺序时,除了上述实验中已经用到的两种方法外,还可以根据 _______ 进行判断(任写一种)。
4.生活中所用“免洗液”中含有一定量的乙醇(C2H5OH),工业生产无水乙醇的方法是在工业酒精(含有一定量水的乙醇)中加足量的生石灰后蒸馏。
(1)生石灰与水反应的化学方程式为___________。
(2)无水乙醇与金属钠反应时有气体产生。以下是某化学兴趣小组对该反应产生的气体进行的探究,请你填答相关问题。
【提出问题】无水乙醇和金属钠反应产生的气体是什么?
【查阅资料】无水乙醇和金属钠反应能生成一种常见的可燃性气体。
【提出假设】对气体提出以下假设
假设I:CO;假设Ⅱ:CH4;假设Ⅲ:H2;假设Ⅳ:CO2。
以上假设中,假设___________不成立,理由是___________。
【实验探究】
实验操作 实验现象 结论
a.向盛无水乙醇的试管中加入金属钠。迅速塞上带尖嘴导管的胶塞(如图),在导管口用一支小试管收集并检验气体的纯度 验纯时发出___________ 说明气体不纯
b.点燃气体,在火焰上方罩一个干冷烧杯 烧杯内壁有白雾 假设___________不成立
c.将烧杯迅速倒转,向其中注入适量的___________,充分振荡 ___________ 假设Ⅲ成立
【反思评价】根据实验结果,操作b反应的化学方程式为___________。
5.某同学在博物馆看到一些铜制文物上有绿色的锈迹后,对绿色锈迹产生了探究兴趣。该同学查阅资料得知:
Ⅰ、绿色锈迹是碱式碳酸铜【Cu2(OH)2CO3】,受热易分解。
Ⅱ、无水硫酸铜为白色粉末,遇水变蓝。
Ⅲ、碱石灰是CaO和NaOH的固体混合物,NaOH与CO2反应生成碳酸钠和水。
Ⅳ、氧化铜与稀硫酸反应生成蓝色溶液,碳粉不与稀硫酸反应也不溶解在稀硫酸中。
查阅资料后,该同学将少量碱式碳酸铜放入试管中加热,发现试管中的固体由绿色变成黑色,同时试管壁上有无色液滴生成。为了进一步确定碱式碳酸铜受热分解的产物,进行了如下猜想与探究:
(1)该黑色固体可能是①碳粉;②氧化铜:③___________。
请帮助该同学完成下述实验方案设计与记录。
实验操作 现象 实验结论
将少量黑色固体放入试管中,加入___________,充分振荡 ___________ 猜想②正确
(2)对于“加热碱式碳酸铜,试管壁上有无色液滴生成”的现象,该同学猜想无色液滴可能是水,根据反应前后元素守恒,猜想分解产物还有CO2,并选择如下图所示装置进行探究。
①实验步骤:
步骤一:连接A和B,打开活塞,通入一段时间的空气。
步骤二:关闭活塞,依次连接装置A→B→___________→___________(填“C”、“D”)。
步骤三:点燃酒精灯,观察到明显现象后,停止加热。
②当观察到___________,可以得出碱式碳酸铜受热分解生成了H2O,根据装置C的实验现象可以得出碱式碳酸铜受热分解生成了CO2,请写出C中反应的化学方程___________。
③上述装置A中碱石灰的作用是___________。
6.科学探究
(1)课外小组同学进一步研究铁与氧气的反应。
【提出问题】铁丝燃烧时为什么会有“火星四射”的现象?
【查阅资料】铁丝燃烧时“火星四射”现象与铁丝含碳量有关。
【进行实验】探究铁丝在氧气燃烧时“火星四射”的现象与其含碳量的关系。
实验 现象 解释与结论
实验1:取直径0.20mm,含碳0.1%的铁丝,在氧气中燃烧 零星的火星四射 ①铁燃烧的化学方程式是_____ ②0.20mm的铁丝在氧气中燃烧“火星四射”与其含碳量的关系为_____
实验2:取直径0.20mm,含碳0.32%的铁丝,在氧气中燃烧 较明显的火星四射
实验3:取直径0.20mm,含碳0.52%的铁丝,在氧气中燃烧 ①_____
【实验拓展】
(2)同学们认为燃烧的现象还与氧气的浓度有关,想收集不同浓度的氧气进行相关实验。
①若用排水集气法收集一瓶体积分数约为80%的氧气,预先应向容积为360mL的集气瓶中加水,水的体积约为_____mL(取整数)。
②观察并记录现象,列入下表:
集气瓶号 1 2 3 4 5
收集O2的体积分数(%) 31 33 35 37 39
空气的体积分数(%) 69 67 65 63 61
总O2体积分数(%) 45.5 47.1 48.7 50.2 51.8
木条火星的状况 很亮 很亮 很亮 复燃 _____
结论:当氧气浓度达到_____%左右时,带火星的木条即可复燃。用这种方法检验集气瓶中是否集满氧气是_____(填“可靠”或“不可靠”)的。
7.物质燃烧的剧烈程度与很多因素有关。进行铁丝燃烧实验时,某小组发现实验现象与预期的不同。
【查阅资料】铁丝根据用途不同,成分也有差异,通常含碳和其它元素(本题不考虑其它元素)。
【提出问题】铁丝燃烧的剧烈程度与什么因素有关?
【作出猜想】猜想一:______
猜想二:氧气含量
猜想三:铁丝的含碳量
【进行实验】
实验编号 氧气含量 铁丝情况 燃烧现象
1 21% 铁丝 不能燃烧
2 21% 铁粉 剧烈燃烧,火星四射
3 60% 铁丝 燃烧,轻微火星四射
4 100% 铁丝 燃烧,火星四射明显
5 X 含碳0.2%的铁丝 剧烈燃烧,少量火星四射
6 100% 含碳0.6%的铁丝 剧烈燃烧,火星四射
【实验分析】①铁丝燃烧的化学方程式为:______;
②实验1和______对比,说明猜想一正确,实验3和4对比,说明猜想______正确;
③实验5与实验6对比,X的值为______,对比说明铁丝的含碳量越高,______的现象越明显;
④铁丝易生锈,实验前需用砂纸打磨,由此推测还有______会影响铁丝燃烧情况,若要验证此猜想,需要控制的变量有:______。
A氧气的含量 B铁丝的含碳量 C反应物的接触面积
8.焦炭与水蒸气在高温下反应,产物是一种俗称水煤气的气体燃料(其中不含甲烷),为确定水煤气的成分,某实验小组进行了如下探究:
【查阅资料】新鲜的鸡血遇一氧化碳变为樱桃红色。
【提出猜想】
小组成员对水煤气的成分提出以下四种猜想:
猜想1:H2、CO2;
猜想2:H2、CO;
猜想3:CO、CO2;
猜想4:H2、CO、CO2。
请你说明猜想3不能成立的理由:__________。
【实验探究】小组设计了下图所示的实验装置进行探究。
【实验现象】通入水煤气后,澄清石灰水不变浑浊,新鲜鸡血变樱桃红色。
(1)由此可知,水煤气中不含__________,含有__________。(填化学式)。
【继续实验】在B处点燃气体,然后用一个干冷的烧杯罩在火焰上方。
(1)气体通过A后再在B处点燃时,观察到火焰呈__________色,所罩烧杯的内壁__________,由此证明水煤气中含有H2,猜想__________成立。
(2)由探究结果可知,焦炭与水蒸气在高温下反应的化学方程式为_____________。
9.我国可燃冰试采创造了“产气总量、日均产气量”的世界纪录,可燃冰的主要成份是甲烷水合物。某同学设计如下实验探究甲烷燃烧产物的成分。
【提出问题】甲烷燃烧后生成哪些物质?
【查阅资料】① 含碳元素的物质完全燃烧生成CO2,不完全燃烧生成CO;② 白色无水硫酸铜粉末遇水变为蓝色;③ CO与人体内的血红蛋白结合,会造成人缺氧中毒。
【猜想与假设】猜想一: CO2、H2O 猜想二:CO、H2O 猜想三:______________。
【实验探究】将甲烷在一定量的纯净空气中燃烧的产物依次通过A→F 装置(部分夹持、固定装置略)进行验证:
(1)实验时,装置A中现象为__________________________,装置B、E中澄清石灰水均变浑浊原因是_______________________________(用化学方程式表示),装置D中现象为___________________________________,由此推断猜想_________成立。
(2)装置C的作用是______________________,装置F的作用是________________。
【反思与交流】生活中,使用含碳燃料一定要注意__________,防止_________中毒。
10.小明对灭火器的种类及其使用注意事项特别感兴趣,并对“制镁企业不能使用CO2灭火器”的问题进行探究。
小明将点燃的镁条插入盛满CO2的集气瓶内,镁条继续剧烈燃烧,生成白色固体并有黑色物质附着于集气瓶内壁。小明对镁与CO2反应的产物进行探究。
【提出猜想】
猜想Ⅰ:产物是MgO和C;
猜想Ⅱ:产物是MgO、MgC2和C。
提出以上猜想的依据是___________;
【查阅资料】
,Mg(OH)2在热水中的溶解能力增大;
。
【实验操作与分析】为探究固体的成分,兴趣小组同学进行了如下实验:
(1)取少量反应后的固体混合物放入试管中,并加入足量热水,观察到无气体放出,说明猜想___________不正确;
(2)为了进一步验证产物中的固体成分,兴趣小组同学进行如上图所示的实验,观察到烧杯B中的实验现象为___________,说明固体成分中含有___________(写名称),请写出B中反应的化学方程式___________。
(3)依据实验分析,请写出Mg跟CO2发生的化学反应方程式________,此反应的反应类型是_______(填“基本反应类型”)。
【实验反思】通过本实验,对“制镁企业不能使用CO2灭火器”和“CO2不助燃”,你有什么新的认识:___________。
11.某实验小组将少量氢化钙(CaH2)溶于水,形成了无色透明的溶液,再向其中加入碳酸钠溶液,有沉淀产生,经过滤后得到滤渣和滤液。然后进行了滤渣验证和滤液溶质成分的探究。
(1)【查阅资料】氢化钙在常温下能与水反应生成氢氧化钙和氢气,写出该反应的化学方程式______________。
(2)【交流验证】滤渣只能是碳酸钙,用盐酸验证此滤渣的化学方程式为______________。
(3)【提出问题】滤液中溶质的成分是什么?
(4)【猜想假设】猜想一:NaOH
猜想二:NaOH和Na2CO3
猜想三:NaOH和________。
猜想四:NaOH、Na2CO3和Ca(OH)2
(5)【讨论分析】经过讨论认为最不合理的是猜想____,原因是______________。
(6)【实验与结论】
实验步骤 现象 结论
步骤I:取少量滤液,向其中加入足量盐酸溶液 ________ 猜想二不成立
步骤Ⅱ:另取少量滤液,向其中滴入适量Na2CO3溶液 产生白色沉淀 猜想____成立
(7)【拓展延伸】在分析反应后所得物质的成分时,除考虑生成物外,还需考虑___________。
12.过氧化钠(Na2O2)是一种常用的供氧剂,空气中的水和二氧化碳均能与其发生反应生成氧气:2Na2O2+2H2O=4NaOH+O2,2Na2O2+2CO2=2Na2CO3+O2.
为了探究久置空气中的过氧化钠的成分,兴趣小组中的小琪同学设计了如下的实验方案:
【实验1】探究固体中是否存在过氧化钠:
实验操作 实验现象 小琪的结论
取部分固体于烧杯中,加入足量的_________ __________ 固体中存在过氧化钠
【实验2】探究固体中是否存在碳酸钠:
实验操作 实验现象 小琪的结论
取少量实验1所得溶液于试管中,加入足量的_______ 有气泡产生 固体中存在碳酸钠。
【实验3】探究固体中是否存在氢氧化钠:
实验操作 实验现象 小琪的结论
取少量实验1所得溶液于试管中,加入_______ 产生白色沉淀 固体中存在氢氧化钠。
________ ________
但小明认为小琪设计的【实验3】无法确定原固体药品中是否含有氢氧化钠。他的理由是:________
2022年广州中考之科学探究题专练
1.84消毒液是一种无色或者淡黄色具有刺激性气味的含氯消毒剂,有效成分为次氯酸钠(NaClO),广泛用于医院、宾馆、旅游、家庭等的卫生消毒。某化学兴趣小组对该消毒液进行了如下系列探究。
【查阅资料】I.84消毒液不稳定,其杀菌作用主要依靠有效氯,有效氯越高杀菌效果越好。
Ⅱ.消毒杀菌就是使病毒蛋白质变性,鸡蛋中蛋白质发生变性反应时变成白色固体。
探究一:84消毒液中有效氯含量的稳定性。
0.5%的84消毒液在不同温度、不同存放时间下的有效氯含量:
存放时间(小时) 不同温度下,有效氯存留率
60℃ 70℃ 80℃ 90℃
0(对照) 100% 100% 100% 100%
3.0 …………… ……….. 94.66% 88.05%
6.0 ……………. 96.66% 89.67% 74.69%
12.0 ………….. 93.32% 82.62% ………….
20.0 94.75% ……….. ………. ………..
30.0 92.99% ………. ………. …………
【解释与结论】
(1)次氯酸钠(NaClO)中Cl元素的化合价为_______。
(2)综合分析探究一中数据,在其他条件不变时,0.5%的84消毒液有效氯存留率受温度和时间的影响,其影响的变化趋势是_________。因此保存84消毒液应注意的问题是___________。
探究二:不同浓度84消毒液的杀菌效果
在四只试管中各加入鸡蛋液2mL,分别加入不同浓度的消毒液,静置15分钟后,记录如下:
序号 2—1 2—2 2—3 2—4
实验操作 加入0.5mL消毒原液 加入0.5mL消毒原液,12.5mL水 加入0.5mL消毒原液,50mL水 加入0.5mL消毒原液,100mL水
现象 液体表面产生气泡,无其他现象 液体中产生大量白色固体 液体中产生少量白色固体 液体中产生极少量白色固体
【解释与结论】
(3)探究二中杀菌效果最好的一组实验为________(填序号)。
(4)洁厕灵主要成分是盐酸,与84消毒液混合会产生有毒气体Cl2,完成反应的化学方程式:___________。
【答案】 +1 在实验研究范围内,在其它条件下不变时,随着温度升高、存放时间延长,有效氯存留率减小 阴暗、低温处存放,不能长久存放 2-2 NaCl
2.某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。
(1)请写出镁条与氧气反应的化学方程式:______。
(2)某兴趣小组实验时,发现镁条完全燃烧后,称量石棉网上的燃烧产物质量比反应前镁条质量大,小霖认为此实验不符合质量守恒定律,我______(选填“同意”或“不同意”)她的观点,我的理由是______。
(3)由此实验可知,如反应过程中有气体参加或生成,需要在______容器中进行。
【改进实验】兴趣小组按如图1装置改进实验,验证了质量守恒定律,却发现产物中还有一些黄色固体。
【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁(化学式为 Mg3N2)固体;
③氮化镁可与水反应生成氨气,氨气极易溶于水形成氨水;
④氨水能使酚酞试液变红。
【作出猜想】黄色固体为氮化镁。
【实验探究】实验操作:如图2,取燃烧产物于烧杯中,加入适量水, 然后用大烧杯罩住。
(4)实验现象:______。
实验结论:黄色固体为氮化镁。
【反思交流】
(5)根据你所学过的知识,写出镁与氮气燃烧生成Mg3N2的化学方程式:______。
(6)空气中N2与O2的体积比大约是______,而镁条在空气中燃烧生成的MgO 却远多于 Mg3N2,可见镁更容易和氧气反应。作出合理的解释:______。
(7)如果用图1装置(气密性良好)和药品(足量)测定空气中氧气含量,该实验所测得的氧气体积分数______ 。(选填“大于”“小于”或“等于”)
【拓展延伸】
(8)人们对燃烧的认识是不断发展的,通过镁在空气中的燃烧实验,你对于燃烧的条件又有什么新的认识?______。
【答案】 不同意 参加反应的氧气没有测量 密闭 脱脂棉变红 4:1 氧气化学性质比氮气活泼 大于 燃烧不一定需要氧气
3.M是生活中常见的金属,MSO4溶液是无色液体,某化学兴趣小组的同学欲探究M与铜、铝的活动性顺序,请你和他们一起进行以下探究活动.
【提出问题】M、铜、铝的金属活动性顺序是怎样的?
【猜想与假设】小敏的猜想是Al>Cu>M;小强的猜想是Al>M>Cu;你的猜想是 ______ .
【设计与实验一】小莉取M丝、铜丝、铝丝和编号为①、②、③的3支试管,进行如表的实验(试管中均盛有体积相同、溶质质量分数也相同的稀盐酸);
实验操作 M丝插入试管①中 铜丝插入试管②中 铝丝插入试管③中 实验结论
刚开始的现象 有少量气泡产生 无气泡 无气泡 M>Cu: ______
几分钟后的现象 有少量气泡产生 无气泡 有大量气泡产生 ______
【交流与表达】同学们对同一实验得出两种不同结论的现象进行了讨论,明白了实验刚开始时试管③中无气泡产生的原因,该原因是 ____________________ 。
【设计与实验二】为了进一步探究三种金属的活动性顺序,同学们取粗细相同,打磨干净的M丝、铝丝及相关溶液,又进行了如图所示的实验:
(1)试管乙中观察到的现象是 _________________________ 。
(2)试管丙中反应的化学方程式为 _______________ 。
【交流与表达】同学们经讨论后认为该实验可以优化,去掉试管 __ (填试管编号)中的实验,也可以得出正确的结论.
【解释与结论】通过以上实验,同学们得出了三种金属的活动性顺序.
【评价与反思】实验结束后,同学们对实验过程进行了如下反思:
(1)影响金属与酸反应速率快慢的因素,除了相互反应的金属和酸的性质外,还有 ______________ (任写一种)。
(2)探究金属活动性顺序时,除了上述实验中已经用到的两种方法外,还可以根据 _______ 进行判断(任写一种)。
【答案】 M>Al>Cu M>Al Al>M>Cu 铝表面有一层氧化膜 M表面出现一层红色物质 2Al+3CuSO4=Al2(SO4)3+3Cu 丙 反应物接触面积、温度等 与氧气反应的剧烈程度
4.生活中所用“免洗液”中含有一定量的乙醇(C2H5OH),工业生产无水乙醇的方法是在工业酒精(含有一定量水的乙醇)中加足量的生石灰后蒸馏。
(1)生石灰与水反应的化学方程式为___________。
(2)无水乙醇与金属钠反应时有气体产生。以下是某化学兴趣小组对该反应产生的气体进行的探究,请你填答相关问题。
【提出问题】无水乙醇和金属钠反应产生的气体是什么?
【查阅资料】无水乙醇和金属钠反应能生成一种常见的可燃性气体。
【提出假设】对气体提出以下假设
假设I:CO;假设Ⅱ:CH4;假设Ⅲ:H2;假设Ⅳ:CO2。
以上假设中,假设___________不成立,理由是___________。
【实验探究】
实验操作 实验现象 结论
a.向盛无水乙醇的试管中加入金属钠。迅速塞上带尖嘴导管的胶塞(如图),在导管口用一支小试管收集并检验气体的纯度 验纯时发出___________ 说明气体不纯
b.点燃气体,在火焰上方罩一个干冷烧杯 烧杯内壁有白雾 假设___________不成立
c.将烧杯迅速倒转,向其中注入适量的___________,充分振荡 ___________ 假设Ⅲ成立
【反思评价】根据实验结果,操作b反应的化学方程式为___________。
【答案】(1)
(2) Ⅳ 二氧化碳没有可燃性 尖锐的爆鸣声 I 澄清石灰水 石灰水不变浑浊
5.某同学在博物馆看到一些铜制文物上有绿色的锈迹后,对绿色锈迹产生了探究兴趣。该同学查阅资料得知:
Ⅰ、绿色锈迹是碱式碳酸铜【Cu2(OH)2CO3】,受热易分解。
Ⅱ、无水硫酸铜为白色粉末,遇水变蓝。
Ⅲ、碱石灰是CaO和NaOH的固体混合物,NaOH与CO2反应生成碳酸钠和水。
Ⅳ、氧化铜与稀硫酸反应生成蓝色溶液,碳粉不与稀硫酸反应也不溶解在稀硫酸中。
查阅资料后,该同学将少量碱式碳酸铜放入试管中加热,发现试管中的固体由绿色变成黑色,同时试管壁上有无色液滴生成。为了进一步确定碱式碳酸铜受热分解的产物,进行了如下猜想与探究:
(1)该黑色固体可能是①碳粉;②氧化铜:③___________。
请帮助该同学完成下述实验方案设计与记录。
实验操作 现象 实验结论
将少量黑色固体放入试管中,加入___________,充分振荡 ___________ 猜想②正确
(2)对于“加热碱式碳酸铜,试管壁上有无色液滴生成”的现象,该同学猜想无色液滴可能是水,根据反应前后元素守恒,猜想分解产物还有CO2,并选择如下图所示装置进行探究。
①实验步骤:
步骤一:连接A和B,打开活塞,通入一段时间的空气。
步骤二:关闭活塞,依次连接装置A→B→___________→___________(填“C”、“D”)。
步骤三:点燃酒精灯,观察到明显现象后,停止加热。
②当观察到___________,可以得出碱式碳酸铜受热分解生成了H2O,根据装置C的实验现象可以得出碱式碳酸铜受热分解生成了CO2,请写出C中反应的化学方程___________。
③上述装置A中碱石灰的作用是___________。
【答案】(1) 碳和氧化铜的混合物 足量稀硫酸 黑色固体完全溶解,溶液变为蓝色
(2) D C 无水硫酸铜变蓝 除去空气中的二氧化碳和水蒸气
6.科学探究
(1)课外小组同学进一步研究铁与氧气的反应。
【提出问题】铁丝燃烧时为什么会有“火星四射”的现象?
【查阅资料】铁丝燃烧时“火星四射”现象与铁丝含碳量有关。
【进行实验】探究铁丝在氧气燃烧时“火星四射”的现象与其含碳量的关系。
实验 现象 解释与结论
实验1:取直径0.20mm,含碳0.1%的铁丝,在氧气中燃烧 零星的火星四射 ①铁燃烧的化学方程式是_____ ②0.20mm的铁丝在氧气中燃烧“火星四射”与其含碳量的关系为_____
实验2:取直径0.20mm,含碳0.32%的铁丝,在氧气中燃烧 较明显的火星四射
实验3:取直径0.20mm,含碳0.52%的铁丝,在氧气中燃烧 ①_____
【实验拓展】
(2)同学们认为燃烧的现象还与氧气的浓度有关,想收集不同浓度的氧气进行相关实验。
①若用排水集气法收集一瓶体积分数约为80%的氧气,预先应向容积为360mL的集气瓶中加水,水的体积约为_____mL(取整数)。
②观察并记录现象,列入下表:
集气瓶号 1 2 3 4 5
收集O2的体积分数(%) 31 33 35 37 39
空气的体积分数(%) 69 67 65 63 61
总O2体积分数(%) 45.5 47.1 48.7 50.2 51.8
木条火星的状况 很亮 很亮 很亮 复燃 _____
结论:当氧气浓度达到_____%左右时,带火星的木条即可复燃。用这种方法检验集气瓶中是否集满氧气是_____(填“可靠”或“不可靠”)的。
【答案】 0.20mm的铁丝含碳量越高,在氧气中燃烧“火星四射”的现象越明显 剧烈燃烧,火星四射 270 复燃 50.2 不可靠
7.物质燃烧的剧烈程度与很多因素有关。进行铁丝燃烧实验时,某小组发现实验现象与预期的不同。
【查阅资料】铁丝根据用途不同,成分也有差异,通常含碳和其它元素(本题不考虑其它元素)。
【提出问题】铁丝燃烧的剧烈程度与什么因素有关?
【作出猜想】猜想一:______
猜想二:氧气含量
猜想三:铁丝的含碳量
【进行实验】
实验编号 氧气含量 铁丝情况 燃烧现象
1 21% 铁丝 不能燃烧
2 21% 铁粉 剧烈燃烧,火星四射
3 60% 铁丝 燃烧,轻微火星四射
4 100% 铁丝 燃烧,火星四射明显
5 X 含碳0.2%的铁丝 剧烈燃烧,少量火星四射
6 100% 含碳0.6%的铁丝 剧烈燃烧,火星四射
【实验分析】①铁丝燃烧的化学方程式为:______;
②实验1和______对比,说明猜想一正确,实验3和4对比,说明猜想______正确;
③实验5与实验6对比,X的值为______,对比说明铁丝的含碳量越高,______的现象越明显;
④铁丝易生锈,实验前需用砂纸打磨,由此推测还有______会影响铁丝燃烧情况,若要验证此猜想,需要控制的变量有:______。
A氧气的含量 B铁丝的含碳量 C反应物的接触面积
【答案】 反应物的接触面积 2 二 100% 火星四射 铁锈 ABC
8.焦炭与水蒸气在高温下反应,产物是一种俗称水煤气的气体燃料(其中不含甲烷),为确定水煤气的成分,某实验小组进行了如下探究:
【查阅资料】新鲜的鸡血遇一氧化碳变为樱桃红色。
【提出猜想】
小组成员对水煤气的成分提出以下四种猜想:
猜想1:H2、CO2;
猜想2:H2、CO;
猜想3:CO、CO2;
猜想4:H2、CO、CO2。
请你说明猜想3不能成立的理由:__________。
【实验探究】小组设计了下图所示的实验装置进行探究。
【实验现象】通入水煤气后,澄清石灰水不变浑浊,新鲜鸡血变樱桃红色。
(1)由此可知,水煤气中不含__________,含有__________。(填化学式)。
【继续实验】在B处点燃气体,然后用一个干冷的烧杯罩在火焰上方。
(1)气体通过A后再在B处点燃时,观察到火焰呈__________色,所罩烧杯的内壁__________,由此证明水煤气中含有H2,猜想__________成立。
(2)由探究结果可知,焦炭与水蒸气在高温下反应的化学方程式为_____________。
【答案】 不符合质量守恒定律 CO2 CO 淡蓝 出现水雾 2 C +H2OCO+H2
9.我国可燃冰试采创造了“产气总量、日均产气量”的世界纪录,可燃冰的主要成份是甲烷水合物。某同学设计如下实验探究甲烷燃烧产物的成分。
【提出问题】甲烷燃烧后生成哪些物质?
【查阅资料】① 含碳元素的物质完全燃烧生成CO2,不完全燃烧生成CO;② 白色无水硫酸铜粉末遇水变为蓝色;③ CO与人体内的血红蛋白结合,会造成人缺氧中毒。
【猜想与假设】猜想一: CO2、H2O 猜想二:CO、H2O 猜想三:______________。
【实验探究】将甲烷在一定量的纯净空气中燃烧的产物依次通过A→F 装置(部分夹持、固定装置略)进行验证:
(1)实验时,装置A中现象为__________________________,装置B、E中澄清石灰水均变浑浊原因是_______________________________(用化学方程式表示),装置D中现象为___________________________________,由此推断猜想_________成立。
(2)装置C的作用是______________________,装置F的作用是________________。
【反思与交流】生活中,使用含碳燃料一定要注意__________,防止_________中毒。
【答案】 CO2、CO、H2O 白色粉末变为蓝色 CO2 + Ca(OH)2 = CaCO3↓+ H2O 黑色粉末变成红色 三 吸收过量的CO2,防止对后续实验造成干扰 收集尾气CO,防止其逸散到空气中,污染环境 通风 CO或一氧化碳
10.小明对灭火器的种类及其使用注意事项特别感兴趣,并对“制镁企业不能使用CO2灭火器”的问题进行探究。
小明将点燃的镁条插入盛满CO2的集气瓶内,镁条继续剧烈燃烧,生成白色固体并有黑色物质附着于集气瓶内壁。小明对镁与CO2反应的产物进行探究。
【提出猜想】
猜想Ⅰ:产物是MgO和C;
猜想Ⅱ:产物是MgO、MgC2和C。
提出以上猜想的依据是___________;
【查阅资料】
,Mg(OH)2在热水中的溶解能力增大;
。
【实验操作与分析】为探究固体的成分,兴趣小组同学进行了如下实验:
(1)取少量反应后的固体混合物放入试管中,并加入足量热水,观察到无气体放出,说明猜想___________不正确;
(2)为了进一步验证产物中的固体成分,兴趣小组同学进行如上图所示的实验,观察到烧杯B中的实验现象为___________,说明固体成分中含有___________(写名称),请写出B中反应的化学方程式___________。
(3)依据实验分析,请写出Mg跟CO2发生的化学反应方程式________,此反应的反应类型是_______(填“基本反应类型”)。
【实验反思】通过本实验,对“制镁企业不能使用CO2灭火器”和“CO2不助燃”,你有什么新的认识:___________。
【答案】 化学反应前后元素种类不变(或质量守恒定律) Ⅱ 澄清石灰水变浑浊 碳 置换反应 二氧化碳灭火器不适用于扑灭如钾、钠、镁等金属燃烧形成的火灾;二氧化碳不助燃是相对的,应辩证地认识物质的性质
11.某实验小组将少量氢化钙(CaH2)溶于水,形成了无色透明的溶液,再向其中加入碳酸钠溶液,有沉淀产生,经过滤后得到滤渣和滤液。然后进行了滤渣验证和滤液溶质成分的探究。
(1)【查阅资料】氢化钙在常温下能与水反应生成氢氧化钙和氢气,写出该反应的化学方程式______________。
(2)【交流验证】滤渣只能是碳酸钙,用盐酸验证此滤渣的化学方程式为______________。
(3)【提出问题】滤液中溶质的成分是什么?
(4)【猜想假设】猜想一:NaOH
猜想二:NaOH和Na2CO3
猜想三:NaOH和________。
猜想四:NaOH、Na2CO3和Ca(OH)2
(5)【讨论分析】经过讨论认为最不合理的是猜想____,原因是______________。
(6)【实验与结论】
实验步骤 现象 结论
步骤I:取少量滤液,向其中加入足量盐酸溶液 ________ 猜想二不成立
步骤Ⅱ:另取少量滤液,向其中滴入适量Na2CO3溶液 产生白色沉淀 猜想____成立
(7)【拓展延伸】在分析反应后所得物质的成分时,除考虑生成物外,还需考虑___________。
【答案】 Ca(OH)2 四 (或“氢氧化钙能与碳酸钠能反应生成了碳酸钙沉淀和氢氧化钠”) 没有气泡产生 三 反应物是否过量
12.过氧化钠(Na2O2)是一种常用的供氧剂,空气中的水和二氧化碳均能与其发生反应生成氧气:2Na2O2+2H2O=4NaOH+O2,2Na2O2+2CO2=2Na2CO3+O2.
为了探究久置空气中的过氧化钠的成分,兴趣小组中的小琪同学设计了如下的实验方案:
【实验1】探究固体中是否存在过氧化钠:
实验操作 实验现象 小琪的结论
取部分固体于烧杯中,加入足量的_________ __________ 固体中存在过氧化钠
【实验2】探究固体中是否存在碳酸钠:
实验操作 实验现象 小琪的结论
取少量实验1所得溶液于试管中,加入足量的_______ 有气泡产生 固体中存在碳酸钠。
【实验3】探究固体中是否存在氢氧化钠:
实验操作 实验现象 小琪的结论
取少量实验1所得溶液于试管中,加入_______ 产生白色沉淀 固体中存在氢氧化钠。
________ ________
但小明认为小琪设计的【实验3】无法确定原固体药品中是否含有氢氧化钠。他的理由是:________
【答案】 水 产生气泡 稀盐酸 足量的氯化钙溶液 静置,取上层清液少量于试管中,滴加酚酞试液 溶液变红 步骤一中过氧化钠反应生成了氢氧化钠
同课章节目录
