2022年广东省广州市中考之与催化剂有关的实验探究题专练(word版 含答案)
文档属性
| 名称 | 2022年广东省广州市中考之与催化剂有关的实验探究题专练(word版 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 333.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-25 00:00:00 | ||
图片预览


文档简介
2022年广州中考之与催化剂有关的实验探究题专练
1.为验证“氧化铁能加快过氧化氢制氧气的速率,其本身的化学性质在反应前后没有改变”,小红同学设计了以下实验方案:
①称取1.5g氧化铁装入试管,把带火星的木条伸入试管,观察现象。
②在上述试管中加入5mL5%过氧化氢溶液,把带火星的木条伸入试管,观察现象。
③待实验②的试管中没有现象发生时,重新加入5mL5%过氧化氢溶液,观察现象。
④待实验③的试管中又没有现象发生时,再重新加入5mL5%过氧化氢溶液,观察现象。
⑤把实验④中的氧化铁过滤出来,洗净、干燥、称量。
请回答:
(1)实验②中观察到的现象是___________,反应的化学方程式为__________。
(2)实验①至⑤中,不必进行的一个实验是__________。
(3)小明同学认为以上实验方案不完整,还需要补充实验。请你把需要补充的实验的有关内容填写在下面实验报告的空格内。
实验操作 实验现象 解释
____ ____ ___
2.化学兴趣小组的同学学习了“二氧化锰在过氧化氢分解中起催化作用”后,想探究四氧化三铁能否在过氧化氢分解中起催化作用,请你一起参与他们的探究过程。
【提出问题】四氧化三铁能否作过氧化氢分解的催化剂呢?
【猜想与假设】四氧化三铁能作为过氧化氢分解的催化剂。
【进行试验】
(1)填写下表。
编号 实验操作 实验现象
① 在试管中加入过氧化氢溶液。然后将带火星的木条伸入试管中 产生少量气泡,木条不复燃
② 在装有过氧化氢溶液的试管中加入1g四氧化三铁,然后将带火星的木条伸入试管中 产生大量气泡,木条复燃
③ 待②中反应结束,将试管中的剩余物进行过滤,洗涤、干燥、称量 称得固体质量为1g
④ 将③中所得固体放入试管中,向其中加入过氧化氢溶液,然后将带火星的木条伸入试管中 _________
【实验结论】
(2)实验③④证明,四氧化三铁的________和_______在反应前后均没有发生变化,可以作为过氧化氢分解的催化剂。
(3)写出该反应的化学方程式________。
【实验拓展】
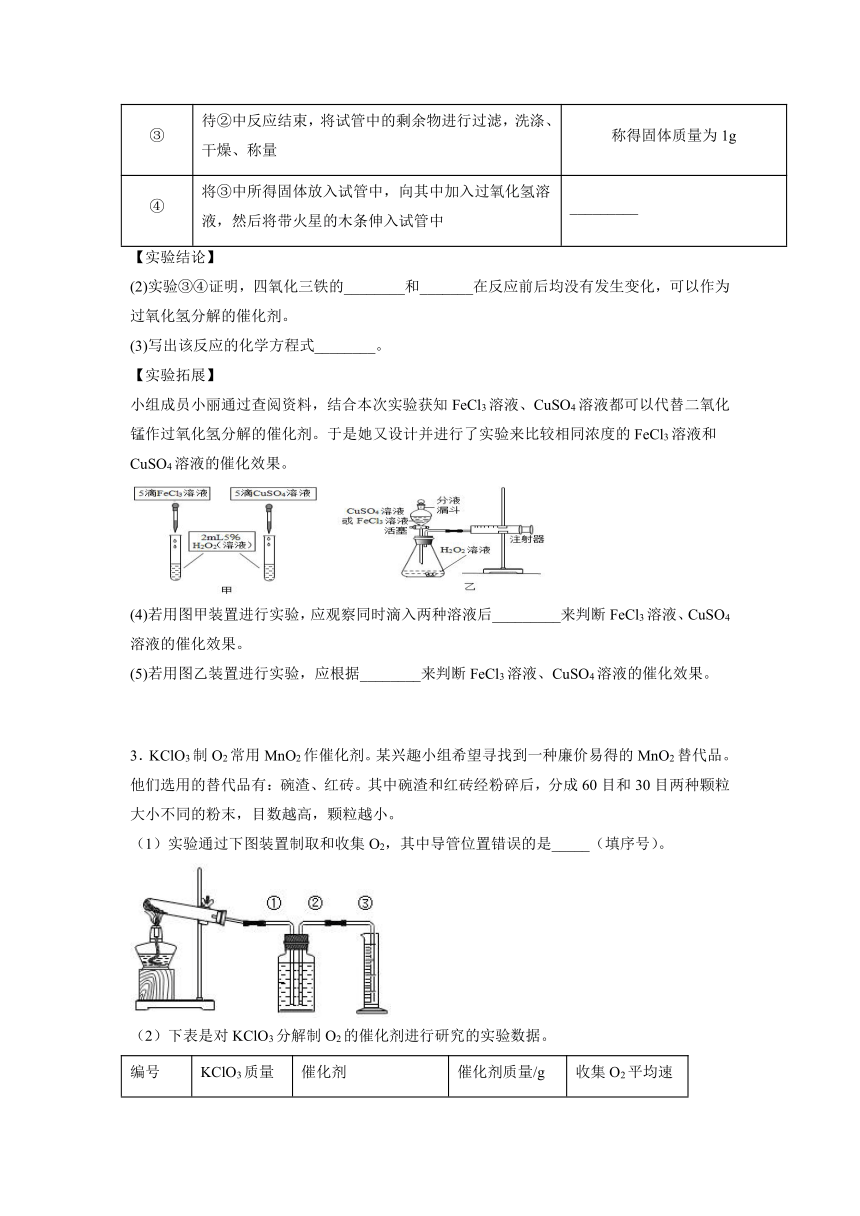
小组成员小丽通过查阅资料,结合本次实验获知FeCl3溶液、CuSO4溶液都可以代替二氧化锰作过氧化氢分解的催化剂。于是她又设计并进行了实验来比较相同浓度的FeCl3溶液和CuSO4溶液的催化效果。
(4)若用图甲装置进行实验,应观察同时滴入两种溶液后_________来判断FeCl3溶液、CuSO4溶液的催化效果。
(5)若用图乙装置进行实验,应根据________来判断FeCl3溶液、CuSO4溶液的催化效果。
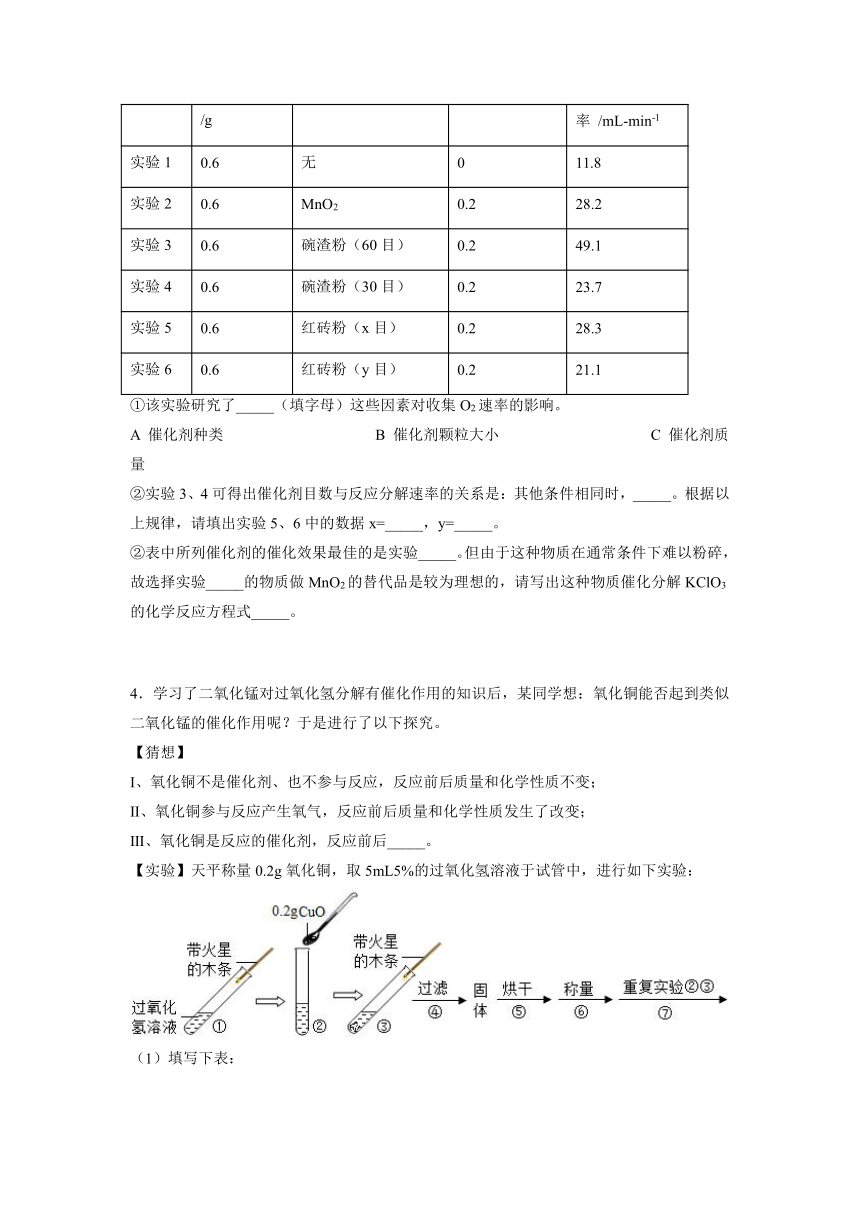
3.KClO3制O2常用MnO2作催化剂。某兴趣小组希望寻找到一种廉价易得的MnO2替代品。他们选用的替代品有:碗渣、红砖。其中碗渣和红砖经粉碎后,分成60目和30目两种颗粒大小不同的粉末,目数越高,颗粒越小。
(1)实验通过下图装置制取和收集O2,其中导管位置错误的是_____(填序号)。
(2)下表是对KClO3分解制O2的催化剂进行研究的实验数据。
编号 KClO3质量/g 催化剂 催化剂质量/g 收集O2平均速率 /mL-min-1
实验1 0.6 无 0 11.8
实验2 0.6 MnO2 0.2 28.2
实验3 0.6 碗渣粉(60目) 0.2 49.1
实验4 0.6 碗渣粉(30目) 0.2 23.7
实验5 0.6 红砖粉(x目) 0.2 28.3
实验6 0.6 红砖粉(y目) 0.2 21.1
①该实验研究了_____(填字母)这些因素对收集O2速率的影响。
A 催化剂种类 B 催化剂颗粒大小 C 催化剂质量
②实验3、4可得出催化剂目数与反应分解速率的关系是:其他条件相同时,_____。根据以上规律,请填出实验5、6中的数据x=_____,y=_____。
②表中所列催化剂的催化效果最佳的是实验_____。但由于这种物质在通常条件下难以粉碎,故选择实验_____的物质做MnO2的替代品是较为理想的,请写出这种物质催化分解KClO3的化学反应方程式_____。
4.学习了二氧化锰对过氧化氢分解有催化作用的知识后,某同学想:氧化铜能否起到类似二氧化锰的催化作用呢?于是进行了以下探究。
【猜想】
Ⅰ、氧化铜不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ、氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变;
Ⅲ、氧化铜是反应的催化剂,反应前后_____。
【实验】天平称量0.2g氧化铜,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
(1)填写下表:
步骤③现象 步骤⑥结果 步骤⑦现象 结论
溶液中有气泡放出,带火星的木条复燃 _____ 溶液中有气泡放出,_____ 猜想Ⅰ、Ⅱ不成立; 猜想Ⅲ成立。
(2)步骤①③对比可以说明_____。
(3)步骤⑦的目的是_____。
(4)过氧化氢能被氧化铜催化分解放出氧气的文字表达式为_____。
(8分)多种物质都可催化过氧化氢分解,如MnO2、CuSO4等。实验小组的同学探究漂白液(主要成分是Na2CO3和NaC1)、FeCl3、K2SO4能否催化过氧化氢分解。
(1)MnO2催化过氧化氢分解的化学方程式是_________________________。
(2)如图所示,分别向三支试管中多次加入5%过氧化氢溶液,每次2mL,如有气泡产生,则将__________伸入试管,检验是否有氧气生成。结果如下表。
研究对象 第1次 第2次 第3次 第4次
漂白液 大量气泡 较多气泡 少量气泡 无气泡
FeCl3溶液 较多气泡 较多气泡 较多气泡 较多气泡
K2SO4溶液 ________
实验结论 i.实验中产生的气体都是氧气 (查阅得知:NaClO+H2O2=O2↑+NaCl+H2O) ii.K2SO4不能催化过氧化氢分解。 iii.________可能是过氧化氢分解的催化剂。 iv.……
(3)下列物质中,也可能是过氧化氢分解的催化剂的是________(填标号)
A. CuCl2 B. Fe2(SO4)3 C. Na2SO4 D. KCl
(4)探究不同催化剂催化效果的实验方案:将等体积5%过氧化氢溶液加到不同催化剂中,比较用排水法收集50mL氧气的快慢。请从下图中选择合适的仪器(每种仪器限用一次),组成该探究的完整实验装置,不需要用到的是________(填标号)。
6.化学是一门以实验为基础的科学。根据下列图示回答问题:
(1)写出仪器的名称:a______,b______。
(2)实验室用锌粒和稀硫酸制取氢气同时得到硫酸锌的化学方程式为______;若要控制反应的发生或停止,应选择的发生装置是______(填序号),利用D装置收集氢气的理由是______。
(3)某化学兴趣小组设计如表所示的对比实验来比较MnO2、CuO对过氧化氢分解的催化效果,所用实验装置如图所示。
实验序号 过氧化氢溶液 催化剂
实验1 5mL 4% 粉末状MnO20.2g
实验2 5mL 4% 粉末状CuO0.2g
①实验1中制取氧气的化学方程式为______。
②实验需要测量并记录的数据有:氧气体积和______。
③实验时,分别将过氧化氢溶液一次性注入盛有催化剂的小试管中,测量并记录数据,实验过程中发现U型管内右侧液面上升,原因是______。
④结论:MnO2对过氧化氢分解的催化效果比CuO好,得出该结论的依据是______。
7.实验室也可用双氧水制氧气。某同学为研究MnO2粉末用量对双氧水分解速率的影响,做了以下实验:采用不同质量的MnO2粉末做催化剂,每次均用30mL 10% 的双氧水其他实验条件均相同,测定收集500mL氧气所用的时间,结果如表:
序号 1 2 3 4 5 6 7 8 9
MnO2用量/g 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9
所用时间/s 17 8 6 3 2 2 2 2 2
(1)该实验可得出的结论是______。
(2)若上述实验选用B做发生装置,也可以制取氧气则长颈漏斗下端管口必须浸没在液体中,原因是______。若选用C做发生装置,你认为选用装置C的优点是______。
(3)仪器1的名称______,仪器2的名称______。
(4)写出A装置制取氧气的化学方程式_________该反应属于________反应(基本反应类型)
(5)实验室需少量甲烷气体,可用加热无水醋酸钠与碱石灰两种固体混合物制得。制甲烷气体的发生装置应选用______填字母装置,收集甲烷气可选用E或F装置,由此推断甲烷气具有的物理性质是______、______,若用如图装置收集该甲烷,气体由______端通入填“a”或“b”
(6)在实验室里制取氧气,既可采用分解过氧化氢的方法,也可采用分解氯酸钾的方法。上述两种方法的主要共同点有______,分解氯酸钾的化学方程式__________。
①采用MnO2均可改变其反应速率 ②反应都不需加热
③都利用含氧物质的分解来达到目的 ④两种方法所需仪器相同。
8.某实验小组对过氧化氢分解反应进行探究:
(探究一)探究影响过氧化氢分解速率的因素:
分别取 5 mL H2O2溶液进行实验,测定产生4 mL O2所需时间,实验结果记录如下表:
实验序号 H2O2溶液的浓度(%) 温度(℃) MnO2粉末用量(g) 反应时间(t)
① 30 35 0 t1
② 30 55 0 t2
③ 5 20 0.1 t3
④ 15 20 0.1 t4
(1)对比①②两个实验,若t1>t2,则可得出的结论是: _____。
(2)能证明过氧化氢分解速率与其浓度有关的实验组合是_____(填实验序号)。
(探究二)探究氧化铁(Fe2O3)能否用作过氧化氢分解的催化剂
实验步骤及现象如下:
实验步骤 预期实验现象
I。往A、B两支试管中分别加入5mL5%的H2O2溶液,向A试管中加入0.5g氧化铁粉末,将带火星的木条分别伸入两支试管中。 A试管中产生大量气泡,带火星的木条复燃; B试管中①_____
II。待A试管中不再产生气泡时,重新加入过氧化氢溶液,并把带火星的木条伸入试管中。 试管中产生大量气泡,带火星的木条复燃。
Ⅲ、待实验Ⅱ中不再产生气泡时,将试管中的固体剩余物过滤,洗涤、干燥、称量。 所得固体质量为②_____g
(3)请将上面表格中①②两空格的实验现象补充完整。
(4)实验II和III的目的是_____。
(5)写出氧化铁催化作用下,过氧化氢分解的化学方程式_____。
(7)分析与结论:实验小组根掘实验数据绘制了两种催化剂的实验时间与氧气体积关系图(如图)。依图分析,两种物质的催化效果是_____(填序号)。
A 催化效果基本相同 B 二氧化锰催化效果好 C 氧化铁催化效果好 D 无法判断
9.为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的速率影响效果,某研究小组进行了如下探究:
(定性研究)
(1)如图甲,可通过观察 _________________ 来定性比较两者的速率影响效果。
(定量研究)
(2)如图乙,实验前检查该装置气密性的方法是 __________________________ 。要定量比较两者的速率影响效果,可测量生成等体积气体所需的 _______________ 。
(深入研究)
(3)在FeCl3溶液中,究竟是哪种粒子影响过氧化氢的分解速率?
猜想1:水分子(H2O)影响过氧化氢的分解速率;
猜想2: ___________ 影响过氧化氢的分解速率;
猜想3: ___________ 影响过氧化氢的分解速率;……
请设计实验,验证猜想
实验操作
实验现象
实验结论
分别取同温度同体积同浓度的H2O2溶液于2支试管中,再分别加入等质量的FeCl3和NaCl。观察现象。
加入FeCl3的试管中产生的气体快,加入NaCl的试管中产生的气体慢。
证明是Fe3+影响过氧化氢的分解速率
(4)(反思与讨论)上述实验确实可以证明Fe3+可以改变过氧化氢的分解速率,但不能证明FeCl3是过氧化氢分解的催化剂。若要证明FeCl3是过氧化氢分解的催化剂,还需要通过实验证明FeCl3在反应前后 ___________________ 。
请写出FeCl3催化H2O2分解的化学方程式 ___________________________________ 。
10.某兴趣小组同学对实验室制备氧气的若干问题进行如下实验探究。
(1)为探究催化剂的种类对氯酸钾分解速度的影响,甲同学设计以下对比实验:
Ⅰ、将2.45gKClO3与1.0gMnO2均匀混合加热
Ⅱ、将xgKClO3与1.0gCuO均匀混合加热
在相同温度下,比较两组实验产生O2的快慢。通常采用的方法有:
①测相同时间内产生O2的体积
②测_____;
Ⅰ中反应的化学方程式是_____;Ⅱ中x的值应为_____。
(2)乙同学探究了影响双氧水分解速度的某种因素,实验数据记录如表:
双氧水的质量 双氧水的浓度 MnO2的质量 相同时间内产生O2的体积
I 50.0g 1% 0.1g 9mL
II 50.0g 2% 0.1g 16mL
III 50.0g 4% 0.1g 31mL
(数据处理及结论)
①本实验中,测量O2体积的装置是_____(选填下图1中“a”“b”“c”编号)。
②实验结论:在相同条件下,_____,双氧水分解速率越快。
③丙用如图2装置进行实验,通过比较_____也能达到实验目的。
2022年广州中考之与催化剂有关的实验探究题专练
1.为验证“氧化铁能加快过氧化氢制氧气的速率,其本身的化学性质在反应前后没有改变”,小红同学设计了以下实验方案:
①称取1.5g氧化铁装入试管,把带火星的木条伸入试管,观察现象。
②在上述试管中加入5mL5%过氧化氢溶液,把带火星的木条伸入试管,观察现象。
③待实验②的试管中没有现象发生时,重新加入5mL5%过氧化氢溶液,观察现象。
④待实验③的试管中又没有现象发生时,再重新加入5mL5%过氧化氢溶液,观察现象。
⑤把实验④中的氧化铁过滤出来,洗净、干燥、称量。
请回答:
(1)实验②中观察到的现象是___________,反应的化学方程式为__________。
(2)实验①至⑤中,不必进行的一个实验是__________。
(3)小明同学认为以上实验方案不完整,还需要补充实验。请你把需要补充的实验的有关内容填写在下面实验报告的空格内。
实验操作 实验现象 解释
____ ____ ___
【答案】(1) 试管中产生大量气泡,带火星木条复燃 2H2O22H2O+O2↑
(2)④
(3) 向试管中加入5mL5%过氧化氢溶液,把带火星的木条伸入试管,观察现象 试管中产生极少量的气泡,木条不复燃 没有催化剂的作用,过氧化氢分解的速率很慢
2.化学兴趣小组的同学学习了“二氧化锰在过氧化氢分解中起催化作用”后,想探究四氧化三铁能否在过氧化氢分解中起催化作用,请你一起参与他们的探究过程。
【提出问题】四氧化三铁能否作过氧化氢分解的催化剂呢?
【猜想与假设】四氧化三铁能作为过氧化氢分解的催化剂。
【进行试验】
(1)填写下表。
编号 实验操作 实验现象
① 在试管中加入过氧化氢溶液。然后将带火星的木条伸入试管中 产生少量气泡,木条不复燃
② 在装有过氧化氢溶液的试管中加入1g四氧化三铁,然后将带火星的木条伸入试管中 产生大量气泡,木条复燃
③ 待②中反应结束,将试管中的剩余物进行过滤,洗涤、干燥、称量 称得固体质量为1g
④ 将③中所得固体放入试管中,向其中加入过氧化氢溶液,然后将带火星的木条伸入试管中 _________
【实验结论】
(2)实验③④证明,四氧化三铁的________和_______在反应前后均没有发生变化,可以作为过氧化氢分解的催化剂。
(3)写出该反应的化学方程式________。
【实验拓展】
小组成员小丽通过查阅资料,结合本次实验获知FeCl3溶液、CuSO4溶液都可以代替二氧化锰作过氧化氢分解的催化剂。于是她又设计并进行了实验来比较相同浓度的FeCl3溶液和CuSO4溶液的催化效果。
(4)若用图甲装置进行实验,应观察同时滴入两种溶液后_________来判断FeCl3溶液、CuSO4溶液的催化效果。
(5)若用图乙装置进行实验,应根据________来判断FeCl3溶液、CuSO4溶液的催化效果。
【答案】(1)产生大量气泡,木条复燃 (2) 质量 化学性质
(3) (4)气泡产生速率 (5)产生相同体积氧气时所需时间
3.KClO3制O2常用MnO2作催化剂。某兴趣小组希望寻找到一种廉价易得的MnO2替代品。他们选用的替代品有:碗渣、红砖。其中碗渣和红砖经粉碎后,分成60目和30目两种颗粒大小不同的粉末,目数越高,颗粒越小。
(1)实验通过下图装置制取和收集O2,其中导管位置错误的是_____(填序号)。
(2)下表是对KClO3分解制O2的催化剂进行研究的实验数据。
编号 KClO3质量/g 催化剂 催化剂质量/g 收集O2平均速率 /mL-min-1
实验1 0.6 无 0 11.8
实验2 0.6 MnO2 0.2 28.2
实验3 0.6 碗渣粉(60目) 0.2 49.1
实验4 0.6 碗渣粉(30目) 0.2 23.7
实验5 0.6 红砖粉(x目) 0.2 28.3
实验6 0.6 红砖粉(y目) 0.2 21.1
①该实验研究了_____(填字母)这些因素对收集O2速率的影响。
A 催化剂种类 B 催化剂颗粒大小 C 催化剂质量
②实验3、4可得出催化剂目数与反应分解速率的关系是:其他条件相同时,_____。根据以上规律,请填出实验5、6中的数据x=_____,y=_____。
②表中所列催化剂的催化效果最佳的是实验_____。但由于这种物质在通常条件下难以粉碎,故选择实验_____的物质做MnO2的替代品是较为理想的,请写出这种物质催化分解KClO3的化学反应方程式_____。
【答案】 ① AB 催化剂目数越大,反应速率越快 60 30 3 5 2KClO32KCl+3O2↑
4.学习了二氧化锰对过氧化氢分解有催化作用的知识后,某同学想:氧化铜能否起到类似二氧化锰的催化作用呢?于是进行了以下探究。
【猜想】
Ⅰ、氧化铜不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ、氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变;
Ⅲ、氧化铜是反应的催化剂,反应前后_____。
【实验】天平称量0.2g氧化铜,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
(1)填写下表:
步骤③现象 步骤⑥结果 步骤⑦现象 结论
溶液中有气泡放出,带火星的木条复燃 _____ 溶液中有气泡放出,_____ 猜想Ⅰ、Ⅱ不成立; 猜想Ⅲ成立。
(2)步骤①③对比可以说明_____。
(3)步骤⑦的目的是_____。
(4)过氧化氢能被氧化铜催化分解放出氧气的文字表达式为_____。
【答案】 质量和化学性质都不变 氧化铜的质量仍然为0.2g 带火星的木条复燃 氧化铜可以加快过氧化氢分解速率 证明氧化铜化学性质不变 过氧化氢 水 + 氧气
(8分)多种物质都可催化过氧化氢分解,如MnO2、CuSO4等。实验小组的同学探究漂白液(主要成分是Na2CO3和NaC1)、FeCl3、K2SO4能否催化过氧化氢分解。
(1)MnO2催化过氧化氢分解的化学方程式是_________________________。
(2)如图所示,分别向三支试管中多次加入5%过氧化氢溶液,每次2mL,如有气泡产生,则将__________伸入试管,检验是否有氧气生成。结果如下表。
研究对象 第1次 第2次 第3次 第4次
漂白液 大量气泡 较多气泡 少量气泡 无气泡
FeCl3溶液 较多气泡 较多气泡 较多气泡 较多气泡
K2SO4溶液 ________
实验结论 i.实验中产生的气体都是氧气 (查阅得知:NaClO+H2O2=O2↑+NaCl+H2O) ii.K2SO4不能催化过氧化氢分解。 iii.________可能是过氧化氢分解的催化剂。 iv.……
(3)下列物质中,也可能是过氧化氢分解的催化剂的是________(填标号)
A. CuCl2 B. Fe2(SO4)3 C. Na2SO4 D. KCl
(4)探究不同催化剂催化效果的实验方案:将等体积5%过氧化氢溶液加到不同催化剂中,比较用排水法收集50mL氧气的快慢。请从下图中选择合适的仪器(每种仪器限用一次),组成该探究的完整实验装置,不需要用到的是________(填标号)。
答案:
带火星木条;无气泡冒出;FeCl3溶液
AB
AFH
6.化学是一门以实验为基础的科学。根据下列图示回答问题:
(1)写出仪器的名称:a______,b______。
(2)实验室用锌粒和稀硫酸制取氢气同时得到硫酸锌的化学方程式为______;若要控制反应的发生或停止,应选择的发生装置是______(填序号),利用D装置收集氢气的理由是______。
(3)某化学兴趣小组设计如表所示的对比实验来比较MnO2、CuO对过氧化氢分解的催化效果,所用实验装置如图所示。
实验序号 过氧化氢溶液 催化剂
实验1 5mL 4% 粉末状MnO20.2g
实验2 5mL 4% 粉末状CuO0.2g
①实验1中制取氧气的化学方程式为______。
②实验需要测量并记录的数据有:氧气体积和______。
③实验时,分别将过氧化氢溶液一次性注入盛有催化剂的小试管中,测量并记录数据,实验过程中发现U型管内右侧液面上升,原因是______。
④结论:MnO2对过氧化氢分解的催化效果比CuO好,得出该结论的依据是______。
【答案】锥形瓶 水槽 C 氢气的密度比空气小且不与空气中的成分反应 反应时间 反应放热 产生相同体积的氧气时MnO2所用的时间短
7.实验室也可用双氧水制氧气。某同学为研究MnO2粉末用量对双氧水分解速率的影响,做了以下实验:采用不同质量的MnO2粉末做催化剂,每次均用30mL 10% 的双氧水其他实验条件均相同,测定收集500mL氧气所用的时间,结果如表:
序号 1 2 3 4 5 6 7 8 9
MnO2用量/g 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9
所用时间/s 17 8 6 3 2 2 2 2 2
(1)该实验可得出的结论是______。
(2)若上述实验选用B做发生装置,也可以制取氧气则长颈漏斗下端管口必须浸没在液体中,原因是______。若选用C做发生装置,你认为选用装置C的优点是______。
(3)仪器1的名称______,仪器2的名称______。
(4)写出A装置制取氧气的化学方程式_________该反应属于________反应(基本反应类型)
(5)实验室需少量甲烷气体,可用加热无水醋酸钠与碱石灰两种固体混合物制得。制甲烷气体的发生装置应选用______填字母装置,收集甲烷气可选用E或F装置,由此推断甲烷气具有的物理性质是______、______,若用如图装置收集该甲烷,气体由______端通入填“a”或“b”
(6)在实验室里制取氧气,既可采用分解过氧化氢的方法,也可采用分解氯酸钾的方法。上述两种方法的主要共同点有______,分解氯酸钾的化学方程式__________。
①采用MnO2均可改变其反应速率 ②反应都不需加热
③都利用含氧物质的分解来达到目的 ④两种方法所需仪器相同。
【答案】其他条件相同时,在一定范围内MnO2粉末用量越多,双氧水分解速率越快 防止生成的氧气从长颈漏斗中逸出 控制反应的速率 长颈漏斗 水槽 分解反应 A 甲烷密度比空气小 难溶于水 a ①③
8.某实验小组对过氧化氢分解反应进行探究:
(探究一)探究影响过氧化氢分解速率的因素:
分别取 5 mL H2O2溶液进行实验,测定产生4 mL O2所需时间,实验结果记录如下表:
实验序号 H2O2溶液的浓度(%) 温度(℃) MnO2粉末用量(g) 反应时间(t)
① 30 35 0 t1
② 30 55 0 t2
③ 5 20 0.1 t3
④ 15 20 0.1 t4
(1)对比①②两个实验,若t1>t2,则可得出的结论是: _____。
(2)能证明过氧化氢分解速率与其浓度有关的实验组合是_____(填实验序号)。
(探究二)探究氧化铁(Fe2O3)能否用作过氧化氢分解的催化剂
实验步骤及现象如下:
实验步骤 预期实验现象
I。往A、B两支试管中分别加入5mL5%的H2O2溶液,向A试管中加入0.5g氧化铁粉末,将带火星的木条分别伸入两支试管中。 A试管中产生大量气泡,带火星的木条复燃; B试管中①_____
II。待A试管中不再产生气泡时,重新加入过氧化氢溶液,并把带火星的木条伸入试管中。 试管中产生大量气泡,带火星的木条复燃。
Ⅲ、待实验Ⅱ中不再产生气泡时,将试管中的固体剩余物过滤,洗涤、干燥、称量。 所得固体质量为②_____g
(3)请将上面表格中①②两空格的实验现象补充完整。
(4)实验II和III的目的是_____。
(5)写出氧化铁催化作用下,过氧化氢分解的化学方程式_____。
(7)分析与结论:实验小组根掘实验数据绘制了两种催化剂的实验时间与氧气体积关系图(如图)。依图分析,两种物质的催化效果是_____(填序号)。
A 催化效果基本相同 B 二氧化锰催化效果好 C 氧化铁催化效果好 D 无法判断
答案:略
9.为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的速率影响效果,某研究小组进行了如下探究:
(定性研究)
(1)如图甲,可通过观察 _________________ 来定性比较两者的速率影响效果。
(定量研究)
(2)如图乙,实验前检查该装置气密性的方法是 __________________________ 。要定量比较两者的速率影响效果,可测量生成等体积气体所需的 _______________ 。
(深入研究)
(3)在FeCl3溶液中,究竟是哪种粒子影响过氧化氢的分解速率?
猜想1:水分子(H2O)影响过氧化氢的分解速率;
猜想2: ___________ 影响过氧化氢的分解速率;
猜想3: ___________ 影响过氧化氢的分解速率;……
请设计实验,验证猜想
实验操作
实验现象
实验结论
分别取同温度同体积同浓度的H2O2溶液于2支试管中,再分别加入等质量的FeCl3和NaCl。观察现象。
加入FeCl3的试管中产生的气体快,加入NaCl的试管中产生的气体慢。
证明是Fe3+影响过氧化氢的分解速率
(4)(反思与讨论)上述实验确实可以证明Fe3+可以改变过氧化氢的分解速率,但不能证明FeCl3是过氧化氢分解的催化剂。若要证明FeCl3是过氧化氢分解的催化剂,还需要通过实验证明FeCl3在反应前后 ___________________ 。
请写出FeCl3催化H2O2分解的化学方程式 ___________________________________ 。
答案:略
10.某兴趣小组同学对实验室制备氧气的若干问题进行如下实验探究。
(1)为探究催化剂的种类对氯酸钾分解速度的影响,甲同学设计以下对比实验:
Ⅰ、将2.45gKClO3与1.0gMnO2均匀混合加热
Ⅱ、将xgKClO3与1.0gCuO均匀混合加热
在相同温度下,比较两组实验产生O2的快慢。通常采用的方法有:
①测相同时间内产生O2的体积
②测_____;
Ⅰ中反应的化学方程式是_____;Ⅱ中x的值应为_____。
(2)乙同学探究了影响双氧水分解速度的某种因素,实验数据记录如表:
双氧水的质量 双氧水的浓度 MnO2的质量 相同时间内产生O2的体积
I 50.0g 1% 0.1g 9mL
II 50.0g 2% 0.1g 16mL
III 50.0g 4% 0.1g 31mL
(数据处理及结论)
①本实验中,测量O2体积的装置是_____(选填下图1中“a”“b”“c”编号)。
②实验结论:在相同条件下,_____,双氧水分解速率越快。
③丙用如图2装置进行实验,通过比较_____也能达到实验目的。
答案:略
1.为验证“氧化铁能加快过氧化氢制氧气的速率,其本身的化学性质在反应前后没有改变”,小红同学设计了以下实验方案:
①称取1.5g氧化铁装入试管,把带火星的木条伸入试管,观察现象。
②在上述试管中加入5mL5%过氧化氢溶液,把带火星的木条伸入试管,观察现象。
③待实验②的试管中没有现象发生时,重新加入5mL5%过氧化氢溶液,观察现象。
④待实验③的试管中又没有现象发生时,再重新加入5mL5%过氧化氢溶液,观察现象。
⑤把实验④中的氧化铁过滤出来,洗净、干燥、称量。
请回答:
(1)实验②中观察到的现象是___________,反应的化学方程式为__________。
(2)实验①至⑤中,不必进行的一个实验是__________。
(3)小明同学认为以上实验方案不完整,还需要补充实验。请你把需要补充的实验的有关内容填写在下面实验报告的空格内。
实验操作 实验现象 解释
____ ____ ___
2.化学兴趣小组的同学学习了“二氧化锰在过氧化氢分解中起催化作用”后,想探究四氧化三铁能否在过氧化氢分解中起催化作用,请你一起参与他们的探究过程。
【提出问题】四氧化三铁能否作过氧化氢分解的催化剂呢?
【猜想与假设】四氧化三铁能作为过氧化氢分解的催化剂。
【进行试验】
(1)填写下表。
编号 实验操作 实验现象
① 在试管中加入过氧化氢溶液。然后将带火星的木条伸入试管中 产生少量气泡,木条不复燃
② 在装有过氧化氢溶液的试管中加入1g四氧化三铁,然后将带火星的木条伸入试管中 产生大量气泡,木条复燃
③ 待②中反应结束,将试管中的剩余物进行过滤,洗涤、干燥、称量 称得固体质量为1g
④ 将③中所得固体放入试管中,向其中加入过氧化氢溶液,然后将带火星的木条伸入试管中 _________
【实验结论】
(2)实验③④证明,四氧化三铁的________和_______在反应前后均没有发生变化,可以作为过氧化氢分解的催化剂。
(3)写出该反应的化学方程式________。
【实验拓展】
小组成员小丽通过查阅资料,结合本次实验获知FeCl3溶液、CuSO4溶液都可以代替二氧化锰作过氧化氢分解的催化剂。于是她又设计并进行了实验来比较相同浓度的FeCl3溶液和CuSO4溶液的催化效果。
(4)若用图甲装置进行实验,应观察同时滴入两种溶液后_________来判断FeCl3溶液、CuSO4溶液的催化效果。
(5)若用图乙装置进行实验,应根据________来判断FeCl3溶液、CuSO4溶液的催化效果。
3.KClO3制O2常用MnO2作催化剂。某兴趣小组希望寻找到一种廉价易得的MnO2替代品。他们选用的替代品有:碗渣、红砖。其中碗渣和红砖经粉碎后,分成60目和30目两种颗粒大小不同的粉末,目数越高,颗粒越小。
(1)实验通过下图装置制取和收集O2,其中导管位置错误的是_____(填序号)。
(2)下表是对KClO3分解制O2的催化剂进行研究的实验数据。
编号 KClO3质量/g 催化剂 催化剂质量/g 收集O2平均速率 /mL-min-1
实验1 0.6 无 0 11.8
实验2 0.6 MnO2 0.2 28.2
实验3 0.6 碗渣粉(60目) 0.2 49.1
实验4 0.6 碗渣粉(30目) 0.2 23.7
实验5 0.6 红砖粉(x目) 0.2 28.3
实验6 0.6 红砖粉(y目) 0.2 21.1
①该实验研究了_____(填字母)这些因素对收集O2速率的影响。
A 催化剂种类 B 催化剂颗粒大小 C 催化剂质量
②实验3、4可得出催化剂目数与反应分解速率的关系是:其他条件相同时,_____。根据以上规律,请填出实验5、6中的数据x=_____,y=_____。
②表中所列催化剂的催化效果最佳的是实验_____。但由于这种物质在通常条件下难以粉碎,故选择实验_____的物质做MnO2的替代品是较为理想的,请写出这种物质催化分解KClO3的化学反应方程式_____。
4.学习了二氧化锰对过氧化氢分解有催化作用的知识后,某同学想:氧化铜能否起到类似二氧化锰的催化作用呢?于是进行了以下探究。
【猜想】
Ⅰ、氧化铜不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ、氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变;
Ⅲ、氧化铜是反应的催化剂,反应前后_____。
【实验】天平称量0.2g氧化铜,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
(1)填写下表:
步骤③现象 步骤⑥结果 步骤⑦现象 结论
溶液中有气泡放出,带火星的木条复燃 _____ 溶液中有气泡放出,_____ 猜想Ⅰ、Ⅱ不成立; 猜想Ⅲ成立。
(2)步骤①③对比可以说明_____。
(3)步骤⑦的目的是_____。
(4)过氧化氢能被氧化铜催化分解放出氧气的文字表达式为_____。
(8分)多种物质都可催化过氧化氢分解,如MnO2、CuSO4等。实验小组的同学探究漂白液(主要成分是Na2CO3和NaC1)、FeCl3、K2SO4能否催化过氧化氢分解。
(1)MnO2催化过氧化氢分解的化学方程式是_________________________。
(2)如图所示,分别向三支试管中多次加入5%过氧化氢溶液,每次2mL,如有气泡产生,则将__________伸入试管,检验是否有氧气生成。结果如下表。
研究对象 第1次 第2次 第3次 第4次
漂白液 大量气泡 较多气泡 少量气泡 无气泡
FeCl3溶液 较多气泡 较多气泡 较多气泡 较多气泡
K2SO4溶液 ________
实验结论 i.实验中产生的气体都是氧气 (查阅得知:NaClO+H2O2=O2↑+NaCl+H2O) ii.K2SO4不能催化过氧化氢分解。 iii.________可能是过氧化氢分解的催化剂。 iv.……
(3)下列物质中,也可能是过氧化氢分解的催化剂的是________(填标号)
A. CuCl2 B. Fe2(SO4)3 C. Na2SO4 D. KCl
(4)探究不同催化剂催化效果的实验方案:将等体积5%过氧化氢溶液加到不同催化剂中,比较用排水法收集50mL氧气的快慢。请从下图中选择合适的仪器(每种仪器限用一次),组成该探究的完整实验装置,不需要用到的是________(填标号)。
6.化学是一门以实验为基础的科学。根据下列图示回答问题:
(1)写出仪器的名称:a______,b______。
(2)实验室用锌粒和稀硫酸制取氢气同时得到硫酸锌的化学方程式为______;若要控制反应的发生或停止,应选择的发生装置是______(填序号),利用D装置收集氢气的理由是______。
(3)某化学兴趣小组设计如表所示的对比实验来比较MnO2、CuO对过氧化氢分解的催化效果,所用实验装置如图所示。
实验序号 过氧化氢溶液 催化剂
实验1 5mL 4% 粉末状MnO20.2g
实验2 5mL 4% 粉末状CuO0.2g
①实验1中制取氧气的化学方程式为______。
②实验需要测量并记录的数据有:氧气体积和______。
③实验时,分别将过氧化氢溶液一次性注入盛有催化剂的小试管中,测量并记录数据,实验过程中发现U型管内右侧液面上升,原因是______。
④结论:MnO2对过氧化氢分解的催化效果比CuO好,得出该结论的依据是______。
7.实验室也可用双氧水制氧气。某同学为研究MnO2粉末用量对双氧水分解速率的影响,做了以下实验:采用不同质量的MnO2粉末做催化剂,每次均用30mL 10% 的双氧水其他实验条件均相同,测定收集500mL氧气所用的时间,结果如表:
序号 1 2 3 4 5 6 7 8 9
MnO2用量/g 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9
所用时间/s 17 8 6 3 2 2 2 2 2
(1)该实验可得出的结论是______。
(2)若上述实验选用B做发生装置,也可以制取氧气则长颈漏斗下端管口必须浸没在液体中,原因是______。若选用C做发生装置,你认为选用装置C的优点是______。
(3)仪器1的名称______,仪器2的名称______。
(4)写出A装置制取氧气的化学方程式_________该反应属于________反应(基本反应类型)
(5)实验室需少量甲烷气体,可用加热无水醋酸钠与碱石灰两种固体混合物制得。制甲烷气体的发生装置应选用______填字母装置,收集甲烷气可选用E或F装置,由此推断甲烷气具有的物理性质是______、______,若用如图装置收集该甲烷,气体由______端通入填“a”或“b”
(6)在实验室里制取氧气,既可采用分解过氧化氢的方法,也可采用分解氯酸钾的方法。上述两种方法的主要共同点有______,分解氯酸钾的化学方程式__________。
①采用MnO2均可改变其反应速率 ②反应都不需加热
③都利用含氧物质的分解来达到目的 ④两种方法所需仪器相同。
8.某实验小组对过氧化氢分解反应进行探究:
(探究一)探究影响过氧化氢分解速率的因素:
分别取 5 mL H2O2溶液进行实验,测定产生4 mL O2所需时间,实验结果记录如下表:
实验序号 H2O2溶液的浓度(%) 温度(℃) MnO2粉末用量(g) 反应时间(t)
① 30 35 0 t1
② 30 55 0 t2
③ 5 20 0.1 t3
④ 15 20 0.1 t4
(1)对比①②两个实验,若t1>t2,则可得出的结论是: _____。
(2)能证明过氧化氢分解速率与其浓度有关的实验组合是_____(填实验序号)。
(探究二)探究氧化铁(Fe2O3)能否用作过氧化氢分解的催化剂
实验步骤及现象如下:
实验步骤 预期实验现象
I。往A、B两支试管中分别加入5mL5%的H2O2溶液,向A试管中加入0.5g氧化铁粉末,将带火星的木条分别伸入两支试管中。 A试管中产生大量气泡,带火星的木条复燃; B试管中①_____
II。待A试管中不再产生气泡时,重新加入过氧化氢溶液,并把带火星的木条伸入试管中。 试管中产生大量气泡,带火星的木条复燃。
Ⅲ、待实验Ⅱ中不再产生气泡时,将试管中的固体剩余物过滤,洗涤、干燥、称量。 所得固体质量为②_____g
(3)请将上面表格中①②两空格的实验现象补充完整。
(4)实验II和III的目的是_____。
(5)写出氧化铁催化作用下,过氧化氢分解的化学方程式_____。
(7)分析与结论:实验小组根掘实验数据绘制了两种催化剂的实验时间与氧气体积关系图(如图)。依图分析,两种物质的催化效果是_____(填序号)。
A 催化效果基本相同 B 二氧化锰催化效果好 C 氧化铁催化效果好 D 无法判断
9.为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的速率影响效果,某研究小组进行了如下探究:
(定性研究)
(1)如图甲,可通过观察 _________________ 来定性比较两者的速率影响效果。
(定量研究)
(2)如图乙,实验前检查该装置气密性的方法是 __________________________ 。要定量比较两者的速率影响效果,可测量生成等体积气体所需的 _______________ 。
(深入研究)
(3)在FeCl3溶液中,究竟是哪种粒子影响过氧化氢的分解速率?
猜想1:水分子(H2O)影响过氧化氢的分解速率;
猜想2: ___________ 影响过氧化氢的分解速率;
猜想3: ___________ 影响过氧化氢的分解速率;……
请设计实验,验证猜想
实验操作
实验现象
实验结论
分别取同温度同体积同浓度的H2O2溶液于2支试管中,再分别加入等质量的FeCl3和NaCl。观察现象。
加入FeCl3的试管中产生的气体快,加入NaCl的试管中产生的气体慢。
证明是Fe3+影响过氧化氢的分解速率
(4)(反思与讨论)上述实验确实可以证明Fe3+可以改变过氧化氢的分解速率,但不能证明FeCl3是过氧化氢分解的催化剂。若要证明FeCl3是过氧化氢分解的催化剂,还需要通过实验证明FeCl3在反应前后 ___________________ 。
请写出FeCl3催化H2O2分解的化学方程式 ___________________________________ 。
10.某兴趣小组同学对实验室制备氧气的若干问题进行如下实验探究。
(1)为探究催化剂的种类对氯酸钾分解速度的影响,甲同学设计以下对比实验:
Ⅰ、将2.45gKClO3与1.0gMnO2均匀混合加热
Ⅱ、将xgKClO3与1.0gCuO均匀混合加热
在相同温度下,比较两组实验产生O2的快慢。通常采用的方法有:
①测相同时间内产生O2的体积
②测_____;
Ⅰ中反应的化学方程式是_____;Ⅱ中x的值应为_____。
(2)乙同学探究了影响双氧水分解速度的某种因素,实验数据记录如表:
双氧水的质量 双氧水的浓度 MnO2的质量 相同时间内产生O2的体积
I 50.0g 1% 0.1g 9mL
II 50.0g 2% 0.1g 16mL
III 50.0g 4% 0.1g 31mL
(数据处理及结论)
①本实验中,测量O2体积的装置是_____(选填下图1中“a”“b”“c”编号)。
②实验结论:在相同条件下,_____,双氧水分解速率越快。
③丙用如图2装置进行实验,通过比较_____也能达到实验目的。
2022年广州中考之与催化剂有关的实验探究题专练
1.为验证“氧化铁能加快过氧化氢制氧气的速率,其本身的化学性质在反应前后没有改变”,小红同学设计了以下实验方案:
①称取1.5g氧化铁装入试管,把带火星的木条伸入试管,观察现象。
②在上述试管中加入5mL5%过氧化氢溶液,把带火星的木条伸入试管,观察现象。
③待实验②的试管中没有现象发生时,重新加入5mL5%过氧化氢溶液,观察现象。
④待实验③的试管中又没有现象发生时,再重新加入5mL5%过氧化氢溶液,观察现象。
⑤把实验④中的氧化铁过滤出来,洗净、干燥、称量。
请回答:
(1)实验②中观察到的现象是___________,反应的化学方程式为__________。
(2)实验①至⑤中,不必进行的一个实验是__________。
(3)小明同学认为以上实验方案不完整,还需要补充实验。请你把需要补充的实验的有关内容填写在下面实验报告的空格内。
实验操作 实验现象 解释
____ ____ ___
【答案】(1) 试管中产生大量气泡,带火星木条复燃 2H2O22H2O+O2↑
(2)④
(3) 向试管中加入5mL5%过氧化氢溶液,把带火星的木条伸入试管,观察现象 试管中产生极少量的气泡,木条不复燃 没有催化剂的作用,过氧化氢分解的速率很慢
2.化学兴趣小组的同学学习了“二氧化锰在过氧化氢分解中起催化作用”后,想探究四氧化三铁能否在过氧化氢分解中起催化作用,请你一起参与他们的探究过程。
【提出问题】四氧化三铁能否作过氧化氢分解的催化剂呢?
【猜想与假设】四氧化三铁能作为过氧化氢分解的催化剂。
【进行试验】
(1)填写下表。
编号 实验操作 实验现象
① 在试管中加入过氧化氢溶液。然后将带火星的木条伸入试管中 产生少量气泡,木条不复燃
② 在装有过氧化氢溶液的试管中加入1g四氧化三铁,然后将带火星的木条伸入试管中 产生大量气泡,木条复燃
③ 待②中反应结束,将试管中的剩余物进行过滤,洗涤、干燥、称量 称得固体质量为1g
④ 将③中所得固体放入试管中,向其中加入过氧化氢溶液,然后将带火星的木条伸入试管中 _________
【实验结论】
(2)实验③④证明,四氧化三铁的________和_______在反应前后均没有发生变化,可以作为过氧化氢分解的催化剂。
(3)写出该反应的化学方程式________。
【实验拓展】
小组成员小丽通过查阅资料,结合本次实验获知FeCl3溶液、CuSO4溶液都可以代替二氧化锰作过氧化氢分解的催化剂。于是她又设计并进行了实验来比较相同浓度的FeCl3溶液和CuSO4溶液的催化效果。
(4)若用图甲装置进行实验,应观察同时滴入两种溶液后_________来判断FeCl3溶液、CuSO4溶液的催化效果。
(5)若用图乙装置进行实验,应根据________来判断FeCl3溶液、CuSO4溶液的催化效果。
【答案】(1)产生大量气泡,木条复燃 (2) 质量 化学性质
(3) (4)气泡产生速率 (5)产生相同体积氧气时所需时间
3.KClO3制O2常用MnO2作催化剂。某兴趣小组希望寻找到一种廉价易得的MnO2替代品。他们选用的替代品有:碗渣、红砖。其中碗渣和红砖经粉碎后,分成60目和30目两种颗粒大小不同的粉末,目数越高,颗粒越小。
(1)实验通过下图装置制取和收集O2,其中导管位置错误的是_____(填序号)。
(2)下表是对KClO3分解制O2的催化剂进行研究的实验数据。
编号 KClO3质量/g 催化剂 催化剂质量/g 收集O2平均速率 /mL-min-1
实验1 0.6 无 0 11.8
实验2 0.6 MnO2 0.2 28.2
实验3 0.6 碗渣粉(60目) 0.2 49.1
实验4 0.6 碗渣粉(30目) 0.2 23.7
实验5 0.6 红砖粉(x目) 0.2 28.3
实验6 0.6 红砖粉(y目) 0.2 21.1
①该实验研究了_____(填字母)这些因素对收集O2速率的影响。
A 催化剂种类 B 催化剂颗粒大小 C 催化剂质量
②实验3、4可得出催化剂目数与反应分解速率的关系是:其他条件相同时,_____。根据以上规律,请填出实验5、6中的数据x=_____,y=_____。
②表中所列催化剂的催化效果最佳的是实验_____。但由于这种物质在通常条件下难以粉碎,故选择实验_____的物质做MnO2的替代品是较为理想的,请写出这种物质催化分解KClO3的化学反应方程式_____。
【答案】 ① AB 催化剂目数越大,反应速率越快 60 30 3 5 2KClO32KCl+3O2↑
4.学习了二氧化锰对过氧化氢分解有催化作用的知识后,某同学想:氧化铜能否起到类似二氧化锰的催化作用呢?于是进行了以下探究。
【猜想】
Ⅰ、氧化铜不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ、氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变;
Ⅲ、氧化铜是反应的催化剂,反应前后_____。
【实验】天平称量0.2g氧化铜,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
(1)填写下表:
步骤③现象 步骤⑥结果 步骤⑦现象 结论
溶液中有气泡放出,带火星的木条复燃 _____ 溶液中有气泡放出,_____ 猜想Ⅰ、Ⅱ不成立; 猜想Ⅲ成立。
(2)步骤①③对比可以说明_____。
(3)步骤⑦的目的是_____。
(4)过氧化氢能被氧化铜催化分解放出氧气的文字表达式为_____。
【答案】 质量和化学性质都不变 氧化铜的质量仍然为0.2g 带火星的木条复燃 氧化铜可以加快过氧化氢分解速率 证明氧化铜化学性质不变 过氧化氢 水 + 氧气
(8分)多种物质都可催化过氧化氢分解,如MnO2、CuSO4等。实验小组的同学探究漂白液(主要成分是Na2CO3和NaC1)、FeCl3、K2SO4能否催化过氧化氢分解。
(1)MnO2催化过氧化氢分解的化学方程式是_________________________。
(2)如图所示,分别向三支试管中多次加入5%过氧化氢溶液,每次2mL,如有气泡产生,则将__________伸入试管,检验是否有氧气生成。结果如下表。
研究对象 第1次 第2次 第3次 第4次
漂白液 大量气泡 较多气泡 少量气泡 无气泡
FeCl3溶液 较多气泡 较多气泡 较多气泡 较多气泡
K2SO4溶液 ________
实验结论 i.实验中产生的气体都是氧气 (查阅得知:NaClO+H2O2=O2↑+NaCl+H2O) ii.K2SO4不能催化过氧化氢分解。 iii.________可能是过氧化氢分解的催化剂。 iv.……
(3)下列物质中,也可能是过氧化氢分解的催化剂的是________(填标号)
A. CuCl2 B. Fe2(SO4)3 C. Na2SO4 D. KCl
(4)探究不同催化剂催化效果的实验方案:将等体积5%过氧化氢溶液加到不同催化剂中,比较用排水法收集50mL氧气的快慢。请从下图中选择合适的仪器(每种仪器限用一次),组成该探究的完整实验装置,不需要用到的是________(填标号)。
答案:
带火星木条;无气泡冒出;FeCl3溶液
AB
AFH
6.化学是一门以实验为基础的科学。根据下列图示回答问题:
(1)写出仪器的名称:a______,b______。
(2)实验室用锌粒和稀硫酸制取氢气同时得到硫酸锌的化学方程式为______;若要控制反应的发生或停止,应选择的发生装置是______(填序号),利用D装置收集氢气的理由是______。
(3)某化学兴趣小组设计如表所示的对比实验来比较MnO2、CuO对过氧化氢分解的催化效果,所用实验装置如图所示。
实验序号 过氧化氢溶液 催化剂
实验1 5mL 4% 粉末状MnO20.2g
实验2 5mL 4% 粉末状CuO0.2g
①实验1中制取氧气的化学方程式为______。
②实验需要测量并记录的数据有:氧气体积和______。
③实验时,分别将过氧化氢溶液一次性注入盛有催化剂的小试管中,测量并记录数据,实验过程中发现U型管内右侧液面上升,原因是______。
④结论:MnO2对过氧化氢分解的催化效果比CuO好,得出该结论的依据是______。
【答案】锥形瓶 水槽 C 氢气的密度比空气小且不与空气中的成分反应 反应时间 反应放热 产生相同体积的氧气时MnO2所用的时间短
7.实验室也可用双氧水制氧气。某同学为研究MnO2粉末用量对双氧水分解速率的影响,做了以下实验:采用不同质量的MnO2粉末做催化剂,每次均用30mL 10% 的双氧水其他实验条件均相同,测定收集500mL氧气所用的时间,结果如表:
序号 1 2 3 4 5 6 7 8 9
MnO2用量/g 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9
所用时间/s 17 8 6 3 2 2 2 2 2
(1)该实验可得出的结论是______。
(2)若上述实验选用B做发生装置,也可以制取氧气则长颈漏斗下端管口必须浸没在液体中,原因是______。若选用C做发生装置,你认为选用装置C的优点是______。
(3)仪器1的名称______,仪器2的名称______。
(4)写出A装置制取氧气的化学方程式_________该反应属于________反应(基本反应类型)
(5)实验室需少量甲烷气体,可用加热无水醋酸钠与碱石灰两种固体混合物制得。制甲烷气体的发生装置应选用______填字母装置,收集甲烷气可选用E或F装置,由此推断甲烷气具有的物理性质是______、______,若用如图装置收集该甲烷,气体由______端通入填“a”或“b”
(6)在实验室里制取氧气,既可采用分解过氧化氢的方法,也可采用分解氯酸钾的方法。上述两种方法的主要共同点有______,分解氯酸钾的化学方程式__________。
①采用MnO2均可改变其反应速率 ②反应都不需加热
③都利用含氧物质的分解来达到目的 ④两种方法所需仪器相同。
【答案】其他条件相同时,在一定范围内MnO2粉末用量越多,双氧水分解速率越快 防止生成的氧气从长颈漏斗中逸出 控制反应的速率 长颈漏斗 水槽 分解反应 A 甲烷密度比空气小 难溶于水 a ①③
8.某实验小组对过氧化氢分解反应进行探究:
(探究一)探究影响过氧化氢分解速率的因素:
分别取 5 mL H2O2溶液进行实验,测定产生4 mL O2所需时间,实验结果记录如下表:
实验序号 H2O2溶液的浓度(%) 温度(℃) MnO2粉末用量(g) 反应时间(t)
① 30 35 0 t1
② 30 55 0 t2
③ 5 20 0.1 t3
④ 15 20 0.1 t4
(1)对比①②两个实验,若t1>t2,则可得出的结论是: _____。
(2)能证明过氧化氢分解速率与其浓度有关的实验组合是_____(填实验序号)。
(探究二)探究氧化铁(Fe2O3)能否用作过氧化氢分解的催化剂
实验步骤及现象如下:
实验步骤 预期实验现象
I。往A、B两支试管中分别加入5mL5%的H2O2溶液,向A试管中加入0.5g氧化铁粉末,将带火星的木条分别伸入两支试管中。 A试管中产生大量气泡,带火星的木条复燃; B试管中①_____
II。待A试管中不再产生气泡时,重新加入过氧化氢溶液,并把带火星的木条伸入试管中。 试管中产生大量气泡,带火星的木条复燃。
Ⅲ、待实验Ⅱ中不再产生气泡时,将试管中的固体剩余物过滤,洗涤、干燥、称量。 所得固体质量为②_____g
(3)请将上面表格中①②两空格的实验现象补充完整。
(4)实验II和III的目的是_____。
(5)写出氧化铁催化作用下,过氧化氢分解的化学方程式_____。
(7)分析与结论:实验小组根掘实验数据绘制了两种催化剂的实验时间与氧气体积关系图(如图)。依图分析,两种物质的催化效果是_____(填序号)。
A 催化效果基本相同 B 二氧化锰催化效果好 C 氧化铁催化效果好 D 无法判断
答案:略
9.为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的速率影响效果,某研究小组进行了如下探究:
(定性研究)
(1)如图甲,可通过观察 _________________ 来定性比较两者的速率影响效果。
(定量研究)
(2)如图乙,实验前检查该装置气密性的方法是 __________________________ 。要定量比较两者的速率影响效果,可测量生成等体积气体所需的 _______________ 。
(深入研究)
(3)在FeCl3溶液中,究竟是哪种粒子影响过氧化氢的分解速率?
猜想1:水分子(H2O)影响过氧化氢的分解速率;
猜想2: ___________ 影响过氧化氢的分解速率;
猜想3: ___________ 影响过氧化氢的分解速率;……
请设计实验,验证猜想
实验操作
实验现象
实验结论
分别取同温度同体积同浓度的H2O2溶液于2支试管中,再分别加入等质量的FeCl3和NaCl。观察现象。
加入FeCl3的试管中产生的气体快,加入NaCl的试管中产生的气体慢。
证明是Fe3+影响过氧化氢的分解速率
(4)(反思与讨论)上述实验确实可以证明Fe3+可以改变过氧化氢的分解速率,但不能证明FeCl3是过氧化氢分解的催化剂。若要证明FeCl3是过氧化氢分解的催化剂,还需要通过实验证明FeCl3在反应前后 ___________________ 。
请写出FeCl3催化H2O2分解的化学方程式 ___________________________________ 。
答案:略
10.某兴趣小组同学对实验室制备氧气的若干问题进行如下实验探究。
(1)为探究催化剂的种类对氯酸钾分解速度的影响,甲同学设计以下对比实验:
Ⅰ、将2.45gKClO3与1.0gMnO2均匀混合加热
Ⅱ、将xgKClO3与1.0gCuO均匀混合加热
在相同温度下,比较两组实验产生O2的快慢。通常采用的方法有:
①测相同时间内产生O2的体积
②测_____;
Ⅰ中反应的化学方程式是_____;Ⅱ中x的值应为_____。
(2)乙同学探究了影响双氧水分解速度的某种因素,实验数据记录如表:
双氧水的质量 双氧水的浓度 MnO2的质量 相同时间内产生O2的体积
I 50.0g 1% 0.1g 9mL
II 50.0g 2% 0.1g 16mL
III 50.0g 4% 0.1g 31mL
(数据处理及结论)
①本实验中,测量O2体积的装置是_____(选填下图1中“a”“b”“c”编号)。
②实验结论:在相同条件下,_____,双氧水分解速率越快。
③丙用如图2装置进行实验,通过比较_____也能达到实验目的。
答案:略
同课章节目录
