2021-2022学年高二化学苏教版(2019)选择性必修2-3.3共价键共价晶体一课一练(word版含解析)
文档属性
| 名称 | 2021-2022学年高二化学苏教版(2019)选择性必修2-3.3共价键共价晶体一课一练(word版含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 272.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-27 18:21:51 | ||
图片预览




文档简介
3.3共价键 共价晶体——一课一练2021-2022学年高中化学苏教版(2020)选择性必修2
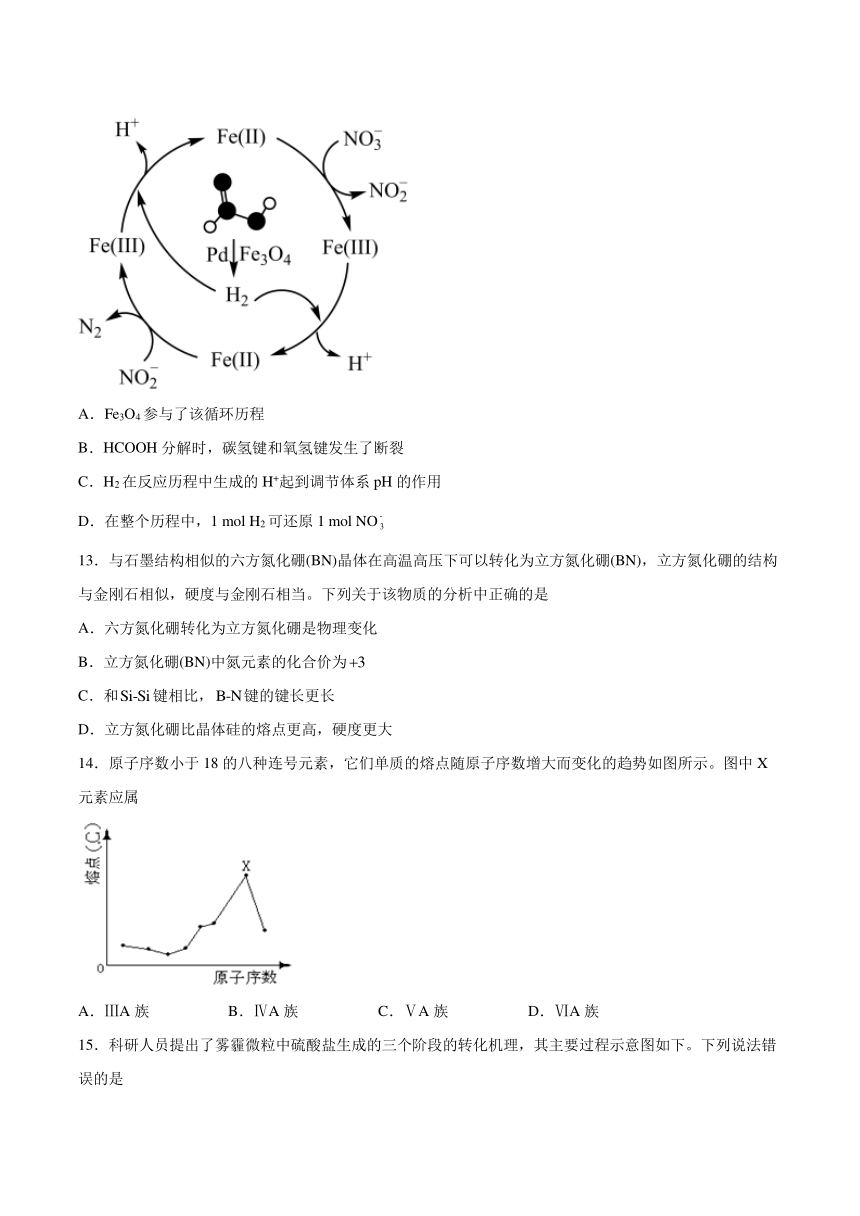
一、选择题(共15题)
1.下列物质中只含有共价键的是
A.Na2O B.NaCl C.H2O D.NaOH
2.下列分子中所有原子都满足最外层为8电子结构的是
A. B. C. D.
3.下列物质中,既含有离子键又含有共价键的是
A.KOH B.KCl C.H2O D.H2
4.(g) (g)+ H2(g) △H = +124 kJ mol-1。已知:部分化学键的键能如下,则X值为
化学键 C-H C-C C=C H-H
键能/kJ·mol-1 412 348 X 436
A.264 B.536 C.612 D.696
5.NA为阿伏伽德罗常数的值。下列说法正确的是
A.1 mol Cl2与足量 Fe 反应转移电子数一定为 3NA
B.60g SiO2中含有共价键数为 2NA
C.28g N2中含有π键总数为 2NA
D.密闭容器中 2molNO 与 1molO2充分反应,产物的分子数为 2NA
6.下列物质属于共价化合物的是
A.KCl B.H2 C.H2SO4 D.Cl2
7.含有共价键的盐是
A.CaCl2 B.NaClO C.Mg3N2 D.NaOH
8.降低硫含量是裂化汽油精制处理的关键。S—Zorb技术使用Ni/ZnO作脱硫吸附剂脱除噻吩()中硫原子的过程如图。
下列说法不正确的是
A.过程①涉及极性键和非极性键的断裂
B.过程③通入O2的主要目的是将ZnS转化为ZnO和SO2
C.过程③中参加反应的O2和ZnS的物质的量之比是3∶2
D.过程④通入H2的主要目的是使脱硫吸附剂再生
9.短周期主族元素A、B、C、D、E的原子序数依次增大,A、B、C三种元素组成的化合物为强碱;化合物D2E2是一种具有难闻气味的黄红色液体,与其他元素组成的物质有如下转化关系:2D2E2+2A2B=DB2↑+□↓+4AE(方框代表一种生成物)。下列说法不正确的是
A.DB2能使紫色石蕊变色
B.简单阴离子还原性:D>E>A
C.D2E2分子中既存在极性键又存在非极性键
D.上述方程式所涉物质中的□存在多种同素异形体
10.下列物质中,只含有非极性键的是
A. B. C. D.
11.下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是
A.Cl2+H2O=HClO+HCl
B.2Na2O2+2H2O=4NaOH+O2↑
C.NH4Cl+NaOHNaCl+NH3↑+H2O
D.2FeCl2+H2O2+2HCl=2FeCl3+2H2O
12.硝酸盐污染已成为一个日益严重的环境问题。甲酸( HCOOH)在纳米级Pd表面分解为活性H2和CO2,再经下列历程实现NO的催化还原,进而减少污染。已知Fe( II)、Fe(III)表示Fe3O4中二价铁和三价铁。下列说法错误的是
A.Fe3O4参与了该循环历程
B.HCOOH分解时,碳氢键和氧氢键发生了断裂
C.H2在反应历程中生成的H+起到调节体系pH的作用
D.在整个历程中,1 mol H2可还原1 mol NO
13.与石墨结构相似的六方氮化硼(BN)晶体在高温高压下可以转化为立方氮化硼(BN),立方氮化硼的结构与金刚石相似,硬度与金刚石相当。下列关于该物质的分析中正确的是
A.六方氮化硼转化为立方氮化硼是物理变化
B.立方氮化硼(BN)中氮元素的化合价为
C.和键相比,键的键长更长
D.立方氮化硼比晶体硅的熔点更高,硬度更大
14.原子序数小于18的八种连号元素,它们单质的熔点随原子序数增大而变化的趋势如图所示。图中X元素应属
A.ⅢA族 B.ⅣA族 C.ⅤA族 D.ⅥA族
15.科研人员提出了雾霾微粒中硫酸盐生成的三个阶段的转化机理,其主要过程示意图如下。下列说法错误的是
A.氧化性:,还原性:
B.第Ⅱ、Ⅲ阶段总的化学方程式为:
C.该过程中为中间产物
D.上述反应过程中,的成键数目保持不变
二、填空题(共4题)
16.工业上最早在19世纪中叶便已生产的过氧化氢,目前成为社会需求量迅速增长的化学品,因为它有较强的氧化性,通常用于污水处理中,氧化除去水中的杂质。在过氧化氢分子中,有1个过氧键:-O-O-,每个氧原子再连接一个氢原子。纯的过氧化氢为蓝色的粘稠状液体,沸点是152.1℃,冰点是-0.89℃。
(1)过氧化氢的电子式为___________;
(2)过氧化氢是___________化合物(离子或共价);
(3)在低于-0.89℃时,过氧化氢是一种蓝色___________态物质,组成它的基本微粒是___________。
A.H2O2 B.H和O C.H2和O2 D.H和O2
17.元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)第三周期元素的原子所形成的简单离子中:半径最大的阴离子是__;氧化性最强的阳离子是__.
(2)下列事实可以作为S和Cl非金属性强弱的判断依据的是__(选填序号)
a.Cl的最高正价比S高 b.可用浓H2SO4制HCl
c.HCl的酸性比H2S强 d.Cl2与H2S反应生成S.
(3)硅元素最外层有__种能量不同的电子;SiCl4的空间构型和CH4相同,写出SiCl4的电子式:__.
(4)PH3和NH3的某些化学性质相似.下列对晶体PH4I性质的推测,错误的是__(选填序号)
a.PH4I是一种共价化合物 b.PH4I能与烧碱溶液反应
c.PH4I加热后会发生升华 d.PH4I溶液能与溴水反应.
(5)二氯化二硫(S2C12)可用作橡胶工业的硫化剂,它的分子结构与H2O2相似.下列有关说法不正确的是__(选填序号)
a.S2C12分子中有4对共用电子对
b.S2C12分子中没有非极性键
c.S2C12分子中,S为+1价,Cl为﹣1价
d.S2C12分子中各原子均为8电子稳定结构.
18.分子筛是一一种天然或人工合成的泡沸石型水合铝硅酸盐晶体。人工合成的分子筛有几十种,皆为骨架型结构,其中最常用的是A型、X型、Y型和丝光沸石型分子筛,化学组成可表示为Mm[AlpSiqOm(p+q)]·xH2O。
(1)Si4+、Al3+和O2-的离子半径分别为41 pm、50 pm和140 pm,通过计算说明在水合铝硅酸盐晶体中Si4+和Al3+各占据由氧构成的何种类型的多面体空隙。
Si4+ Al3+
_____ ______
(2)上述化学式中的n=____,说明理由_____。若M为2价离子,写出m与p的关系式___。
(3) X光衍射测得Si-O键键长为160 pm。此数据说明_____。如何理解_____。
(4)说明以下事实的原因 。
①铝比(有时用SiO2/Al2O3表示)越高,分子筛越稳定;
②最小硅铝比不小于1。
(5)人工合成的A型分子筛钠盐,属于立方晶系,正当晶胞参数a=2464 pm,晶胞组成为Na96[Al96Si96O384]·xH2O。将811.5克该分子筛在1.01325 ×105 Pa、700°C加热6小时将结晶水完全除去,得到798.6升水蒸气(视为理想气体)。计算该分子筛的密度D=___。
19.安全气囊是行车安全的重要设施。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客。为研究安全气囊工作的化学原理,取安全装置中的粉末进行研究。经实验分析,确定该粉末是一种混合物且只含Na、Fe、N、O四种元素。
(1)氧元素在元素周期表中的位置是__________________,Na原子结构示意图为_____________,其中三种主族元素的离子半径从大到小的顺序是___________________(用离子符号表示)。
(2)氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐,该盐晶体中含有的化学键类型是____________________。
(3)水溶性实验表明,安全气囊中固体粉末部分溶解,不溶物为一种红棕色固体,可溶于盐酸,写出反应的化学方程式_______________________________________________。
三、综合题(共4题)
20.(1)近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+ Cl2(g) ΔH1=83 kJ·mol 1
CuCl(s)+O2(g)=CuO(s)+Cl2(g) ΔH2= 20 kJ·mol 1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3= 121 kJ·mol 1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol 1。其中O2的电子式为__________
(2)硅粉与HCl在300℃时反应生成1mol SiHCl3气体和H2 ,放出225KJ热量,该反应的热化学方程式为________________________。SiHCl3中含有的化学键类型为__________
(3)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g)SiHCl3(g)+HCl(g) ΔH1>0
②3SiCl4(g)+2H2(g)+Si(s)4SiHCl3(g) ΔH2<0
③2SiCl4(g)+H2(g)+Si(s)+HCl(g)3SiHCl3(g) ΔH3
则反应③的ΔH3______(用ΔH1,ΔH2表示)。
(4)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与Na2SO3反应制得.请写出反应的离子方程式________________________
(5)氯化铵常用作焊接.如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:_______CuO+______NH4Cl______Cu+______CuCl2+______N2↑+______H2O
①配平此氧化还原反应方程式___________________________
②此反应中若产生0.2mol的气体,则有__________mol的电子转移.
21.A、B、C、D、E为主族元素。A、B、C同周期且原子半径逐渐减小,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和。A元素的最外层电子数为次外层电子数的两倍,B的氢化物可与它的最高价氧化物的水化物反应生成盐。D元素位于元素周期表中第一个长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数。E是元素周期表中原子半径最小的元素。试回答下列问题:
(1)C元素简单离子的电子排布图是_______________________。
(2)A、B两元素各有多种氢化物,其电子数为10的氢化物中沸点较高的是________(填化学式)。
(3)B与E可形成离子化合物BE5,其阴离子的电子式是_______________,BE5含有的化学键类型有_________(选填代号:A.离子键 B.极性键 C.非极性键 D.配位键)。
(4)下列晶体结构示意图中(●代表阳离子,○代表阴离子),能表示C与D形成的离子化合物的晶体结构的是__________(选填字母标号“a”或“b”)。
22.有A,B,C,D四种元素。已知:①它们均为周期表中前20号元素,C,D在同一周期,A,B在同一主族;②它们可以组成化合物B2C2、A2C、DC2等;③B的阳离子与C的阴离子的核外电子排布相同;④B2C2同A2C或DC2反应都生成气体C2,B与A2C反应产生气体A2,A2与气体C2按体积比2∶1混合后点燃能发生爆炸,其产物是一种无色无味的液体(在常温下)。请回答下列问题:
(1)写出A,B,C,D四种元素的符号:
A________,B________,C________,D________。
(2)在B2C2、A2C和DC2中,属于离子化合物的是________,其电子式是__________________,属于共价化合物的是____________,其结构式是____________________。并指出含几个σ键,几个π键。
(3)写出有关的化学方程式:_____________________________________。
23.氮和氮的化合物与人类有密切关系。
(1)氮的固定有利于生物吸收氮。下列属于氮的固定的是___(填序号)。
①工业上N2和H2合成NH3
②N2和O2放电条件下生成NO
③NH3催化氧化生成NO
(2)治理NO通常是在氧化剂作用下,将NO氧化成溶解度高的NO2,然后用水或碱液吸收脱氮。下列物质可以用作氧化NO的是___(填序号)。
A.NaCl溶液 B.NaOH溶液 C.Na2CO3溶液 D.KMnO4溶液
若以NaClO溶液氧化NO,写出该反应的化学方程式,并用双线桥法标出反应中电子的得失和数目___。
(3)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应。用Rh做催化剂时该反应的过程示意图如图:
①过程Ⅰ为____过程(填“吸热”或“放热”)。过程Ⅱ生成的化学键有___(填“极性键”、“非极性键”或“极性键和非极性键”)。
②已知过程Ⅰ的焓变为akJ/mol,过程Ⅱ的焓变为bkJ/mol,则该反应的热化学方程式为:___。
试卷第1页,共3页
参考答案:
1.C
【详解】
A.Na2O是离子化合物,2个Na+与O2-之间以离子键结合,A不符合题意;
B.NaCl是离子化合物,Na+与Cl-之间以离子键结合,B不符合题意;
C.H2O是共价化合物,在分子中2个H原子与O之间以共价键结合,因此物质中只含有共价键,C符合题意;
D.NaOH是离子化合物,Na+与OH-之间以离子键结合,在OH-中H原子与O原子之间以共价键结合,因此该物质中含有离子键和共价键,D不符合题意;
故合理选项是C。
2.A
【详解】
A.CO2中C的化合价为+4,故最外层电子数为4+4=8;氧元素化合价为-2,最外层电子数为6+2=8;故均满足8电子结构,A正确;
B.NH3中H的化合价为+1,最外层电子数是1+1=2,不满足8电子结构,B错误;
C.BF3中B元素为+3价,最外层电子数=3+3=6,不满足8电子稳定结构,C错误;
D.H2O2中,H为+1价,最外层满足2电子结构,与题意不符,D错误。
故选A。
3.A
【详解】
一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,所以A中含有离子键和极性键,B中含有离子键,C中含有极性键,D中含有非极性键,答案选A。
4.C
【详解】
由题给条件可知,该反应为吸热反应,即化学键断裂吸收的总能量高于形成化学键放出的总能量,不考虑苯环中化学键的变化可得:(412×5+348)-(412×3+x+436)=124,解得x=612;答案选C。
5.C
【详解】
A.Cl2与Fe反应生成FeCl3,氯元素由0价降低到-1价,由于1个Cl2含有2个氯原子,故1个Cl2反应化合价降低2价,即1 mol Cl2反应转移电子为2 mol,A错误;
B.n(SiO2)=,1个Si原子周围形成4个Si—O键,故1 mol SiO2中含4 mol Si—O键,即1 mol SiO2含共价键数目为4NA,B错误;
C.n(N2)=,由N2的结构式为N≡N,知1个N2中含2个π键,故1 mol N2中含2 mol π键,C正确;
D.由反应2NO+O2=2NO2,知2 mol NO与1 mol O2恰好反应生成2 mol NO2,但NO2体系中存在平衡2NO2N2O4,故最终气体分子数小于2 mol,D错误;
故答案选C。
6.C
【详解】
A.KCl含有离子键,属于离子化合物,故不选A;
B.H2是由氢元素组成的单质,故不选B;
C.H2SO4只含共价键,属于共价化合物,故选C;
D.Cl2是由氯元素组成的单质,故不选D;
选C。
7.B
【详解】
A. CaCl2只含有离子键,故A不选;
B. NaClO中钠离子与次氯酸根离子间形成离子键,氯与氧原子之间形成共价键,NaClO属于盐,故B符合;
C. Mg3N2只含有离子键,故C不选;
D. NaOH中钠离子与氢氧根离子间形成离子键,氢与氧原子之间形成共价键,但属于碱,故D不选;
故选B。
8.C
【详解】
A.由题中图示可知,反应①方程式为Ni+ +H2+NiS,该反应中涉及C-S极性键断裂和H2中H-H非极性键断裂,故A正确;
B.由题中图示可知,反应③的方程式为Ni+ZnS+2O2=NiO+ZnO+SO2,该过程通入O2的主要目的是将ZnS转化为ZnO和SO2,故B正确;
C.由题中图示可知,反应③的方程式为Ni+ZnS+2O2=NiO+ZnO+SO2,该过程参加反应的O2和ZnS的物质的量之比是2:1,故C错误;
D.由题中图示可知,反应④的方程式为NiO+H2=Ni+H2O,该过程通入H2的主要目的是使脱硫吸附剂再生,即产生Ni单质,故D正确;
答案为C。
9.B
【详解】
根据上述分析可知:A是H,B是O,C是Na,D是S,E是Cl元素。
A.DB2是SO2,SO2是酸性气体,可使紫色石蕊变红色,A正确;
B.元素的非金属性越强,对应的阴离子的还原性就越弱,A是H,D是S,E是Cl,元素的非金属性:Cl>S>H,则简单阴离子的还原性:H->S2->Cl-,用字母表示为:A>D>E,B错误﹔
C.D2E2是S2Cl2,S2Cl2中存在S-S键和S-Cl键,S-S键是非金属性,S-Cl键是极性键,因此该物质分子中既存在极性键又存在非极性键,C正确﹔
D.上述方程式所涉物质中为S,S单质有S2、S4、S6、S8多种物质,它们是同一元素组成的不同性质的单质,互为同素异形体,D正确;
故合理选项是B。
10.C
【详解】
一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,则A.NaOH中含有离子键和极性键,选项A错误;
B.NaCl中只含有离子键,选项B错误;
C.H2分子中只有非极性键,选项C正确;
D.H2S中只有极性键,选项D错误;
答案选C。
11.B
【详解】
A.反应Cl2+H2O=HClO+HCl中,Cl和Cl之间的非极性键断裂,H和O之间的极性键断裂,H和O、O和Cl,H和Cl之间的极性键形成,A不满足题意;
B.反应2Na2O2+2H2O=4NaOH+O2↑中,钠离子和过氧离子之间的离子键断裂,过氧离子中两个O之间的非极性键断裂,H和O之间的极性键断裂,钠离子和氢氧根离子之间的离子键形成,H和O之间的极性键形成,O和O之间的非极性键形成,B满足题意;
C.反应NH4Cl+NaOHNaCl+NH3↑+H2O中,铵根离子和氯离子之间的离子键、钠离子和氢氧根离子之间的离子键断裂,铵根中N和H之间的极性键,氢氧根中H和O之间的极性键断裂,氯离子和钠离子之间的离子键、N和H之间的极性键、H和O之间的极性键形成,C不满足题意;
D.反应2FeCl2+H2O2+2HCl=2FeCl3+2H2O中,亚铁离子和氯离子之间的离子键、H和O之间的极性键、O和O之间的非极性键断裂,Fe和Cl之间的极性共价键(FeCl3是共价化合物)、H和O之间的极性共价键形成,D不满足题意;
答案选B。
12.D
【详解】
A.Fe3O4参与了该循环历程,因为铁离子有价态的变化,故A正确;
B. HCOOH分解时,碳氢键和氧氢键发生了断裂,而后形成了碳氧双键,故B正确;
C.酸性条件下,NO 比NO的氧化性更强,H+起到调节体系pH的作用,故C正确;
D.在整个历程中,2mol Fe2+可还原1 mol NO,氢气还原Fe3+,故D错误;
故选D。
13.D
【详解】
A.由题干信息可知,六方氮化硼和立方氮化硼的结构不同,性质不同,故六方氮化硼转化为立方氮化硼有新物质生成,故是化学变化,A错误;
B.由于N的电负性强于B的,故立方氮化硼(BN)中氮元素的化合价为-3价,B错误;
C.共价键的键长是指两原子的核间距,近似等于两原子半径之和,由于Si的半径大于B和N的,故和键相比,键的键长更短,C错误;
D.由于Si的半径大于B和N的,故立方氮化硼中B-N键的键长比晶体硅中Si-Si键的键长更短,键能更大,故立方氮化硼比晶体硅的熔点更高,硬度更大,D正确;
故答案为:D。
14.B
【详解】
根据图像可知,X的熔点最高,在短周期元素中,应该是第ⅣA族的碳元素形成的金刚石,所以答案选B。
15.D
【详解】
A.根据方程式和可得氧化性:,还原性:,A正确;
B.根据图示可知:在第Ⅱ阶段,、在存在条件反应产生、。在第Ⅲ阶段,结合变为,结合变为,故第Ⅱ、Ⅲ阶段总的化学方程式为:,B正确;
C.根据图示的转化过程知该过程中→→,为中间产物,C正确;
D.由题图可知由,最终生成,的成健数目由3变为4,D错误。
故答案选D。
16.(1)
(2)共价
(3) 固 A
【分析】
(1)过氧化氢是共价化合物,电子式为;
(2)过氧化氢中化学键全部是共价键,属于共价化合物;
(3)过氧化氢的冰点是-0.89℃,则在低于-0.89℃时,过氧化氢是一种蓝色固态态物质,组成它的基本微粒是H2O2分子,答案选A。
17. P3﹣ Al3+ d 2 ac ab
【详解】
(1)同周期中元素原子半径依次减小,稀有气体除外,形成的简单离子,先看电子层,再看核电荷数,第三周期元素中形成简单的阴离子为P3﹣、S2﹣、Cl﹣,电子层数相同,核电荷数越大,半径越小,则半径最大的阴离子是P3﹣,元素对应的单质还原性越弱,对应离子氧化性越强,所以最强的是铝离子,故答案为:P3﹣,Al3+;
(2)比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸性、氢化物的稳定性等角度分析,
a、Cl的最高正价比S高,不能通过化合价来判断非金属性强弱,故a错误;
b、可用浓H2SO4制HCl,是利用不挥发性的酸来制备挥发性的酸,故b错误;
c、HCl的酸性比H2S强,不是最高价含氧酸的酸性,故c错误;
d、Cl2与H2S反应生成S,氯的非金属性强于硫,故d正确;
答案选d;
(3)硅元素最外层有4个电子,外围电子排布3s23p2,所以有2 种能量不同的电子;SiCl4的空间构型和CH4相同,所以硅与四个氯形成四对共用电子对,电子式为:,故答案为:2;;
(4)a.PH4I类似NH4Cl是离子化合物,故a错误;
b.NH4Cl能与碱反应,所以PH4I能与烧碱溶液反应,故正b确;
c.PH4I加热后会发生PH4IPH3↑+I2+H2↑,发生分解而不是升华,故c错误;
d.PH4I溶液中的碘离子能与溴水中的单质溴置换反应,故d正确;故选ac,故答案为:ac;
(5)S2C12的分子结构与H2O2相似,所以S2C12的分子结构与H2O2相似,结构式为Cl﹣S﹣S﹣Cl,所以分子中有3对共用电子对,S2C12分子中有硫硫非极性,S2C12分子中,S为+1价,Cl为﹣1,S2C12分子中各原子均为8电子稳定结构,故选ab,故答案为:ab。
18. = 0.29介于0.225和0.414间,四面体 = 0.36 介于0.225和0.414间,四面体 2 由(1)结果知,Si(Al)O4为骨架型结构,氧原子被2个四面体共用(p+q)/ n(p+q)=0.5,n=2m = 1/2p 实测Si-O键键长( 160pm)远小于Si4+和O2-的离子半径之和(181pm), 表明Si-O键中已有较大的共价成分 Si4+ 电价高、半径小,极化力较大,导致了键型变异 (离子键向共价键过渡) 硅氧四面体和铝氧四面体无序地按硅铝原子比交替排列,①硅氧键强于铝-氧键;②若Al3+数超过Si4+数,必出现铝氧四面体直接相连的情况,结构中引入不稳定因素,导致骨架强度削弱。 1.946 g cm-3
【详解】
811.5g分子筛含水量为
n= = 10.00mol 。
一个晶胞的质量为
(g)
811.5:= 6.022×1024: x x=216
分子筛密度为
D=。=
= 1.946(gcm -3)
n=10.00mol: x=216: D= 1.946 g cm-32分。
用另外的算法,算式与结果皆正确(包括有效数字和单位)。亦得满分。
19. 第二周期第ⅥA族 N3->O2->Na+ 离子键、共价键 Fe2O3+6HCl===2FeCl3+3H2O
【详解】
(1)氧原子有2个电子层,最外层电子数为6,处于周期表中第二周期第ⅥA族;
Na元素原子核外有11个电子,有3个电子层,由里到外各层电子数依次为2、8、1,原子结构示意图为;N3-、O2-、Na+电子层结构相同,核电荷数越大离子半径越小,故离子半径N3->O2->Na+;
(2)氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐,该盐为NH4NO3,含有离子键、共价键;
(3)不溶物为一种红棕色固体,可溶于盐酸,该不溶物能发生铝热反应,则红棕色不溶物为氧化铁,氧化铁与稀盐酸发生反应生成氯化铁和水的反应方程式为Fe2O3+6HCl===2FeCl3+3H2O。
20. -116 Si(s)+3HCl(g)=SiHCl3(g)+H2(g) △H=-225kJ·mol-1 共价键 △H2-△H1 2ClO3-+SO32-+2H+=2ClO2↑+SO42-+H2O 4CuO+2NH4Cl3Cu+CuCl2+N2↑+4H2O 1.2
【详解】
(1)①CuCl2(s)=CuCl(s)+Cl2(g),②CuCl(s)+O2(g)=CuO(s)+Cl2(g),③CuO(s)+2HCl(g)=CuCl2(s)+H2O(g),根据目标反应方程式,2×①+2×②+2×③得出2×(△H1+△H2+△H3)=2×(83-20-121)kJ·mol-1=-116kJ·mol-1;O2分子中有共价键,其电子式为;
(2)硅粉与HCl反应的方程式为Si+3HCl=SiHCl3+H2,生成1molSiHCl3,放出225kJ,因此热化学反应方程式为Si(s)+3HCl(g)=SiHCl3(g)+H2(g) △H=-225kJ·mol-1;SiHCl3属于共价化合物,含有共价键;
(3)根据盖斯定律,推出②-①得出△H3=△H2-△H1;
(4)根据信息,KClO3被还原成ClO2,SO32-被氧化成SO42-,根据化合价升降法进行配平,其离子方程式为2ClO3-+SO32-+2H+=2ClO2↑+SO42-+H2O;
(5)①根据化合价升降法进行配平,得出4CuO+2NH4Cl3Cu+CuCl2+N2↑+4H2O;
②根据反应方程式,生成1molN2,转移电子物质的量为6mol,即生成0.2molN2时,转移电子物质的量为0.2mol×6=1.2mol。
21. NH3 ABD b
【详解】
A、B、C、D、E为主族元素.E是元素周期表中原子半径最小的元素,则E为H元素;D元素位于元素周期表中第一个长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数,各层电子数为2、8、8、2,故D为Ca元素;A元素的最外层电子数为次外层电子数的两倍,原子只能有2个电子层,最外层电子数为4,故A为碳元素;A、B、C同周期且原子半径逐渐减小,B的氢化物可与它的最高价氧化物的水化物反应生成盐,则B为N元素,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和,则C元素最外层电子数为4+3-2=5,故C为F元素;
(1)C为F元素,F-离子的电子排布图是;
(2)A、B两元素各有多种氢化物,其电子数为10的氢化物为CH4、NH3,由于氨气分子之间存在氢键,沸点高于甲烷的;
(3)N与H可形成离子化合物NH4H,其阴离子的电子式是,NH4H中铵根离子与氢负离子之间形成离子键,铵根离子中N原子与H原子之间形成极性键、配位键,故答案为ABD;
(4)C与D形成的离子化合物为CaF2,阳离子与阴离子数目之比为1:2,图a中阳离子与阴离子数目之比为1:1,图2中阳离子与阴离子数目之比为4×:1=1:2,故答案为b。
22. H Na O C Na2O2 H2O、CO2 (2个σ键)、O=C=O(2个σ键、2个π键) 2Na2O2+2H2O===4NaOH+O2↑、2Na2O2+2CO2===2Na2CO3+O2、2Na+2H2O===2NaOH+H2↑、2H2+O22H2O
【详解】
原子序数均小于20的A、B、C、D四种元素,由四元素相互间可形成A2C、B2C2、DC2等化合物,A2与气体C2按体积比2:1混合后点燃能发生爆炸,其产物是一种无色无味的液体(在常温下),则A2C为H2O , B2C2与A2C或DC2反应都生成C2气体,则A为H,B为Na,C为O,D为C, 符合A和B在同一主族,C和D在同一周期及B的阳离子与C的阴离子核外电子层结构相同。
(1)由上述分析可以知道,A为H,B为Na,C为O,D为C;正确答案: H; Na; O;C。
(2)B2C2为Na2O2,是离子化合物,其电子式为;A2C为H2O,是共价化合物,其结构式为,分子中含有2个σ键;DC2为CO2,为共价化合物,其结构式是O=C=O,分子中含有2个σ键、2个π键;正确答案:Na2O2 ;; H2O、CO2 ; (2个σ键)、O=C=O(2个σ键、2个π键)。
(3)过氧化钠与水反应生成氢氧化钠和氧气,方程式为2Na2O2+2H2O===4NaOH+O2↑;过氧化钠与二氧化碳反应生成碳酸钠和氧气,方程式为2Na2O2+2CO2===2Na2CO3+O2;金属钠与水反应生成氢氧化钠和氢气,方程式为2Na+2H2O===2NaOH+H2↑;氢气与氧气反应生成水,方程式为:2H2+O22H2O;正确答案:2Na2O2+2H2O===4NaOH+O2↑、2Na2O2+2CO2===2Na2CO3+O2、2Na+2H2O===2NaOH+H2↑、2H2+O22H2O。
23.(1)①②
(2) D
(3) 吸热 极性键和非极性键 2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH=(a+b)kJ/mol
【分析】
(1)氮的固定是氮元素由游离态转化为化合态,所以属于氮的固定的是①工业上N2和H2合成NH3、②N2和O2放电条件下生成NO,选①②;
(2)KMnO4是常用的氧化剂,具有氧化性,KMnO4溶液可以氧化NO,选D;
NaClO溶液把NO氧化为NO2,自身被还原为NaCl,氮元素化合价由+2升高为+4,氯元素化合价由+1降低为-1,该反应的化学方程式是NaClO+NO= NaCl+ NO2,用双线桥法标出反应中电子的得失和数目为。
(3)①过程Ⅰ氮氧键断裂,化学键断裂吸收能量,过程Ⅰ为吸热过程。根据图示,过程Ⅱ生成的化学键有碳氧键、氮氮键,碳氧键是极性键、氮氮键是非极性键。
②已知过程Ⅰ的焓变为akJ/mol,过程Ⅱ的焓变为bkJ/mol,过程Ⅰ表示为2NO(g)=2N(g)+2O(g) ΔH=akJ/mol,过程Ⅱ表示为2CO+2N(g)+2O(g)= 2CO2(g)+N2(g) ΔH=bkJ/mol,根据盖斯定律Ⅰ+Ⅱ得2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH=(a+b)kJ/mol。
一、选择题(共15题)
1.下列物质中只含有共价键的是
A.Na2O B.NaCl C.H2O D.NaOH
2.下列分子中所有原子都满足最外层为8电子结构的是
A. B. C. D.
3.下列物质中,既含有离子键又含有共价键的是
A.KOH B.KCl C.H2O D.H2
4.(g) (g)+ H2(g) △H = +124 kJ mol-1。已知:部分化学键的键能如下,则X值为
化学键 C-H C-C C=C H-H
键能/kJ·mol-1 412 348 X 436
A.264 B.536 C.612 D.696
5.NA为阿伏伽德罗常数的值。下列说法正确的是
A.1 mol Cl2与足量 Fe 反应转移电子数一定为 3NA
B.60g SiO2中含有共价键数为 2NA
C.28g N2中含有π键总数为 2NA
D.密闭容器中 2molNO 与 1molO2充分反应,产物的分子数为 2NA
6.下列物质属于共价化合物的是
A.KCl B.H2 C.H2SO4 D.Cl2
7.含有共价键的盐是
A.CaCl2 B.NaClO C.Mg3N2 D.NaOH
8.降低硫含量是裂化汽油精制处理的关键。S—Zorb技术使用Ni/ZnO作脱硫吸附剂脱除噻吩()中硫原子的过程如图。
下列说法不正确的是
A.过程①涉及极性键和非极性键的断裂
B.过程③通入O2的主要目的是将ZnS转化为ZnO和SO2
C.过程③中参加反应的O2和ZnS的物质的量之比是3∶2
D.过程④通入H2的主要目的是使脱硫吸附剂再生
9.短周期主族元素A、B、C、D、E的原子序数依次增大,A、B、C三种元素组成的化合物为强碱;化合物D2E2是一种具有难闻气味的黄红色液体,与其他元素组成的物质有如下转化关系:2D2E2+2A2B=DB2↑+□↓+4AE(方框代表一种生成物)。下列说法不正确的是
A.DB2能使紫色石蕊变色
B.简单阴离子还原性:D>E>A
C.D2E2分子中既存在极性键又存在非极性键
D.上述方程式所涉物质中的□存在多种同素异形体
10.下列物质中,只含有非极性键的是
A. B. C. D.
11.下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是
A.Cl2+H2O=HClO+HCl
B.2Na2O2+2H2O=4NaOH+O2↑
C.NH4Cl+NaOHNaCl+NH3↑+H2O
D.2FeCl2+H2O2+2HCl=2FeCl3+2H2O
12.硝酸盐污染已成为一个日益严重的环境问题。甲酸( HCOOH)在纳米级Pd表面分解为活性H2和CO2,再经下列历程实现NO的催化还原,进而减少污染。已知Fe( II)、Fe(III)表示Fe3O4中二价铁和三价铁。下列说法错误的是
A.Fe3O4参与了该循环历程
B.HCOOH分解时,碳氢键和氧氢键发生了断裂
C.H2在反应历程中生成的H+起到调节体系pH的作用
D.在整个历程中,1 mol H2可还原1 mol NO
13.与石墨结构相似的六方氮化硼(BN)晶体在高温高压下可以转化为立方氮化硼(BN),立方氮化硼的结构与金刚石相似,硬度与金刚石相当。下列关于该物质的分析中正确的是
A.六方氮化硼转化为立方氮化硼是物理变化
B.立方氮化硼(BN)中氮元素的化合价为
C.和键相比,键的键长更长
D.立方氮化硼比晶体硅的熔点更高,硬度更大
14.原子序数小于18的八种连号元素,它们单质的熔点随原子序数增大而变化的趋势如图所示。图中X元素应属
A.ⅢA族 B.ⅣA族 C.ⅤA族 D.ⅥA族
15.科研人员提出了雾霾微粒中硫酸盐生成的三个阶段的转化机理,其主要过程示意图如下。下列说法错误的是
A.氧化性:,还原性:
B.第Ⅱ、Ⅲ阶段总的化学方程式为:
C.该过程中为中间产物
D.上述反应过程中,的成键数目保持不变
二、填空题(共4题)
16.工业上最早在19世纪中叶便已生产的过氧化氢,目前成为社会需求量迅速增长的化学品,因为它有较强的氧化性,通常用于污水处理中,氧化除去水中的杂质。在过氧化氢分子中,有1个过氧键:-O-O-,每个氧原子再连接一个氢原子。纯的过氧化氢为蓝色的粘稠状液体,沸点是152.1℃,冰点是-0.89℃。
(1)过氧化氢的电子式为___________;
(2)过氧化氢是___________化合物(离子或共价);
(3)在低于-0.89℃时,过氧化氢是一种蓝色___________态物质,组成它的基本微粒是___________。
A.H2O2 B.H和O C.H2和O2 D.H和O2
17.元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)第三周期元素的原子所形成的简单离子中:半径最大的阴离子是__;氧化性最强的阳离子是__.
(2)下列事实可以作为S和Cl非金属性强弱的判断依据的是__(选填序号)
a.Cl的最高正价比S高 b.可用浓H2SO4制HCl
c.HCl的酸性比H2S强 d.Cl2与H2S反应生成S.
(3)硅元素最外层有__种能量不同的电子;SiCl4的空间构型和CH4相同,写出SiCl4的电子式:__.
(4)PH3和NH3的某些化学性质相似.下列对晶体PH4I性质的推测,错误的是__(选填序号)
a.PH4I是一种共价化合物 b.PH4I能与烧碱溶液反应
c.PH4I加热后会发生升华 d.PH4I溶液能与溴水反应.
(5)二氯化二硫(S2C12)可用作橡胶工业的硫化剂,它的分子结构与H2O2相似.下列有关说法不正确的是__(选填序号)
a.S2C12分子中有4对共用电子对
b.S2C12分子中没有非极性键
c.S2C12分子中,S为+1价,Cl为﹣1价
d.S2C12分子中各原子均为8电子稳定结构.
18.分子筛是一一种天然或人工合成的泡沸石型水合铝硅酸盐晶体。人工合成的分子筛有几十种,皆为骨架型结构,其中最常用的是A型、X型、Y型和丝光沸石型分子筛,化学组成可表示为Mm[AlpSiqOm(p+q)]·xH2O。
(1)Si4+、Al3+和O2-的离子半径分别为41 pm、50 pm和140 pm,通过计算说明在水合铝硅酸盐晶体中Si4+和Al3+各占据由氧构成的何种类型的多面体空隙。
Si4+ Al3+
_____ ______
(2)上述化学式中的n=____,说明理由_____。若M为2价离子,写出m与p的关系式___。
(3) X光衍射测得Si-O键键长为160 pm。此数据说明_____。如何理解_____。
(4)说明以下事实的原因 。
①铝比(有时用SiO2/Al2O3表示)越高,分子筛越稳定;
②最小硅铝比不小于1。
(5)人工合成的A型分子筛钠盐,属于立方晶系,正当晶胞参数a=2464 pm,晶胞组成为Na96[Al96Si96O384]·xH2O。将811.5克该分子筛在1.01325 ×105 Pa、700°C加热6小时将结晶水完全除去,得到798.6升水蒸气(视为理想气体)。计算该分子筛的密度D=___。
19.安全气囊是行车安全的重要设施。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客。为研究安全气囊工作的化学原理,取安全装置中的粉末进行研究。经实验分析,确定该粉末是一种混合物且只含Na、Fe、N、O四种元素。
(1)氧元素在元素周期表中的位置是__________________,Na原子结构示意图为_____________,其中三种主族元素的离子半径从大到小的顺序是___________________(用离子符号表示)。
(2)氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐,该盐晶体中含有的化学键类型是____________________。
(3)水溶性实验表明,安全气囊中固体粉末部分溶解,不溶物为一种红棕色固体,可溶于盐酸,写出反应的化学方程式_______________________________________________。
三、综合题(共4题)
20.(1)近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+ Cl2(g) ΔH1=83 kJ·mol 1
CuCl(s)+O2(g)=CuO(s)+Cl2(g) ΔH2= 20 kJ·mol 1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3= 121 kJ·mol 1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol 1。其中O2的电子式为__________
(2)硅粉与HCl在300℃时反应生成1mol SiHCl3气体和H2 ,放出225KJ热量,该反应的热化学方程式为________________________。SiHCl3中含有的化学键类型为__________
(3)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g)SiHCl3(g)+HCl(g) ΔH1>0
②3SiCl4(g)+2H2(g)+Si(s)4SiHCl3(g) ΔH2<0
③2SiCl4(g)+H2(g)+Si(s)+HCl(g)3SiHCl3(g) ΔH3
则反应③的ΔH3______(用ΔH1,ΔH2表示)。
(4)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与Na2SO3反应制得.请写出反应的离子方程式________________________
(5)氯化铵常用作焊接.如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:_______CuO+______NH4Cl______Cu+______CuCl2+______N2↑+______H2O
①配平此氧化还原反应方程式___________________________
②此反应中若产生0.2mol的气体,则有__________mol的电子转移.
21.A、B、C、D、E为主族元素。A、B、C同周期且原子半径逐渐减小,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和。A元素的最外层电子数为次外层电子数的两倍,B的氢化物可与它的最高价氧化物的水化物反应生成盐。D元素位于元素周期表中第一个长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数。E是元素周期表中原子半径最小的元素。试回答下列问题:
(1)C元素简单离子的电子排布图是_______________________。
(2)A、B两元素各有多种氢化物,其电子数为10的氢化物中沸点较高的是________(填化学式)。
(3)B与E可形成离子化合物BE5,其阴离子的电子式是_______________,BE5含有的化学键类型有_________(选填代号:A.离子键 B.极性键 C.非极性键 D.配位键)。
(4)下列晶体结构示意图中(●代表阳离子,○代表阴离子),能表示C与D形成的离子化合物的晶体结构的是__________(选填字母标号“a”或“b”)。
22.有A,B,C,D四种元素。已知:①它们均为周期表中前20号元素,C,D在同一周期,A,B在同一主族;②它们可以组成化合物B2C2、A2C、DC2等;③B的阳离子与C的阴离子的核外电子排布相同;④B2C2同A2C或DC2反应都生成气体C2,B与A2C反应产生气体A2,A2与气体C2按体积比2∶1混合后点燃能发生爆炸,其产物是一种无色无味的液体(在常温下)。请回答下列问题:
(1)写出A,B,C,D四种元素的符号:
A________,B________,C________,D________。
(2)在B2C2、A2C和DC2中,属于离子化合物的是________,其电子式是__________________,属于共价化合物的是____________,其结构式是____________________。并指出含几个σ键,几个π键。
(3)写出有关的化学方程式:_____________________________________。
23.氮和氮的化合物与人类有密切关系。
(1)氮的固定有利于生物吸收氮。下列属于氮的固定的是___(填序号)。
①工业上N2和H2合成NH3
②N2和O2放电条件下生成NO
③NH3催化氧化生成NO
(2)治理NO通常是在氧化剂作用下,将NO氧化成溶解度高的NO2,然后用水或碱液吸收脱氮。下列物质可以用作氧化NO的是___(填序号)。
A.NaCl溶液 B.NaOH溶液 C.Na2CO3溶液 D.KMnO4溶液
若以NaClO溶液氧化NO,写出该反应的化学方程式,并用双线桥法标出反应中电子的得失和数目___。
(3)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应。用Rh做催化剂时该反应的过程示意图如图:
①过程Ⅰ为____过程(填“吸热”或“放热”)。过程Ⅱ生成的化学键有___(填“极性键”、“非极性键”或“极性键和非极性键”)。
②已知过程Ⅰ的焓变为akJ/mol,过程Ⅱ的焓变为bkJ/mol,则该反应的热化学方程式为:___。
试卷第1页,共3页
参考答案:
1.C
【详解】
A.Na2O是离子化合物,2个Na+与O2-之间以离子键结合,A不符合题意;
B.NaCl是离子化合物,Na+与Cl-之间以离子键结合,B不符合题意;
C.H2O是共价化合物,在分子中2个H原子与O之间以共价键结合,因此物质中只含有共价键,C符合题意;
D.NaOH是离子化合物,Na+与OH-之间以离子键结合,在OH-中H原子与O原子之间以共价键结合,因此该物质中含有离子键和共价键,D不符合题意;
故合理选项是C。
2.A
【详解】
A.CO2中C的化合价为+4,故最外层电子数为4+4=8;氧元素化合价为-2,最外层电子数为6+2=8;故均满足8电子结构,A正确;
B.NH3中H的化合价为+1,最外层电子数是1+1=2,不满足8电子结构,B错误;
C.BF3中B元素为+3价,最外层电子数=3+3=6,不满足8电子稳定结构,C错误;
D.H2O2中,H为+1价,最外层满足2电子结构,与题意不符,D错误。
故选A。
3.A
【详解】
一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,所以A中含有离子键和极性键,B中含有离子键,C中含有极性键,D中含有非极性键,答案选A。
4.C
【详解】
由题给条件可知,该反应为吸热反应,即化学键断裂吸收的总能量高于形成化学键放出的总能量,不考虑苯环中化学键的变化可得:(412×5+348)-(412×3+x+436)=124,解得x=612;答案选C。
5.C
【详解】
A.Cl2与Fe反应生成FeCl3,氯元素由0价降低到-1价,由于1个Cl2含有2个氯原子,故1个Cl2反应化合价降低2价,即1 mol Cl2反应转移电子为2 mol,A错误;
B.n(SiO2)=,1个Si原子周围形成4个Si—O键,故1 mol SiO2中含4 mol Si—O键,即1 mol SiO2含共价键数目为4NA,B错误;
C.n(N2)=,由N2的结构式为N≡N,知1个N2中含2个π键,故1 mol N2中含2 mol π键,C正确;
D.由反应2NO+O2=2NO2,知2 mol NO与1 mol O2恰好反应生成2 mol NO2,但NO2体系中存在平衡2NO2N2O4,故最终气体分子数小于2 mol,D错误;
故答案选C。
6.C
【详解】
A.KCl含有离子键,属于离子化合物,故不选A;
B.H2是由氢元素组成的单质,故不选B;
C.H2SO4只含共价键,属于共价化合物,故选C;
D.Cl2是由氯元素组成的单质,故不选D;
选C。
7.B
【详解】
A. CaCl2只含有离子键,故A不选;
B. NaClO中钠离子与次氯酸根离子间形成离子键,氯与氧原子之间形成共价键,NaClO属于盐,故B符合;
C. Mg3N2只含有离子键,故C不选;
D. NaOH中钠离子与氢氧根离子间形成离子键,氢与氧原子之间形成共价键,但属于碱,故D不选;
故选B。
8.C
【详解】
A.由题中图示可知,反应①方程式为Ni+ +H2+NiS,该反应中涉及C-S极性键断裂和H2中H-H非极性键断裂,故A正确;
B.由题中图示可知,反应③的方程式为Ni+ZnS+2O2=NiO+ZnO+SO2,该过程通入O2的主要目的是将ZnS转化为ZnO和SO2,故B正确;
C.由题中图示可知,反应③的方程式为Ni+ZnS+2O2=NiO+ZnO+SO2,该过程参加反应的O2和ZnS的物质的量之比是2:1,故C错误;
D.由题中图示可知,反应④的方程式为NiO+H2=Ni+H2O,该过程通入H2的主要目的是使脱硫吸附剂再生,即产生Ni单质,故D正确;
答案为C。
9.B
【详解】
根据上述分析可知:A是H,B是O,C是Na,D是S,E是Cl元素。
A.DB2是SO2,SO2是酸性气体,可使紫色石蕊变红色,A正确;
B.元素的非金属性越强,对应的阴离子的还原性就越弱,A是H,D是S,E是Cl,元素的非金属性:Cl>S>H,则简单阴离子的还原性:H->S2->Cl-,用字母表示为:A>D>E,B错误﹔
C.D2E2是S2Cl2,S2Cl2中存在S-S键和S-Cl键,S-S键是非金属性,S-Cl键是极性键,因此该物质分子中既存在极性键又存在非极性键,C正确﹔
D.上述方程式所涉物质中为S,S单质有S2、S4、S6、S8多种物质,它们是同一元素组成的不同性质的单质,互为同素异形体,D正确;
故合理选项是B。
10.C
【详解】
一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,则A.NaOH中含有离子键和极性键,选项A错误;
B.NaCl中只含有离子键,选项B错误;
C.H2分子中只有非极性键,选项C正确;
D.H2S中只有极性键,选项D错误;
答案选C。
11.B
【详解】
A.反应Cl2+H2O=HClO+HCl中,Cl和Cl之间的非极性键断裂,H和O之间的极性键断裂,H和O、O和Cl,H和Cl之间的极性键形成,A不满足题意;
B.反应2Na2O2+2H2O=4NaOH+O2↑中,钠离子和过氧离子之间的离子键断裂,过氧离子中两个O之间的非极性键断裂,H和O之间的极性键断裂,钠离子和氢氧根离子之间的离子键形成,H和O之间的极性键形成,O和O之间的非极性键形成,B满足题意;
C.反应NH4Cl+NaOHNaCl+NH3↑+H2O中,铵根离子和氯离子之间的离子键、钠离子和氢氧根离子之间的离子键断裂,铵根中N和H之间的极性键,氢氧根中H和O之间的极性键断裂,氯离子和钠离子之间的离子键、N和H之间的极性键、H和O之间的极性键形成,C不满足题意;
D.反应2FeCl2+H2O2+2HCl=2FeCl3+2H2O中,亚铁离子和氯离子之间的离子键、H和O之间的极性键、O和O之间的非极性键断裂,Fe和Cl之间的极性共价键(FeCl3是共价化合物)、H和O之间的极性共价键形成,D不满足题意;
答案选B。
12.D
【详解】
A.Fe3O4参与了该循环历程,因为铁离子有价态的变化,故A正确;
B. HCOOH分解时,碳氢键和氧氢键发生了断裂,而后形成了碳氧双键,故B正确;
C.酸性条件下,NO 比NO的氧化性更强,H+起到调节体系pH的作用,故C正确;
D.在整个历程中,2mol Fe2+可还原1 mol NO,氢气还原Fe3+,故D错误;
故选D。
13.D
【详解】
A.由题干信息可知,六方氮化硼和立方氮化硼的结构不同,性质不同,故六方氮化硼转化为立方氮化硼有新物质生成,故是化学变化,A错误;
B.由于N的电负性强于B的,故立方氮化硼(BN)中氮元素的化合价为-3价,B错误;
C.共价键的键长是指两原子的核间距,近似等于两原子半径之和,由于Si的半径大于B和N的,故和键相比,键的键长更短,C错误;
D.由于Si的半径大于B和N的,故立方氮化硼中B-N键的键长比晶体硅中Si-Si键的键长更短,键能更大,故立方氮化硼比晶体硅的熔点更高,硬度更大,D正确;
故答案为:D。
14.B
【详解】
根据图像可知,X的熔点最高,在短周期元素中,应该是第ⅣA族的碳元素形成的金刚石,所以答案选B。
15.D
【详解】
A.根据方程式和可得氧化性:,还原性:,A正确;
B.根据图示可知:在第Ⅱ阶段,、在存在条件反应产生、。在第Ⅲ阶段,结合变为,结合变为,故第Ⅱ、Ⅲ阶段总的化学方程式为:,B正确;
C.根据图示的转化过程知该过程中→→,为中间产物,C正确;
D.由题图可知由,最终生成,的成健数目由3变为4,D错误。
故答案选D。
16.(1)
(2)共价
(3) 固 A
【分析】
(1)过氧化氢是共价化合物,电子式为;
(2)过氧化氢中化学键全部是共价键,属于共价化合物;
(3)过氧化氢的冰点是-0.89℃,则在低于-0.89℃时,过氧化氢是一种蓝色固态态物质,组成它的基本微粒是H2O2分子,答案选A。
17. P3﹣ Al3+ d 2 ac ab
【详解】
(1)同周期中元素原子半径依次减小,稀有气体除外,形成的简单离子,先看电子层,再看核电荷数,第三周期元素中形成简单的阴离子为P3﹣、S2﹣、Cl﹣,电子层数相同,核电荷数越大,半径越小,则半径最大的阴离子是P3﹣,元素对应的单质还原性越弱,对应离子氧化性越强,所以最强的是铝离子,故答案为:P3﹣,Al3+;
(2)比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸性、氢化物的稳定性等角度分析,
a、Cl的最高正价比S高,不能通过化合价来判断非金属性强弱,故a错误;
b、可用浓H2SO4制HCl,是利用不挥发性的酸来制备挥发性的酸,故b错误;
c、HCl的酸性比H2S强,不是最高价含氧酸的酸性,故c错误;
d、Cl2与H2S反应生成S,氯的非金属性强于硫,故d正确;
答案选d;
(3)硅元素最外层有4个电子,外围电子排布3s23p2,所以有2 种能量不同的电子;SiCl4的空间构型和CH4相同,所以硅与四个氯形成四对共用电子对,电子式为:,故答案为:2;;
(4)a.PH4I类似NH4Cl是离子化合物,故a错误;
b.NH4Cl能与碱反应,所以PH4I能与烧碱溶液反应,故正b确;
c.PH4I加热后会发生PH4IPH3↑+I2+H2↑,发生分解而不是升华,故c错误;
d.PH4I溶液中的碘离子能与溴水中的单质溴置换反应,故d正确;故选ac,故答案为:ac;
(5)S2C12的分子结构与H2O2相似,所以S2C12的分子结构与H2O2相似,结构式为Cl﹣S﹣S﹣Cl,所以分子中有3对共用电子对,S2C12分子中有硫硫非极性,S2C12分子中,S为+1价,Cl为﹣1,S2C12分子中各原子均为8电子稳定结构,故选ab,故答案为:ab。
18. = 0.29介于0.225和0.414间,四面体 = 0.36 介于0.225和0.414间,四面体 2 由(1)结果知,Si(Al)O4为骨架型结构,氧原子被2个四面体共用(p+q)/ n(p+q)=0.5,n=2m = 1/2p 实测Si-O键键长( 160pm)远小于Si4+和O2-的离子半径之和(181pm), 表明Si-O键中已有较大的共价成分 Si4+ 电价高、半径小,极化力较大,导致了键型变异 (离子键向共价键过渡) 硅氧四面体和铝氧四面体无序地按硅铝原子比交替排列,①硅氧键强于铝-氧键;②若Al3+数超过Si4+数,必出现铝氧四面体直接相连的情况,结构中引入不稳定因素,导致骨架强度削弱。 1.946 g cm-3
【详解】
811.5g分子筛含水量为
n= = 10.00mol 。
一个晶胞的质量为
(g)
811.5:= 6.022×1024: x x=216
分子筛密度为
D=。=
= 1.946(gcm -3)
n=10.00mol: x=216: D= 1.946 g cm-32分。
用另外的算法,算式与结果皆正确(包括有效数字和单位)。亦得满分。
19. 第二周期第ⅥA族 N3->O2->Na+ 离子键、共价键 Fe2O3+6HCl===2FeCl3+3H2O
【详解】
(1)氧原子有2个电子层,最外层电子数为6,处于周期表中第二周期第ⅥA族;
Na元素原子核外有11个电子,有3个电子层,由里到外各层电子数依次为2、8、1,原子结构示意图为;N3-、O2-、Na+电子层结构相同,核电荷数越大离子半径越小,故离子半径N3->O2->Na+;
(2)氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐,该盐为NH4NO3,含有离子键、共价键;
(3)不溶物为一种红棕色固体,可溶于盐酸,该不溶物能发生铝热反应,则红棕色不溶物为氧化铁,氧化铁与稀盐酸发生反应生成氯化铁和水的反应方程式为Fe2O3+6HCl===2FeCl3+3H2O。
20. -116 Si(s)+3HCl(g)=SiHCl3(g)+H2(g) △H=-225kJ·mol-1 共价键 △H2-△H1 2ClO3-+SO32-+2H+=2ClO2↑+SO42-+H2O 4CuO+2NH4Cl3Cu+CuCl2+N2↑+4H2O 1.2
【详解】
(1)①CuCl2(s)=CuCl(s)+Cl2(g),②CuCl(s)+O2(g)=CuO(s)+Cl2(g),③CuO(s)+2HCl(g)=CuCl2(s)+H2O(g),根据目标反应方程式,2×①+2×②+2×③得出2×(△H1+△H2+△H3)=2×(83-20-121)kJ·mol-1=-116kJ·mol-1;O2分子中有共价键,其电子式为;
(2)硅粉与HCl反应的方程式为Si+3HCl=SiHCl3+H2,生成1molSiHCl3,放出225kJ,因此热化学反应方程式为Si(s)+3HCl(g)=SiHCl3(g)+H2(g) △H=-225kJ·mol-1;SiHCl3属于共价化合物,含有共价键;
(3)根据盖斯定律,推出②-①得出△H3=△H2-△H1;
(4)根据信息,KClO3被还原成ClO2,SO32-被氧化成SO42-,根据化合价升降法进行配平,其离子方程式为2ClO3-+SO32-+2H+=2ClO2↑+SO42-+H2O;
(5)①根据化合价升降法进行配平,得出4CuO+2NH4Cl3Cu+CuCl2+N2↑+4H2O;
②根据反应方程式,生成1molN2,转移电子物质的量为6mol,即生成0.2molN2时,转移电子物质的量为0.2mol×6=1.2mol。
21. NH3 ABD b
【详解】
A、B、C、D、E为主族元素.E是元素周期表中原子半径最小的元素,则E为H元素;D元素位于元素周期表中第一个长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数,各层电子数为2、8、8、2,故D为Ca元素;A元素的最外层电子数为次外层电子数的两倍,原子只能有2个电子层,最外层电子数为4,故A为碳元素;A、B、C同周期且原子半径逐渐减小,B的氢化物可与它的最高价氧化物的水化物反应生成盐,则B为N元素,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和,则C元素最外层电子数为4+3-2=5,故C为F元素;
(1)C为F元素,F-离子的电子排布图是;
(2)A、B两元素各有多种氢化物,其电子数为10的氢化物为CH4、NH3,由于氨气分子之间存在氢键,沸点高于甲烷的;
(3)N与H可形成离子化合物NH4H,其阴离子的电子式是,NH4H中铵根离子与氢负离子之间形成离子键,铵根离子中N原子与H原子之间形成极性键、配位键,故答案为ABD;
(4)C与D形成的离子化合物为CaF2,阳离子与阴离子数目之比为1:2,图a中阳离子与阴离子数目之比为1:1,图2中阳离子与阴离子数目之比为4×:1=1:2,故答案为b。
22. H Na O C Na2O2 H2O、CO2 (2个σ键)、O=C=O(2个σ键、2个π键) 2Na2O2+2H2O===4NaOH+O2↑、2Na2O2+2CO2===2Na2CO3+O2、2Na+2H2O===2NaOH+H2↑、2H2+O22H2O
【详解】
原子序数均小于20的A、B、C、D四种元素,由四元素相互间可形成A2C、B2C2、DC2等化合物,A2与气体C2按体积比2:1混合后点燃能发生爆炸,其产物是一种无色无味的液体(在常温下),则A2C为H2O , B2C2与A2C或DC2反应都生成C2气体,则A为H,B为Na,C为O,D为C, 符合A和B在同一主族,C和D在同一周期及B的阳离子与C的阴离子核外电子层结构相同。
(1)由上述分析可以知道,A为H,B为Na,C为O,D为C;正确答案: H; Na; O;C。
(2)B2C2为Na2O2,是离子化合物,其电子式为;A2C为H2O,是共价化合物,其结构式为,分子中含有2个σ键;DC2为CO2,为共价化合物,其结构式是O=C=O,分子中含有2个σ键、2个π键;正确答案:Na2O2 ;; H2O、CO2 ; (2个σ键)、O=C=O(2个σ键、2个π键)。
(3)过氧化钠与水反应生成氢氧化钠和氧气,方程式为2Na2O2+2H2O===4NaOH+O2↑;过氧化钠与二氧化碳反应生成碳酸钠和氧气,方程式为2Na2O2+2CO2===2Na2CO3+O2;金属钠与水反应生成氢氧化钠和氢气,方程式为2Na+2H2O===2NaOH+H2↑;氢气与氧气反应生成水,方程式为:2H2+O22H2O;正确答案:2Na2O2+2H2O===4NaOH+O2↑、2Na2O2+2CO2===2Na2CO3+O2、2Na+2H2O===2NaOH+H2↑、2H2+O22H2O。
23.(1)①②
(2) D
(3) 吸热 极性键和非极性键 2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH=(a+b)kJ/mol
【分析】
(1)氮的固定是氮元素由游离态转化为化合态,所以属于氮的固定的是①工业上N2和H2合成NH3、②N2和O2放电条件下生成NO,选①②;
(2)KMnO4是常用的氧化剂,具有氧化性,KMnO4溶液可以氧化NO,选D;
NaClO溶液把NO氧化为NO2,自身被还原为NaCl,氮元素化合价由+2升高为+4,氯元素化合价由+1降低为-1,该反应的化学方程式是NaClO+NO= NaCl+ NO2,用双线桥法标出反应中电子的得失和数目为。
(3)①过程Ⅰ氮氧键断裂,化学键断裂吸收能量,过程Ⅰ为吸热过程。根据图示,过程Ⅱ生成的化学键有碳氧键、氮氮键,碳氧键是极性键、氮氮键是非极性键。
②已知过程Ⅰ的焓变为akJ/mol,过程Ⅱ的焓变为bkJ/mol,过程Ⅰ表示为2NO(g)=2N(g)+2O(g) ΔH=akJ/mol,过程Ⅱ表示为2CO+2N(g)+2O(g)= 2CO2(g)+N2(g) ΔH=bkJ/mol,根据盖斯定律Ⅰ+Ⅱ得2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH=(a+b)kJ/mol。
