2021-2022学年高一下学期化学人教版(2019)必修第二册8-1-1金属的冶炼、海水资源的开发利用课件(19张ppt)
文档属性
| 名称 | 2021-2022学年高一下学期化学人教版(2019)必修第二册8-1-1金属的冶炼、海水资源的开发利用课件(19张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-28 11:21:40 | ||
图片预览






文档简介
(共19张PPT)
第八章 化学与自然资源的开发利用
第一节 自然资源的开发利用
第1课时 金属矿物的开发利用 海水资源的开发利用
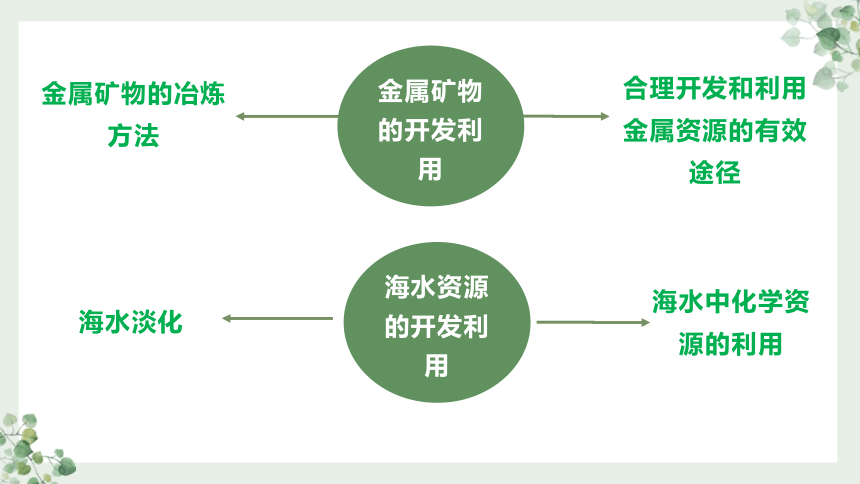
金属矿物的冶炼方法
海水资源的开发利用
合理开发和利用金属资源的有效途径
金属矿物的开发利用
海水淡化
海水中化学资源的利用
一、金属矿物的冶炼方法
金矿
Au
铂矿
Pt
1、金属的存在
大多数金属是以化合态存在
少数不活泼金属以游离态存在
铝矿Al2O3
赤铁矿Fe2O3
(1)物理方法
淘金
原理:金的质量较沙重,在淘去粗沙后,用水银滚动吸附金,水银是已知唯一可以粘附金的物质.
一、金属矿物的冶炼方法
2 、金属的冶炼
原理:化合态到单质的过程,即金属得电子
(2)化学方法
2Ag2O == 4Ag + O2↑
▲
2HgO == 2Hg + O2↑
▲
(1)不活泼的金属——热分解法
不活泼金属(Hg、Ag),加热分解其氧化物
(2)非常活泼的金属——电解法
通电分解其熔融离子化合物的方法来冶炼。
①常用的还原剂有焦炭、CO、H2
(3)其他金属——热还原法
Fe2O3+3CO == 2Fe + 3CO2 ↑
高温
CuO+H2 == Cu + H2O
高温
②一些活泼金属也可作还原剂,将相对不活泼的金属从其化合物中置换出来。
Fe+CuSO4==FeSO4+Cu
2Al+Fe2O3==2Fe+Al2O3
高温
铝热反应
反应放出大量的热,产生高温。
金属 冶炼原理
Fe
Cu
Mg
Al
Na
Fe2O3+3CO===2Fe+3CO2(高炉炼铁)
Fe2O3+2Al===2Fe+Al2O3(铝热法炼铁)
高温
高温
Cu2S+O2 == 2Cu+SO2 (火法炼铜)
Fe+CuSO4=FeSO4+Cu(湿法炼铜)
高温
电解
MgCl2(熔融)=== Mg+Cl2↑
2Al2O3(熔融)===4Al+3O2↑
2NaCl(熔融)===2Na+Cl2↑
电解
冰晶石
电解
常见金属的冶炼原理
【归纳小结】
CuO+H2 == Cu + H2O
金属的发现与使用、冶炼难度、活泼性三者的关系?
Au
Ag
Cu
Fe
Al
······
金属越活泼,冶炼难度越大,发现得通常越晚。
公元前一万年
公元前八千年
公元前七千年
十九世纪初期
十三世纪初期
合理开发和利用金属资源的有效途径
1、提高金属矿物的利用率
2、开发环保高效的金属冶炼方法
3、防止金属的腐蚀
4、加强废旧金属的回收和再利用
5、使用其他材料代替金属材料
二、海水资源的开发利用
海水资源
水资源
化学资源
矿产资源
生物资源
能源
空间资源
海水资源的特点:
分散性
广阔性
多样性
水资源的利用
⑴直接利用
⑵海水淡化
蒸 馏 法
电渗析法
离子交换法
1、水资源的利用
原理:利用液体中各组分沸点的差别,使低沸点物质汽化并随之冷凝,从而实现其与所含组分的分离。(实际生成中将水加热至105℃蒸发汽化,然后将蒸汽冷凝而得到蒸馏水的方法)
海水蒸馏原理示意图
海水淡化后的浓缩海水的利用
粗盐的提纯
浓缩海水
结晶池
蒸发池
粗盐
母液
盐田法
(太阳能蒸发法)
日晒风吹蒸发水分
蒸发结晶
继续日晒风吹成为过饱和溶液,析出晶体
如何除去NaCI溶液中少量
的Mg2+、Ca2+、SO42-
2、海水中化学资源的利用
富集程度很低
地球上99%以上的溴蕴藏在大海中, 以Br-形式存在,因此溴又被称为“海洋元素”。
如何从海水中提取溴(Br2)
海水提溴
(原理:溴离子转化为溴单质)
含溴离子
请写出②④⑤步骤的化学反应方程式
从海水中提取物质的一般思路
浓缩
还原或 氧化
海
水
含离子浓度较高的溶液
粗品
纯品
提纯
【归纳总结】
思考
查阅资料,如何从海水中得到碘单质和镁单质?
课堂练习
优化设计P85例题1、变式训练1;
P86例题2、变式训练2
1.取二张滤纸叠成漏斗状。
2.内层滤纸底部剪一个小孔后用水润湿。
3.把滤纸架在铁圈上,下面放置一盛沙子的蒸发皿。
4.把混合物(5g氧化铁+2g铝粉)放入纸漏斗中。
5.在混合物上面加少量氯酸钾固体,中间插一根用砂纸磨过的镁条。
6.用火柴点燃镁条。观察现象。
铝热反应
关于实验的几点内容:
1.现象:镁条剧烈燃烧,并发出耀眼的光芒。纸漏斗的下部被烧穿,有熔融物落入沙中。待熔融物冷却后,除去外层熔渣,可以发现落下的是铁珠。
2.参加反应的是 和 ,它们混合物叫 。
3.镁条的作用是 。
4.氯酸钾的作用是 。
5.此反应证明 作还原剂,此反应叫 反应。
6.此反应有什么特点?反应放出大量的热,产生高温。
7.铝热反应有什么实际应用?(参考铝热反应的特点)
2Al+Fe2O3==2Fe+Al2O3
高温
铝热反应的应用:
铝热反应应用
冶炼难熔的金属
焊接钢轨
第八章 化学与自然资源的开发利用
第一节 自然资源的开发利用
第1课时 金属矿物的开发利用 海水资源的开发利用
金属矿物的冶炼方法
海水资源的开发利用
合理开发和利用金属资源的有效途径
金属矿物的开发利用
海水淡化
海水中化学资源的利用
一、金属矿物的冶炼方法
金矿
Au
铂矿
Pt
1、金属的存在
大多数金属是以化合态存在
少数不活泼金属以游离态存在
铝矿Al2O3
赤铁矿Fe2O3
(1)物理方法
淘金
原理:金的质量较沙重,在淘去粗沙后,用水银滚动吸附金,水银是已知唯一可以粘附金的物质.
一、金属矿物的冶炼方法
2 、金属的冶炼
原理:化合态到单质的过程,即金属得电子
(2)化学方法
2Ag2O == 4Ag + O2↑
▲
2HgO == 2Hg + O2↑
▲
(1)不活泼的金属——热分解法
不活泼金属(Hg、Ag),加热分解其氧化物
(2)非常活泼的金属——电解法
通电分解其熔融离子化合物的方法来冶炼。
①常用的还原剂有焦炭、CO、H2
(3)其他金属——热还原法
Fe2O3+3CO == 2Fe + 3CO2 ↑
高温
CuO+H2 == Cu + H2O
高温
②一些活泼金属也可作还原剂,将相对不活泼的金属从其化合物中置换出来。
Fe+CuSO4==FeSO4+Cu
2Al+Fe2O3==2Fe+Al2O3
高温
铝热反应
反应放出大量的热,产生高温。
金属 冶炼原理
Fe
Cu
Mg
Al
Na
Fe2O3+3CO===2Fe+3CO2(高炉炼铁)
Fe2O3+2Al===2Fe+Al2O3(铝热法炼铁)
高温
高温
Cu2S+O2 == 2Cu+SO2 (火法炼铜)
Fe+CuSO4=FeSO4+Cu(湿法炼铜)
高温
电解
MgCl2(熔融)=== Mg+Cl2↑
2Al2O3(熔融)===4Al+3O2↑
2NaCl(熔融)===2Na+Cl2↑
电解
冰晶石
电解
常见金属的冶炼原理
【归纳小结】
CuO+H2 == Cu + H2O
金属的发现与使用、冶炼难度、活泼性三者的关系?
Au
Ag
Cu
Fe
Al
······
金属越活泼,冶炼难度越大,发现得通常越晚。
公元前一万年
公元前八千年
公元前七千年
十九世纪初期
十三世纪初期
合理开发和利用金属资源的有效途径
1、提高金属矿物的利用率
2、开发环保高效的金属冶炼方法
3、防止金属的腐蚀
4、加强废旧金属的回收和再利用
5、使用其他材料代替金属材料
二、海水资源的开发利用
海水资源
水资源
化学资源
矿产资源
生物资源
能源
空间资源
海水资源的特点:
分散性
广阔性
多样性
水资源的利用
⑴直接利用
⑵海水淡化
蒸 馏 法
电渗析法
离子交换法
1、水资源的利用
原理:利用液体中各组分沸点的差别,使低沸点物质汽化并随之冷凝,从而实现其与所含组分的分离。(实际生成中将水加热至105℃蒸发汽化,然后将蒸汽冷凝而得到蒸馏水的方法)
海水蒸馏原理示意图
海水淡化后的浓缩海水的利用
粗盐的提纯
浓缩海水
结晶池
蒸发池
粗盐
母液
盐田法
(太阳能蒸发法)
日晒风吹蒸发水分
蒸发结晶
继续日晒风吹成为过饱和溶液,析出晶体
如何除去NaCI溶液中少量
的Mg2+、Ca2+、SO42-
2、海水中化学资源的利用
富集程度很低
地球上99%以上的溴蕴藏在大海中, 以Br-形式存在,因此溴又被称为“海洋元素”。
如何从海水中提取溴(Br2)
海水提溴
(原理:溴离子转化为溴单质)
含溴离子
请写出②④⑤步骤的化学反应方程式
从海水中提取物质的一般思路
浓缩
还原或 氧化
海
水
含离子浓度较高的溶液
粗品
纯品
提纯
【归纳总结】
思考
查阅资料,如何从海水中得到碘单质和镁单质?
课堂练习
优化设计P85例题1、变式训练1;
P86例题2、变式训练2
1.取二张滤纸叠成漏斗状。
2.内层滤纸底部剪一个小孔后用水润湿。
3.把滤纸架在铁圈上,下面放置一盛沙子的蒸发皿。
4.把混合物(5g氧化铁+2g铝粉)放入纸漏斗中。
5.在混合物上面加少量氯酸钾固体,中间插一根用砂纸磨过的镁条。
6.用火柴点燃镁条。观察现象。
铝热反应
关于实验的几点内容:
1.现象:镁条剧烈燃烧,并发出耀眼的光芒。纸漏斗的下部被烧穿,有熔融物落入沙中。待熔融物冷却后,除去外层熔渣,可以发现落下的是铁珠。
2.参加反应的是 和 ,它们混合物叫 。
3.镁条的作用是 。
4.氯酸钾的作用是 。
5.此反应证明 作还原剂,此反应叫 反应。
6.此反应有什么特点?反应放出大量的热,产生高温。
7.铝热反应有什么实际应用?(参考铝热反应的特点)
2Al+Fe2O3==2Fe+Al2O3
高温
铝热反应的应用:
铝热反应应用
冶炼难熔的金属
焊接钢轨
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
