第5章第3节无机非金属材料-第二课时新型无机非金属材料课件2021-2022学年下学期高一化学人教版(2019)必修第二册
文档属性
| 名称 | 第5章第3节无机非金属材料-第二课时新型无机非金属材料课件2021-2022学年下学期高一化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 8.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-01 20:15:49 | ||
图片预览







文档简介
(共20张PPT)
无机非金属材料
第二课时 新型无机非金属材料
一、硅的性质、制备及应用
1. 硅单质(Si)
(1)在元素周期表中的位置
位于元素周期表第三周期、第ⅣA族,正好处于金属与非金属的过渡位置,其单质的导电性介于导体与绝缘体之间,是应用最为广泛的半导体材料。
(2)自然界存在形式
硅在自然界主要以硅酸盐(如地壳中的大多数矿物)和氧化物(如水晶、玛瑙)的形式存在。
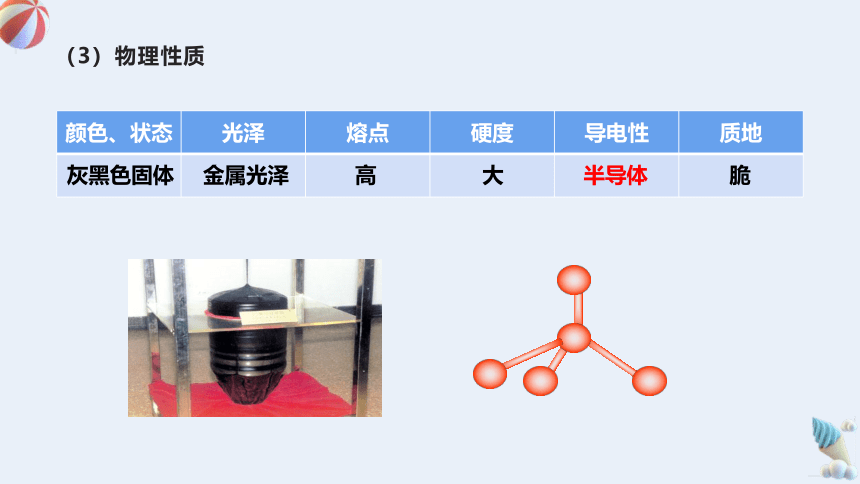
(3)物理性质
颜色、状态 光泽 熔点 硬度 导电性 质地
灰黑色固体
金属光泽
高
大
半导体
脆
(4)化学性质
①常温下,硅的化学性质不活泼,只与F2、HF(氢氟酸)、强碱(如NaOH)溶液反应。
Si的特性
类比Al与强碱的反应
②加热条件下和某些非金属单质(如O2、Cl2、C)发生反应。
(5)用途
①用作半导体材料。
②制作计算机芯片。
③制造光电池,将光能直接转化为电能。
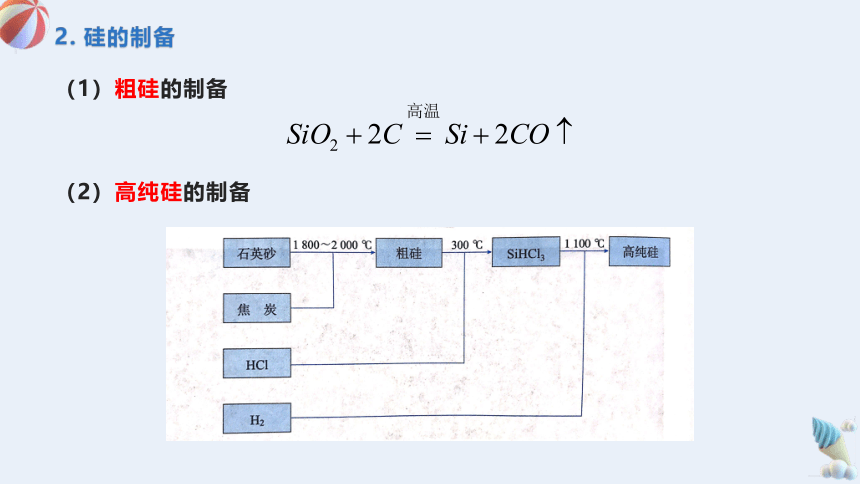
2. 硅的制备
(1)粗硅的制备
(2)高纯硅的制备
其中涉及的主要化学反应为:
课堂练习:
1. 我国已跨入“互联网+”时代,而“互联网”的建设离不开新型无机非金属材料硅。下列物品中用到硅单质的是( )
A. 陶瓷餐具 B. 石英钟表
C. 计算机芯片 D. 光导纤维
C
2. 工业上制造金刚砂(SiC)的反应的化学方程式为:
,在这个氧化还原反应中,氧化剂与还原剂的物质的量之比是( )
A. 1:2 B. 2:1
C. 1:3 D. 3:5
A
二、二氧化硅的性质和应用
1. 二氧化硅(SiO2)
(1)存在
SiO2广泛存在于自然界中,是沙子、石英的主要成分。
(2)物理性质
颜色、状态 熔点 硬度 溶解度 导电性
无色晶体
很高
大
不溶于水
不导电
(3)化学性质
①具有酸性氧化物的通性:
a. 常温下SiO2与强碱溶液反应生成盐和水
b. 与碱性氧化物反应生成盐
盛NaOH溶液的试剂瓶用橡胶塞而不用玻璃塞
②弱氧化性
③特性:SiO2能与氢氟酸反应
注意:除氢氟酸外,二氧化硅不与其他任何酸(如浓硫酸、浓硝酸等)发生反应。
氢氟酸腐蚀玻璃
(4)用途
①用于生产光导纤维。
②水晶可用于制造电子工业的重要部件、光学仪器和工艺品。
③石英玻璃常用来制造耐高温的化学仪器。
④石英砂常用作玻璃原料和建筑材料。
课堂练习:
3. 有下列物质:①氢氟酸;②浓硫酸;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥浓硝酸。其中在一定条件下能与SiO2反应的是( )
A. ①②⑥ B. ②③⑥
C. ①③④⑤ D. ①②③④⑤⑥
C
4. 高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种线路,其中一种工业流程示意图及主要反应如下图所示。下列说法中正确的是( )
A. 自然界中存在大量的单质硅
B. 电弧炉中反应的化学方程式为
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点为33.0℃)中含有少量的SiCl4(沸点为57.7℃),通过蒸馏可提纯SiHCl3
D
三、新型陶瓷和碳纳米材料
1. 新型陶瓷
新型陶瓷在组成上不在局限于传统的硅酸盐体系,在光学、热学、电学、磁学等方面具有很多新的特性和功能,进一步拓展了陶瓷的应用领域。
新型陶瓷
高温结构陶瓷
压电陶瓷
透明陶瓷
超导陶瓷
2. 碳纳米材料
碳纳米材料是近年来人们十分关注的一类新型无机非金属材料。
碳纳米材料
富勒烯
碳纳米管
石墨烯
课堂练习:
5. 下列说法中错误的是( )
A. 氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si4N3
B. 碳化硅(SiC)的硬度大、熔点高,可用于制作高温结构陶瓷和轴承
C. 金刚石、富勒烯、碳纳米管等都是碳单质,互为同素异形体
D. 12g石墨烯和12g金刚石均含有NA个碳原子
A
无机非金属材料
第二课时 新型无机非金属材料
一、硅的性质、制备及应用
1. 硅单质(Si)
(1)在元素周期表中的位置
位于元素周期表第三周期、第ⅣA族,正好处于金属与非金属的过渡位置,其单质的导电性介于导体与绝缘体之间,是应用最为广泛的半导体材料。
(2)自然界存在形式
硅在自然界主要以硅酸盐(如地壳中的大多数矿物)和氧化物(如水晶、玛瑙)的形式存在。
(3)物理性质
颜色、状态 光泽 熔点 硬度 导电性 质地
灰黑色固体
金属光泽
高
大
半导体
脆
(4)化学性质
①常温下,硅的化学性质不活泼,只与F2、HF(氢氟酸)、强碱(如NaOH)溶液反应。
Si的特性
类比Al与强碱的反应
②加热条件下和某些非金属单质(如O2、Cl2、C)发生反应。
(5)用途
①用作半导体材料。
②制作计算机芯片。
③制造光电池,将光能直接转化为电能。
2. 硅的制备
(1)粗硅的制备
(2)高纯硅的制备
其中涉及的主要化学反应为:
课堂练习:
1. 我国已跨入“互联网+”时代,而“互联网”的建设离不开新型无机非金属材料硅。下列物品中用到硅单质的是( )
A. 陶瓷餐具 B. 石英钟表
C. 计算机芯片 D. 光导纤维
C
2. 工业上制造金刚砂(SiC)的反应的化学方程式为:
,在这个氧化还原反应中,氧化剂与还原剂的物质的量之比是( )
A. 1:2 B. 2:1
C. 1:3 D. 3:5
A
二、二氧化硅的性质和应用
1. 二氧化硅(SiO2)
(1)存在
SiO2广泛存在于自然界中,是沙子、石英的主要成分。
(2)物理性质
颜色、状态 熔点 硬度 溶解度 导电性
无色晶体
很高
大
不溶于水
不导电
(3)化学性质
①具有酸性氧化物的通性:
a. 常温下SiO2与强碱溶液反应生成盐和水
b. 与碱性氧化物反应生成盐
盛NaOH溶液的试剂瓶用橡胶塞而不用玻璃塞
②弱氧化性
③特性:SiO2能与氢氟酸反应
注意:除氢氟酸外,二氧化硅不与其他任何酸(如浓硫酸、浓硝酸等)发生反应。
氢氟酸腐蚀玻璃
(4)用途
①用于生产光导纤维。
②水晶可用于制造电子工业的重要部件、光学仪器和工艺品。
③石英玻璃常用来制造耐高温的化学仪器。
④石英砂常用作玻璃原料和建筑材料。
课堂练习:
3. 有下列物质:①氢氟酸;②浓硫酸;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥浓硝酸。其中在一定条件下能与SiO2反应的是( )
A. ①②⑥ B. ②③⑥
C. ①③④⑤ D. ①②③④⑤⑥
C
4. 高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种线路,其中一种工业流程示意图及主要反应如下图所示。下列说法中正确的是( )
A. 自然界中存在大量的单质硅
B. 电弧炉中反应的化学方程式为
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点为33.0℃)中含有少量的SiCl4(沸点为57.7℃),通过蒸馏可提纯SiHCl3
D
三、新型陶瓷和碳纳米材料
1. 新型陶瓷
新型陶瓷在组成上不在局限于传统的硅酸盐体系,在光学、热学、电学、磁学等方面具有很多新的特性和功能,进一步拓展了陶瓷的应用领域。
新型陶瓷
高温结构陶瓷
压电陶瓷
透明陶瓷
超导陶瓷
2. 碳纳米材料
碳纳米材料是近年来人们十分关注的一类新型无机非金属材料。
碳纳米材料
富勒烯
碳纳米管
石墨烯
课堂练习:
5. 下列说法中错误的是( )
A. 氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si4N3
B. 碳化硅(SiC)的硬度大、熔点高,可用于制作高温结构陶瓷和轴承
C. 金刚石、富勒烯、碳纳米管等都是碳单质,互为同素异形体
D. 12g石墨烯和12g金刚石均含有NA个碳原子
A
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
