2021-2022学年高一下学期化学人教版(2019)必修第二册第六章第一节第四课时化学电源课件(16张ppt)
文档属性
| 名称 | 2021-2022学年高一下学期化学人教版(2019)必修第二册第六章第一节第四课时化学电源课件(16张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-28 11:35:29 | ||
图片预览






文档简介
第六章 化学反应与能量
第一节 化学反应与能量
第4课时 化学电源
1、了解干电池、充电电池、燃料电池等化学电源的特点
2、能正确书写简单化学电源的电极反应式。
学习目标
形形色色的电池
干电池
碱性电池
蓄电池
锂离子电池
燃料电池
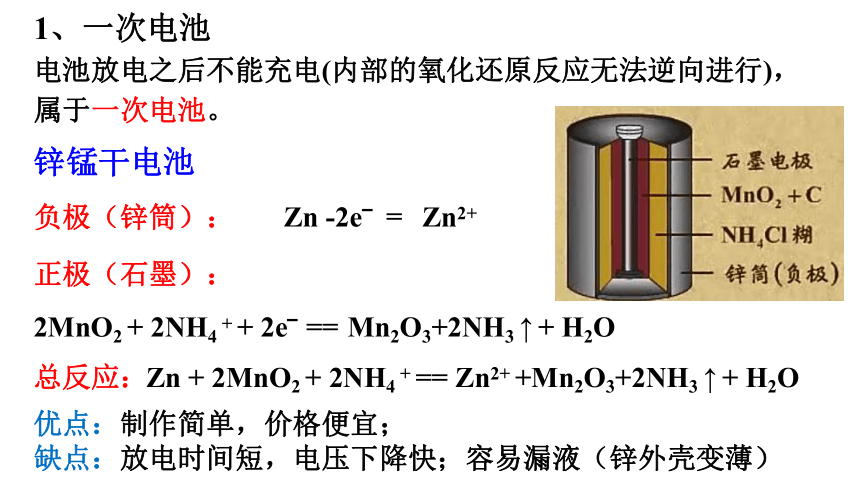
锌锰干电池
负极(锌筒):
总反应:
Zn + 2MnO2 + 2NH4 + == Zn2+ +Mn2O3+2NH3 ↑ + H2O
Zn -2e? Zn2+
=
2MnO2 + 2NH4 + + 2e? Mn2O3+2NH3 ↑ + H2O
==
正极(石墨):
电池放电之后不能充电(内部的氧化还原反应无法逆向进行),属于一次电池。
1、一次电池
优点:制作简单,价格便宜;
缺点:放电时间短,电压下降快;容易漏液(锌外壳变薄)
碱性干电池
电极 :
Zn为负极,碳棒为正极
电解液:
KOH
负极:
Zn + 2OH- - 2e- == Zn(OH)2
2MnO2 + H2O + 2e- == Mn2O3 + 2OH-
Zn + 2MnO2 + H2O == Zn(OH)2 + Mn2O3
总反应:
正极:
碱性干电池的优点:能量和储存时间有所提高,适用于大电流和连续放电;不易发生泄漏
2、充电电池
充电电池又称二次电池,放电时所进行的氧化还原反应,在充电时又逆向进行,使电池恢复到放电前的状态。
铅酸蓄电池
镍氢电池
锂离子电池
铅酸蓄电池
电极:Pb为负极, PbO2为正极.
电解液: 30%的H2SO4溶液
放电时:原电池
负极:
正极:
总电池反应:
Pb+SO42--2e- == PbSO4
PbO2+4H++SO42-+2e- == PbSO4+2H2O
PbO2+Pb+2H2SO4 2PbSO4+2H2O
放电
充电
利用原电池的工作原理,燃料和氧化剂分别放在两个电极上发生氧化还原反应,将化学能直接转化为电能。
反应物不储存在电池内部,由外设设备提供燃料和氧化剂。
高效(燃料利用率高), 环境友好。
优点
3.
与其他电池的区别
2.
原理
1.
3、燃料电池
A
Pt
(-)
Pt
(+)
正极室
负极室
隔膜
电解质溶液
H2
O2
(1)氢氧燃料电池
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
酸性电解质
碱性电解质
负极反应
2H2-4e—= 4H+
2H2+4OH—-4e—= 4H2O
正极反应
O2 +4H+ +4e—= 2H2O
O2+2H2O+4e— = 4OH—
总反应
2H2 + O2 = 2H2O
常见的燃料电池
4.
中性电解质
负极反应:
正极反应:
2H2 - 4e- == 4H+
O2 + 2H2O + 4e- == 4OH-
甲烷电池
H2SO4作电解质
KOH作电解质
负极反应
?
?
正极反应
?
?
总反应
?
?
CH4 + 2H2O - 8e- === CO2 + 8H+
CH4 + 10OH- - 8e- === ????????????????? + 7H2O
?
2O2 + 8H+ + 8e- === 4H2O
2O2 + 8e- + 4H2O === 8OH-
CH4 + 2O2 === CO2 + 2H2O
CH4 + 2O2 + 2OH- === ????????????????? + 3H2O
?
(2)甲烷燃料电池
(3)甲醇燃料电池
酸性电解质下反应式:
负极:2CH3OH - 12e— +2H2O = 12H+ + 2CO2
正极:3O2 + 12e—+12H+ = 6H2O
总反应:2CH3OH + 3O2 = 2CO2 + 4H2O
注意:1.燃料电池不燃烧,不写“点燃”条件。
2.电极一般都为 Pt或C 。
3.燃料为负极,O2为正极
4.电解质酸碱性不同,电极反应不同。
1、银锌电池广泛用作电子仪器的电源,它的充电和放电过程可以表示为:
在此电池放电时,负极上发生反应的物质是( )
A、Ag B、Zn(OH)2
C、Ag2O D、Zn
2Ag + Zn(OH)2 Ag2O +Zn+H2O
充电
放电
D
2、铅酸电池常用作汽车电瓶,其构造如图所示,工作时该电池总的方程式为:
Pb+PbO2+2H2SO4===2PbSO4+2H2O
按要求回答下列问题:
(1)负极材料是____,正极材料是______,电解质
溶液是_______。
(2)工作时,电解质溶液中的H+移向___________极。
(3)工作时,电解质溶液中硫酸的浓度_____(填“增大”“减小”或“不变”)。
Pb
PbO2
H2SO4
PbO2电(正)
减小
3、据媒体报道:以氢氧燃料电池为动力的公交车即将在北京试运行。质子交换膜燃料电池(PEMFC)常作为电动汽车的动力源。该燃料电池以氢为燃料,空气为氧化剂,铂做催化剂,导电离子是H+。下列对该燃料电池的描述中正确的是( )
①正极反应为:O2 + 4H+ + 4e- = 2H2O
②负极反应为:2H2-4e- = 4H+
③总的化学反应为:2H2 + O2 == 2H2O
④氢离子通过电解质向正极移动
A①②③ B②③④ C①②④ D①②③④
D
练一练
练习书写乙烷(C2H6)、乙醇(C2H6O)燃料电池的电极反应
巩固练习:
6.1.2化学反应与电能第2课时
第一节 化学反应与能量
第4课时 化学电源
1、了解干电池、充电电池、燃料电池等化学电源的特点
2、能正确书写简单化学电源的电极反应式。
学习目标
形形色色的电池
干电池
碱性电池
蓄电池
锂离子电池
燃料电池
锌锰干电池
负极(锌筒):
总反应:
Zn + 2MnO2 + 2NH4 + == Zn2+ +Mn2O3+2NH3 ↑ + H2O
Zn -2e? Zn2+
=
2MnO2 + 2NH4 + + 2e? Mn2O3+2NH3 ↑ + H2O
==
正极(石墨):
电池放电之后不能充电(内部的氧化还原反应无法逆向进行),属于一次电池。
1、一次电池
优点:制作简单,价格便宜;
缺点:放电时间短,电压下降快;容易漏液(锌外壳变薄)
碱性干电池
电极 :
Zn为负极,碳棒为正极
电解液:
KOH
负极:
Zn + 2OH- - 2e- == Zn(OH)2
2MnO2 + H2O + 2e- == Mn2O3 + 2OH-
Zn + 2MnO2 + H2O == Zn(OH)2 + Mn2O3
总反应:
正极:
碱性干电池的优点:能量和储存时间有所提高,适用于大电流和连续放电;不易发生泄漏
2、充电电池
充电电池又称二次电池,放电时所进行的氧化还原反应,在充电时又逆向进行,使电池恢复到放电前的状态。
铅酸蓄电池
镍氢电池
锂离子电池
铅酸蓄电池
电极:Pb为负极, PbO2为正极.
电解液: 30%的H2SO4溶液
放电时:原电池
负极:
正极:
总电池反应:
Pb+SO42--2e- == PbSO4
PbO2+4H++SO42-+2e- == PbSO4+2H2O
PbO2+Pb+2H2SO4 2PbSO4+2H2O
放电
充电
利用原电池的工作原理,燃料和氧化剂分别放在两个电极上发生氧化还原反应,将化学能直接转化为电能。
反应物不储存在电池内部,由外设设备提供燃料和氧化剂。
高效(燃料利用率高), 环境友好。
优点
3.
与其他电池的区别
2.
原理
1.
3、燃料电池
A
Pt
(-)
Pt
(+)
正极室
负极室
隔膜
电解质溶液
H2
O2
(1)氢氧燃料电池
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
酸性电解质
碱性电解质
负极反应
2H2-4e—= 4H+
2H2+4OH—-4e—= 4H2O
正极反应
O2 +4H+ +4e—= 2H2O
O2+2H2O+4e— = 4OH—
总反应
2H2 + O2 = 2H2O
常见的燃料电池
4.
中性电解质
负极反应:
正极反应:
2H2 - 4e- == 4H+
O2 + 2H2O + 4e- == 4OH-
甲烷电池
H2SO4作电解质
KOH作电解质
负极反应
?
?
正极反应
?
?
总反应
?
?
CH4 + 2H2O - 8e- === CO2 + 8H+
CH4 + 10OH- - 8e- === ????????????????? + 7H2O
?
2O2 + 8H+ + 8e- === 4H2O
2O2 + 8e- + 4H2O === 8OH-
CH4 + 2O2 === CO2 + 2H2O
CH4 + 2O2 + 2OH- === ????????????????? + 3H2O
?
(2)甲烷燃料电池
(3)甲醇燃料电池
酸性电解质下反应式:
负极:2CH3OH - 12e— +2H2O = 12H+ + 2CO2
正极:3O2 + 12e—+12H+ = 6H2O
总反应:2CH3OH + 3O2 = 2CO2 + 4H2O
注意:1.燃料电池不燃烧,不写“点燃”条件。
2.电极一般都为 Pt或C 。
3.燃料为负极,O2为正极
4.电解质酸碱性不同,电极反应不同。
1、银锌电池广泛用作电子仪器的电源,它的充电和放电过程可以表示为:
在此电池放电时,负极上发生反应的物质是( )
A、Ag B、Zn(OH)2
C、Ag2O D、Zn
2Ag + Zn(OH)2 Ag2O +Zn+H2O
充电
放电
D
2、铅酸电池常用作汽车电瓶,其构造如图所示,工作时该电池总的方程式为:
Pb+PbO2+2H2SO4===2PbSO4+2H2O
按要求回答下列问题:
(1)负极材料是____,正极材料是______,电解质
溶液是_______。
(2)工作时,电解质溶液中的H+移向___________极。
(3)工作时,电解质溶液中硫酸的浓度_____(填“增大”“减小”或“不变”)。
Pb
PbO2
H2SO4
PbO2电(正)
减小
3、据媒体报道:以氢氧燃料电池为动力的公交车即将在北京试运行。质子交换膜燃料电池(PEMFC)常作为电动汽车的动力源。该燃料电池以氢为燃料,空气为氧化剂,铂做催化剂,导电离子是H+。下列对该燃料电池的描述中正确的是( )
①正极反应为:O2 + 4H+ + 4e- = 2H2O
②负极反应为:2H2-4e- = 4H+
③总的化学反应为:2H2 + O2 == 2H2O
④氢离子通过电解质向正极移动
A①②③ B②③④ C①②④ D①②③④
D
练一练
练习书写乙烷(C2H6)、乙醇(C2H6O)燃料电池的电极反应
巩固练习:
6.1.2化学反应与电能第2课时
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
