11.2化学肥料课后练习—2021—2022学年九年级化学人教版下册(word版含解析)
文档属性
| 名称 | 11.2化学肥料课后练习—2021—2022学年九年级化学人教版下册(word版含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 276.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-25 21:50:41 | ||
图片预览




文档简介
11.2化学肥料
一、选择题(共16题)
1.下列能作为复合肥料的是
A.KCl
B.(NH4)3 PO4
C.NaNO3
D.Ca(H2PO4)2
2.下列关于化肥和农药的说法错误的是
A.农药本身有毒,应该禁止施用
B.化肥对提高农作物产量有重要作用
C.尿素()是一种氮肥
D.目前施用农药仍是最重要的作物保护手段
3.化肥为保证粮食丰产起了重要作用。下列化肥属于磷肥的是
A.碳酸氢铵(NH4HCO3 ) B.硫酸钾(K2SO4)
C.硝酸钾(KNO3) D.磷酸二氢钙[Ca(H2PO4)2]
4.下列有关化学知识应用说法中正确的是
A.用于杀灭新冠病毒的 84 消毒液有效成分是 NaClO,其中 Cl 元素的化合价表示为:
B.清华大学发现有效抑制新冠病毒复制的抑制剂 C25H40O8,其碳、氢、氧元素质量比为:25:40:8
C.化肥 NH4H2PO4 与草木灰混合使用效果更好
D.用于减轻被蚊虫叮咬引起痛痒的氨水 NH3·H2O 属于碱
5.下列实验现象描述不正确的是( )
A.氢氧化钠溶液能使紫色石蕊溶液变红
B.将镁条放入稀硫酸中,有气泡产生
C.细铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体
D.铵态氮肥与烧碱共热放出无色有刺激性气味的气体
6.下列化学肥料中属于磷肥的是( )
A.CO(NH2)2 B.KCl C.KNO3 D.Ca(H2PO4)2
7.下列说法正确的是
A.具有稳定性的液体一定属于溶液
B.农药本身有毒,应该禁止使用农药
C.为了防止CO中毒,在火炉旁放一盆水
D.生活中使用洗发剂后需用护发剂的化学原理是酸碱中和
8.如图是某品牌化肥标签的部分内容。下列相关说法错误的是
A.该化肥是由C、H、O、N四种元素组成的纯净物
B.该化肥属于铵态氮肥,易溶于水
C.NH4HCO3能与碱性物质反应
D.NH4HCO3受热后会产生含氮元素的气体
9.实验室区分下列各组物质的两种方法都合理的是
选项 待区分物质 方法一 方法二
A 厕所清洁剂和炉具清洁剂 加入碳酸钙粉末 加入金属铜
B 氯化钠和碳酸钠 饱和的食盐水 加水溶解
C 碳铵和硫铵 闻气味 加水溶解
D 碘和高锰酸钾 加水溶解 加汽油溶解
A.A B.B C.C D.D
10.化肥和农药对农作物的高产丰收具有重要作用。下列有关说法错误的是
A.玉米地的玉米叶子发黄,须及时施加氮肥,如NH4NO3
B.铵态氮肥与氢氧化钙混合时有刺激性气味的气体生成,可使肥效增强
C.过多的营养物质(如尿素等)进入水体会使水体恶化,出现“水华”现象
D.残留农药可通过农作物转移到人体中
11.绿色生活,造福你我。下列做法不值得提倡的是
A.大力开发煤和石油,充分利用能源 B.减少含酸废水排放量,加强水质检测
C.使用不含铅的汽油,减少空气污染 D.合理施用农药和化肥,提高作物产量
12.下列关于物质的组成、结构、性质、变化规律以及用途的总结中,正确的是
A.H2O2,KMnO4,KClO3均由氧气组成,都属于氧化物
B.铁原子(Fe)和铁离子(Fe3+)含有的质子数相同,都属于铁元素
C.H2、CH4、CO2、O2都具有可燃性,都可用作日常生活中的燃料
D.HNO3、NH4Cl,(NH4)2SO4都含有NH4+,都能和烧碱反应生成氨气和水
13.化学是一门以实验为基础的科学。下列实验方案不能达到目的的是
A.制备:实验室用锌粒和稀硫酸制备H2
B.除杂:用硫酸铜溶液除去铜粉中混有的铁粉
C.检验:用氢氧化钡溶液检验CO中是否混有CO2
D.鉴别:用熟石灰鉴别NH4Cl固体和(NH4)2SO4固体
14.下列有关生产、环保、能源、资源问题叙述错误的是
A.“温室效应”主要是由二氧化碳等气体引起的
B.长期使用硫酸铵会使土壤呈酸性,应将硫酸铵与熟石灰混合使用
C.pH < 5.6的酸性降水称为酸雨,它的形成与大气中SO2等酸性污染物增多有关
D.研制并使用可降解塑料能缓解白色污染
15.“百里柳江,百里画廊”,保护母亲河,我们在行动。以下符合保护柳江河的做法是( )
A.在水源地大量网箱养鱼 B.大量使用化肥、农药
C.在河边填埋生活垃圾 D.工业废水经净化处理达标后,方能排放
16.下列说法不正确的是( )
A.硫在空气中燃烧后生成无色无味的气体
B.实验室通常用澄清石灰水溶液来检验二氧化碳的气体
C.现有氮肥:尿素、硫酸铵、氧化铵、硝酸铵,区别尿素与铵盐的方法是加碱
D.金刚石、石墨和C60的化学性质相似,物理性质差异较大,是它们碳原子的排列方式不同
二、综合题(共6题)
17.已知氯化钠和硝酸钾的溶解度如表:
温度/℃ 0 20 40 60
溶解度/g NaCl 35.7 36.0 36.6 37.3
KNO3 13.3 31.6 63.9 110
(1)20℃时,氯化钠饱和溶液的溶质质量分数是_________________%.
(2)请在如图中画出KNO3的溶解度曲线:图中两溶解度曲线交点的意义是________________
(3)KNO3是化学肥料中的___肥料,从热的KNO3浓溶液中析出晶体的方法是________________________ .
18.农作物生长不仅需要阳光、空气和水,还需要多种化学元素。当植物缺乏N元素时,表现为植株生长缓慢、叶色发黄,严重时叶片脱落直至死亡。
(1)下列可作氮肥的是_________
A.硫酸铵 B.磷矿粉 C.硫酸钾
(2)氮肥的制备,首先涉及氨的合成,其原理是:氮气和氢气在高温、高压和催化剂的条件下,制得氨气,请写出该反应的化学方程式:_______________
(3)某化工厂为了综合利用废料 CaSO4,与相邻的合成氨厂设计了以下制备(NH4)2SO4 的工艺流程
请回答以下问题:
①从滤液中获取(NH4)2SO4晶体,必须的操作步骤是______(填写序号)
A.加热蒸干 B.蒸发浓缩 C.冷却结晶 D.过滤
②该生产过程中可以循环使用的X是______。
③在生产中,要检查输送氨气的管道是否漏气,可选用______(填写序号)
A.稀盐酸 B.湿润的蓝色石蕊试纸 C.稀硫酸 D.湿润的红色石蕊试纸
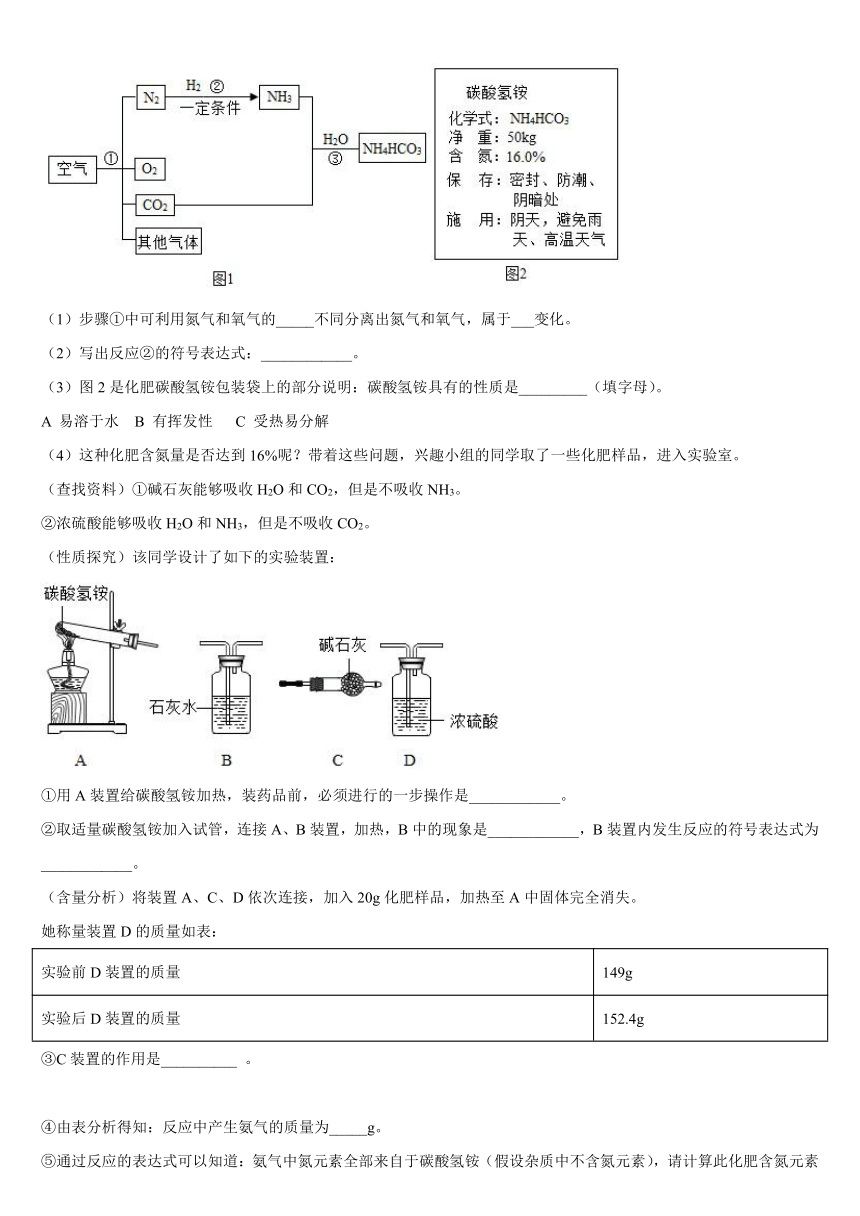
19.空气是人类最宝贵的自然资源。空气中氮气的含量最多,氮气在高温、高能量条件下可与某些物质发生反应。图1是以空气和其他必要的原料合成氮肥(NH4HCO3)的流程。请按要求回答下列问题:
(1)步骤①中可利用氮气和氧气的_____不同分离出氮气和氧气,属于___变化。
(2)写出反应②的符号表达式:____________。
(3)图2是化肥碳酸氢铵包装袋上的部分说明:碳酸氢铵具有的性质是_________(填字母)。
A 易溶于水 B 有挥发性 C 受热易分解
(4)这种化肥含氮量是否达到16%呢?带着这些问题,兴趣小组的同学取了一些化肥样品,进入实验室。
(查找资料)①碱石灰能够吸收H2O和CO2,但是不吸收NH3。
②浓硫酸能够吸收H2O和NH3,但是不吸收CO2。
(性质探究)该同学设计了如下的实验装置:
①用A装置给碳酸氢铵加热,装药品前,必须进行的一步操作是____________。
②取适量碳酸氢铵加入试管,连接A、B装置,加热,B中的现象是____________,B装置内发生反应的符号表达式为____________。
(含量分析)将装置A、C、D依次连接,加入20g化肥样品,加热至A中固体完全消失。
她称量装置D的质量如表:
实验前D装置的质量 149g
实验后D装置的质量 152.4g
③C装置的作用是__________ 。
④由表分析得知:反应中产生氨气的质量为_____g。
⑤通过反应的表达式可以知道:氨气中氮元素全部来自于碳酸氢铵(假设杂质中不含氮元素),请计算此化肥含氮元素的质量分数______________。(写计算过程)
20.普通干电池在生活中的用途很广。
(1)普通干电池照明时化学能转化为____。
(2)目前,废旧电池对环境的污染已越来越引起人们的重视。为了实现可持续发展的战略目标,许多有识之士正在研究废旧电池的有效回收再利用技术。如图为普通电池(锌锰电池)示意图,请你根据图示分析:将回收的废旧电池进行分离,可以得到的金属单质有(用化学式表示,下同)____,氧化物有___,盐有____,有机物有__(写名称)。
(3)小明同学想得到⑤中纯净干燥的二氧化锰和氯化铵溶液,并检验氯化铵中的铵根离子。设计了如下实验步骤,请你帮他完成。
实验步骤 实验现象 结论或解释
①剥开干电池,取出碳棒周围的黑色粉末
②溶解、___(填操作名称)、洗涤 得到黑色粉末和无色澄清液体 黑色粉末的成分为__。
③对黑色粉末进行__ 得到纯净的MnO2固体
④检验第②步中得到的无色澄清液体中是否含铵根离子的方法是:_____ _____ 化学方程式为:______
(4)对分离回收的铜帽净化处理,放入硝酸银溶液中,一段时间以后,可观察到的现象是__,反应的化学方程式是_____,其基本反应类型为___反应。
21.酸、碱、盐是九年级化学学习的重要知识,并且它们具有广泛的用途。
(1)下列关于酸、碱、盐的生产或应用中的说法合理的是(________)
A 将氯化铵与草木灰混合施用
B 烧碱既可以从内陆盐湖提取,又可用侯氏联合制碱法制取
C 用小苏打治疗胃酸过多
D 高温煅烧生石灰可以得到熟石灰
(2)随着新能源汽车的发展,动力电池领域对氢氧化锂的需求量越来越大。氢氧化锂(LiOH)与氢氧化钠化学性质相似,其原因是溶液中都有_______(填离子符号)。
(3)盐酸可用于金属表面除锈,请写出盐酸除铁锈的化学方程式_______。
(4)粗盐中含有泥沙、MgCl2、CaCl2、Na2SO4等杂质,为了得到纯净的氯化钠,化学兴趣小组设计如下实验:
Ⅰ.在操作①、操作②、操作③中都会用到同一种玻璃仪器,该仪器在操作③中的作用是什么?____
Ⅱ.写出一个加入Na2CO3溶液时所发生反应的化学方程式_______。
Ⅲ.上述流程中若将过滤和加盐酸的操作顺序颠倒,所得精盐产品中含有哪些杂质?_____(BaSO4不溶于水也不溶于酸)。
Ⅳ.如何判断加入盐酸达到适量_____。
(5)10g碳酸钙与100g稀盐酸恰好完全反应,生成4.4g二氧化碳,则反应所得氯化钙溶液的溶质质量分数为______(准确到0.1%)?
22.“绿水青山就是金山银山”,废旧干电池中含有锌皮、铜帽(含Cu、Zn)、石墨、二氧化锰、氯化铵等物质,生活中若将废旧电池随意丢弃会造成水和土壤污染,某兴趣小组同学回收废旧干电池的部分物质流程如图所示,(已知:)请回答下列问题:
(1)溶液I一定所含的溶质是________(写化学式)。
(2)加入物质A需要过量,过量的作用是________,将得到的硫酸锌溶液经过_____(填操作名称),得到硫酸锌固体。
(3)溶液1加入过量物质A一定发生反应的化学方程式是__________。
(4)回收得到的氯化铵可在农业上用作化肥,但长期使用会出现土壤酸化板结现象,下列推理合理的是________(填字母序号)。
ANH4Cl属于酸 BNH4Cl溶液能使紫色石蕊溶液变红
CNH4Cl是一种复合肥 D为防止土壤酸化,施用NH4Cl时应加入熟石灰
(5)取分拣的铜帽20克置于烧杯中,向烧杯中连续三次加入稀硫酸反应,并记录所得气体的质量,请根据下表中实验数据计算铜帽中铜的质量分数________(计算结果保留一位小数)。
第一次 第二次 第三次
连续加入稀硫酸的质量(g) 40 40 40
生成气体的总质量(g) 0.08 0.16 0.20
参考答案
1.B
【详解】
A、KCl中含有钾元素,属于钾肥,不符合题意;
B、(NH4)3 PO4中含有氮元素和磷元素,属于复合肥,符合题意;
C、NaNO3中含有氮元素,属于氮肥,不符合题意;
D、Ca(H2PO4)2中含有磷元素,属于磷肥,不符合题意。
故选B。
2.A
【详解】
A、农药本身有毒,应该合理施用;故选项错误,但符合题意;
B、化肥对提高农作物产量有重要作用;故选项正确,但不符合题意;
C、尿素()含有氮元素是一种氮肥;故选项正确,但不符合题意;
D、目前施用农药仍是最重要的作物保护手段;故选项正确,但不符合题意;
故选A。
3.D
【详解】
试题分析:化肥属于磷肥的条件是化肥中含有磷元素。故选D.
4.D
【详解】
A、在NaClO中,钠元素的化合价为+1,氧元素的化合价为-2,设氯元素的化合价为X,根据化合物中正负化合价为0,则有,解得X=+1,NaClO中 Cl 元素的化合价为+1,A不正确;
B、在C25H40O8,其碳、氢、氧元素的质量比为:,B不正确;
C、化肥 NH4H2PO4含有铵根离子,不能与草木灰混合使用,因为草木灰的主要成分是碳酸钾,它呈碱性,会使铵态化肥产生氨气,降低肥效,C不正确;
D、氨水是氨气的水溶液,主要成分是NH3·H2O,水溶液能电离出氢氧根离子,具有碱的通性,属于碱,D正确。故选D。
5.A
【详解】
A、氢氧化钠溶液显碱性,能使紫色石蕊溶液变蓝,故选项说法错误;
B、将镁条放入稀硫酸中,生成硫酸镁和氢气,会观察到有气泡产生,故选项说法正确;
C、铁丝在氧气中剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体,故选项说法正确;
D、铵态氮肥与烧碱共热生成氨气,故放出无色有刺激性气味的气体,故选项说法正确。
故选A。
6.D
【详解】
A. CO(NH2)2含有氮元素,属于氮肥,选项错误;
B. KCl含有钾元素,属于钾肥,选项错误;
C. KNO3含有钾元素和氮元素,属于复合肥,选项错误;
D. Ca(H2PO4)2含有磷元素,属于磷肥,选项正确,故选D。
7.D
【详解】
A、具有稳定性的液体不一定属于溶液,例如水属于纯净物,错误;
B、农药本身有毒,应该合理使用农药,错误;
C、一氧化碳难溶于水,为了防止CO中毒,在火炉旁放一盆水不起作用,错误;
D、生活中使用洗发剂后需用护发剂的化学原理是酸碱中和,正确。
故选D。
8.A
【详解】
A、碳酸氢铵中,氮元素的含量为:,而标签上的含氮量为16%,所以该化肥为混合物,故A错误;
B、碳酸氢铵中含有铵根离子,属于铵态氮肥,该化肥保存时需要防潮,说明该化肥易溶于水,故B正确;
C、NH4HCO3中含有铵根离子,铵根离子能与碱性物质中的氢氧根离子反应释放出氨气,故C正确;
D、碳酸氢铵是由碳、氢、氮、氧四种元素组成的,由质量守恒定律可知,化学反应前后元素的种类不变,所以碳酸氢铵受热后会产生含氮元素的气体,故D正确。
故选A。
9.D
【详解】
A、铜与盐酸、氢氧化钠都不反应,现象相同,不能鉴别,不符合题意,故错误;
B、氯化钠和碳酸钠都易溶于水,现象相同,不能鉴别,不符合题意,故错误;
C、碳铵和硫铵都有氨味,都能溶于水,现象相同,不能鉴别,不符合题意,故错误;
D、取样于试管中,分别加蒸馏水溶解,溶于水的是高锰酸钾,不溶于水的是碘单质,分别加汽油溶解,溶液汽油的是碘单质,不溶于汽油的是高锰酸钾,可以鉴别,故正确。
故选D。
10.B
【详解】
A、氮肥的作用能促进叶色浓绿,所以玉米地的玉米叶子发黄,须及时施加氮肥,如NH4NO3,故A正确;
B、铵态氮肥与碱性肥料反应产生氨气降低肥效,故B错误;
C、过多的营养物质(如尿素等)进入水体会使水体恶化,植物疯长,出现“水华”现象,故C正确;
D、残留农药可通过农作物经过食物链转移到人体中,故D正确。故选B。
11.A
【详解】
A、大力开发煤、石油等资源,会产生大量的空气污染物,要减少使用化石燃料,开发利用新能源,做法错误;
B、水污染有三大来源:生活污染、农业污染、工业污染,减少含酸废水排放量,加强水质检测可,减少水污染,做法正确;
C、使用无铅汽油可以少空气污染,做法正确;
D、防止水污染,应合理使用化肥和农药,做法正确。
故选:A。
12.B
【详解】
A、H2O2、KMnO4、KClO3均含有氧元素,均不含氧气,KMnO4、KClO3均由三种元素组成,不属于氧化物,故选项错误;
B、元素是质子数(即核电荷数)相同的一类原子的总称,铁原子(Fe)和铁离子(Fe2+)含有的质子数相同,都属于铁元素,故选项正确;
C、H2、CH4都具有可燃性,都可用作日常生活中的燃料;二氧化碳、氧气不具有可燃性,不能作燃料,故选项错误;
D、NH4Cl、(NH4)2SO4都含有NH4+,都能和烧碱反应生成氨气和水;HNO3中不含铵根离子,不能和烧碱反应生成氨气和水,故选项错误。故选B。
13.D
【详解】
A、锌和稀硫酸生成硫酸锌和氢气,可制备氢气,A正确。
B、铁和硫酸铜生成硫酸亚铁和铜,可用硫酸铜溶液除去铜粉中混有的铁粉,B正确。
C、二氧化碳和氢氧化钡反应生成碳酸钡沉淀和水,一氧化碳不反应,用氢氧化钡溶液检验CO中是否混有CO2,C正确。
D、氯化铵和硫酸铵都可以和熟石灰生成刺激性气味的氨气,现象相同,无法鉴别,D错误。
故选:D。
14.B
【详解】
A、二氧化碳是引起“温室效应”的主要气体,故A正确;
B、铵盐与显碱性的物质混合时,能够反应生成氨气,降低肥效,故B错误;
C、pH<5.6的雨水属于酸雨,它的形成与大气中SO2等酸性污染物增多有关,故C正确;
D、塑料制品的随意丢弃是造成白色污染的主要原因,所以研制并使用可降解塑料能缓解白色污染,故D正确.
故选B.
15.D
【详解】
A、在水源地大量网箱养鱼会因为鱼类排便、呼吸缺氧死亡而造成水体污染,不符合题意;
B、大量使用化肥、农药会造成水体污染,不符合题意;
C、在河边填埋生活垃圾会因为降雨造成水体污染,不符合题意;
D、工业废水经净化处理达标后排放可以防止水污染,符合题意。故选D。
16.A
【详解】
A、硫在空气中燃烧,发出淡蓝色火焰,产生一种具有刺激性气味的气体,故错误;
B、二氧化碳能使澄清的石灰水变浑浊,实验室通常用澄清石灰水溶液来检验二氧化碳的气体,故正确;
C、铵盐与碱性物质混合研磨后能放出有刺激性气味的气体,区别尿素与铵盐的方法是加碱,混合研磨,故正确;
D、金刚石、石墨和C60的化学性质相似,物理性质差异较大,是因为它们碳原子的排列方式不同,故正确。故选A。
17.26.5 在该温度下,氯化钠和硝酸钾的溶解度相等 复合 降温结晶或冷却
【详解】
(1)根据题目信息和表格可知:20℃时,氯化钠饱和溶液的溶质质量分数=; (2)图中两溶解度曲线交点的意义是:在该温度下,氯化钠和硝酸钾的溶解度相等;画图如下:;(3)KNO3是化学肥料中的复合肥料,因为硝酸钾中有钾元素和氮元素;从热的KNO3浓溶液中析出晶体的方法是:降温结晶或冷却。
18.A N2+3H22NH3 BCD CO2 D
【详解】
(1)A、硫酸铵含有氮元素,属于氮肥; B、磷矿粉中含磷元素,属于磷肥;C、硫酸钾中含有钾元素,属于钾肥。故选A;
(2)氮气和氢气在高温、高压和催化剂的条件下,制得氨气,该反应的化学方程式是N2+3H22NH3;
(3)①从滤液中获取(NH4)2SO4晶体,必须的操作步骤是蒸发浓缩、冷却结晶、过滤故答案为BCD;
②根据流程图,该生产过程中可以循环使用的X是CO2;
③氨气的水溶液呈碱性。在生产中,要检查输送氨气的管道是否漏气,可选用湿润的红色石蕊试纸。故选D。
19.沸点 物理 N2+H2NH3 AC 检查装置气密性 石灰水变浑浊 CO2+Ca(OH)2CaCO3+H2O 去除混合气体中的H2O和CO2 3.4 14%
【详解】
(1)利用氮气和氧气的沸点不同可以分离出氮气和氧气;此过程没有生成新物质,属于物理变化;
(2)氢气和氮气在一定条件下生成氨气,反应的符号表达式为:N2+H2NH3;
(3)由标签中的“防潮防晒”可知,碳酸氢铵易溶于水且受热易分解,不能说明碳酸氢铵具有挥发性;
(4)①用A装置给碳酸氢铵加热,装药品前,必须进行的一步操作是:检查装置的气密性;
②取适量碳酸氢铵加入试管,连接A、B装置,加热,碳酸氢铵受热分解生成氨气、二氧化碳和水,二氧化碳能使澄清石灰水变浑浊,所以观察到试管口的现象是有水珠出现,B中的现象是澄清石灰水变浑浊;B装置内发生反应的符号表达式为:CO2+Ca(OH)2CaCO3+H2O;
③碱石灰能够吸收H2O和CO2,但是不吸收NH3,所以C装置的作用是去除混合气体中的H2O和CO2;
④碱石灰能吸收水和二氧化碳,浓硫酸和氨气反应生成硫酸铵,所以实验后D装置增加的质量就是氨气的质量,所以氨气的质量为152.4g-149g=3.4g;
⑤化肥含氮元素质量分数=×100%=14%。
20.电能 Cu、Zn MnO2 NH4Cl、ZnCl2 淀粉 过滤 二氧化锰和炭粉 灼烧(或暴露在空气中加强热) 取样于试管中,加入氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口 产生强烈刺激性气味气体,湿润的红色石蕊试纸变蓝色 NH4Cl+NaOHNaCl+H2O+NH3↑ 铜表面有银白色固体析出,溶液由无色变为蓝色 Cu+2AgNO3=2Ag+Cu(NO3)2 置换
【详解】
(1)电池是化学能转化为电能的装置,故填:电能;
(2)由同种元素组成的纯净物叫做单质,如:电池中的铜、锌属于金属单质;
由两种元素组成的化合物中,其中一种是氧元素的叫做氧化物,如电池中的二氧化锰;
盐是由金属离子(铵根离子)和酸根离子构成的化合物,如电池中的氯化铵、氯化锌;
其中淀粉属于有机物。故填:Cu、Zn;MnO2;NH4Cl、ZnCl2;淀粉;
(3)②碳棒周围的黑色粉末主要有二氧化锰、碳粉和氯化铵,因为氯化铵溶于水,所以可先溶解,再过滤,滤液为氯化铵溶液,滤渣是二氧化锰和碳粉;
③根据实验目的是要达到纯净干燥的二氧化锰,所以对滤渣进行灼烧,可以将碳粉变为二氧化碳除去,表面残留的氯化铵受热分解也除去了;
④根据氯化铵溶液与碱反应可以生成氨气,NH4Cl+NaOHNaCl+H2O+NH3↑,氨气呈碱性且有刺激性气味,能使湿润的红色石蕊试纸变蓝色,所以可以设计实验为取少量滤液于试管中,加入氢氧化钠溶液,然后检验生成的气体即可;
故答案为:②过滤;二氧化锰和炭粉;③灼烧(或暴露在空气中加强热);
④取样于试管中,加入氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口;产生强烈刺激性气味气体,湿润的红色石蕊试纸变蓝色;NH4Cl+NaOHNaCl+H2O+NH3↑。
(3)分离回收铜帽,经净化处理后放入硝酸银溶液中,铜与硝酸银反应生成了硝酸铜和银,反应的化学方程式是:Cu+2AgNO3=2Ag+Cu(NO3)2,反应现象是铜表面有银白色固体析出,溶液由无色变为蓝色,该反应是单质与化合物反应生成单质和化合物,属于置换反应;故填:铜表面有银白色固体析出,溶液由无色变为蓝色;Cu+2AgNO3=2Ag+Cu(NO3)2;置换。
21.C OH- 搅拌,防止因局部温度过高造成液滴飞溅 (或) 氯化钙、氯化钡、氯化镁 当不再有气泡出时停止滴加稀盐酸 解:设反应后生成氯化钙质量为x
x=11.1g
答:滤液中氯化钙的质量分数是10.5%。
【详解】
(1) A 、铵态氮肥和碱性物质反应生成氨气,造成肥效降低,草木灰显碱性,故氯化铵与草木灰不能混合施用,错误;
B 、烧碱是氢氧化钠俗名;纯碱碳酸钠既可以从内陆盐湖提取,又可用侯氏联合制碱法制取,错误;
C 、小苏打可以和胃酸中盐酸反应,可用于治疗胃酸过多,正确;
D 、生石灰氧化钙和水反应可以得到熟石灰,错误。
故选C。
(2)碱具有通性的原因是电离出的阴离子都是氢氧根离子。氢氧化锂(LiOH)与氢氧化钠化学性质相似,其原因是溶液中都有氢氧根离子0H-。
(3) 氧化铁和盐酸反应生成氯化铁和水,。
(4)Ⅰ.在操作①、操作②、操作③中都会用到同一种玻璃仪器:玻璃棒;操作③为蒸发结晶得到氯化钠晶体,玻璃棒的作用搅拌,防止因局部温度过高造成液滴飞溅。
Ⅱ.操作②中碳酸钠可以和氯化钙及过量的氯化钡反应除去杂质,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠:(或碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠:)。
Ⅲ.上述流程中若将过滤和加盐酸的操作顺序颠倒,那么加入的稀盐酸会和前面生成的氢氧化镁固体、碳酸钙固体、碳酸钡固体分别反应生成引入氯化镁、氯化钙、氯化钡杂质。
Ⅳ.滤液M中含有过量的碳酸钠和氢氧化钠,盐酸首先和氢氧化钠反应生成氯化钠和水,再和碳酸钠反应生成氯化钠和水和二氧化碳,当不再有气泡冒出时停止滴加稀盐酸,此时盐酸适量。
(5)见答案。
22.CuSO4、ZnSO4 把CuSO4中的铜全部置换出来 蒸发 B 解:设铜帽中锌的质量分数为x
答:铜帽中铜的质量分数为67.5%。
【分析】
废旧干电池中有锌皮、铜帽(含Cu、Zn)、石墨、二氧化锰、氯化铵等物质,加水后得到固体中有锌皮、铜帽(含Cu、Zn)、石墨、二氧化锰,从中分拣出铜和锌,加稀硫酸后,锌与硫酸反应生成硫酸锌,铜与硫酸和氧气反应生成硫酸铜,则溶液Ⅰ中有CuSO4、ZnSO4;加入过量的物质A后得到固体Ⅱ,那说明A是锌,它与溶液中的硫酸铜反应生成铜和硫酸锌溶液,因为A过量,所以固体Ⅱ中有铜和锌两种物质,加入物质B后得到的只有铜和硫酸锌溶液,说明B是稀硫酸。
【详解】
(1)由分析可知,溶液Ⅰ中有CuSO4、ZnSO4;
(2)加过量A(锌)的目的是将溶液中的CuSO4中的铜全部置换出来;通过蒸发硫酸锌溶液可以得到硫酸锌固体;
(3)锌与硫酸铜反应生成铜和硫酸锌,化学方程式为:Zn+CuSO4=Cu+ZnSO4;
(4)A、氯化铵是由铵根离子与酸根离子构成的化合物,属于盐,选项错误;
B、长期使用氯化铵会出现土壤酸化板结现象,说明氯化铵显酸性,可以使紫色石蕊溶液变红,选项正确;
C、NH4Cl只含氮元素,属于氮肥,不属于复合肥,选项错误;
D、NH4Cl与熟石灰(氢氧化钙)混合使用会产生氨气,降低肥效,选项错误;
故选:B。
(5)根据表中数据分析第三次实验中锌完全反应,稀硫酸有剩余,因此生成氢气总质量为0.20g,根据化学方程式计算出锌的质量分数为32.5%,则铜的质量分数为67.5%。具体计算过程见答案。
一、选择题(共16题)
1.下列能作为复合肥料的是
A.KCl
B.(NH4)3 PO4
C.NaNO3
D.Ca(H2PO4)2
2.下列关于化肥和农药的说法错误的是
A.农药本身有毒,应该禁止施用
B.化肥对提高农作物产量有重要作用
C.尿素()是一种氮肥
D.目前施用农药仍是最重要的作物保护手段
3.化肥为保证粮食丰产起了重要作用。下列化肥属于磷肥的是
A.碳酸氢铵(NH4HCO3 ) B.硫酸钾(K2SO4)
C.硝酸钾(KNO3) D.磷酸二氢钙[Ca(H2PO4)2]
4.下列有关化学知识应用说法中正确的是
A.用于杀灭新冠病毒的 84 消毒液有效成分是 NaClO,其中 Cl 元素的化合价表示为:
B.清华大学发现有效抑制新冠病毒复制的抑制剂 C25H40O8,其碳、氢、氧元素质量比为:25:40:8
C.化肥 NH4H2PO4 与草木灰混合使用效果更好
D.用于减轻被蚊虫叮咬引起痛痒的氨水 NH3·H2O 属于碱
5.下列实验现象描述不正确的是( )
A.氢氧化钠溶液能使紫色石蕊溶液变红
B.将镁条放入稀硫酸中,有气泡产生
C.细铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体
D.铵态氮肥与烧碱共热放出无色有刺激性气味的气体
6.下列化学肥料中属于磷肥的是( )
A.CO(NH2)2 B.KCl C.KNO3 D.Ca(H2PO4)2
7.下列说法正确的是
A.具有稳定性的液体一定属于溶液
B.农药本身有毒,应该禁止使用农药
C.为了防止CO中毒,在火炉旁放一盆水
D.生活中使用洗发剂后需用护发剂的化学原理是酸碱中和
8.如图是某品牌化肥标签的部分内容。下列相关说法错误的是
A.该化肥是由C、H、O、N四种元素组成的纯净物
B.该化肥属于铵态氮肥,易溶于水
C.NH4HCO3能与碱性物质反应
D.NH4HCO3受热后会产生含氮元素的气体
9.实验室区分下列各组物质的两种方法都合理的是
选项 待区分物质 方法一 方法二
A 厕所清洁剂和炉具清洁剂 加入碳酸钙粉末 加入金属铜
B 氯化钠和碳酸钠 饱和的食盐水 加水溶解
C 碳铵和硫铵 闻气味 加水溶解
D 碘和高锰酸钾 加水溶解 加汽油溶解
A.A B.B C.C D.D
10.化肥和农药对农作物的高产丰收具有重要作用。下列有关说法错误的是
A.玉米地的玉米叶子发黄,须及时施加氮肥,如NH4NO3
B.铵态氮肥与氢氧化钙混合时有刺激性气味的气体生成,可使肥效增强
C.过多的营养物质(如尿素等)进入水体会使水体恶化,出现“水华”现象
D.残留农药可通过农作物转移到人体中
11.绿色生活,造福你我。下列做法不值得提倡的是
A.大力开发煤和石油,充分利用能源 B.减少含酸废水排放量,加强水质检测
C.使用不含铅的汽油,减少空气污染 D.合理施用农药和化肥,提高作物产量
12.下列关于物质的组成、结构、性质、变化规律以及用途的总结中,正确的是
A.H2O2,KMnO4,KClO3均由氧气组成,都属于氧化物
B.铁原子(Fe)和铁离子(Fe3+)含有的质子数相同,都属于铁元素
C.H2、CH4、CO2、O2都具有可燃性,都可用作日常生活中的燃料
D.HNO3、NH4Cl,(NH4)2SO4都含有NH4+,都能和烧碱反应生成氨气和水
13.化学是一门以实验为基础的科学。下列实验方案不能达到目的的是
A.制备:实验室用锌粒和稀硫酸制备H2
B.除杂:用硫酸铜溶液除去铜粉中混有的铁粉
C.检验:用氢氧化钡溶液检验CO中是否混有CO2
D.鉴别:用熟石灰鉴别NH4Cl固体和(NH4)2SO4固体
14.下列有关生产、环保、能源、资源问题叙述错误的是
A.“温室效应”主要是由二氧化碳等气体引起的
B.长期使用硫酸铵会使土壤呈酸性,应将硫酸铵与熟石灰混合使用
C.pH < 5.6的酸性降水称为酸雨,它的形成与大气中SO2等酸性污染物增多有关
D.研制并使用可降解塑料能缓解白色污染
15.“百里柳江,百里画廊”,保护母亲河,我们在行动。以下符合保护柳江河的做法是( )
A.在水源地大量网箱养鱼 B.大量使用化肥、农药
C.在河边填埋生活垃圾 D.工业废水经净化处理达标后,方能排放
16.下列说法不正确的是( )
A.硫在空气中燃烧后生成无色无味的气体
B.实验室通常用澄清石灰水溶液来检验二氧化碳的气体
C.现有氮肥:尿素、硫酸铵、氧化铵、硝酸铵,区别尿素与铵盐的方法是加碱
D.金刚石、石墨和C60的化学性质相似,物理性质差异较大,是它们碳原子的排列方式不同
二、综合题(共6题)
17.已知氯化钠和硝酸钾的溶解度如表:
温度/℃ 0 20 40 60
溶解度/g NaCl 35.7 36.0 36.6 37.3
KNO3 13.3 31.6 63.9 110
(1)20℃时,氯化钠饱和溶液的溶质质量分数是_________________%.
(2)请在如图中画出KNO3的溶解度曲线:图中两溶解度曲线交点的意义是________________
(3)KNO3是化学肥料中的___肥料,从热的KNO3浓溶液中析出晶体的方法是________________________ .
18.农作物生长不仅需要阳光、空气和水,还需要多种化学元素。当植物缺乏N元素时,表现为植株生长缓慢、叶色发黄,严重时叶片脱落直至死亡。
(1)下列可作氮肥的是_________
A.硫酸铵 B.磷矿粉 C.硫酸钾
(2)氮肥的制备,首先涉及氨的合成,其原理是:氮气和氢气在高温、高压和催化剂的条件下,制得氨气,请写出该反应的化学方程式:_______________
(3)某化工厂为了综合利用废料 CaSO4,与相邻的合成氨厂设计了以下制备(NH4)2SO4 的工艺流程
请回答以下问题:
①从滤液中获取(NH4)2SO4晶体,必须的操作步骤是______(填写序号)
A.加热蒸干 B.蒸发浓缩 C.冷却结晶 D.过滤
②该生产过程中可以循环使用的X是______。
③在生产中,要检查输送氨气的管道是否漏气,可选用______(填写序号)
A.稀盐酸 B.湿润的蓝色石蕊试纸 C.稀硫酸 D.湿润的红色石蕊试纸
19.空气是人类最宝贵的自然资源。空气中氮气的含量最多,氮气在高温、高能量条件下可与某些物质发生反应。图1是以空气和其他必要的原料合成氮肥(NH4HCO3)的流程。请按要求回答下列问题:
(1)步骤①中可利用氮气和氧气的_____不同分离出氮气和氧气,属于___变化。
(2)写出反应②的符号表达式:____________。
(3)图2是化肥碳酸氢铵包装袋上的部分说明:碳酸氢铵具有的性质是_________(填字母)。
A 易溶于水 B 有挥发性 C 受热易分解
(4)这种化肥含氮量是否达到16%呢?带着这些问题,兴趣小组的同学取了一些化肥样品,进入实验室。
(查找资料)①碱石灰能够吸收H2O和CO2,但是不吸收NH3。
②浓硫酸能够吸收H2O和NH3,但是不吸收CO2。
(性质探究)该同学设计了如下的实验装置:
①用A装置给碳酸氢铵加热,装药品前,必须进行的一步操作是____________。
②取适量碳酸氢铵加入试管,连接A、B装置,加热,B中的现象是____________,B装置内发生反应的符号表达式为____________。
(含量分析)将装置A、C、D依次连接,加入20g化肥样品,加热至A中固体完全消失。
她称量装置D的质量如表:
实验前D装置的质量 149g
实验后D装置的质量 152.4g
③C装置的作用是__________ 。
④由表分析得知:反应中产生氨气的质量为_____g。
⑤通过反应的表达式可以知道:氨气中氮元素全部来自于碳酸氢铵(假设杂质中不含氮元素),请计算此化肥含氮元素的质量分数______________。(写计算过程)
20.普通干电池在生活中的用途很广。
(1)普通干电池照明时化学能转化为____。
(2)目前,废旧电池对环境的污染已越来越引起人们的重视。为了实现可持续发展的战略目标,许多有识之士正在研究废旧电池的有效回收再利用技术。如图为普通电池(锌锰电池)示意图,请你根据图示分析:将回收的废旧电池进行分离,可以得到的金属单质有(用化学式表示,下同)____,氧化物有___,盐有____,有机物有__(写名称)。
(3)小明同学想得到⑤中纯净干燥的二氧化锰和氯化铵溶液,并检验氯化铵中的铵根离子。设计了如下实验步骤,请你帮他完成。
实验步骤 实验现象 结论或解释
①剥开干电池,取出碳棒周围的黑色粉末
②溶解、___(填操作名称)、洗涤 得到黑色粉末和无色澄清液体 黑色粉末的成分为__。
③对黑色粉末进行__ 得到纯净的MnO2固体
④检验第②步中得到的无色澄清液体中是否含铵根离子的方法是:_____ _____ 化学方程式为:______
(4)对分离回收的铜帽净化处理,放入硝酸银溶液中,一段时间以后,可观察到的现象是__,反应的化学方程式是_____,其基本反应类型为___反应。
21.酸、碱、盐是九年级化学学习的重要知识,并且它们具有广泛的用途。
(1)下列关于酸、碱、盐的生产或应用中的说法合理的是(________)
A 将氯化铵与草木灰混合施用
B 烧碱既可以从内陆盐湖提取,又可用侯氏联合制碱法制取
C 用小苏打治疗胃酸过多
D 高温煅烧生石灰可以得到熟石灰
(2)随着新能源汽车的发展,动力电池领域对氢氧化锂的需求量越来越大。氢氧化锂(LiOH)与氢氧化钠化学性质相似,其原因是溶液中都有_______(填离子符号)。
(3)盐酸可用于金属表面除锈,请写出盐酸除铁锈的化学方程式_______。
(4)粗盐中含有泥沙、MgCl2、CaCl2、Na2SO4等杂质,为了得到纯净的氯化钠,化学兴趣小组设计如下实验:
Ⅰ.在操作①、操作②、操作③中都会用到同一种玻璃仪器,该仪器在操作③中的作用是什么?____
Ⅱ.写出一个加入Na2CO3溶液时所发生反应的化学方程式_______。
Ⅲ.上述流程中若将过滤和加盐酸的操作顺序颠倒,所得精盐产品中含有哪些杂质?_____(BaSO4不溶于水也不溶于酸)。
Ⅳ.如何判断加入盐酸达到适量_____。
(5)10g碳酸钙与100g稀盐酸恰好完全反应,生成4.4g二氧化碳,则反应所得氯化钙溶液的溶质质量分数为______(准确到0.1%)?
22.“绿水青山就是金山银山”,废旧干电池中含有锌皮、铜帽(含Cu、Zn)、石墨、二氧化锰、氯化铵等物质,生活中若将废旧电池随意丢弃会造成水和土壤污染,某兴趣小组同学回收废旧干电池的部分物质流程如图所示,(已知:)请回答下列问题:
(1)溶液I一定所含的溶质是________(写化学式)。
(2)加入物质A需要过量,过量的作用是________,将得到的硫酸锌溶液经过_____(填操作名称),得到硫酸锌固体。
(3)溶液1加入过量物质A一定发生反应的化学方程式是__________。
(4)回收得到的氯化铵可在农业上用作化肥,但长期使用会出现土壤酸化板结现象,下列推理合理的是________(填字母序号)。
ANH4Cl属于酸 BNH4Cl溶液能使紫色石蕊溶液变红
CNH4Cl是一种复合肥 D为防止土壤酸化,施用NH4Cl时应加入熟石灰
(5)取分拣的铜帽20克置于烧杯中,向烧杯中连续三次加入稀硫酸反应,并记录所得气体的质量,请根据下表中实验数据计算铜帽中铜的质量分数________(计算结果保留一位小数)。
第一次 第二次 第三次
连续加入稀硫酸的质量(g) 40 40 40
生成气体的总质量(g) 0.08 0.16 0.20
参考答案
1.B
【详解】
A、KCl中含有钾元素,属于钾肥,不符合题意;
B、(NH4)3 PO4中含有氮元素和磷元素,属于复合肥,符合题意;
C、NaNO3中含有氮元素,属于氮肥,不符合题意;
D、Ca(H2PO4)2中含有磷元素,属于磷肥,不符合题意。
故选B。
2.A
【详解】
A、农药本身有毒,应该合理施用;故选项错误,但符合题意;
B、化肥对提高农作物产量有重要作用;故选项正确,但不符合题意;
C、尿素()含有氮元素是一种氮肥;故选项正确,但不符合题意;
D、目前施用农药仍是最重要的作物保护手段;故选项正确,但不符合题意;
故选A。
3.D
【详解】
试题分析:化肥属于磷肥的条件是化肥中含有磷元素。故选D.
4.D
【详解】
A、在NaClO中,钠元素的化合价为+1,氧元素的化合价为-2,设氯元素的化合价为X,根据化合物中正负化合价为0,则有,解得X=+1,NaClO中 Cl 元素的化合价为+1,A不正确;
B、在C25H40O8,其碳、氢、氧元素的质量比为:,B不正确;
C、化肥 NH4H2PO4含有铵根离子,不能与草木灰混合使用,因为草木灰的主要成分是碳酸钾,它呈碱性,会使铵态化肥产生氨气,降低肥效,C不正确;
D、氨水是氨气的水溶液,主要成分是NH3·H2O,水溶液能电离出氢氧根离子,具有碱的通性,属于碱,D正确。故选D。
5.A
【详解】
A、氢氧化钠溶液显碱性,能使紫色石蕊溶液变蓝,故选项说法错误;
B、将镁条放入稀硫酸中,生成硫酸镁和氢气,会观察到有气泡产生,故选项说法正确;
C、铁丝在氧气中剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体,故选项说法正确;
D、铵态氮肥与烧碱共热生成氨气,故放出无色有刺激性气味的气体,故选项说法正确。
故选A。
6.D
【详解】
A. CO(NH2)2含有氮元素,属于氮肥,选项错误;
B. KCl含有钾元素,属于钾肥,选项错误;
C. KNO3含有钾元素和氮元素,属于复合肥,选项错误;
D. Ca(H2PO4)2含有磷元素,属于磷肥,选项正确,故选D。
7.D
【详解】
A、具有稳定性的液体不一定属于溶液,例如水属于纯净物,错误;
B、农药本身有毒,应该合理使用农药,错误;
C、一氧化碳难溶于水,为了防止CO中毒,在火炉旁放一盆水不起作用,错误;
D、生活中使用洗发剂后需用护发剂的化学原理是酸碱中和,正确。
故选D。
8.A
【详解】
A、碳酸氢铵中,氮元素的含量为:,而标签上的含氮量为16%,所以该化肥为混合物,故A错误;
B、碳酸氢铵中含有铵根离子,属于铵态氮肥,该化肥保存时需要防潮,说明该化肥易溶于水,故B正确;
C、NH4HCO3中含有铵根离子,铵根离子能与碱性物质中的氢氧根离子反应释放出氨气,故C正确;
D、碳酸氢铵是由碳、氢、氮、氧四种元素组成的,由质量守恒定律可知,化学反应前后元素的种类不变,所以碳酸氢铵受热后会产生含氮元素的气体,故D正确。
故选A。
9.D
【详解】
A、铜与盐酸、氢氧化钠都不反应,现象相同,不能鉴别,不符合题意,故错误;
B、氯化钠和碳酸钠都易溶于水,现象相同,不能鉴别,不符合题意,故错误;
C、碳铵和硫铵都有氨味,都能溶于水,现象相同,不能鉴别,不符合题意,故错误;
D、取样于试管中,分别加蒸馏水溶解,溶于水的是高锰酸钾,不溶于水的是碘单质,分别加汽油溶解,溶液汽油的是碘单质,不溶于汽油的是高锰酸钾,可以鉴别,故正确。
故选D。
10.B
【详解】
A、氮肥的作用能促进叶色浓绿,所以玉米地的玉米叶子发黄,须及时施加氮肥,如NH4NO3,故A正确;
B、铵态氮肥与碱性肥料反应产生氨气降低肥效,故B错误;
C、过多的营养物质(如尿素等)进入水体会使水体恶化,植物疯长,出现“水华”现象,故C正确;
D、残留农药可通过农作物经过食物链转移到人体中,故D正确。故选B。
11.A
【详解】
A、大力开发煤、石油等资源,会产生大量的空气污染物,要减少使用化石燃料,开发利用新能源,做法错误;
B、水污染有三大来源:生活污染、农业污染、工业污染,减少含酸废水排放量,加强水质检测可,减少水污染,做法正确;
C、使用无铅汽油可以少空气污染,做法正确;
D、防止水污染,应合理使用化肥和农药,做法正确。
故选:A。
12.B
【详解】
A、H2O2、KMnO4、KClO3均含有氧元素,均不含氧气,KMnO4、KClO3均由三种元素组成,不属于氧化物,故选项错误;
B、元素是质子数(即核电荷数)相同的一类原子的总称,铁原子(Fe)和铁离子(Fe2+)含有的质子数相同,都属于铁元素,故选项正确;
C、H2、CH4都具有可燃性,都可用作日常生活中的燃料;二氧化碳、氧气不具有可燃性,不能作燃料,故选项错误;
D、NH4Cl、(NH4)2SO4都含有NH4+,都能和烧碱反应生成氨气和水;HNO3中不含铵根离子,不能和烧碱反应生成氨气和水,故选项错误。故选B。
13.D
【详解】
A、锌和稀硫酸生成硫酸锌和氢气,可制备氢气,A正确。
B、铁和硫酸铜生成硫酸亚铁和铜,可用硫酸铜溶液除去铜粉中混有的铁粉,B正确。
C、二氧化碳和氢氧化钡反应生成碳酸钡沉淀和水,一氧化碳不反应,用氢氧化钡溶液检验CO中是否混有CO2,C正确。
D、氯化铵和硫酸铵都可以和熟石灰生成刺激性气味的氨气,现象相同,无法鉴别,D错误。
故选:D。
14.B
【详解】
A、二氧化碳是引起“温室效应”的主要气体,故A正确;
B、铵盐与显碱性的物质混合时,能够反应生成氨气,降低肥效,故B错误;
C、pH<5.6的雨水属于酸雨,它的形成与大气中SO2等酸性污染物增多有关,故C正确;
D、塑料制品的随意丢弃是造成白色污染的主要原因,所以研制并使用可降解塑料能缓解白色污染,故D正确.
故选B.
15.D
【详解】
A、在水源地大量网箱养鱼会因为鱼类排便、呼吸缺氧死亡而造成水体污染,不符合题意;
B、大量使用化肥、农药会造成水体污染,不符合题意;
C、在河边填埋生活垃圾会因为降雨造成水体污染,不符合题意;
D、工业废水经净化处理达标后排放可以防止水污染,符合题意。故选D。
16.A
【详解】
A、硫在空气中燃烧,发出淡蓝色火焰,产生一种具有刺激性气味的气体,故错误;
B、二氧化碳能使澄清的石灰水变浑浊,实验室通常用澄清石灰水溶液来检验二氧化碳的气体,故正确;
C、铵盐与碱性物质混合研磨后能放出有刺激性气味的气体,区别尿素与铵盐的方法是加碱,混合研磨,故正确;
D、金刚石、石墨和C60的化学性质相似,物理性质差异较大,是因为它们碳原子的排列方式不同,故正确。故选A。
17.26.5 在该温度下,氯化钠和硝酸钾的溶解度相等 复合 降温结晶或冷却
【详解】
(1)根据题目信息和表格可知:20℃时,氯化钠饱和溶液的溶质质量分数=; (2)图中两溶解度曲线交点的意义是:在该温度下,氯化钠和硝酸钾的溶解度相等;画图如下:;(3)KNO3是化学肥料中的复合肥料,因为硝酸钾中有钾元素和氮元素;从热的KNO3浓溶液中析出晶体的方法是:降温结晶或冷却。
18.A N2+3H22NH3 BCD CO2 D
【详解】
(1)A、硫酸铵含有氮元素,属于氮肥; B、磷矿粉中含磷元素,属于磷肥;C、硫酸钾中含有钾元素,属于钾肥。故选A;
(2)氮气和氢气在高温、高压和催化剂的条件下,制得氨气,该反应的化学方程式是N2+3H22NH3;
(3)①从滤液中获取(NH4)2SO4晶体,必须的操作步骤是蒸发浓缩、冷却结晶、过滤故答案为BCD;
②根据流程图,该生产过程中可以循环使用的X是CO2;
③氨气的水溶液呈碱性。在生产中,要检查输送氨气的管道是否漏气,可选用湿润的红色石蕊试纸。故选D。
19.沸点 物理 N2+H2NH3 AC 检查装置气密性 石灰水变浑浊 CO2+Ca(OH)2CaCO3+H2O 去除混合气体中的H2O和CO2 3.4 14%
【详解】
(1)利用氮气和氧气的沸点不同可以分离出氮气和氧气;此过程没有生成新物质,属于物理变化;
(2)氢气和氮气在一定条件下生成氨气,反应的符号表达式为:N2+H2NH3;
(3)由标签中的“防潮防晒”可知,碳酸氢铵易溶于水且受热易分解,不能说明碳酸氢铵具有挥发性;
(4)①用A装置给碳酸氢铵加热,装药品前,必须进行的一步操作是:检查装置的气密性;
②取适量碳酸氢铵加入试管,连接A、B装置,加热,碳酸氢铵受热分解生成氨气、二氧化碳和水,二氧化碳能使澄清石灰水变浑浊,所以观察到试管口的现象是有水珠出现,B中的现象是澄清石灰水变浑浊;B装置内发生反应的符号表达式为:CO2+Ca(OH)2CaCO3+H2O;
③碱石灰能够吸收H2O和CO2,但是不吸收NH3,所以C装置的作用是去除混合气体中的H2O和CO2;
④碱石灰能吸收水和二氧化碳,浓硫酸和氨气反应生成硫酸铵,所以实验后D装置增加的质量就是氨气的质量,所以氨气的质量为152.4g-149g=3.4g;
⑤化肥含氮元素质量分数=×100%=14%。
20.电能 Cu、Zn MnO2 NH4Cl、ZnCl2 淀粉 过滤 二氧化锰和炭粉 灼烧(或暴露在空气中加强热) 取样于试管中,加入氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口 产生强烈刺激性气味气体,湿润的红色石蕊试纸变蓝色 NH4Cl+NaOHNaCl+H2O+NH3↑ 铜表面有银白色固体析出,溶液由无色变为蓝色 Cu+2AgNO3=2Ag+Cu(NO3)2 置换
【详解】
(1)电池是化学能转化为电能的装置,故填:电能;
(2)由同种元素组成的纯净物叫做单质,如:电池中的铜、锌属于金属单质;
由两种元素组成的化合物中,其中一种是氧元素的叫做氧化物,如电池中的二氧化锰;
盐是由金属离子(铵根离子)和酸根离子构成的化合物,如电池中的氯化铵、氯化锌;
其中淀粉属于有机物。故填:Cu、Zn;MnO2;NH4Cl、ZnCl2;淀粉;
(3)②碳棒周围的黑色粉末主要有二氧化锰、碳粉和氯化铵,因为氯化铵溶于水,所以可先溶解,再过滤,滤液为氯化铵溶液,滤渣是二氧化锰和碳粉;
③根据实验目的是要达到纯净干燥的二氧化锰,所以对滤渣进行灼烧,可以将碳粉变为二氧化碳除去,表面残留的氯化铵受热分解也除去了;
④根据氯化铵溶液与碱反应可以生成氨气,NH4Cl+NaOHNaCl+H2O+NH3↑,氨气呈碱性且有刺激性气味,能使湿润的红色石蕊试纸变蓝色,所以可以设计实验为取少量滤液于试管中,加入氢氧化钠溶液,然后检验生成的气体即可;
故答案为:②过滤;二氧化锰和炭粉;③灼烧(或暴露在空气中加强热);
④取样于试管中,加入氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口;产生强烈刺激性气味气体,湿润的红色石蕊试纸变蓝色;NH4Cl+NaOHNaCl+H2O+NH3↑。
(3)分离回收铜帽,经净化处理后放入硝酸银溶液中,铜与硝酸银反应生成了硝酸铜和银,反应的化学方程式是:Cu+2AgNO3=2Ag+Cu(NO3)2,反应现象是铜表面有银白色固体析出,溶液由无色变为蓝色,该反应是单质与化合物反应生成单质和化合物,属于置换反应;故填:铜表面有银白色固体析出,溶液由无色变为蓝色;Cu+2AgNO3=2Ag+Cu(NO3)2;置换。
21.C OH- 搅拌,防止因局部温度过高造成液滴飞溅 (或) 氯化钙、氯化钡、氯化镁 当不再有气泡出时停止滴加稀盐酸 解:设反应后生成氯化钙质量为x
x=11.1g
答:滤液中氯化钙的质量分数是10.5%。
【详解】
(1) A 、铵态氮肥和碱性物质反应生成氨气,造成肥效降低,草木灰显碱性,故氯化铵与草木灰不能混合施用,错误;
B 、烧碱是氢氧化钠俗名;纯碱碳酸钠既可以从内陆盐湖提取,又可用侯氏联合制碱法制取,错误;
C 、小苏打可以和胃酸中盐酸反应,可用于治疗胃酸过多,正确;
D 、生石灰氧化钙和水反应可以得到熟石灰,错误。
故选C。
(2)碱具有通性的原因是电离出的阴离子都是氢氧根离子。氢氧化锂(LiOH)与氢氧化钠化学性质相似,其原因是溶液中都有氢氧根离子0H-。
(3) 氧化铁和盐酸反应生成氯化铁和水,。
(4)Ⅰ.在操作①、操作②、操作③中都会用到同一种玻璃仪器:玻璃棒;操作③为蒸发结晶得到氯化钠晶体,玻璃棒的作用搅拌,防止因局部温度过高造成液滴飞溅。
Ⅱ.操作②中碳酸钠可以和氯化钙及过量的氯化钡反应除去杂质,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠:(或碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠:)。
Ⅲ.上述流程中若将过滤和加盐酸的操作顺序颠倒,那么加入的稀盐酸会和前面生成的氢氧化镁固体、碳酸钙固体、碳酸钡固体分别反应生成引入氯化镁、氯化钙、氯化钡杂质。
Ⅳ.滤液M中含有过量的碳酸钠和氢氧化钠,盐酸首先和氢氧化钠反应生成氯化钠和水,再和碳酸钠反应生成氯化钠和水和二氧化碳,当不再有气泡冒出时停止滴加稀盐酸,此时盐酸适量。
(5)见答案。
22.CuSO4、ZnSO4 把CuSO4中的铜全部置换出来 蒸发 B 解:设铜帽中锌的质量分数为x
答:铜帽中铜的质量分数为67.5%。
【分析】
废旧干电池中有锌皮、铜帽(含Cu、Zn)、石墨、二氧化锰、氯化铵等物质,加水后得到固体中有锌皮、铜帽(含Cu、Zn)、石墨、二氧化锰,从中分拣出铜和锌,加稀硫酸后,锌与硫酸反应生成硫酸锌,铜与硫酸和氧气反应生成硫酸铜,则溶液Ⅰ中有CuSO4、ZnSO4;加入过量的物质A后得到固体Ⅱ,那说明A是锌,它与溶液中的硫酸铜反应生成铜和硫酸锌溶液,因为A过量,所以固体Ⅱ中有铜和锌两种物质,加入物质B后得到的只有铜和硫酸锌溶液,说明B是稀硫酸。
【详解】
(1)由分析可知,溶液Ⅰ中有CuSO4、ZnSO4;
(2)加过量A(锌)的目的是将溶液中的CuSO4中的铜全部置换出来;通过蒸发硫酸锌溶液可以得到硫酸锌固体;
(3)锌与硫酸铜反应生成铜和硫酸锌,化学方程式为:Zn+CuSO4=Cu+ZnSO4;
(4)A、氯化铵是由铵根离子与酸根离子构成的化合物,属于盐,选项错误;
B、长期使用氯化铵会出现土壤酸化板结现象,说明氯化铵显酸性,可以使紫色石蕊溶液变红,选项正确;
C、NH4Cl只含氮元素,属于氮肥,不属于复合肥,选项错误;
D、NH4Cl与熟石灰(氢氧化钙)混合使用会产生氨气,降低肥效,选项错误;
故选:B。
(5)根据表中数据分析第三次实验中锌完全反应,稀硫酸有剩余,因此生成氢气总质量为0.20g,根据化学方程式计算出锌的质量分数为32.5%,则铜的质量分数为67.5%。具体计算过程见答案。
同课章节目录
