氧化还原反应
图片预览









文档简介
课件45张PPT。Welcome To Our Chemistry Class!ChemistryTopic
氧化还原反应
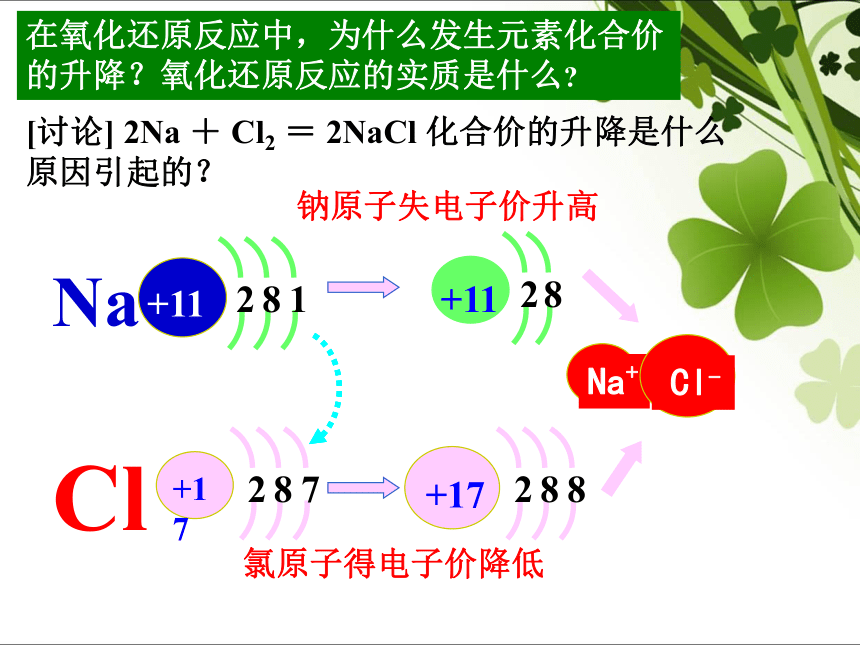
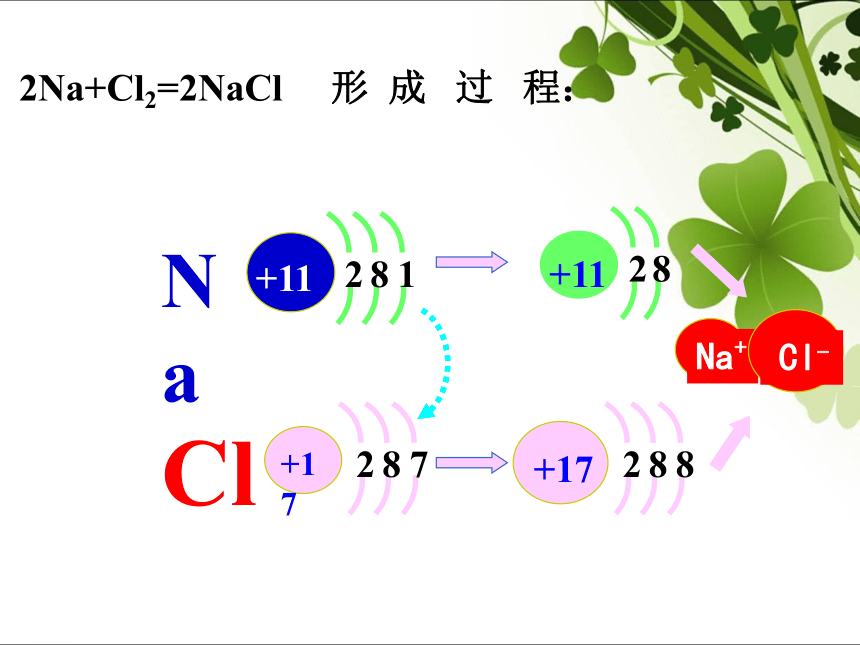
Aims感受氧化还原反应的存在 刚削好的苹果放置30分钟以后的苹果刚泡好的绿茶放置2小时后的绿茶感受氧化还原反应的存在 感受氧化还原反应的存在 好吃的月饼幕后的英雄(抗氧化剂)感受氧化还原反应的存在 金属生锈在氧化还原反应中,为什么发生元素化合价的升降?氧化还原反应的实质是什么?[讨论] 2Na + Cl2 = 2NaCl 化合价的升降是什么原因引起的?氯原子得电子价降低钠原子失电子价升高2Na+Cl2=2NaCl 形 成 过 程:一、氧化还原反应
概念:
本质:
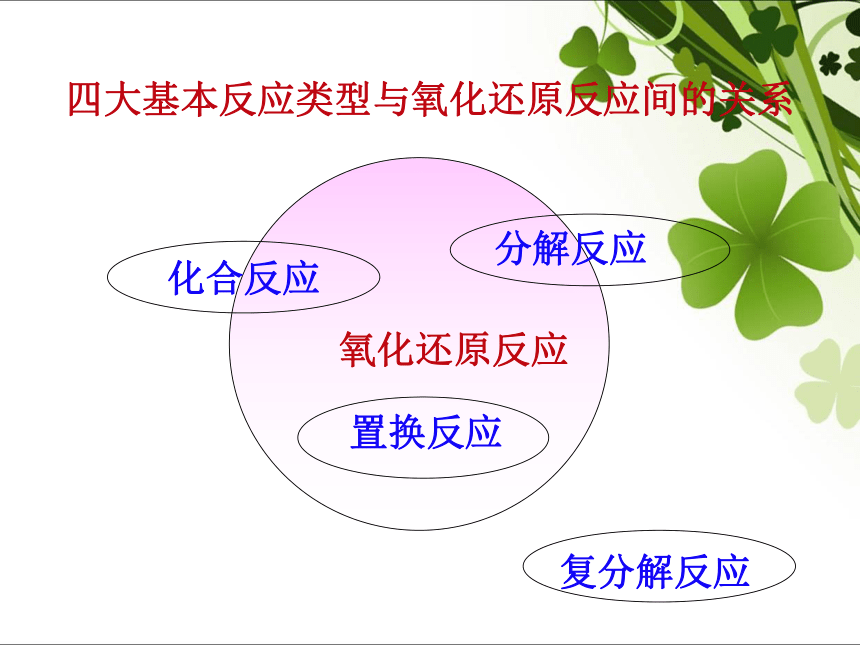
特征凡是有电子的转移(电子的得失或共用电子对的偏移)的化学反应电子的转移化合价发生了变化(判断依据)笔记思考:化合价升降的原因是什么?用化合价升降的观点判断下面反应,哪些是氧化还原反应?凡是有化合价升降的化学反应都是氧化还原反应√√√√√ 四大基本反应类型与氧化还原反应间的关系氧化还原反应 课堂练习11. 判断下列反应哪些是氧化还原反应。CO2 + 2NaOH== Na2CO3 + H2ONaOH + HCl == NaCl + H2O( X )( X )(√ )(√ )Cl2+H2O===HCl+HClO二、氧化还原反应
1、定义:
一种物质被氧化,同时另一种物质被还原的反应。
2、特征:
反应前后有元素化合价发生变化(也是判断依据)小试牛刀判断下列哪些是氧化还原反应,四种基本反应类型与氧化还原反应的关系:1. CaO + H2O == Ca (OH)2
2. C + O2 === CO2
3. CaCO3 === CaO + CO2
4. 2KMnO4 === K2MnO4 + MnO2 + O2
5. Zn + 2HCl === ZnCl2 + H2
6. CuO + 2HCl == CuCl2 + H2O 氧化还原反应:2、4、5四大基本反应类型:化合化应:A+B=AB分解反应:置换反应:复分解反应:AB=A+BA+BC=AC+BAB+CD=AD+CB
氧化还原反应置换反应复分解反应非氧化还原反应化合反应分解反应在氧化还原反应中,为什么发生元素化合价的升降?氧化还原反应的实质是什么?[讨论] 2Na + Cl2 = 2NaCl 化合价的升降是什么原因引起的?钠原子失电子价升高
氯原子得电子价降低Cl+我想要一个电子。Na老兄,干嘛愁眉苦脸的?
●●●●●●Cl●●Na+你给我一个电子,好吗?让我想想那好吧●●●●●●●●谢谢你!Cl﹣没关系,互相帮助嘛。Na﹢●NaCl●Cl-Na+还原反应氧化反应氧化剂还原剂得到电子,被还原失去电子,被氧化化合价升降的原因: 电子的转移,包括得失或偏移,综上所述,可以给氧化还原反应下一个更为本质的定义:凡是有电子转移(得失或偏移)的反应都是氧化还原反应。讲授新知二、氧化剂和还原剂
1. 定义:
氧化剂:得到电子(元素化合价降低)的物质
———被还原。
还原剂:失去电子(元素化合价升高)的物质
———被氧化。遵循两个守恒:注意失电子总数=得电子总数化合价升高总数=化合价降低总数2. 常见的氧化剂和还原剂氧化剂:
⑴某些非金属单质:O2、Cl2、S、F2等
⑵某些含氧酸:浓硫酸、HNO3、HClO
⑶含高价金属的盐:KMnO4、 FeCl3等还原剂:
⑴活泼金属单质:Al、Zn、Fe等
⑵某些非金属单质:C、H2等
⑶含低价元素的化合物:CO、H2S、Fe2+等练习:
1、在下列反应中,属于氧化还原反应的是( )
A、CaCO3+2HCl = CaCl2+CO2 +H2O
B、CaO + H2O = Ca(OH)2
C、2H2O2 ==== 2H2O + O2
D、CaCO3 === CaO + CO2
2、在下列反应中,HCl中氯元素的化合价发生变化的是( ),HCl中氢元素的化合价发生变化的是( )
A、NaOH + HCl = NaCl + H2O
B、Zn +2HCl = ZnCl2 + H2
C、MnO2 + 4HCl(浓) == MnCl2 + 2H2O + Cl2
D、CuO + 2HCl = CuCl2 + H2O 催化剂高温CCB2、判断下列反应哪些是氧化剂、还原剂、氧化产物、还原产物4、 2FeCl2 + Cl2 = 2FeCl3 1、Zn+CuSO4=Cu+ZnSO4三、双线桥法表示电子转移情况的步骤及特点2. 常见的氧化剂和还原剂:
氧化剂:O2、Cl2、HClO,MnO2等。
还原剂:Al、Zn、Fe、C、H2、CO 、KI 等:
1 、标化合价,找变价
2、画线桥:箭头从反应物指向生成物,起止为同一元素,箭头不代表电子转移方向
3、写数目:电子转移的数目用a×b e-的形式(a表示共有多少个原子得失电子,b表示每个原子得失电子数)
4、检查:电子有得必有失,电子得失总数应相等(得电子总数=失电子总数,化合价升高总数=化合价降低总数)得电子,化合价降低,还原反应
失电子,化合价升高,氧化反应
氧化还原在反应中相伴而生,即得失电子必然同时进行,且得失电子总数必然相等。记忆方法写出工业制Cl2,实验室制Cl2及工业制漂白粉的化学反应方程式,用双线桥表示电子转移,并注明还原剂,氧化剂,还原产物和氧化产物你会多少?还原剂失电子被氧化化合价升高氧化剂得电子被还原化合价降低氧化反应氧化产物还原反应还原产物 氧化剂+还原剂 ==== 还原产物 + 氧化产物失电子,化合价升高,被氧化
得电子,化合价降低,被还原
小结板书设计 (即小结)如下:
一、氧化还原反应
1、定义:2、特征:
二、氧化剂和还原剂
1. 定义:
氧化剂:得到电子(元素化合价降低)的物质——被还原。
还原剂:失去电子(元素化合价升高)的物质——被氧化
2. 常见的氧化剂和还原剂:
氧化剂:O2、Cl2、HClO,MnO2等。
还原剂:Al、Zn、Fe、C、H2、CO 、KI 等双线桥法+4+2-10得2e-失2e-步骤:
①标价态:变价元素的价态
②连双线:箭头从反应物指向生成物的同种元素;
③注得失:电子转移的数目表示:a×be-
(a:原子个数 b:每个原子得失电子数)
④检查:得电子总数=失电子总数=转移的电子总数三、氧化还原反应电子转移的表示方法MnO2 + 4HCl(浓) = MnCl2 + Cl2 + 2H2O用双线桥表示并标明化合价升降、得失电子数、被氧化被还原情况。3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O0 +5 +2 +2化合价升高,失3×2e-,被氧化化合价降低,得2×3e-,被还原氧化剂___________ 还原剂___________
氧化产物__________ 还原产物_________
转移的电子数____________HNO3 CuCu(NO3)2NO6e-用双线桥表示下列氧化还原反应并指明氧化剂和还原剂失2e-得2e-失2xe-得2xe-失2x3e-得6xe-课堂练习3在反应中,氧化剂是_____,氧化产物是________,氧化产物与还原产物的物质的量之比为_________,若有0.2mol HCl被氧化,产生的Cl2质量为________g,电子转移的总数为 _____,MnO2Cl21:1 7.10.2mol失2e-得2e-课堂练习4四、氧化还原反应的规律①可以根据化学反应判断
氧化性: 氧化剂 > 氧化产物
还原性:还原剂 > 还原产物⑴氧化性、还原性强弱的比较 已知:判断下列物质的氧化能力由强到弱的顺序是( )
A. B. C.。 D. B②根据金属活动性顺序进行判断 P导学39延伸:金属单质的还原性 K > Ca > Na > Mg ……
对应阳离子的氧化性 K+ < Ca 2+ < Na+ < Mg 2+ ……延伸:非金属单质的氧化性 F2> Cl2 > Br2 > I2 >S ……
对应阴离子的氧化性 F- < Cl - < Br- < I-如:浓H2SO4 HNO3 FeCl3 KMnO4
②元素最低价态:只具有还原性
如: KI H2S Zn HCl
③元素中间价态:既具有氧化性又有还原性
如: FeCl2 S SO2 Cl2 CO 练习6:
氯的原子结构示意图为 , 氯元素有多种化合价,其最高正价为+7价,最低化合价为 。在微粒Cl2、Cl-、ClO-、ClO3-、ClO4-中,氯元素的化合价依次是 ,从氯元素的化合价分析,上述微粒中有还原性而无氧化性的是 ,有氧化性而无还原性的是 。-1价0价、-1价、+1价、+5价、+7价Cl-ClO4- 练习:在几种微粒中,
只有氧化性的是________,
只有还原性的是__________,
既有氧化性又有还原性的是_________。 提示:金属无负价;非金属一般既有正价,又有负价;F无正价,O一般为-2价√从元素化合价升降、电子得失角度分析:得电子总数=失电子总数=电子转移总数⑶氧化还原反应中得失电子的关系例:结论:谢谢
氧化还原反应
Aims感受氧化还原反应的存在 刚削好的苹果放置30分钟以后的苹果刚泡好的绿茶放置2小时后的绿茶感受氧化还原反应的存在 感受氧化还原反应的存在 好吃的月饼幕后的英雄(抗氧化剂)感受氧化还原反应的存在 金属生锈在氧化还原反应中,为什么发生元素化合价的升降?氧化还原反应的实质是什么?[讨论] 2Na + Cl2 = 2NaCl 化合价的升降是什么原因引起的?氯原子得电子价降低钠原子失电子价升高2Na+Cl2=2NaCl 形 成 过 程:一、氧化还原反应
概念:
本质:
特征凡是有电子的转移(电子的得失或共用电子对的偏移)的化学反应电子的转移化合价发生了变化(判断依据)笔记思考:化合价升降的原因是什么?用化合价升降的观点判断下面反应,哪些是氧化还原反应?凡是有化合价升降的化学反应都是氧化还原反应√√√√√ 四大基本反应类型与氧化还原反应间的关系氧化还原反应 课堂练习11. 判断下列反应哪些是氧化还原反应。CO2 + 2NaOH== Na2CO3 + H2ONaOH + HCl == NaCl + H2O( X )( X )(√ )(√ )Cl2+H2O===HCl+HClO二、氧化还原反应
1、定义:
一种物质被氧化,同时另一种物质被还原的反应。
2、特征:
反应前后有元素化合价发生变化(也是判断依据)小试牛刀判断下列哪些是氧化还原反应,四种基本反应类型与氧化还原反应的关系:1. CaO + H2O == Ca (OH)2
2. C + O2 === CO2
3. CaCO3 === CaO + CO2
4. 2KMnO4 === K2MnO4 + MnO2 + O2
5. Zn + 2HCl === ZnCl2 + H2
6. CuO + 2HCl == CuCl2 + H2O 氧化还原反应:2、4、5四大基本反应类型:化合化应:A+B=AB分解反应:置换反应:复分解反应:AB=A+BA+BC=AC+BAB+CD=AD+CB
氧化还原反应置换反应复分解反应非氧化还原反应化合反应分解反应在氧化还原反应中,为什么发生元素化合价的升降?氧化还原反应的实质是什么?[讨论] 2Na + Cl2 = 2NaCl 化合价的升降是什么原因引起的?钠原子失电子价升高
氯原子得电子价降低Cl+我想要一个电子。Na老兄,干嘛愁眉苦脸的?
●●●●●●Cl●●Na+你给我一个电子,好吗?让我想想那好吧●●●●●●●●谢谢你!Cl﹣没关系,互相帮助嘛。Na﹢●NaCl●Cl-Na+还原反应氧化反应氧化剂还原剂得到电子,被还原失去电子,被氧化化合价升降的原因: 电子的转移,包括得失或偏移,综上所述,可以给氧化还原反应下一个更为本质的定义:凡是有电子转移(得失或偏移)的反应都是氧化还原反应。讲授新知二、氧化剂和还原剂
1. 定义:
氧化剂:得到电子(元素化合价降低)的物质
———被还原。
还原剂:失去电子(元素化合价升高)的物质
———被氧化。遵循两个守恒:注意失电子总数=得电子总数化合价升高总数=化合价降低总数2. 常见的氧化剂和还原剂氧化剂:
⑴某些非金属单质:O2、Cl2、S、F2等
⑵某些含氧酸:浓硫酸、HNO3、HClO
⑶含高价金属的盐:KMnO4、 FeCl3等还原剂:
⑴活泼金属单质:Al、Zn、Fe等
⑵某些非金属单质:C、H2等
⑶含低价元素的化合物:CO、H2S、Fe2+等练习:
1、在下列反应中,属于氧化还原反应的是( )
A、CaCO3+2HCl = CaCl2+CO2 +H2O
B、CaO + H2O = Ca(OH)2
C、2H2O2 ==== 2H2O + O2
D、CaCO3 === CaO + CO2
2、在下列反应中,HCl中氯元素的化合价发生变化的是( ),HCl中氢元素的化合价发生变化的是( )
A、NaOH + HCl = NaCl + H2O
B、Zn +2HCl = ZnCl2 + H2
C、MnO2 + 4HCl(浓) == MnCl2 + 2H2O + Cl2
D、CuO + 2HCl = CuCl2 + H2O 催化剂高温CCB2、判断下列反应哪些是氧化剂、还原剂、氧化产物、还原产物4、 2FeCl2 + Cl2 = 2FeCl3 1、Zn+CuSO4=Cu+ZnSO4三、双线桥法表示电子转移情况的步骤及特点2. 常见的氧化剂和还原剂:
氧化剂:O2、Cl2、HClO,MnO2等。
还原剂:Al、Zn、Fe、C、H2、CO 、KI 等:
1 、标化合价,找变价
2、画线桥:箭头从反应物指向生成物,起止为同一元素,箭头不代表电子转移方向
3、写数目:电子转移的数目用a×b e-的形式(a表示共有多少个原子得失电子,b表示每个原子得失电子数)
4、检查:电子有得必有失,电子得失总数应相等(得电子总数=失电子总数,化合价升高总数=化合价降低总数)得电子,化合价降低,还原反应
失电子,化合价升高,氧化反应
氧化还原在反应中相伴而生,即得失电子必然同时进行,且得失电子总数必然相等。记忆方法写出工业制Cl2,实验室制Cl2及工业制漂白粉的化学反应方程式,用双线桥表示电子转移,并注明还原剂,氧化剂,还原产物和氧化产物你会多少?还原剂失电子被氧化化合价升高氧化剂得电子被还原化合价降低氧化反应氧化产物还原反应还原产物 氧化剂+还原剂 ==== 还原产物 + 氧化产物失电子,化合价升高,被氧化
得电子,化合价降低,被还原
小结板书设计 (即小结)如下:
一、氧化还原反应
1、定义:2、特征:
二、氧化剂和还原剂
1. 定义:
氧化剂:得到电子(元素化合价降低)的物质——被还原。
还原剂:失去电子(元素化合价升高)的物质——被氧化
2. 常见的氧化剂和还原剂:
氧化剂:O2、Cl2、HClO,MnO2等。
还原剂:Al、Zn、Fe、C、H2、CO 、KI 等双线桥法+4+2-10得2e-失2e-步骤:
①标价态:变价元素的价态
②连双线:箭头从反应物指向生成物的同种元素;
③注得失:电子转移的数目表示:a×be-
(a:原子个数 b:每个原子得失电子数)
④检查:得电子总数=失电子总数=转移的电子总数三、氧化还原反应电子转移的表示方法MnO2 + 4HCl(浓) = MnCl2 + Cl2 + 2H2O用双线桥表示并标明化合价升降、得失电子数、被氧化被还原情况。3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O0 +5 +2 +2化合价升高,失3×2e-,被氧化化合价降低,得2×3e-,被还原氧化剂___________ 还原剂___________
氧化产物__________ 还原产物_________
转移的电子数____________HNO3 CuCu(NO3)2NO6e-用双线桥表示下列氧化还原反应并指明氧化剂和还原剂失2e-得2e-失2xe-得2xe-失2x3e-得6xe-课堂练习3在反应中,氧化剂是_____,氧化产物是________,氧化产物与还原产物的物质的量之比为_________,若有0.2mol HCl被氧化,产生的Cl2质量为________g,电子转移的总数为 _____,MnO2Cl21:1 7.10.2mol失2e-得2e-课堂练习4四、氧化还原反应的规律①可以根据化学反应判断
氧化性: 氧化剂 > 氧化产物
还原性:还原剂 > 还原产物⑴氧化性、还原性强弱的比较 已知:判断下列物质的氧化能力由强到弱的顺序是( )
A. B. C.。 D. B②根据金属活动性顺序进行判断 P导学39延伸:金属单质的还原性 K > Ca > Na > Mg ……
对应阳离子的氧化性 K+ < Ca 2+ < Na+ < Mg 2+ ……延伸:非金属单质的氧化性 F2> Cl2 > Br2 > I2 >S ……
对应阴离子的氧化性 F- < Cl - < Br- < I-
②元素最低价态:只具有还原性
如: KI H2S Zn HCl
③元素中间价态:既具有氧化性又有还原性
如: FeCl2 S SO2 Cl2 CO 练习6:
氯的原子结构示意图为 , 氯元素有多种化合价,其最高正价为+7价,最低化合价为 。在微粒Cl2、Cl-、ClO-、ClO3-、ClO4-中,氯元素的化合价依次是 ,从氯元素的化合价分析,上述微粒中有还原性而无氧化性的是 ,有氧化性而无还原性的是 。-1价0价、-1价、+1价、+5价、+7价Cl-ClO4- 练习:在几种微粒中,
只有氧化性的是________,
只有还原性的是__________,
既有氧化性又有还原性的是_________。 提示:金属无负价;非金属一般既有正价,又有负价;F无正价,O一般为-2价√从元素化合价升降、电子得失角度分析:得电子总数=失电子总数=电子转移总数⑶氧化还原反应中得失电子的关系例:结论:谢谢
