第9章第三节溶解度分层作业基础练习-2021-2022学年九年级化学京改版下册(word版含解析)
文档属性
| 名称 | 第9章第三节溶解度分层作业基础练习-2021-2022学年九年级化学京改版下册(word版含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 366.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-25 22:24:48 | ||
图片预览



文档简介
第三节溶解度分层作业基础练习第九章溶液2021_2022学年九年级化学(京改版2013)
一.选择题(共13小题)
1.如图是探究物质溶于水时热量变化的实验过程,有关说法正确的是( )
A.②中搅拌可增加硝酸钾在水中溶解的质量
B.④中大烧杯中放入的a物质可能是氯化钠
C.⑤中的溶液一定是硝酸钾的饱和溶液
D.⑥中大烧杯中放入的b物质可能是硝酸铵
2.NaCl和KNO3的溶解度曲线如图所示,下列说法正确的是( )
A.NaCl的溶解度一定大于KNO3
B.NaCl的溶解度受温度影响的程度比KNO3大
C.40℃时,100g KNO3饱和溶液中含有63.9g KNO3
D.将60℃时210g KNO3饱和溶液降温至20℃,析出KNO3晶体78.4g
3.如图为KCl和Na2CO3的溶解度曲线,下列说法正确的是( )
A.T1℃时两物质溶液中溶质质量分数相等
B.T2℃时将20g Na2CO3加入50g水中,充分搅拌得70g溶液
C.降低温度一定能使Na2CO3的饱和溶液变成不饱和溶液
D.T2℃时两物质的饱和溶液升温到T3℃,所得溶液中溶质质量分数大小关系为:KCl=Na2CO3
4.冬天,人们喜欢喝热的可乐。打开可乐盖时可观察到有大量气泡冒出,而且能闻到可乐的香味,但加热之后就观察不到气泡了。对此合理的解释是( )
A.香料的分子在不停地运动
B.打开盖时,二氧化碳分子分成了原子
C.加热时,二氧化碳的溶解度增大
D.打开盖时,二氧化碳的溶解度增大
5.下表提供了A、B两种固体物质的溶解度数据。下列判断正确的是( )
温度℃ 0 20 40 60 80 100
溶解度/g A 27.6 37.0 50.0 59.5 69.1 77.8
B 13.3 36.6 75.9 120 172 246
A.A、B两种物质都属于微溶物
B.40℃时,将20g A加入到50g水中,充分溶解可获得A的饱和溶液
C.60℃时,B物质的饱和溶液中溶质和溶剂的质量比为15:6
D.给出的曲线中①与B物质溶解度变化趋势相符
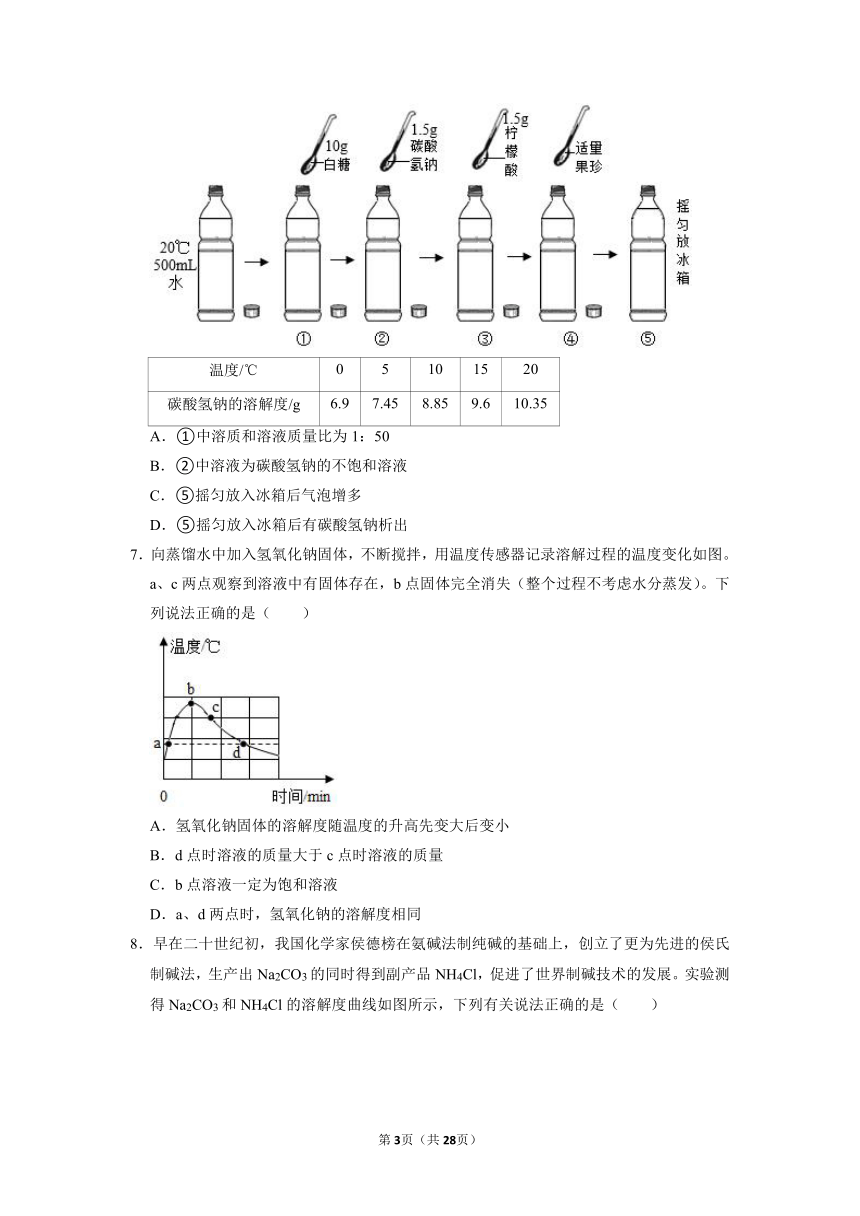
6.某同学自制汽水(如图)并记录了心得,下列记录正确的是( )
温度/℃ 0 5 10 15 20
碳酸氢钠的溶解度/g 6.9 7.45 8.85 9.6 10.35
A.①中溶质和溶液质量比为1:50
B.②中溶液为碳酸氢钠的不饱和溶液
C.⑤摇匀放入冰箱后气泡增多
D.⑤摇匀放入冰箱后有碳酸氢钠析出
7.向蒸馏水中加入氢氧化钠固体,不断搅拌,用温度传感器记录溶解过程的温度变化如图。a、c两点观察到溶液中有固体存在,b点固体完全消失(整个过程不考虑水分蒸发)。下列说法正确的是( )
A.氢氧化钠固体的溶解度随温度的升高先变大后变小
B.d点时溶液的质量大于c点时溶液的质量
C.b点溶液一定为饱和溶液
D.a、d两点时,氢氧化钠的溶解度相同
8.早在二十世纪初,我国化学家侯德榜在氨碱法制纯碱的基础上,创立了更为先进的侯氏制碱法,生产出Na2CO3的同时得到副产品NH4Cl,促进了世界制碱技术的发展。实验测得Na2CO3和NH4Cl的溶解度曲线如图所示,下列有关说法正确的是( )
A.NH4Cl的溶解度大于Na2CO3的溶解度
B.t1℃时,100g的Na2CO3饱和溶液中含溶质20g
C.t2℃时,Na2CO3和NH4Cl的饱和溶液中溶质质量分数相等
D.将t2℃时Na2CO3和NH4Cl的饱和溶液降温至t1℃,Na2CO3晶体析出的多
9.为探究硝酸钾的溶解性,进行了如图实验(见图1),结合KNO3的溶解度曲线(见图2)判断,下列说法错误的是( )
A.溶液②、溶液④一定是饱和溶液
B.溶液①、溶液③一定是不饱和溶液
C.②和④中固体的质量一定相等
D.溶液②③④的溶质质量分数:③>②=④
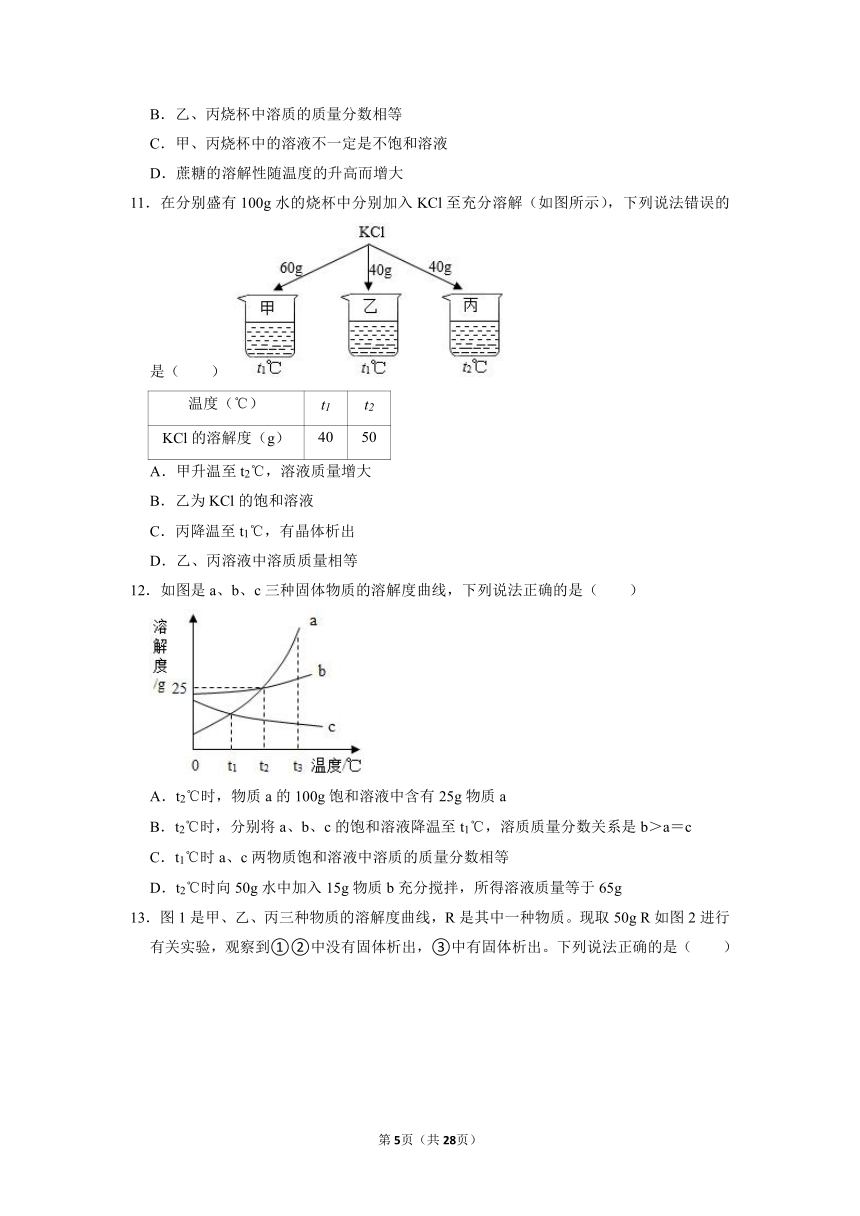
10.向盛有等质量水的甲、乙、丙三个烧杯中分别加入15g、30g、30g蔗糖固体,充分搅拌后静置,现象如图所示。下列说法错误的是( )
A.可采用升温的方法使乙烧杯中剩余的固体溶解
B.乙、丙烧杯中溶质的质量分数相等
C.甲、丙烧杯中的溶液不一定是不饱和溶液
D.蔗糖的溶解性随温度的升高而增大
11.在分别盛有100g水的烧杯中分别加入KCl至充分溶解(如图所示),下列说法错误的是( )
温度(℃) t1 t2
KCl的溶解度(g) 40 50
A.甲升温至t2℃,溶液质量增大
B.乙为KCl的饱和溶液
C.丙降温至t1℃,有晶体析出
D.乙、丙溶液中溶质质量相等
12.如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是( )
A.t2℃时,物质a的100g饱和溶液中含有25g物质a
B.t2℃时,分别将a、b、c的饱和溶液降温至t1℃,溶质质量分数关系是b>a=c
C.t1℃时a、c两物质饱和溶液中溶质的质量分数相等
D.t2℃时向50g水中加入15g物质b充分搅拌,所得溶液质量等于65g
13.图1是甲、乙、丙三种物质的溶解度曲线,R是其中一种物质。现取50g R如图2进行有关实验,观察到①②中没有固体析出,③中有固体析出。下列说法正确的是( )
A.从图2的实验结合图1分析,R是丙物质
B.①和②的溶液中,溶质的质量分数不相等
C.①②③中,只有③的上层清液是饱和溶液
D.①②③中,①的溶液中溶质的质量分数最大
二.填空题(共4小题)
14.向装有等量水的A、B、C烧杯中分别加入10g、25g、25g NaNO3固体,充分溶解后,现象如图中1所示.
(1)烧杯中的溶液一定属于饱和溶液的是 (填字母序号).
(2)图2中能表示NaNO3溶解度曲线的是 (选填“甲”或“乙”).
(3)要使B烧杯中剩余固体继续溶解,可采用的方法是 .
(4)由图2分析,若分别将100g甲、乙饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的是 (填字母序号).
A.甲、乙都是饱和溶液 B.所含溶剂质量:甲<乙
C.溶液质量:甲>乙 D.溶质质量分数:甲>乙.
15.如表是氯化钠和硝酸钾在不同温度下的溶解度(假设硝酸钾与氯化钠同时溶解在水中各自的溶解度不变,实验过程中水分损失忽略不计)。
温度(℃) 0 20 40 60 80 100
溶解度(g/100g水) KNO3 13.3 31.6 64.0 110.0 169.0 246.0
NaCl 35.7 36.0 36.6 37.3 38.4 39.8
①由表可知影响硝酸钾溶解度的因素是 。
②硝酸钾和氯化钠的溶解度相同时的温度范围是 。
A.0℃﹣20℃B.20℃﹣40℃C.40℃﹣60℃D.60℃﹣80℃
③在80℃的100g水中溶解NaCl和KNO3,进行以下实验,已知溶液a中的硝酸钾恰好饱和:
Ⅰ.操作1的名称是 。
Ⅱ.X= 克:固体C的成分和该成分的质量是 。
Ⅲ.对整个实验过程分析正确的是 。
A.40℃﹣60℃开始析出晶体
B.氯化钠在整个过程中一直保持不饱和状态
C.上述方法不能将氯化钠和硝酸钾完全分离
D.原溶液直接降温结晶,析出硝酸钾的质量不变
16.如图是甲、乙、丙三种物质的溶解度曲线。据此回答下列问题:
(1)图中P点的含义是 。
(2)将等质量的甲、乙、丙三种物质,分别配制成t1℃时的饱和溶液,需要水的质量最少的是 。
(3)将丙的饱和溶液变为不饱和溶液,在不改变溶液质量的前提下,宜采用的方法是 。
(4)将t2℃时,甲、乙、丙三种物质等质量的饱和溶液降温到t1℃,所得三种溶液的质量由大到小的顺序是 (用甲、乙、丙表示)。
17.A、B、C三种物质的溶解度曲线如图所示,根据如图回答:
(1)M点表示的意义是
(2)当温度为t1℃时,三种物质溶解度由小到大依次为 ,当温度为t3℃时,溶解度最大的是 。
(3)如果分别把A、B、C放入100g水中配成t3℃时的饱和溶液,再冷却到t1℃,析出晶体最多的是 没有晶体析出的是 。
(4)将某温度下一瓶接近饱和的C溶液变为饱和溶液,可采取的措施是 ; ; 。
(5)t3℃时,在90gA物质的饱和溶液中,含有A物质 克。
三.解答题(共3小题)
18.下面的表格中列出了NH4Cl在不同温度下的溶解度:
温度/℃ 0 10 20 30 40 50 60 70 80
溶解度/g 29.4 33.3 37.2 41.4 45.8 50.4 55.2 60.2 65.6
(1)由上表可推出溶解度曲线的变化规律是 ;
(2)在20℃时,向100g水中加入50g NH4Cl,形成的 (填“饱和”或“不饱和”)溶液,将其温度升高到60℃时,该溶液中溶质与溶剂的质量比为 。
19.根据表中氯化钠和硝酸钾部分溶解度数据分析,回答下列问题。
温度/℃ 0 10 20 30 40 50 60
溶解度/g
NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
(1)10℃时,氯化钠的溶解度是 g。
(2)与硝酸钾相比较,氯化钠的溶解度受温度变化影响 (填“较大”或“较小”)。
(3)20℃时,在100g水中加入40g硝酸钾,充分搅拌后,将溶液温度升高到30℃(不考虑水分蒸发),所得溶液是 (填“饱和溶液”或“不饱和溶液”)。
20.根据图中(Ⅰ)和(Ⅱ)回答问题:
(1)在t1℃时,等质量的甲、乙两种固体物质在水中的溶解现象,如图(Ⅰ)所示,要使剩余的甲固体继续溶解可采用的方法是 。
(2)图(Ⅱ)中a、b分别表示上述两种物质的溶解度曲线,在 ℃时,这两种物质的溶解度相等;a表示的是 物质(填“甲”或“乙”)的溶解度曲线。
第三节溶解度分层作业基础练习第九章溶液2021_2022学年九年级化学(京改版2013)
参考答案与试题解析
一.选择题(共13小题)
1.如图是探究物质溶于水时热量变化的实验过程,有关说法正确的是( )
A.②中搅拌可增加硝酸钾在水中溶解的质量
B.④中大烧杯中放入的a物质可能是氯化钠
C.⑤中的溶液一定是硝酸钾的饱和溶液
D.⑥中大烧杯中放入的b物质可能是硝酸铵
【分析】A、根据搅拌可以加快溶解速率,不能增大溶解量来分析;
B、根据氯化钠溶于水,温度几乎不变来分析;
C、根据饱和溶液的判断方法来分析;
D、根据硝酸铵溶于水吸收热量,温度降低来分析。
【解答】解:A、②中搅拌可加快硝酸钾的溶解速率,但不能增加硝酸钾在水中溶解的质量,故A错误;
B、硝酸钾的溶解度随着温度的升高而增大,④中大烧杯中放入a物质后,硝酸钾完全溶解,说明该物质溶于水放出热量,不可能是氯化钠,故B错误;
C、⑤中硝酸钾完全溶解,所得溶液可能是硝酸钾的饱和溶液,也可能是硝酸钾的不饱和溶液,故C错误;
D、⑥中大烧杯中放入的b物质后,部分硝酸钾结晶析出,说明该物质溶于水吸收热量,温度降低,因此该物质可能是硝酸铵,故D正确。
故选:D。
【点评】在解此类题时,首先要将题中的知识认知透,然后结合学过的知识进行解答。
2.NaCl和KNO3的溶解度曲线如图所示,下列说法正确的是( )
A.NaCl的溶解度一定大于KNO3
B.NaCl的溶解度受温度影响的程度比KNO3大
C.40℃时,100g KNO3饱和溶液中含有63.9g KNO3
D.将60℃时210g KNO3饱和溶液降温至20℃,析出KNO3晶体78.4g
【分析】根据题目信息和溶解度曲线可知:NaCl和KNO3的溶解度,都是随温度升高而增大,而硝酸钾的溶解度随温度的升高变化比氯化钠大;
A、溶解度大小的比较;
B、溶解度随温度的变化情况;
C、40℃时,163.9gKNO3饱和溶液中含有63.9gKNO3;
D、有关的计算要正确。
【解答】解:A、NaCl的溶解度一定大于KNO3错误,因为没有指明温度;故选项错误;
B、NaCl的溶解度受温度影响的程度比KNO3大错误,因为硝酸钾的溶解度随温度的升高变化比氯化钠大;故选项错误;
C、40℃时,163.9gKNO3饱和溶液中含有63.9gKNO3,100gKNO3饱和溶液中含有63.9gKNO3错误,故选项错误;
D、将60℃时210gKNO3饱和溶液中,水是100g,降温至20℃,溶剂不变,析出KNO3晶体质量=110g﹣31.6g=78.4g,故选项正确;
故选:D。
【点评】本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的计算,有关的计算要准确,本考点主要出现在选择题和填空题中。
3.如图为KCl和Na2CO3的溶解度曲线,下列说法正确的是( )
A.T1℃时两物质溶液中溶质质量分数相等
B.T2℃时将20g Na2CO3加入50g水中,充分搅拌得70g溶液
C.降低温度一定能使Na2CO3的饱和溶液变成不饱和溶液
D.T2℃时两物质的饱和溶液升温到T3℃,所得溶液中溶质质量分数大小关系为:KCl=Na2CO3
【分析】根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较。
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况。
根据物质的溶解度曲线、溶质质量、溶剂质量可以判断配制的溶液质量。
饱和溶液和不饱和溶液之间可以相互转化。
饱和溶液的溶质质量分数=×100%。
【解答】解:A、T1℃时两物质溶解度相等,饱和溶液中溶质质量分数相等,不饱和溶液中的溶质质量分数可能相等,也可能不相等,该选项不正确。
B、T2℃时碳酸钠的溶解度是49g,将20g Na2CO3加入50g水中,能够完全溶解,充分搅拌得70g溶液,该选项正确。
C、碳酸钠的溶解度随着温度饱和呈现不同的变化趋势,降低温度不一定能使Na2CO3的饱和溶液变成不饱和溶液,该选项不正确。
D、碳酸钠在T3℃时的溶解度大于氯化钾在T2℃时的溶解度,所得溶液中溶质质量分数大小关系为:KCl小于Na2CO3,该选项不正确。
故选:B。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
4.冬天,人们喜欢喝热的可乐。打开可乐盖时可观察到有大量气泡冒出,而且能闻到可乐的香味,但加热之后就观察不到气泡了。对此合理的解释是( )
A.香料的分子在不停地运动
B.打开盖时,二氧化碳分子分成了原子
C.加热时,二氧化碳的溶解度增大
D.打开盖时,二氧化碳的溶解度增大
【分析】根据气体的溶解度随温度的升高而减小,随着压强的增大而增大,结合分子的基本性质,进行分析判断。
【解答】解:A、能闻到可乐的香味,说明可乐中含有的分子是在不断运动的,向四周扩散,使人们闻到香味,故选项说法正确。
B、打开盖时,压强减小,二氧化碳分子间的间隔变大,二氧化碳分子本身没有发生改变,故选项说法错误。
C、加热之后就观察不到气泡,是因为温度提高,二氧化碳的溶解度减小,故选项说法错误。
D、打开盖时,压强减小,观察到有大量气泡冒出,是因为二氧化碳的溶解度减小,故选项说法错误。
故选:A。
【点评】本题难度不大,掌握气体溶解度的两个影响因素(温度、压强)、分子的基本性质是正确解答本题的关键。
5.下表提供了A、B两种固体物质的溶解度数据。下列判断正确的是( )
温度℃ 0 20 40 60 80 100
溶解度/g A 27.6 37.0 50.0 59.5 69.1 77.8
B 13.3 36.6 75.9 120 172 246
A.A、B两种物质都属于微溶物
B.40℃时,将20g A加入到50g水中,充分溶解可获得A的饱和溶液
C.60℃时,B物质的饱和溶液中溶质和溶剂的质量比为15:6
D.给出的曲线中①与B物质溶解度变化趋势相符
【分析】根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较。
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况。
根据物质的溶解度曲线、溶质质量、溶剂质量可以判断配制的溶液质量。
饱和溶液和不饱和溶液之间可以相互转化。
【解答】解:A、20℃时,A、B两种物质的溶解度都大于10g,都属于易溶物,该选项不正确。
B、40℃时A的溶解度是50.0g,将20g A加入到50g水中,充分溶解可获得A的不饱和溶液,该选项不正确。
C、60℃时,B物质的溶解度是120g,饱和溶液中溶质和溶剂的质量比为120g:100g=6:5,该选项不正确。
D、结合溶解度曲线和表中数据可知,给出的曲线中①与B物质溶解度变化趋势相符,该选项正确。
故选:D。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
6.某同学自制汽水(如图)并记录了心得,下列记录正确的是( )
温度/℃ 0 5 10 15 20
碳酸氢钠的溶解度/g 6.9 7.45 8.85 9.6 10.35
A.①中溶质和溶液质量比为1:50
B.②中溶液为碳酸氢钠的不饱和溶液
C.⑤摇匀放入冰箱后气泡增多
D.⑤摇匀放入冰箱后有碳酸氢钠析出
【分析】A、根据溶液的组成来分析;
B、根据碳酸氢钠的溶解度来分析;
C、根据温度对气体溶解度的影响来分析;
D、根据碳酸氢钠的溶解度受温度的影响来分析。
【解答】解:20℃时,500mL水的质量为500g。
A、20℃时,向500g水中加入10g蔗糖后,蔗糖完全溶解,①中溶质和溶液质量比为10g:(500g+10g)=1:51,故A错误;
B、20℃时,碳酸氢钠的溶解度为10.35g,因此该温度下向500g水中加入1.5g碳酸氢钠后所得溶液为该温度下碳酸氢钠的不饱和溶液,故B正确;
C、气体的溶解度随着温度的降低而减小,因此⑤摇匀放入冰箱后气泡减少,故C错误;
D、0℃时,碳酸氢钠的溶解度为6.9g,该温度下的500g水中最多能溶解6.9g×5=34.5g碳酸氢钠,因此⑤摇匀放入冰箱后没有碳酸氢钠析出,故D错误。
故选:B。
【点评】本题考查学生根据题中所给的信息及所学的化学知识进行分析解题的能力。
7.向蒸馏水中加入氢氧化钠固体,不断搅拌,用温度传感器记录溶解过程的温度变化如图。a、c两点观察到溶液中有固体存在,b点固体完全消失(整个过程不考虑水分蒸发)。下列说法正确的是( )
A.氢氧化钠固体的溶解度随温度的升高先变大后变小
B.d点时溶液的质量大于c点时溶液的质量
C.b点溶液一定为饱和溶液
D.a、d两点时,氢氧化钠的溶解度相同
【分析】根据题意,向蒸馏水中加入氢氧化钠固体,不断搅拌,用温度传感器记录溶解过程的温度变化,温度先升高,至b点温度达到最高;a、c两点观察到溶液中有固体存在,b点固体完全消失,结合饱和溶液的特征,进行分析判断。
【解答】解:A、向蒸馏水中加入氢氧化钠固体,温度先升高,至b点温度达到最高,c点观察到溶液中有固体存在,是因为一段时间后温度恢复至常温,温度降低,有氢氧化钠析出;不能说明氢氧化钠固体的溶解度随温度的升高先变大后变小,故选项说法错误。
B、溶液中水的质量不变,c点观察到溶液中有固体存在,说明溶液已是饱和溶液,d点时温度更低,析出的氢氧化钠更多,d点时溶液的质量小于c点时溶液的质量,故选项说法错误。
C、b点固体完全消失,可能是不饱和溶液,也可能是恰好饱和的溶液,故选项说法错误。
D、a、d两点时,温度相同,氢氧化钠的溶解度相同,故选项说法正确。
故选:D。
【点评】本题难度不大,掌握饱和溶液的特征、氢氧化钠溶于水放热等是正确解答本题的关键。
8.早在二十世纪初,我国化学家侯德榜在氨碱法制纯碱的基础上,创立了更为先进的侯氏制碱法,生产出Na2CO3的同时得到副产品NH4Cl,促进了世界制碱技术的发展。实验测得Na2CO3和NH4Cl的溶解度曲线如图所示,下列有关说法正确的是( )
A.NH4Cl的溶解度大于Na2CO3的溶解度
B.t1℃时,100g的Na2CO3饱和溶液中含溶质20g
C.t2℃时,Na2CO3和NH4Cl的饱和溶液中溶质质量分数相等
D.将t2℃时Na2CO3和NH4Cl的饱和溶液降温至t1℃,Na2CO3晶体析出的多
【分析】根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较。
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况。
根据物质的溶解度曲线、溶质质量、溶剂质量可以判断配制的溶液质量。
饱和溶液和不饱和溶液之间可以相互转化。
饱和溶液的溶质质量分数=×100%。
根据物质的溶解度曲线、溶液质量可以判断温度变化时析出固体质量的大小。
【解答】解:A、不知道温度范围,不能比较两种物质溶解度大小,该选项不正确。
B、t1℃时碳酸钠溶解度是20g,100g的Na2CO3饱和溶液中含溶质质量小于20g,该选项不正确。
C、t2℃时碳酸钠和氯化铵溶解度相等,Na2CO3和NH4Cl的饱和溶液中溶质质量分数相等,该选项正确。
D、不知道饱和溶液质量,不能比较析出晶体质量大小,该选项不正确。
故选:C。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
9.为探究硝酸钾的溶解性,进行了如图实验(见图1),结合KNO3的溶解度曲线(见图2)判断,下列说法错误的是( )
A.溶液②、溶液④一定是饱和溶液
B.溶液①、溶液③一定是不饱和溶液
C.②和④中固体的质量一定相等
D.溶液②③④的溶质质量分数:③>②=④
【分析】根据题目信息和溶解度曲线可知:A、溶液②、溶液④一定是饱和溶液正确;
B、溶液①、溶液③一定是不饱和溶液错误;
C、固体质量大小的比较;
D、溶质质量分数大小的比较。
【解答】解:A、溶液②、溶液④一定是饱和溶液正确,因为烧杯底部都有剩余固体,正确但不符合题意,故选项错误;
B、溶液①、溶液③一定是不饱和溶液错误,因为溶液③可能恰好饱和,错误符合题意,故选项正确;
C、②和④中固体的质量一定相等正确,因为是同一温度,溶质、溶剂质量一样多,正确但不符合题意,故选项错误;
D、溶液②③④的溶质质量分数:③>②=④正确,因为水都是20g,③中8g固体全部溶解,②和④溶解一样多且小于8g。正确但不符合题意,故选项错误;
故选:B。
【点评】本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的变化等,本考点主要出现在选择题和填空题中。
10.向盛有等质量水的甲、乙、丙三个烧杯中分别加入15g、30g、30g蔗糖固体,充分搅拌后静置,现象如图所示。下列说法错误的是( )
A.可采用升温的方法使乙烧杯中剩余的固体溶解
B.乙、丙烧杯中溶质的质量分数相等
C.甲、丙烧杯中的溶液不一定是不饱和溶液
D.蔗糖的溶解性随温度的升高而增大
【分析】根据题意,向盛有等质量水的甲、乙、丙三个烧杯中分别加入15g、30g、30g蔗糖固体,充分搅拌后静置,甲中蔗糖能全部溶解,乙中蔗糖有剩余,丙中蔗糖能全部溶解,进行分析判断。
【解答】解:A、向盛有等质量水的乙、丙烧杯中分别加入30g、30g蔗糖固体,充分搅拌后静置,乙中蔗糖有剩余,丙中蔗糖能全部溶解,丙中温度高,则可采用升温的方法使乙烧杯中剩余的固体溶解,故选项说法正确。
B、乙、丙烧杯中溶剂质量相等,丙中溶质的质量多,则乙、丙烧杯中溶质的质量分数不相等,故选项说法错误。
C、甲中蔗糖能全部溶解,丙中蔗糖能全部溶解,甲、丙烧杯中的溶液不一定属于不饱和溶液,也可能是恰好饱和的溶液,故选项说法正确。
D、向盛有等质量水的乙、丙烧杯中分别加入30g、30g蔗糖固体,充分搅拌后静置,乙中蔗糖有剩余,丙中蔗糖能全部溶解,丙中温度高,则蔗糖的溶解度随温度的升高而增大,故选项说法正确。
故选:B。
【点评】本题难度不大,掌握饱和溶液与不饱和溶液的特征并能灵活运用是正确解答本题的关键。
11.在分别盛有100g水的烧杯中分别加入KCl至充分溶解(如图所示),下列说法错误的是( )
温度(℃) t1 t2
KCl的溶解度(g) 40 50
A.甲升温至t2℃,溶液质量增大
B.乙为KCl的饱和溶液
C.丙降温至t1℃,有晶体析出
D.乙、丙溶液中溶质质量相等
【分析】根据题意,t1℃时,氯化钾的溶解度为40g,t2℃时,氯化钾的溶解度为50g;在分别盛有100g水的烧杯中分别加入KCl至充分溶解,t1℃时最多能溶解40gKCl,t2℃时最多能溶解50gKCl,进行分析判断。
【解答】解:A、t1℃时,氯化钾的溶解度为40g,甲中最多能溶解40gKCl,升温至t2℃,溶解度增大,氯化钾能继续溶解,溶液质量增大,故选项说法正确。
B、t1℃时,氯化钾的溶解度为40g,乙中加入的40g氯化钾恰好完全溶解,形成饱和溶液,故选项说法正确。
C、t1℃时,氯化钾的溶解度为40g,丙降温至t1℃,40g氯化钾恰好完全溶解,没有晶体析出,故选项说法错误。
D、在分别盛有100g水的烧杯中分别加入KCl至充分溶解,t1℃时最多能溶解40gKCl,t2℃时最多能溶解50gKCl,乙、丙溶液中氯化钾均全部溶解,溶质质量相等,故选项说法正确。
故选:C。
【点评】本题难度不大,掌握溶解度的含义、饱和溶液的特征等是正确解答本题的关键。
12.如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是( )
A.t2℃时,物质a的100g饱和溶液中含有25g物质a
B.t2℃时,分别将a、b、c的饱和溶液降温至t1℃,溶质质量分数关系是b>a=c
C.t1℃时a、c两物质饱和溶液中溶质的质量分数相等
D.t2℃时向50g水中加入15g物质b充分搅拌,所得溶液质量等于65g
【分析】根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较。
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况。
根据物质的溶解度曲线、溶质质量、溶剂质量可以判断配制的溶液质量。
饱和溶液和不饱和溶液之间可以相互转化。
饱和溶液的溶质质量分数=×100%。
【解答】解:A、t2℃时a的溶解度是25g,物质a的100g饱和溶液中含有小于25g物质a,该选项不正确。
B、t2℃时,分别将a、b、c的饱和溶液降温至t1℃,ab都是饱和溶液,b的溶解度大于a,因此b的质量分数大于a,由于a在t1℃时的溶解度大于c在t2℃时的溶解度,因此a的质量分数大于c,溶质质量分数关系是b>a>c,该选项不正确。
C、t1℃时a、c两物质溶解度相等,饱和溶液中溶质的质量分数相等,该选项正确。
D、t2℃时b的溶解度是25g,向50g水中加入15g物质b充分搅拌,能够溶解12.5g,所得溶液质量等于62.5g,该选项不正确。
故选:C。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
13.图1是甲、乙、丙三种物质的溶解度曲线,R是其中一种物质。现取50g R如图2进行有关实验,观察到①②中没有固体析出,③中有固体析出。下列说法正确的是( )
A.从图2的实验结合图1分析,R是丙物质
B.①和②的溶液中,溶质的质量分数不相等
C.①②③中,只有③的上层清液是饱和溶液
D.①②③中,①的溶液中溶质的质量分数最大
【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
【解答】解:A、由图2可知,R物质的溶解度随温度升高,而增大,所以R物质不可能是丙,故A错;
B、②溶液比①溶液少100g水,所以溶质的质量分数不相等,故B正确;
C、③中有固体析出,说明③属于饱和溶液,且③中含有100g水,溶解度要小于50g,所以R物质是乙,在t3℃,乙的溶解度是50g,②中恰好溶解了50g溶质,属于饱和溶液,所以②与③的上层清液都是饱和溶液,故C错;
D、②溶液比①溶液少100g水,所以②溶液的溶质质量分数大于①溶液的溶质质量分数,故D错。
故选:B。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
二.填空题(共4小题)
14.向装有等量水的A、B、C烧杯中分别加入10g、25g、25g NaNO3固体,充分溶解后,现象如图中1所示.
(1)烧杯中的溶液一定属于饱和溶液的是 B (填字母序号).
(2)图2中能表示NaNO3溶解度曲线的是 甲 (选填“甲”或“乙”).
(3)要使B烧杯中剩余固体继续溶解,可采用的方法是 升高温度、加水 .
(4)由图2分析,若分别将100g甲、乙饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的是 BD (填字母序号).
A.甲、乙都是饱和溶液 B.所含溶剂质量:甲<乙
C.溶液质量:甲>乙 D.溶质质量分数:甲>乙.
【分析】(1)一定温度下,有剩余固体存在的溶液为饱和溶液;
(2)由烧杯中不同温度下溶解的硝酸钠的质量变化分析解答;
(3)通常饱和溶液变为不饱和溶液的方法是:升高温度或增加溶剂;
(4)根据甲乙的溶解度曲线随温度变化情况,并结合选项中的问题逐一分析解答.
【解答】解:(1)由图1可知:20℃时向A烧杯中加入10g完全溶解,可能是饱和溶液;B烧杯中加入25g有剩余固体,一定属于饱和溶液;30℃加入25g全部溶解,可能是饱和溶液;
故答案为:B;
(2)由图1可知,随着温度的升高溶解的硝酸钠的质量逐渐增加,所以在图2中,能表示NaNO3溶解度曲线的是甲,故答案为:甲;
(3)由1可知:要使烧杯B中剩余固体继续溶解,可采用升高温度的方法,还可以采取加水的方法;
故答案为:升高温度、加水;
(4)A、乙的溶解度随温度降低逐渐增大,故降低温度变为不饱和溶液,故错误;
B、t2℃时甲的溶解度大于乙的溶解度,所以等质量的饱和溶液中所含溶剂的质量是甲<乙,降低温度溶剂的质量不变;故将100g甲、乙的饱和溶液从 t2℃降温到 t1℃,溶剂的质量关系依然是甲<乙,故正确;
C、分别将100g甲、乙的饱和溶液从 t2℃降温到 t1℃,甲有溶质析出,溶液的质量甲<乙,故错误;
D、等质量的甲、乙饱和溶液从 t2℃降温至 t1℃时,甲析出溶质,乙由于溶解度增大而无晶体析出.降低到 t1℃时,溶解度是甲=乙,但由于乙不是饱和溶液,所以其溶质的质量分数是甲>乙,正确;
故选B D
【点评】本题较为综合的考查了溶解度曲线的理解和应用,以及学生分析题目信息判断饱和溶液的方法,是一道能较好考查学生分析解决问题能力的好题.
15.如表是氯化钠和硝酸钾在不同温度下的溶解度(假设硝酸钾与氯化钠同时溶解在水中各自的溶解度不变,实验过程中水分损失忽略不计)。
温度(℃) 0 20 40 60 80 100
溶解度(g/100g水) KNO3 13.3 31.6 64.0 110.0 169.0 246.0
NaCl 35.7 36.0 36.6 37.3 38.4 39.8
①由表可知影响硝酸钾溶解度的因素是 温度 。
②硝酸钾和氯化钠的溶解度相同时的温度范围是 B 。
A.0℃﹣20℃B.20℃﹣40℃C.40℃﹣60℃D.60℃﹣80℃
③在80℃的100g水中溶解NaCl和KNO3,进行以下实验,已知溶液a中的硝酸钾恰好饱和:
Ⅰ.操作1的名称是 过滤 。
Ⅱ.X= 50 克:固体C的成分和该成分的质量是 KNO3,68.7g 。
Ⅲ.对整个实验过程分析正确的是 BC 。
A.40℃﹣60℃开始析出晶体
B.氯化钠在整个过程中一直保持不饱和状态
C.上述方法不能将氯化钠和硝酸钾完全分离
D.原溶液直接降温结晶,析出硝酸钾的质量不变
【分析】本题考查溶质溶解度影响因素主要包括溶剂、温度,以及饱和溶液的意义。
【解答】解:①由表中数据我们看出里面改变唯一因素为温度,溶剂为水,
故答:温度
②从表中数据可以看出,在20℃的时硝酸钾与氯化钠溶解度分别为31.6g/100g水、36.0g/100g水,在40℃时硝酸钾与氯化钠溶解度分别为64.0g/100g水、36.6g/100g水,随着温度升高两者溶解度增大,若两者溶解度相同,只能出现在此温度区间内;
故选:B
③由80℃降低到20℃时,溶解度减少,溶液中硝酸钾溶解度减少,80℃下100g水中分别可溶解硝酸钾与氯化钠为169.0g、38.4g,而加入的硝酸钾与氯化钠分别为84.5g、15g,所以全部溶解,并且都是不饱和溶液;然后将溶液采取蒸发溶剂的方法使晶体析出,此时硝酸钾达到饱和状态,设剩下溶剂质量为m,
100g 169.0g
m 84.5g
m=50g,所以需要蒸发掉50g水,硝酸钾达到饱和状态;而此时氯化钠还是15g,此时若达到饱和状态,溶解氯化钠质量为a;
100g 38.4g
50g a
a=19.2g,大于15g,所以此时氯化钠全部溶解在溶液中,未到达饱和状态;
当温度下降到20℃时,硝酸钾是饱和溶液,由于温度下降,则有硝酸钾晶体析出,此时硝酸钾在溶液中还是饱和状态,根据20℃下的溶解度计算,此时溶解硝酸钾质量b;
b=15.8g 此时溶液中溶解了15.8g硝酸钾,其余析出,质量=84.5g﹣15.8g=68.7g,所以析出硝酸钾为68.7g,而此条件下氯化钠若到达饱和状态需要溶解质量为c;
c=18g,大于15g,所以此时氯化钠还是未饱和溶液,全部溶解在溶液中,此时析出固体全部为硝酸钾,而固液分离的操作方法为过滤;
故答:Ⅰ过滤;Ⅱ50;KNO3,68.7g。
Ⅲ中A、由于硝酸钾在80℃时成为饱和溶液,所以只要温度下降,就有硝酸钾析出,所以温度不止在40℃﹣60℃就析出,而是低于80℃就析出,所以A错误;
B、从上述计算过程中,氯化钠一直处于未达到饱和的状态,不会有氯化钠析出,所以B正确;
C、20℃时氯化钠和硝酸钾分别溶液溶解了15g、15.8g,所以二者没有完全分离,所以C正确;
D、原溶液内溶剂为100g,当温度在80℃时,溶解硝酸钾质量为84.5g,为不饱和溶液,温度下降时不会有晶体析出,所以最终析出晶体质量减少,所以D错误;
故选:BC。
【点评】对于饱和溶液,减少溶剂的量一定会析出固体,不饱和溶液要根据溶解度计算减少溶剂时,其实际溶解的溶质是多少,判读其是否达到饱和状态。
16.如图是甲、乙、丙三种物质的溶解度曲线。据此回答下列问题:
(1)图中P点的含义是 t1℃时,甲、丙两种物质的溶解度相等 。
(2)将等质量的甲、乙、丙三种物质,分别配制成t1℃时的饱和溶液,需要水的质量最少的是 乙 。
(3)将丙的饱和溶液变为不饱和溶液,在不改变溶液质量的前提下,宜采用的方法是 降低温度 。
(4)将t2℃时,甲、乙、丙三种物质等质量的饱和溶液降温到t1℃,所得三种溶液的质量由大到小的顺序是 丙>乙>甲 (用甲、乙、丙表示)。
【分析】根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定溶解度相同时的温度;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断饱和溶液和不饱和溶液相互转化的方法。
【解答】解:(1)通过分析溶解度曲线可知,图中P点的含义是t1℃时,甲、丙两种物质的溶解度相等;
(2)t1℃时,乙物质的溶解度最大,所以将等质量的甲、乙、丙三种物质,分别配制成t1℃时的饱和溶液,需要水的质量最少的是乙;
(3)丙物质的溶解度随温度的将而增大,所以将丙的饱和溶液变为不饱和溶液,在不改变溶液质量的前提下,宜采用的方法是降低温度;
(4)将t2℃时,甲、乙、丙三种物质等质量的饱和溶液降温到t1℃,丙物质的溶解度增大,不会析出晶体,甲物质的溶解度受温度变化影响较大,析出较多的晶体,所以所得三种溶液的质量由大到小的顺序是丙>乙>甲。
故答案为:(1)t1℃时,甲、丙两种物质的溶解度相等;
(2)乙;
(3)降低温度;
(4)丙>乙>甲。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
17.A、B、C三种物质的溶解度曲线如图所示,根据如图回答:
(1)M点表示的意义是 t2℃时,A、B的溶解度相同
(2)当温度为t1℃时,三种物质溶解度由小到大依次为 A<C<B ,当温度为t3℃时,溶解度最大的是 A 。
(3)如果分别把A、B、C放入100g水中配成t3℃时的饱和溶液,再冷却到t1℃,析出晶体最多的是 A 没有晶体析出的是 C 。
(4)将某温度下一瓶接近饱和的C溶液变为饱和溶液,可采取的措施是 升高温度 ; 增加溶质 ; 蒸发溶剂 。
(5)t3℃时,在90gA物质的饱和溶液中,含有A物质 40 克。
【分析】(1)溶解度曲线交点P的含义:溶解度曲线交于一点表明两物质的溶解度此时相等;
(2)根据溶解度曲线可以比较同一温度下不同物质的溶解度大小;
(3)根据溶解度与温度的变化关系分析饱和溶液降温时的变化,及析出晶体的质量大小关系;
(4)根据溶解度曲线可知物质的溶解度随温度的变化情况,并结合不饱和溶液和饱和溶液的相互转化分析;
(5)根据溶解度可知物质的溶解度,并进行简单计算。
【解答】解:(1)t2℃时A与B两物质溶解度曲线的交点,说明此时它们的溶解度相等。
(2)t1℃时,三种物质溶解度从下到上依次为A、C、B,所以三种物质此时的溶解度由小到大依次为:A<C<B,t3℃时物质A的溶解度曲线在最上方,所以此时A物质的溶解度最大;
(3)根据三种物质的溶解度曲线图,由于从t3℃降温至t1℃物质A的溶解度差值大于B,所以,把A、B、C分别放入100g水中配成t3℃的饱和溶液,再冷却至t1℃,析出晶体最多的为A物质。而C物质的溶解度随降温而增大,因此C的饱和溶液降温后变成不饱和溶液,没有晶体析出;
(4)C的溶解度随温度的升高而减小,所以将某温度下一瓶接近饱和的C溶液变为饱和溶液,可采取升高温度、增加溶质、蒸发溶剂的措施;
(5)t3℃时A的溶解度是80g,即100g水中最多溶解80gA形成180g溶液,则90gA的饱和溶液中应含有40gA;
故答案为:(1)在t2℃时A与B的溶解度相等;
(2)A<C<B;A;
(3)A;C;
(4)升高温度;增加溶质;蒸发溶剂;
(5)40。
【点评】本题主要考查了固体溶解度曲线的意义及根据固体的溶解度曲线解决有关的问题。
三.解答题(共3小题)
18.下面的表格中列出了NH4Cl在不同温度下的溶解度:
温度/℃ 0 10 20 30 40 50 60 70 80
溶解度/g 29.4 33.3 37.2 41.4 45.8 50.4 55.2 60.2 65.6
(1)由上表可推出溶解度曲线的变化规律是 随温度的升高该物质的溶解度逐渐增大 ;
(2)在20℃时,向100g水中加入50g NH4Cl,形成的 饱和 (填“饱和”或“不饱和”)溶液,将其温度升高到60℃时,该溶液中溶质与溶剂的质量比为 1:2 。
【分析】(1)根据表中的溶解度的变化和温度的变化进行分析;
(2)根据20℃时氯化铵的溶解度进行分析;
根据60℃时的溶液质量和溶质质量进行分析。
【解答】解:(1)从表中的数据可以看出,温度逐渐的升高,溶解度的数值也在逐渐的增大,故答案为:随温度的升高该物质的溶解度逐渐增大;
(2)20℃时,氯化铵的溶解度是37.2g,100g水中加入50gNH4Cl,固体物质有剩余,故答案为:饱和,
60℃时,氯化铵溶解度为55.2g,氯化铵固体全部溶解,溶质质量为:50g,溶剂质量为100g,故答案为:1:2。
【点评】在解此类题时,注意识记饱和溶液的判断标准和固体溶解度随温度的变化等知识的综合应用。
19.根据表中氯化钠和硝酸钾部分溶解度数据分析,回答下列问题。
温度/℃ 0 10 20 30 40 50 60
溶解度/g
NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
(1)10℃时,氯化钠的溶解度是 35.8 g。
(2)与硝酸钾相比较,氯化钠的溶解度受温度变化影响 较小 (填“较大”或“较小”)。
(3)20℃时,在100g水中加入40g硝酸钾,充分搅拌后,将溶液温度升高到30℃(不考虑水分蒸发),所得溶液是 不饱和溶液 (填“饱和溶液”或“不饱和溶液”)。
【分析】(1)根据表格中,物质溶解度的信息来分析;
(2)根据不同温度下,两种物质的溶解度以及溶液随温度的变化情况来分析;
(3)根据40℃时物质的溶解度来分析。
【解答】解:(1)根据表格可以看出,在10℃时,氯化钠的溶解度是35.8g,故填:35.8;
(2)由表格数据可知,KNO3、NaCl两种固体物质的溶解度,都是随温度升高而增大,变化较小的是NaCl,变化较大的是KNO3;故填:较小;
(3)30℃时,在硝酸钾的溶解度是45.8g,故在100g水中加入40g硝酸钾,所得溶液是不饱和溶液,故填:不饱和溶液。
【点评】此题是溶解度知识的具体应用,对学生深入理解溶解度的概念有一定帮助,要学会分析溶解度曲线和溶解度表格。
20.根据图中(Ⅰ)和(Ⅱ)回答问题:
(1)在t1℃时,等质量的甲、乙两种固体物质在水中的溶解现象,如图(Ⅰ)所示,要使剩余的甲固体继续溶解可采用的方法是 升高温度或加入水 。
(2)图(Ⅱ)中a、b分别表示上述两种物质的溶解度曲线,在 t2 ℃时,这两种物质的溶解度相等;a表示的是 甲 物质(填“甲”或“乙”)的溶解度曲线。
【分析】根据固体物质的溶解度曲线可以:①比较不同物质在同一温度下的溶解度大小,②判断出物质的溶解度随温度变化的变化情况,从而确定出具体的物质。
【解答】解:如图Ⅱ中a、b是甲、乙两种固体物质的溶解度曲线;而在t1℃时,等质量的甲、乙两种固体物质在等质量的水中的溶解现象如图2所示。根据图Ⅰ和图Ⅱ回答问题:
(1)甲物质的溶解度随温度的升高而增大,要使未溶解的甲固体继续溶解,可采用的方法是加水或升温;
(2)在 t2℃时,甲、乙两种固体物质的溶解度相等;在t1℃时,a的溶解度小,而甲中有不溶物,故a表示的是甲物质的溶解度曲线。
故答案为:(1)升高温度或加入水;
(2)t2;甲。
【点评】本题难度不是很大,主要考查了固体物质的溶解度曲线所表示的意义,从而加深学生对固体溶解度的理解和掌握。
第1页(共1页)
一.选择题(共13小题)
1.如图是探究物质溶于水时热量变化的实验过程,有关说法正确的是( )
A.②中搅拌可增加硝酸钾在水中溶解的质量
B.④中大烧杯中放入的a物质可能是氯化钠
C.⑤中的溶液一定是硝酸钾的饱和溶液
D.⑥中大烧杯中放入的b物质可能是硝酸铵
2.NaCl和KNO3的溶解度曲线如图所示,下列说法正确的是( )
A.NaCl的溶解度一定大于KNO3
B.NaCl的溶解度受温度影响的程度比KNO3大
C.40℃时,100g KNO3饱和溶液中含有63.9g KNO3
D.将60℃时210g KNO3饱和溶液降温至20℃,析出KNO3晶体78.4g
3.如图为KCl和Na2CO3的溶解度曲线,下列说法正确的是( )
A.T1℃时两物质溶液中溶质质量分数相等
B.T2℃时将20g Na2CO3加入50g水中,充分搅拌得70g溶液
C.降低温度一定能使Na2CO3的饱和溶液变成不饱和溶液
D.T2℃时两物质的饱和溶液升温到T3℃,所得溶液中溶质质量分数大小关系为:KCl=Na2CO3
4.冬天,人们喜欢喝热的可乐。打开可乐盖时可观察到有大量气泡冒出,而且能闻到可乐的香味,但加热之后就观察不到气泡了。对此合理的解释是( )
A.香料的分子在不停地运动
B.打开盖时,二氧化碳分子分成了原子
C.加热时,二氧化碳的溶解度增大
D.打开盖时,二氧化碳的溶解度增大
5.下表提供了A、B两种固体物质的溶解度数据。下列判断正确的是( )
温度℃ 0 20 40 60 80 100
溶解度/g A 27.6 37.0 50.0 59.5 69.1 77.8
B 13.3 36.6 75.9 120 172 246
A.A、B两种物质都属于微溶物
B.40℃时,将20g A加入到50g水中,充分溶解可获得A的饱和溶液
C.60℃时,B物质的饱和溶液中溶质和溶剂的质量比为15:6
D.给出的曲线中①与B物质溶解度变化趋势相符
6.某同学自制汽水(如图)并记录了心得,下列记录正确的是( )
温度/℃ 0 5 10 15 20
碳酸氢钠的溶解度/g 6.9 7.45 8.85 9.6 10.35
A.①中溶质和溶液质量比为1:50
B.②中溶液为碳酸氢钠的不饱和溶液
C.⑤摇匀放入冰箱后气泡增多
D.⑤摇匀放入冰箱后有碳酸氢钠析出
7.向蒸馏水中加入氢氧化钠固体,不断搅拌,用温度传感器记录溶解过程的温度变化如图。a、c两点观察到溶液中有固体存在,b点固体完全消失(整个过程不考虑水分蒸发)。下列说法正确的是( )
A.氢氧化钠固体的溶解度随温度的升高先变大后变小
B.d点时溶液的质量大于c点时溶液的质量
C.b点溶液一定为饱和溶液
D.a、d两点时,氢氧化钠的溶解度相同
8.早在二十世纪初,我国化学家侯德榜在氨碱法制纯碱的基础上,创立了更为先进的侯氏制碱法,生产出Na2CO3的同时得到副产品NH4Cl,促进了世界制碱技术的发展。实验测得Na2CO3和NH4Cl的溶解度曲线如图所示,下列有关说法正确的是( )
A.NH4Cl的溶解度大于Na2CO3的溶解度
B.t1℃时,100g的Na2CO3饱和溶液中含溶质20g
C.t2℃时,Na2CO3和NH4Cl的饱和溶液中溶质质量分数相等
D.将t2℃时Na2CO3和NH4Cl的饱和溶液降温至t1℃,Na2CO3晶体析出的多
9.为探究硝酸钾的溶解性,进行了如图实验(见图1),结合KNO3的溶解度曲线(见图2)判断,下列说法错误的是( )
A.溶液②、溶液④一定是饱和溶液
B.溶液①、溶液③一定是不饱和溶液
C.②和④中固体的质量一定相等
D.溶液②③④的溶质质量分数:③>②=④
10.向盛有等质量水的甲、乙、丙三个烧杯中分别加入15g、30g、30g蔗糖固体,充分搅拌后静置,现象如图所示。下列说法错误的是( )
A.可采用升温的方法使乙烧杯中剩余的固体溶解
B.乙、丙烧杯中溶质的质量分数相等
C.甲、丙烧杯中的溶液不一定是不饱和溶液
D.蔗糖的溶解性随温度的升高而增大
11.在分别盛有100g水的烧杯中分别加入KCl至充分溶解(如图所示),下列说法错误的是( )
温度(℃) t1 t2
KCl的溶解度(g) 40 50
A.甲升温至t2℃,溶液质量增大
B.乙为KCl的饱和溶液
C.丙降温至t1℃,有晶体析出
D.乙、丙溶液中溶质质量相等
12.如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是( )
A.t2℃时,物质a的100g饱和溶液中含有25g物质a
B.t2℃时,分别将a、b、c的饱和溶液降温至t1℃,溶质质量分数关系是b>a=c
C.t1℃时a、c两物质饱和溶液中溶质的质量分数相等
D.t2℃时向50g水中加入15g物质b充分搅拌,所得溶液质量等于65g
13.图1是甲、乙、丙三种物质的溶解度曲线,R是其中一种物质。现取50g R如图2进行有关实验,观察到①②中没有固体析出,③中有固体析出。下列说法正确的是( )
A.从图2的实验结合图1分析,R是丙物质
B.①和②的溶液中,溶质的质量分数不相等
C.①②③中,只有③的上层清液是饱和溶液
D.①②③中,①的溶液中溶质的质量分数最大
二.填空题(共4小题)
14.向装有等量水的A、B、C烧杯中分别加入10g、25g、25g NaNO3固体,充分溶解后,现象如图中1所示.
(1)烧杯中的溶液一定属于饱和溶液的是 (填字母序号).
(2)图2中能表示NaNO3溶解度曲线的是 (选填“甲”或“乙”).
(3)要使B烧杯中剩余固体继续溶解,可采用的方法是 .
(4)由图2分析,若分别将100g甲、乙饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的是 (填字母序号).
A.甲、乙都是饱和溶液 B.所含溶剂质量:甲<乙
C.溶液质量:甲>乙 D.溶质质量分数:甲>乙.
15.如表是氯化钠和硝酸钾在不同温度下的溶解度(假设硝酸钾与氯化钠同时溶解在水中各自的溶解度不变,实验过程中水分损失忽略不计)。
温度(℃) 0 20 40 60 80 100
溶解度(g/100g水) KNO3 13.3 31.6 64.0 110.0 169.0 246.0
NaCl 35.7 36.0 36.6 37.3 38.4 39.8
①由表可知影响硝酸钾溶解度的因素是 。
②硝酸钾和氯化钠的溶解度相同时的温度范围是 。
A.0℃﹣20℃B.20℃﹣40℃C.40℃﹣60℃D.60℃﹣80℃
③在80℃的100g水中溶解NaCl和KNO3,进行以下实验,已知溶液a中的硝酸钾恰好饱和:
Ⅰ.操作1的名称是 。
Ⅱ.X= 克:固体C的成分和该成分的质量是 。
Ⅲ.对整个实验过程分析正确的是 。
A.40℃﹣60℃开始析出晶体
B.氯化钠在整个过程中一直保持不饱和状态
C.上述方法不能将氯化钠和硝酸钾完全分离
D.原溶液直接降温结晶,析出硝酸钾的质量不变
16.如图是甲、乙、丙三种物质的溶解度曲线。据此回答下列问题:
(1)图中P点的含义是 。
(2)将等质量的甲、乙、丙三种物质,分别配制成t1℃时的饱和溶液,需要水的质量最少的是 。
(3)将丙的饱和溶液变为不饱和溶液,在不改变溶液质量的前提下,宜采用的方法是 。
(4)将t2℃时,甲、乙、丙三种物质等质量的饱和溶液降温到t1℃,所得三种溶液的质量由大到小的顺序是 (用甲、乙、丙表示)。
17.A、B、C三种物质的溶解度曲线如图所示,根据如图回答:
(1)M点表示的意义是
(2)当温度为t1℃时,三种物质溶解度由小到大依次为 ,当温度为t3℃时,溶解度最大的是 。
(3)如果分别把A、B、C放入100g水中配成t3℃时的饱和溶液,再冷却到t1℃,析出晶体最多的是 没有晶体析出的是 。
(4)将某温度下一瓶接近饱和的C溶液变为饱和溶液,可采取的措施是 ; ; 。
(5)t3℃时,在90gA物质的饱和溶液中,含有A物质 克。
三.解答题(共3小题)
18.下面的表格中列出了NH4Cl在不同温度下的溶解度:
温度/℃ 0 10 20 30 40 50 60 70 80
溶解度/g 29.4 33.3 37.2 41.4 45.8 50.4 55.2 60.2 65.6
(1)由上表可推出溶解度曲线的变化规律是 ;
(2)在20℃时,向100g水中加入50g NH4Cl,形成的 (填“饱和”或“不饱和”)溶液,将其温度升高到60℃时,该溶液中溶质与溶剂的质量比为 。
19.根据表中氯化钠和硝酸钾部分溶解度数据分析,回答下列问题。
温度/℃ 0 10 20 30 40 50 60
溶解度/g
NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
(1)10℃时,氯化钠的溶解度是 g。
(2)与硝酸钾相比较,氯化钠的溶解度受温度变化影响 (填“较大”或“较小”)。
(3)20℃时,在100g水中加入40g硝酸钾,充分搅拌后,将溶液温度升高到30℃(不考虑水分蒸发),所得溶液是 (填“饱和溶液”或“不饱和溶液”)。
20.根据图中(Ⅰ)和(Ⅱ)回答问题:
(1)在t1℃时,等质量的甲、乙两种固体物质在水中的溶解现象,如图(Ⅰ)所示,要使剩余的甲固体继续溶解可采用的方法是 。
(2)图(Ⅱ)中a、b分别表示上述两种物质的溶解度曲线,在 ℃时,这两种物质的溶解度相等;a表示的是 物质(填“甲”或“乙”)的溶解度曲线。
第三节溶解度分层作业基础练习第九章溶液2021_2022学年九年级化学(京改版2013)
参考答案与试题解析
一.选择题(共13小题)
1.如图是探究物质溶于水时热量变化的实验过程,有关说法正确的是( )
A.②中搅拌可增加硝酸钾在水中溶解的质量
B.④中大烧杯中放入的a物质可能是氯化钠
C.⑤中的溶液一定是硝酸钾的饱和溶液
D.⑥中大烧杯中放入的b物质可能是硝酸铵
【分析】A、根据搅拌可以加快溶解速率,不能增大溶解量来分析;
B、根据氯化钠溶于水,温度几乎不变来分析;
C、根据饱和溶液的判断方法来分析;
D、根据硝酸铵溶于水吸收热量,温度降低来分析。
【解答】解:A、②中搅拌可加快硝酸钾的溶解速率,但不能增加硝酸钾在水中溶解的质量,故A错误;
B、硝酸钾的溶解度随着温度的升高而增大,④中大烧杯中放入a物质后,硝酸钾完全溶解,说明该物质溶于水放出热量,不可能是氯化钠,故B错误;
C、⑤中硝酸钾完全溶解,所得溶液可能是硝酸钾的饱和溶液,也可能是硝酸钾的不饱和溶液,故C错误;
D、⑥中大烧杯中放入的b物质后,部分硝酸钾结晶析出,说明该物质溶于水吸收热量,温度降低,因此该物质可能是硝酸铵,故D正确。
故选:D。
【点评】在解此类题时,首先要将题中的知识认知透,然后结合学过的知识进行解答。
2.NaCl和KNO3的溶解度曲线如图所示,下列说法正确的是( )
A.NaCl的溶解度一定大于KNO3
B.NaCl的溶解度受温度影响的程度比KNO3大
C.40℃时,100g KNO3饱和溶液中含有63.9g KNO3
D.将60℃时210g KNO3饱和溶液降温至20℃,析出KNO3晶体78.4g
【分析】根据题目信息和溶解度曲线可知:NaCl和KNO3的溶解度,都是随温度升高而增大,而硝酸钾的溶解度随温度的升高变化比氯化钠大;
A、溶解度大小的比较;
B、溶解度随温度的变化情况;
C、40℃时,163.9gKNO3饱和溶液中含有63.9gKNO3;
D、有关的计算要正确。
【解答】解:A、NaCl的溶解度一定大于KNO3错误,因为没有指明温度;故选项错误;
B、NaCl的溶解度受温度影响的程度比KNO3大错误,因为硝酸钾的溶解度随温度的升高变化比氯化钠大;故选项错误;
C、40℃时,163.9gKNO3饱和溶液中含有63.9gKNO3,100gKNO3饱和溶液中含有63.9gKNO3错误,故选项错误;
D、将60℃时210gKNO3饱和溶液中,水是100g,降温至20℃,溶剂不变,析出KNO3晶体质量=110g﹣31.6g=78.4g,故选项正确;
故选:D。
【点评】本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的计算,有关的计算要准确,本考点主要出现在选择题和填空题中。
3.如图为KCl和Na2CO3的溶解度曲线,下列说法正确的是( )
A.T1℃时两物质溶液中溶质质量分数相等
B.T2℃时将20g Na2CO3加入50g水中,充分搅拌得70g溶液
C.降低温度一定能使Na2CO3的饱和溶液变成不饱和溶液
D.T2℃时两物质的饱和溶液升温到T3℃,所得溶液中溶质质量分数大小关系为:KCl=Na2CO3
【分析】根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较。
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况。
根据物质的溶解度曲线、溶质质量、溶剂质量可以判断配制的溶液质量。
饱和溶液和不饱和溶液之间可以相互转化。
饱和溶液的溶质质量分数=×100%。
【解答】解:A、T1℃时两物质溶解度相等,饱和溶液中溶质质量分数相等,不饱和溶液中的溶质质量分数可能相等,也可能不相等,该选项不正确。
B、T2℃时碳酸钠的溶解度是49g,将20g Na2CO3加入50g水中,能够完全溶解,充分搅拌得70g溶液,该选项正确。
C、碳酸钠的溶解度随着温度饱和呈现不同的变化趋势,降低温度不一定能使Na2CO3的饱和溶液变成不饱和溶液,该选项不正确。
D、碳酸钠在T3℃时的溶解度大于氯化钾在T2℃时的溶解度,所得溶液中溶质质量分数大小关系为:KCl小于Na2CO3,该选项不正确。
故选:B。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
4.冬天,人们喜欢喝热的可乐。打开可乐盖时可观察到有大量气泡冒出,而且能闻到可乐的香味,但加热之后就观察不到气泡了。对此合理的解释是( )
A.香料的分子在不停地运动
B.打开盖时,二氧化碳分子分成了原子
C.加热时,二氧化碳的溶解度增大
D.打开盖时,二氧化碳的溶解度增大
【分析】根据气体的溶解度随温度的升高而减小,随着压强的增大而增大,结合分子的基本性质,进行分析判断。
【解答】解:A、能闻到可乐的香味,说明可乐中含有的分子是在不断运动的,向四周扩散,使人们闻到香味,故选项说法正确。
B、打开盖时,压强减小,二氧化碳分子间的间隔变大,二氧化碳分子本身没有发生改变,故选项说法错误。
C、加热之后就观察不到气泡,是因为温度提高,二氧化碳的溶解度减小,故选项说法错误。
D、打开盖时,压强减小,观察到有大量气泡冒出,是因为二氧化碳的溶解度减小,故选项说法错误。
故选:A。
【点评】本题难度不大,掌握气体溶解度的两个影响因素(温度、压强)、分子的基本性质是正确解答本题的关键。
5.下表提供了A、B两种固体物质的溶解度数据。下列判断正确的是( )
温度℃ 0 20 40 60 80 100
溶解度/g A 27.6 37.0 50.0 59.5 69.1 77.8
B 13.3 36.6 75.9 120 172 246
A.A、B两种物质都属于微溶物
B.40℃时,将20g A加入到50g水中,充分溶解可获得A的饱和溶液
C.60℃时,B物质的饱和溶液中溶质和溶剂的质量比为15:6
D.给出的曲线中①与B物质溶解度变化趋势相符
【分析】根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较。
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况。
根据物质的溶解度曲线、溶质质量、溶剂质量可以判断配制的溶液质量。
饱和溶液和不饱和溶液之间可以相互转化。
【解答】解:A、20℃时,A、B两种物质的溶解度都大于10g,都属于易溶物,该选项不正确。
B、40℃时A的溶解度是50.0g,将20g A加入到50g水中,充分溶解可获得A的不饱和溶液,该选项不正确。
C、60℃时,B物质的溶解度是120g,饱和溶液中溶质和溶剂的质量比为120g:100g=6:5,该选项不正确。
D、结合溶解度曲线和表中数据可知,给出的曲线中①与B物质溶解度变化趋势相符,该选项正确。
故选:D。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
6.某同学自制汽水(如图)并记录了心得,下列记录正确的是( )
温度/℃ 0 5 10 15 20
碳酸氢钠的溶解度/g 6.9 7.45 8.85 9.6 10.35
A.①中溶质和溶液质量比为1:50
B.②中溶液为碳酸氢钠的不饱和溶液
C.⑤摇匀放入冰箱后气泡增多
D.⑤摇匀放入冰箱后有碳酸氢钠析出
【分析】A、根据溶液的组成来分析;
B、根据碳酸氢钠的溶解度来分析;
C、根据温度对气体溶解度的影响来分析;
D、根据碳酸氢钠的溶解度受温度的影响来分析。
【解答】解:20℃时,500mL水的质量为500g。
A、20℃时,向500g水中加入10g蔗糖后,蔗糖完全溶解,①中溶质和溶液质量比为10g:(500g+10g)=1:51,故A错误;
B、20℃时,碳酸氢钠的溶解度为10.35g,因此该温度下向500g水中加入1.5g碳酸氢钠后所得溶液为该温度下碳酸氢钠的不饱和溶液,故B正确;
C、气体的溶解度随着温度的降低而减小,因此⑤摇匀放入冰箱后气泡减少,故C错误;
D、0℃时,碳酸氢钠的溶解度为6.9g,该温度下的500g水中最多能溶解6.9g×5=34.5g碳酸氢钠,因此⑤摇匀放入冰箱后没有碳酸氢钠析出,故D错误。
故选:B。
【点评】本题考查学生根据题中所给的信息及所学的化学知识进行分析解题的能力。
7.向蒸馏水中加入氢氧化钠固体,不断搅拌,用温度传感器记录溶解过程的温度变化如图。a、c两点观察到溶液中有固体存在,b点固体完全消失(整个过程不考虑水分蒸发)。下列说法正确的是( )
A.氢氧化钠固体的溶解度随温度的升高先变大后变小
B.d点时溶液的质量大于c点时溶液的质量
C.b点溶液一定为饱和溶液
D.a、d两点时,氢氧化钠的溶解度相同
【分析】根据题意,向蒸馏水中加入氢氧化钠固体,不断搅拌,用温度传感器记录溶解过程的温度变化,温度先升高,至b点温度达到最高;a、c两点观察到溶液中有固体存在,b点固体完全消失,结合饱和溶液的特征,进行分析判断。
【解答】解:A、向蒸馏水中加入氢氧化钠固体,温度先升高,至b点温度达到最高,c点观察到溶液中有固体存在,是因为一段时间后温度恢复至常温,温度降低,有氢氧化钠析出;不能说明氢氧化钠固体的溶解度随温度的升高先变大后变小,故选项说法错误。
B、溶液中水的质量不变,c点观察到溶液中有固体存在,说明溶液已是饱和溶液,d点时温度更低,析出的氢氧化钠更多,d点时溶液的质量小于c点时溶液的质量,故选项说法错误。
C、b点固体完全消失,可能是不饱和溶液,也可能是恰好饱和的溶液,故选项说法错误。
D、a、d两点时,温度相同,氢氧化钠的溶解度相同,故选项说法正确。
故选:D。
【点评】本题难度不大,掌握饱和溶液的特征、氢氧化钠溶于水放热等是正确解答本题的关键。
8.早在二十世纪初,我国化学家侯德榜在氨碱法制纯碱的基础上,创立了更为先进的侯氏制碱法,生产出Na2CO3的同时得到副产品NH4Cl,促进了世界制碱技术的发展。实验测得Na2CO3和NH4Cl的溶解度曲线如图所示,下列有关说法正确的是( )
A.NH4Cl的溶解度大于Na2CO3的溶解度
B.t1℃时,100g的Na2CO3饱和溶液中含溶质20g
C.t2℃时,Na2CO3和NH4Cl的饱和溶液中溶质质量分数相等
D.将t2℃时Na2CO3和NH4Cl的饱和溶液降温至t1℃,Na2CO3晶体析出的多
【分析】根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较。
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况。
根据物质的溶解度曲线、溶质质量、溶剂质量可以判断配制的溶液质量。
饱和溶液和不饱和溶液之间可以相互转化。
饱和溶液的溶质质量分数=×100%。
根据物质的溶解度曲线、溶液质量可以判断温度变化时析出固体质量的大小。
【解答】解:A、不知道温度范围,不能比较两种物质溶解度大小,该选项不正确。
B、t1℃时碳酸钠溶解度是20g,100g的Na2CO3饱和溶液中含溶质质量小于20g,该选项不正确。
C、t2℃时碳酸钠和氯化铵溶解度相等,Na2CO3和NH4Cl的饱和溶液中溶质质量分数相等,该选项正确。
D、不知道饱和溶液质量,不能比较析出晶体质量大小,该选项不正确。
故选:C。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
9.为探究硝酸钾的溶解性,进行了如图实验(见图1),结合KNO3的溶解度曲线(见图2)判断,下列说法错误的是( )
A.溶液②、溶液④一定是饱和溶液
B.溶液①、溶液③一定是不饱和溶液
C.②和④中固体的质量一定相等
D.溶液②③④的溶质质量分数:③>②=④
【分析】根据题目信息和溶解度曲线可知:A、溶液②、溶液④一定是饱和溶液正确;
B、溶液①、溶液③一定是不饱和溶液错误;
C、固体质量大小的比较;
D、溶质质量分数大小的比较。
【解答】解:A、溶液②、溶液④一定是饱和溶液正确,因为烧杯底部都有剩余固体,正确但不符合题意,故选项错误;
B、溶液①、溶液③一定是不饱和溶液错误,因为溶液③可能恰好饱和,错误符合题意,故选项正确;
C、②和④中固体的质量一定相等正确,因为是同一温度,溶质、溶剂质量一样多,正确但不符合题意,故选项错误;
D、溶液②③④的溶质质量分数:③>②=④正确,因为水都是20g,③中8g固体全部溶解,②和④溶解一样多且小于8g。正确但不符合题意,故选项错误;
故选:B。
【点评】本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的变化等,本考点主要出现在选择题和填空题中。
10.向盛有等质量水的甲、乙、丙三个烧杯中分别加入15g、30g、30g蔗糖固体,充分搅拌后静置,现象如图所示。下列说法错误的是( )
A.可采用升温的方法使乙烧杯中剩余的固体溶解
B.乙、丙烧杯中溶质的质量分数相等
C.甲、丙烧杯中的溶液不一定是不饱和溶液
D.蔗糖的溶解性随温度的升高而增大
【分析】根据题意,向盛有等质量水的甲、乙、丙三个烧杯中分别加入15g、30g、30g蔗糖固体,充分搅拌后静置,甲中蔗糖能全部溶解,乙中蔗糖有剩余,丙中蔗糖能全部溶解,进行分析判断。
【解答】解:A、向盛有等质量水的乙、丙烧杯中分别加入30g、30g蔗糖固体,充分搅拌后静置,乙中蔗糖有剩余,丙中蔗糖能全部溶解,丙中温度高,则可采用升温的方法使乙烧杯中剩余的固体溶解,故选项说法正确。
B、乙、丙烧杯中溶剂质量相等,丙中溶质的质量多,则乙、丙烧杯中溶质的质量分数不相等,故选项说法错误。
C、甲中蔗糖能全部溶解,丙中蔗糖能全部溶解,甲、丙烧杯中的溶液不一定属于不饱和溶液,也可能是恰好饱和的溶液,故选项说法正确。
D、向盛有等质量水的乙、丙烧杯中分别加入30g、30g蔗糖固体,充分搅拌后静置,乙中蔗糖有剩余,丙中蔗糖能全部溶解,丙中温度高,则蔗糖的溶解度随温度的升高而增大,故选项说法正确。
故选:B。
【点评】本题难度不大,掌握饱和溶液与不饱和溶液的特征并能灵活运用是正确解答本题的关键。
11.在分别盛有100g水的烧杯中分别加入KCl至充分溶解(如图所示),下列说法错误的是( )
温度(℃) t1 t2
KCl的溶解度(g) 40 50
A.甲升温至t2℃,溶液质量增大
B.乙为KCl的饱和溶液
C.丙降温至t1℃,有晶体析出
D.乙、丙溶液中溶质质量相等
【分析】根据题意,t1℃时,氯化钾的溶解度为40g,t2℃时,氯化钾的溶解度为50g;在分别盛有100g水的烧杯中分别加入KCl至充分溶解,t1℃时最多能溶解40gKCl,t2℃时最多能溶解50gKCl,进行分析判断。
【解答】解:A、t1℃时,氯化钾的溶解度为40g,甲中最多能溶解40gKCl,升温至t2℃,溶解度增大,氯化钾能继续溶解,溶液质量增大,故选项说法正确。
B、t1℃时,氯化钾的溶解度为40g,乙中加入的40g氯化钾恰好完全溶解,形成饱和溶液,故选项说法正确。
C、t1℃时,氯化钾的溶解度为40g,丙降温至t1℃,40g氯化钾恰好完全溶解,没有晶体析出,故选项说法错误。
D、在分别盛有100g水的烧杯中分别加入KCl至充分溶解,t1℃时最多能溶解40gKCl,t2℃时最多能溶解50gKCl,乙、丙溶液中氯化钾均全部溶解,溶质质量相等,故选项说法正确。
故选:C。
【点评】本题难度不大,掌握溶解度的含义、饱和溶液的特征等是正确解答本题的关键。
12.如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是( )
A.t2℃时,物质a的100g饱和溶液中含有25g物质a
B.t2℃时,分别将a、b、c的饱和溶液降温至t1℃,溶质质量分数关系是b>a=c
C.t1℃时a、c两物质饱和溶液中溶质的质量分数相等
D.t2℃时向50g水中加入15g物质b充分搅拌,所得溶液质量等于65g
【分析】根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较。
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况。
根据物质的溶解度曲线、溶质质量、溶剂质量可以判断配制的溶液质量。
饱和溶液和不饱和溶液之间可以相互转化。
饱和溶液的溶质质量分数=×100%。
【解答】解:A、t2℃时a的溶解度是25g,物质a的100g饱和溶液中含有小于25g物质a,该选项不正确。
B、t2℃时,分别将a、b、c的饱和溶液降温至t1℃,ab都是饱和溶液,b的溶解度大于a,因此b的质量分数大于a,由于a在t1℃时的溶解度大于c在t2℃时的溶解度,因此a的质量分数大于c,溶质质量分数关系是b>a>c,该选项不正确。
C、t1℃时a、c两物质溶解度相等,饱和溶液中溶质的质量分数相等,该选项正确。
D、t2℃时b的溶解度是25g,向50g水中加入15g物质b充分搅拌,能够溶解12.5g,所得溶液质量等于62.5g,该选项不正确。
故选:C。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
13.图1是甲、乙、丙三种物质的溶解度曲线,R是其中一种物质。现取50g R如图2进行有关实验,观察到①②中没有固体析出,③中有固体析出。下列说法正确的是( )
A.从图2的实验结合图1分析,R是丙物质
B.①和②的溶液中,溶质的质量分数不相等
C.①②③中,只有③的上层清液是饱和溶液
D.①②③中,①的溶液中溶质的质量分数最大
【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
【解答】解:A、由图2可知,R物质的溶解度随温度升高,而增大,所以R物质不可能是丙,故A错;
B、②溶液比①溶液少100g水,所以溶质的质量分数不相等,故B正确;
C、③中有固体析出,说明③属于饱和溶液,且③中含有100g水,溶解度要小于50g,所以R物质是乙,在t3℃,乙的溶解度是50g,②中恰好溶解了50g溶质,属于饱和溶液,所以②与③的上层清液都是饱和溶液,故C错;
D、②溶液比①溶液少100g水,所以②溶液的溶质质量分数大于①溶液的溶质质量分数,故D错。
故选:B。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
二.填空题(共4小题)
14.向装有等量水的A、B、C烧杯中分别加入10g、25g、25g NaNO3固体,充分溶解后,现象如图中1所示.
(1)烧杯中的溶液一定属于饱和溶液的是 B (填字母序号).
(2)图2中能表示NaNO3溶解度曲线的是 甲 (选填“甲”或“乙”).
(3)要使B烧杯中剩余固体继续溶解,可采用的方法是 升高温度、加水 .
(4)由图2分析,若分别将100g甲、乙饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的是 BD (填字母序号).
A.甲、乙都是饱和溶液 B.所含溶剂质量:甲<乙
C.溶液质量:甲>乙 D.溶质质量分数:甲>乙.
【分析】(1)一定温度下,有剩余固体存在的溶液为饱和溶液;
(2)由烧杯中不同温度下溶解的硝酸钠的质量变化分析解答;
(3)通常饱和溶液变为不饱和溶液的方法是:升高温度或增加溶剂;
(4)根据甲乙的溶解度曲线随温度变化情况,并结合选项中的问题逐一分析解答.
【解答】解:(1)由图1可知:20℃时向A烧杯中加入10g完全溶解,可能是饱和溶液;B烧杯中加入25g有剩余固体,一定属于饱和溶液;30℃加入25g全部溶解,可能是饱和溶液;
故答案为:B;
(2)由图1可知,随着温度的升高溶解的硝酸钠的质量逐渐增加,所以在图2中,能表示NaNO3溶解度曲线的是甲,故答案为:甲;
(3)由1可知:要使烧杯B中剩余固体继续溶解,可采用升高温度的方法,还可以采取加水的方法;
故答案为:升高温度、加水;
(4)A、乙的溶解度随温度降低逐渐增大,故降低温度变为不饱和溶液,故错误;
B、t2℃时甲的溶解度大于乙的溶解度,所以等质量的饱和溶液中所含溶剂的质量是甲<乙,降低温度溶剂的质量不变;故将100g甲、乙的饱和溶液从 t2℃降温到 t1℃,溶剂的质量关系依然是甲<乙,故正确;
C、分别将100g甲、乙的饱和溶液从 t2℃降温到 t1℃,甲有溶质析出,溶液的质量甲<乙,故错误;
D、等质量的甲、乙饱和溶液从 t2℃降温至 t1℃时,甲析出溶质,乙由于溶解度增大而无晶体析出.降低到 t1℃时,溶解度是甲=乙,但由于乙不是饱和溶液,所以其溶质的质量分数是甲>乙,正确;
故选B D
【点评】本题较为综合的考查了溶解度曲线的理解和应用,以及学生分析题目信息判断饱和溶液的方法,是一道能较好考查学生分析解决问题能力的好题.
15.如表是氯化钠和硝酸钾在不同温度下的溶解度(假设硝酸钾与氯化钠同时溶解在水中各自的溶解度不变,实验过程中水分损失忽略不计)。
温度(℃) 0 20 40 60 80 100
溶解度(g/100g水) KNO3 13.3 31.6 64.0 110.0 169.0 246.0
NaCl 35.7 36.0 36.6 37.3 38.4 39.8
①由表可知影响硝酸钾溶解度的因素是 温度 。
②硝酸钾和氯化钠的溶解度相同时的温度范围是 B 。
A.0℃﹣20℃B.20℃﹣40℃C.40℃﹣60℃D.60℃﹣80℃
③在80℃的100g水中溶解NaCl和KNO3,进行以下实验,已知溶液a中的硝酸钾恰好饱和:
Ⅰ.操作1的名称是 过滤 。
Ⅱ.X= 50 克:固体C的成分和该成分的质量是 KNO3,68.7g 。
Ⅲ.对整个实验过程分析正确的是 BC 。
A.40℃﹣60℃开始析出晶体
B.氯化钠在整个过程中一直保持不饱和状态
C.上述方法不能将氯化钠和硝酸钾完全分离
D.原溶液直接降温结晶,析出硝酸钾的质量不变
【分析】本题考查溶质溶解度影响因素主要包括溶剂、温度,以及饱和溶液的意义。
【解答】解:①由表中数据我们看出里面改变唯一因素为温度,溶剂为水,
故答:温度
②从表中数据可以看出,在20℃的时硝酸钾与氯化钠溶解度分别为31.6g/100g水、36.0g/100g水,在40℃时硝酸钾与氯化钠溶解度分别为64.0g/100g水、36.6g/100g水,随着温度升高两者溶解度增大,若两者溶解度相同,只能出现在此温度区间内;
故选:B
③由80℃降低到20℃时,溶解度减少,溶液中硝酸钾溶解度减少,80℃下100g水中分别可溶解硝酸钾与氯化钠为169.0g、38.4g,而加入的硝酸钾与氯化钠分别为84.5g、15g,所以全部溶解,并且都是不饱和溶液;然后将溶液采取蒸发溶剂的方法使晶体析出,此时硝酸钾达到饱和状态,设剩下溶剂质量为m,
100g 169.0g
m 84.5g
m=50g,所以需要蒸发掉50g水,硝酸钾达到饱和状态;而此时氯化钠还是15g,此时若达到饱和状态,溶解氯化钠质量为a;
100g 38.4g
50g a
a=19.2g,大于15g,所以此时氯化钠全部溶解在溶液中,未到达饱和状态;
当温度下降到20℃时,硝酸钾是饱和溶液,由于温度下降,则有硝酸钾晶体析出,此时硝酸钾在溶液中还是饱和状态,根据20℃下的溶解度计算,此时溶解硝酸钾质量b;
b=15.8g 此时溶液中溶解了15.8g硝酸钾,其余析出,质量=84.5g﹣15.8g=68.7g,所以析出硝酸钾为68.7g,而此条件下氯化钠若到达饱和状态需要溶解质量为c;
c=18g,大于15g,所以此时氯化钠还是未饱和溶液,全部溶解在溶液中,此时析出固体全部为硝酸钾,而固液分离的操作方法为过滤;
故答:Ⅰ过滤;Ⅱ50;KNO3,68.7g。
Ⅲ中A、由于硝酸钾在80℃时成为饱和溶液,所以只要温度下降,就有硝酸钾析出,所以温度不止在40℃﹣60℃就析出,而是低于80℃就析出,所以A错误;
B、从上述计算过程中,氯化钠一直处于未达到饱和的状态,不会有氯化钠析出,所以B正确;
C、20℃时氯化钠和硝酸钾分别溶液溶解了15g、15.8g,所以二者没有完全分离,所以C正确;
D、原溶液内溶剂为100g,当温度在80℃时,溶解硝酸钾质量为84.5g,为不饱和溶液,温度下降时不会有晶体析出,所以最终析出晶体质量减少,所以D错误;
故选:BC。
【点评】对于饱和溶液,减少溶剂的量一定会析出固体,不饱和溶液要根据溶解度计算减少溶剂时,其实际溶解的溶质是多少,判读其是否达到饱和状态。
16.如图是甲、乙、丙三种物质的溶解度曲线。据此回答下列问题:
(1)图中P点的含义是 t1℃时,甲、丙两种物质的溶解度相等 。
(2)将等质量的甲、乙、丙三种物质,分别配制成t1℃时的饱和溶液,需要水的质量最少的是 乙 。
(3)将丙的饱和溶液变为不饱和溶液,在不改变溶液质量的前提下,宜采用的方法是 降低温度 。
(4)将t2℃时,甲、乙、丙三种物质等质量的饱和溶液降温到t1℃,所得三种溶液的质量由大到小的顺序是 丙>乙>甲 (用甲、乙、丙表示)。
【分析】根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定溶解度相同时的温度;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断饱和溶液和不饱和溶液相互转化的方法。
【解答】解:(1)通过分析溶解度曲线可知,图中P点的含义是t1℃时,甲、丙两种物质的溶解度相等;
(2)t1℃时,乙物质的溶解度最大,所以将等质量的甲、乙、丙三种物质,分别配制成t1℃时的饱和溶液,需要水的质量最少的是乙;
(3)丙物质的溶解度随温度的将而增大,所以将丙的饱和溶液变为不饱和溶液,在不改变溶液质量的前提下,宜采用的方法是降低温度;
(4)将t2℃时,甲、乙、丙三种物质等质量的饱和溶液降温到t1℃,丙物质的溶解度增大,不会析出晶体,甲物质的溶解度受温度变化影响较大,析出较多的晶体,所以所得三种溶液的质量由大到小的顺序是丙>乙>甲。
故答案为:(1)t1℃时,甲、丙两种物质的溶解度相等;
(2)乙;
(3)降低温度;
(4)丙>乙>甲。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
17.A、B、C三种物质的溶解度曲线如图所示,根据如图回答:
(1)M点表示的意义是 t2℃时,A、B的溶解度相同
(2)当温度为t1℃时,三种物质溶解度由小到大依次为 A<C<B ,当温度为t3℃时,溶解度最大的是 A 。
(3)如果分别把A、B、C放入100g水中配成t3℃时的饱和溶液,再冷却到t1℃,析出晶体最多的是 A 没有晶体析出的是 C 。
(4)将某温度下一瓶接近饱和的C溶液变为饱和溶液,可采取的措施是 升高温度 ; 增加溶质 ; 蒸发溶剂 。
(5)t3℃时,在90gA物质的饱和溶液中,含有A物质 40 克。
【分析】(1)溶解度曲线交点P的含义:溶解度曲线交于一点表明两物质的溶解度此时相等;
(2)根据溶解度曲线可以比较同一温度下不同物质的溶解度大小;
(3)根据溶解度与温度的变化关系分析饱和溶液降温时的变化,及析出晶体的质量大小关系;
(4)根据溶解度曲线可知物质的溶解度随温度的变化情况,并结合不饱和溶液和饱和溶液的相互转化分析;
(5)根据溶解度可知物质的溶解度,并进行简单计算。
【解答】解:(1)t2℃时A与B两物质溶解度曲线的交点,说明此时它们的溶解度相等。
(2)t1℃时,三种物质溶解度从下到上依次为A、C、B,所以三种物质此时的溶解度由小到大依次为:A<C<B,t3℃时物质A的溶解度曲线在最上方,所以此时A物质的溶解度最大;
(3)根据三种物质的溶解度曲线图,由于从t3℃降温至t1℃物质A的溶解度差值大于B,所以,把A、B、C分别放入100g水中配成t3℃的饱和溶液,再冷却至t1℃,析出晶体最多的为A物质。而C物质的溶解度随降温而增大,因此C的饱和溶液降温后变成不饱和溶液,没有晶体析出;
(4)C的溶解度随温度的升高而减小,所以将某温度下一瓶接近饱和的C溶液变为饱和溶液,可采取升高温度、增加溶质、蒸发溶剂的措施;
(5)t3℃时A的溶解度是80g,即100g水中最多溶解80gA形成180g溶液,则90gA的饱和溶液中应含有40gA;
故答案为:(1)在t2℃时A与B的溶解度相等;
(2)A<C<B;A;
(3)A;C;
(4)升高温度;增加溶质;蒸发溶剂;
(5)40。
【点评】本题主要考查了固体溶解度曲线的意义及根据固体的溶解度曲线解决有关的问题。
三.解答题(共3小题)
18.下面的表格中列出了NH4Cl在不同温度下的溶解度:
温度/℃ 0 10 20 30 40 50 60 70 80
溶解度/g 29.4 33.3 37.2 41.4 45.8 50.4 55.2 60.2 65.6
(1)由上表可推出溶解度曲线的变化规律是 随温度的升高该物质的溶解度逐渐增大 ;
(2)在20℃时,向100g水中加入50g NH4Cl,形成的 饱和 (填“饱和”或“不饱和”)溶液,将其温度升高到60℃时,该溶液中溶质与溶剂的质量比为 1:2 。
【分析】(1)根据表中的溶解度的变化和温度的变化进行分析;
(2)根据20℃时氯化铵的溶解度进行分析;
根据60℃时的溶液质量和溶质质量进行分析。
【解答】解:(1)从表中的数据可以看出,温度逐渐的升高,溶解度的数值也在逐渐的增大,故答案为:随温度的升高该物质的溶解度逐渐增大;
(2)20℃时,氯化铵的溶解度是37.2g,100g水中加入50gNH4Cl,固体物质有剩余,故答案为:饱和,
60℃时,氯化铵溶解度为55.2g,氯化铵固体全部溶解,溶质质量为:50g,溶剂质量为100g,故答案为:1:2。
【点评】在解此类题时,注意识记饱和溶液的判断标准和固体溶解度随温度的变化等知识的综合应用。
19.根据表中氯化钠和硝酸钾部分溶解度数据分析,回答下列问题。
温度/℃ 0 10 20 30 40 50 60
溶解度/g
NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
(1)10℃时,氯化钠的溶解度是 35.8 g。
(2)与硝酸钾相比较,氯化钠的溶解度受温度变化影响 较小 (填“较大”或“较小”)。
(3)20℃时,在100g水中加入40g硝酸钾,充分搅拌后,将溶液温度升高到30℃(不考虑水分蒸发),所得溶液是 不饱和溶液 (填“饱和溶液”或“不饱和溶液”)。
【分析】(1)根据表格中,物质溶解度的信息来分析;
(2)根据不同温度下,两种物质的溶解度以及溶液随温度的变化情况来分析;
(3)根据40℃时物质的溶解度来分析。
【解答】解:(1)根据表格可以看出,在10℃时,氯化钠的溶解度是35.8g,故填:35.8;
(2)由表格数据可知,KNO3、NaCl两种固体物质的溶解度,都是随温度升高而增大,变化较小的是NaCl,变化较大的是KNO3;故填:较小;
(3)30℃时,在硝酸钾的溶解度是45.8g,故在100g水中加入40g硝酸钾,所得溶液是不饱和溶液,故填:不饱和溶液。
【点评】此题是溶解度知识的具体应用,对学生深入理解溶解度的概念有一定帮助,要学会分析溶解度曲线和溶解度表格。
20.根据图中(Ⅰ)和(Ⅱ)回答问题:
(1)在t1℃时,等质量的甲、乙两种固体物质在水中的溶解现象,如图(Ⅰ)所示,要使剩余的甲固体继续溶解可采用的方法是 升高温度或加入水 。
(2)图(Ⅱ)中a、b分别表示上述两种物质的溶解度曲线,在 t2 ℃时,这两种物质的溶解度相等;a表示的是 甲 物质(填“甲”或“乙”)的溶解度曲线。
【分析】根据固体物质的溶解度曲线可以:①比较不同物质在同一温度下的溶解度大小,②判断出物质的溶解度随温度变化的变化情况,从而确定出具体的物质。
【解答】解:如图Ⅱ中a、b是甲、乙两种固体物质的溶解度曲线;而在t1℃时,等质量的甲、乙两种固体物质在等质量的水中的溶解现象如图2所示。根据图Ⅰ和图Ⅱ回答问题:
(1)甲物质的溶解度随温度的升高而增大,要使未溶解的甲固体继续溶解,可采用的方法是加水或升温;
(2)在 t2℃时,甲、乙两种固体物质的溶解度相等;在t1℃时,a的溶解度小,而甲中有不溶物,故a表示的是甲物质的溶解度曲线。
故答案为:(1)升高温度或加入水;
(2)t2;甲。
【点评】本题难度不是很大,主要考查了固体物质的溶解度曲线所表示的意义,从而加深学生对固体溶解度的理解和掌握。
第1页(共1页)
