第9章第三节溶解度分层作业巩固练习-2021-2022学年九年级化学京改版下册(word版含解析)
文档属性
| 名称 | 第9章第三节溶解度分层作业巩固练习-2021-2022学年九年级化学京改版下册(word版含解析) |
|
|
| 格式 | doc | ||
| 文件大小 | 388.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-25 00:00:00 | ||
图片预览


文档简介
第三节溶解度分层作业巩固练习第九章溶液2021_2022学年九年级化学(京改版2013)
一.选择题(共13小题)
1.相同质量的下列物质分别溶于等质量的水中,所得溶液中溶质的质量分数最大的是( )
A.Na2O B.NaOH C.CuSO4 5H2O D.H2SO4
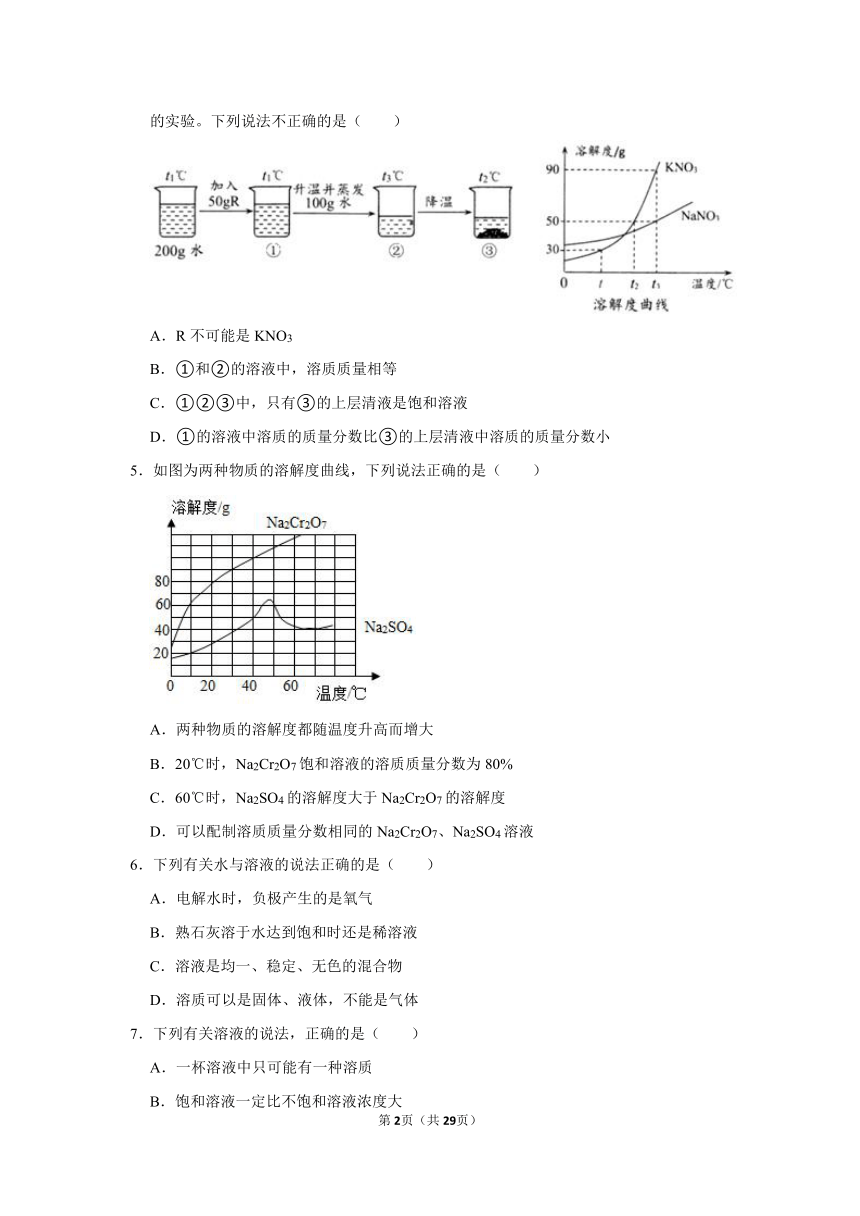
2.甲、乙两种物质的溶解度曲线如图所示。下列说法错误的是( )
A.甲的溶解度随着温度的升高而增大
B.t1℃时,甲和乙的溶解度相等
C.t2℃时,30g的甲溶于在50g的水中,得到80g的溶液
D.升高温度可以将乙的不饱和溶液转化为饱和溶液
3.T2℃时,将70.0g KNO3、KCl固体分别加入到各盛有200.0g水的两个烧杯中,完全溶解,降温到T1℃,现象如图1所示。下列说法正确的是( )
A.甲中加入的固体是KNO3
B.T1℃时,甲中溶液一定不饱和,乙中溶液一定饱和
C.T1℃时,将甲、乙中的物质混合,充分搅拌,一定有固体剩余
D.T2℃时,KCl溶液由a点转化到b点,可加入KCl或恒温蒸发水
4.R是KNO3和NaNO3两种物质中的一种,两物质的溶解度曲线如图,现用R做如图所示的实验。下列说法不正确的是( )
A.R不可能是KNO3
B.①和②的溶液中,溶质质量相等
C.①②③中,只有③的上层清液是饱和溶液
D.①的溶液中溶质的质量分数比③的上层清液中溶质的质量分数小
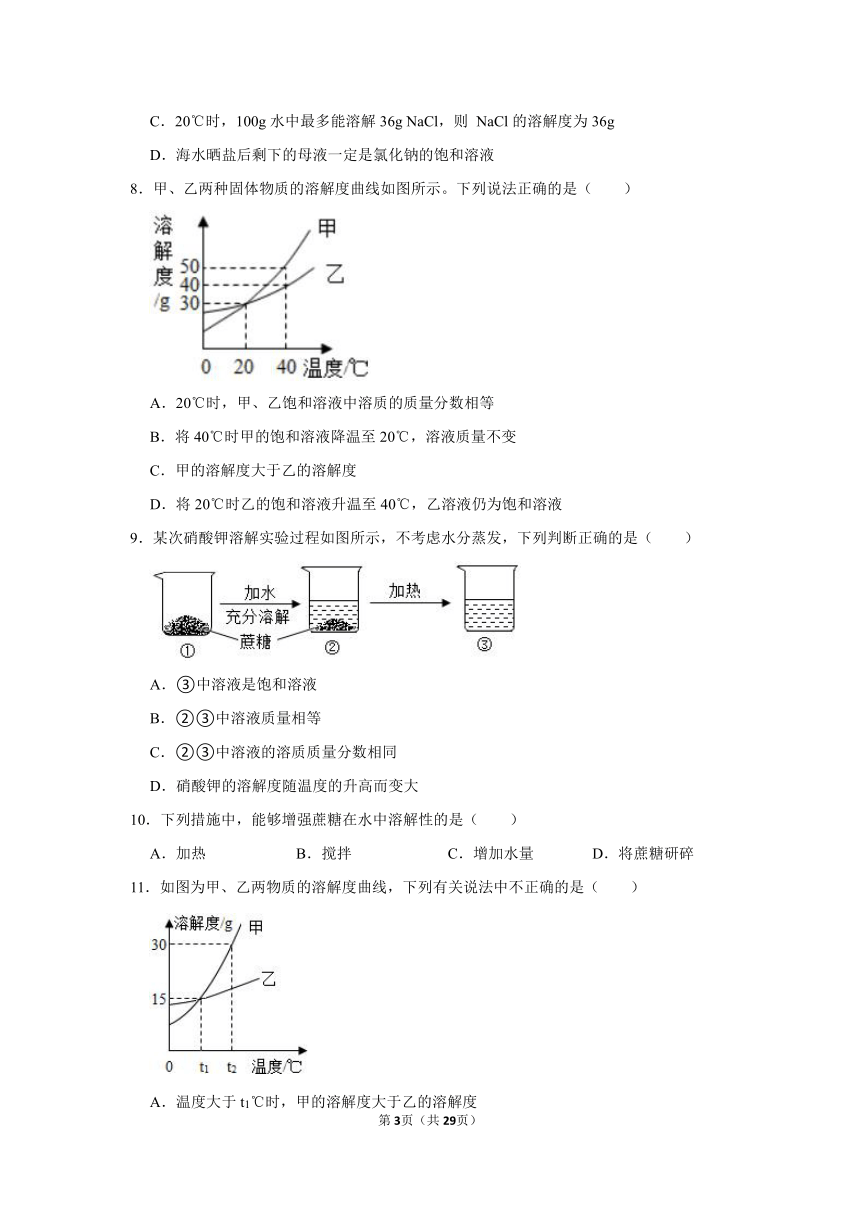
5.如图为两种物质的溶解度曲线,下列说法正确的是( )
A.两种物质的溶解度都随温度升高而增大
B.20℃时,Na2Cr2O7饱和溶液的溶质质量分数为80%
C.60℃时,Na2SO4的溶解度大于Na2Cr2O7的溶解度
D.可以配制溶质质量分数相同的Na2Cr2O7、Na2SO4溶液
6.下列有关水与溶液的说法正确的是( )
A.电解水时,负极产生的是氧气
B.熟石灰溶于水达到饱和时还是稀溶液
C.溶液是均一、稳定、无色的混合物
D.溶质可以是固体、液体,不能是气体
7.下列有关溶液的说法,正确的是( )
A.一杯溶液中只可能有一种溶质
B.饱和溶液一定比不饱和溶液浓度大
C.20℃时,100g水中最多能溶解36g NaCl,则 NaCl的溶解度为36g
D.海水晒盐后剩下的母液一定是氯化钠的饱和溶液
8.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
A.20℃时,甲、乙饱和溶液中溶质的质量分数相等
B.将40℃时甲的饱和溶液降温至20℃,溶液质量不变
C.甲的溶解度大于乙的溶解度
D.将20℃时乙的饱和溶液升温至40℃,乙溶液仍为饱和溶液
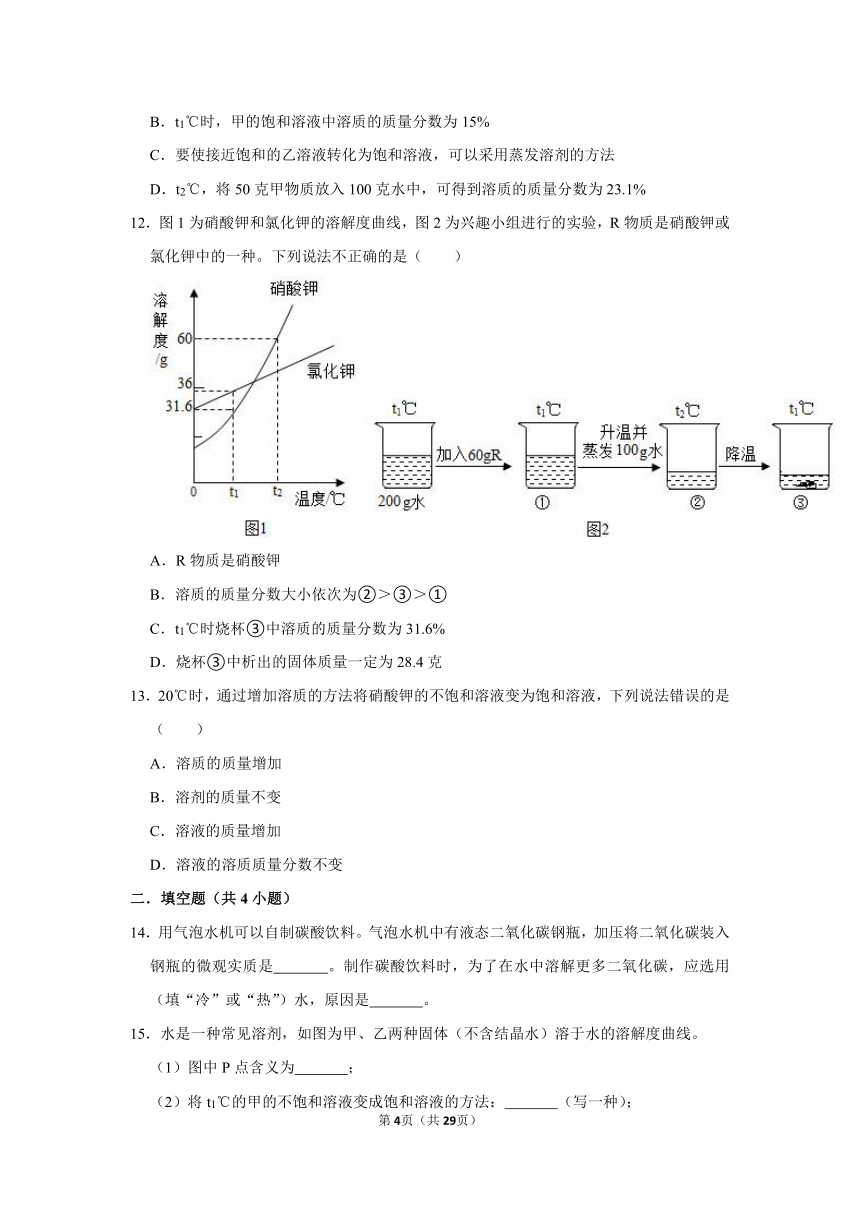
9.某次硝酸钾溶解实验过程如图所示,不考虑水分蒸发,下列判断正确的是( )
A.③中溶液是饱和溶液
B.②③中溶液质量相等
C.②③中溶液的溶质质量分数相同
D.硝酸钾的溶解度随温度的升高而变大
10.下列措施中,能够增强蔗糖在水中溶解性的是( )
A.加热 B.搅拌 C.增加水量 D.将蔗糖研碎
11.如图为甲、乙两物质的溶解度曲线,下列有关说法中不正确的是( )
A.温度大于t1℃时,甲的溶解度大于乙的溶解度
B.t1℃时,甲的饱和溶液中溶质的质量分数为15%
C.要使接近饱和的乙溶液转化为饱和溶液,可以采用蒸发溶剂的方法
D.t2℃,将50克甲物质放入100克水中,可得到溶质的质量分数为23.1%
12.图1为硝酸钾和氯化钾的溶解度曲线,图2为兴趣小组进行的实验,R物质是硝酸钾或氯化钾中的一种。下列说法不正确的是( )
A.R物质是硝酸钾
B.溶质的质量分数大小依次为②>③>①
C.t1℃时烧杯③中溶质的质量分数为31.6%
D.烧杯③中析出的固体质量一定为28.4克
13.20℃时,通过增加溶质的方法将硝酸钾的不饱和溶液变为饱和溶液,下列说法错误的是( )
A.溶质的质量增加
B.溶剂的质量不变
C.溶液的质量增加
D.溶液的溶质质量分数不变
二.填空题(共4小题)
14.用气泡水机可以自制碳酸饮料。气泡水机中有液态二氧化碳钢瓶,加压将二氧化碳装入钢瓶的微观实质是 。制作碳酸饮料时,为了在水中溶解更多二氧化碳,应选用 (填“冷”或“热”)水,原因是 。
15.水是一种常见溶剂,如图为甲、乙两种固体(不含结晶水)溶于水的溶解度曲线。
(1)图中P点含义为 ;
(2)将t1℃的甲的不饱和溶液变成饱和溶液的方法: (写一种);
(3)t2℃时90g甲的饱和溶液恒温蒸发20g水,析出 g固体。
16.甲、乙两种物质的溶解度曲线如图所示,试回答以下问题:
(1)m点表示: 。
(2)20℃时,在100g甲物质的饱和溶液中加入10g水,为使溶液重新达到饱和,需加甲物质 g。
(3)若将乙的不饱和溶液变成饱和溶液,可采取的方法有 (填一种即可)。
(4)40℃时,将甲、乙两物质的饱和溶液各100克,分别降温到20℃,所得甲物质溶液的质量 (选填“>”“<”或“=”)乙物质溶液的质量。
17.如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:
(1)P点的含义是 。
(2)t2℃时,a、b、c三种物质的溶解度由大到小的顺序是 (填序号)。
(3)欲将t2℃时c物质的饱和溶液变为不饱和溶液,可采用的方法是 、 。
(4)t2℃时将50g a物质加入到80g水中充分溶解,所得溶液质量为 g。
(5)t2℃时,将a、b、c三种物质的饱和溶液各100g,分别降温到t1℃,所得三种溶液的质量大小关系是 (填序号)。
Ⅰ.b>a=c
Ⅱ.a=b>c
Ⅲ.b>a>c
Ⅳ.c>b>a
三.解答题(共3小题)
18.溶液与人类生产、生活密切相关。
(1)把少量下列物质分别放入水中,充分搅拌,能得到溶液的是 (填序号)。
A.氯化钠
B.植物油
C.面粉
D.白糖
(2)下列有关溶液的说法中,正确的是 (填序号)。
A.凡是均一的、稳定的液体一定是溶液
B.溶液是均一的、稳定的混合物
C.溶液一定是无色的,且溶剂一定是水
D.海水是溶解有多种溶质的溶液
(3)如图为甲、乙两种固体物质的溶解度曲线。
①溶解度随温度升高而增大的物质是 。
②t1℃时甲物质溶解度 乙物质的溶解度(填“>”“=”“<”)。
③t1℃时的乙物质的不饱和溶液,通过 或 ,可使其转变为饱和溶液。
④t2℃时,甲物质饱和溶液中溶质与溶剂的质量比为 (填最简比)。
19.某同学进行了如图溶解实验。
(1)所得溶液一定属于饱和溶液的是 ,饱和溶液转化为不饱和溶液的方法是 。
(2)甲物质在20℃时溶解度的范围是 (用“=”“>”“<”“≥”“≤”符号表示),B、C、D、E中溶质质量分数的大小关系是 (用“=”“>”“<”“≥”“≤”符号表示)。
(3)t℃时固体恰好完全溶解,则此温度时甲的溶解度为 ,E中溶质的质量分数为 。
20.甲、乙、丙三种固体(均不含结晶水)的部分溶解度见下表。
温度(℃) t1 t2 t3
溶解度(g/100g水) 甲 44.9 54.2 107.5
乙 13.0 9.6 5.3
丙 5.0 10.0 40.0
(1)t2℃时,乙的溶解度是 g/100g水。
(2)如图一所示,t1℃时,甲、乙、丙三种物质各25g放入烧杯中,分别倒入100g水,保持温度不变,充分溶解。
Ⅰ.甲溶液的溶质质量分数是 。
Ⅱ.将三个烧杯中的混合物分别升温至t3℃。溶液质量减少的是 溶液(选填“甲”“乙”或“丙”)。在图二中,绘制丙溶液溶质质量随温度变化的曲线 。
第三节溶解度分层作业巩固练习第九章溶液2021_2022学年九年级化学(京改版2013)
参考答案与试题解析
一.选择题(共13小题)
1.相同质量的下列物质分别溶于等质量的水中,所得溶液中溶质的质量分数最大的是( )
A.Na2O B.NaOH C.CuSO4 5H2O D.H2SO4
【分析】根据物质的性质以及溶质的质量分数=来分析。
【解答】解:假设四种物质的质量均为mg,水的质量均为ng。相同质量的下列物质分别溶于等质量的水中,所得溶液的质量均为(m+n)g。
A、mg的Na2O放入ng水中后会生成氢氧化钠,生成的氢氧化钠的质量大于mg,则所得溶液中溶质的质量分数大于;
B、mg的氢氧化钠放入ng水中,所得溶液中溶质的质量分数为;
C、mg的CuSO4 5H2O放入ng水中,所得溶液为硫酸铜的水溶液,其中溶质的质量分数小于;
D、mg的H2SO4放入ng水中,所得溶液中溶质的质量分数为;
由以上分析可知,所得溶液中溶质的质量分数最大的是A。
故选:A。
【点评】溶于水能与水反应的物质,反应后溶液中的溶质不再是加入的物质,而是生成的物质。
2.甲、乙两种物质的溶解度曲线如图所示。下列说法错误的是( )
A.甲的溶解度随着温度的升高而增大
B.t1℃时,甲和乙的溶解度相等
C.t2℃时,30g的甲溶于在50g的水中,得到80g的溶液
D.升高温度可以将乙的不饱和溶液转化为饱和溶液
【分析】根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较。
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况。
根据物质的溶解度曲线、溶质质量、溶剂质量可以判断配制的溶液质量。
饱和溶液和不饱和溶液之间可以相互转化。
【解答】解:A、甲的溶解度随着温度的升高而增大,该选项正确。
B、t1℃时,甲和乙的溶解度相等,该选项正确。
C、t2℃时甲的溶解度是50g,30g的甲溶于在50g的水中,能够溶解25g,得到75g的溶液,该选项不正确。
D、乙的溶解度随着温度升高而减小,升高温度可以将乙的不饱和溶液转化为饱和溶液,该选项正确。
故选:C。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
3.T2℃时,将70.0g KNO3、KCl固体分别加入到各盛有200.0g水的两个烧杯中,完全溶解,降温到T1℃,现象如图1所示。下列说法正确的是( )
A.甲中加入的固体是KNO3
B.T1℃时,甲中溶液一定不饱和,乙中溶液一定饱和
C.T1℃时,将甲、乙中的物质混合,充分搅拌,一定有固体剩余
D.T2℃时,KCl溶液由a点转化到b点,可加入KCl或恒温蒸发水
【分析】根据题目信息和溶解度曲线可知:KNO3、KCl两种固体物质的溶解度,都是随温度升高而增大,而硝酸钾的溶解度随温度的升高变化比氯化钾大;
A、判断物质的溶解度曲线;
B、饱和溶液与不饱和溶液的判断;
C、T1℃时,将甲、乙中的物质混合,充分搅拌,一定有固体剩余错误;
D、饱和溶液与不饱和溶液的相互转化。
【解答】解:A、T2℃时,将70.0gKNO3、KCl固体分别加入到各盛有200.0g水的两个烧杯中,完全溶解,降温到T1℃,现象如图1所示,因为在T1℃时,氯化钾的溶解度是35g,硝酸钾的溶解度是25g,因此甲是氯化钾,乙是硝酸钾;故选项错误;
B、T1℃时,甲中溶液一定不饱和,乙中溶液一定饱和错误,因为甲溶液恰好达到饱和状态;故选项错误;
C、T1℃时,将甲、乙中的物质混合,充分搅拌,一定有固体剩余错误,因为甲中的还能继续溶解乙中的固体,因此可能有固体剩余,也可能没有剩余;故选项错误;
D、T2℃时,KCl溶液由a点转化到b点,可加入KCl或恒温蒸发水正确;故选项正确;
故选:D。
【点评】本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关饱和溶液与不饱和溶液的相互转化等,本考点主要出现在选择题和填空题中。
4.R是KNO3和NaNO3两种物质中的一种,两物质的溶解度曲线如图,现用R做如图所示的实验。下列说法不正确的是( )
A.R不可能是KNO3
B.①和②的溶液中,溶质质量相等
C.①②③中,只有③的上层清液是饱和溶液
D.①的溶液中溶质的质量分数比③的上层清液中溶质的质量分数小
【分析】根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较;
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况;
根据物质的溶解度曲线、溶质质量、溶剂质量可以判断配制的溶液质量;
饱和溶液和不饱和溶液之间可以相互转化;
根据物质的溶解度曲线可以判断随着温度的变化,溶质质量分数变化的情况;
根据溶质质量分数的计算方法判断溶质质量分数大小。
【解答】解:A、观察图中t2时的烧杯中有晶体析出,说明100g水中无法溶解50gR,即R物质在t2℃时的溶解度小于50g,据此判断R物质是NaNO3,故A说法正确;
B.①和②的溶液中,溶质质量相等,都是50g,该B说法正确;
C.①②③中,②的溶液和③的上层清液是饱和溶液,故C说法不正确;
D.①的溶液中溶质的质量分数=×100%=20%,③是t2℃时NaNO3的饱和溶液,t2℃时NaNO3的溶解度大于30g,上层清液中溶质的质量分数大于:×100%=23.1%,因此①的溶液中溶质的质量分数比③的上层清液中溶质的质量分数小,故D说法正确。
故选:C。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
5.如图为两种物质的溶解度曲线,下列说法正确的是( )
A.两种物质的溶解度都随温度升高而增大
B.20℃时,Na2Cr2O7饱和溶液的溶质质量分数为80%
C.60℃时,Na2SO4的溶解度大于Na2Cr2O7的溶解度
D.可以配制溶质质量分数相同的Na2Cr2O7、Na2SO4溶液
【分析】根据题目信息和溶解度曲线可知:
A、比较两种物质的溶解度的变化情况;
B、有关的计算要准确;
C、溶解度大小的比较;
D、可以配制溶质质量分数相同的Na2Cr2O7、Na2SO4溶液。
【解答】解:A、两种物质的溶解度都随温度升高而增大错误,因为Na2SO4的溶解度在一定的温度下,随温度的升高而减小;故A错误;
B、20℃时,Na2Cr2O7饱和溶液的溶质质量分数=≈44.4%,故B错误;
C、60℃时,Na2Cr2O7的溶解度大于Na2SO4的溶解度,故C错误;
D、可以配制溶质质量分数相同的Na2Cr2O7、Na2SO4不饱和溶液;故D正确。
故选:D。
【点评】本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的计算,有关的计算要准确,本考点主要出现在选择题和填空题中。
6.下列有关水与溶液的说法正确的是( )
A.电解水时,负极产生的是氧气
B.熟石灰溶于水达到饱和时还是稀溶液
C.溶液是均一、稳定、无色的混合物
D.溶质可以是固体、液体,不能是气体
【分析】A、根据电解水的实验结论,进行分析判断。
B、根据熟石灰微溶于水,进行分析判断。
C、根据溶液的特征,进行分析判断。
D、根据溶质的状态,进行分析判断。
【解答】解:A、电解水时,负极产生的是气体体积多,能燃烧,是氢气,故选项说法错误。
B、熟石灰微溶于水,溶于水达到饱和时还是稀溶液,故选项说法正确。
C、溶液是均一、稳定的混合物,有些溶液是带有颜色的,如硫酸铜溶液是蓝色的;故选项说法错误。
D、溶质可以是固体、液体,也可能是气体,故选项说法错误。
故选:B。
【点评】本题难度不大,了解溶液饱和和溶液浓稀的关系、溶液的特征等是正确解答本题的关键。
7.下列有关溶液的说法,正确的是( )
A.一杯溶液中只可能有一种溶质
B.饱和溶液一定比不饱和溶液浓度大
C.20℃时,100g水中最多能溶解36g NaCl,则 NaCl的溶解度为36g
D.海水晒盐后剩下的母液一定是氯化钠的饱和溶液
【分析】A、根据溶液的特征,进行分析判断。
B、根据选项说法没有指明溶质的种类、温度,进行分析判断。
C、溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量。
D、根据饱和溶液的特征,进行分析判断。
【解答】解:A、一种或几种物质分散到另一种物质中,形成均一的、稳定的混合物叫做溶液,一杯溶液中可能有多种溶质,故选项说法错误。
B、选项说法没有指明溶质的种类、温度,则饱和溶液不一定比不饱和溶液浓度大,故选项说法错误。
C、20℃时,100g水中最多能溶解36gNaCl,则20℃时,NaCl的溶解度为36g,故选项说法错误。
D、海水晒盐后剩下的母液,不能继续溶解氯化钠,一定是氯化钠的饱和溶液,故选项说法正确。
故选:D。
【点评】本题难度不大,掌握饱和溶液的特征、溶解度的含义、溶液的特征等是正确解答本题的关键。
8.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
A.20℃时,甲、乙饱和溶液中溶质的质量分数相等
B.将40℃时甲的饱和溶液降温至20℃,溶液质量不变
C.甲的溶解度大于乙的溶解度
D.将20℃时乙的饱和溶液升温至40℃,乙溶液仍为饱和溶液
【分析】根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较。
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况。
饱和溶液和不饱和溶液之间可以相互转化。
饱和溶液的溶质质量分数=×100%。
【解答】解:A、20℃时甲和乙的溶解度相等,甲、乙饱和溶液中溶质的质量分数相等,该选项正确。
B、将40℃时甲的饱和溶液降温至20℃,析出晶体,溶液质量减小,该选项不正确。
C、不知道温度范围,不能比较两种物质溶解度大小,该选项不正确。
D、乙的溶解度随着温度升高而增大,将20℃时乙的饱和溶液升温至40℃,乙溶液变成不饱和溶液,该选项不正确。
故选:A。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
9.某次硝酸钾溶解实验过程如图所示,不考虑水分蒸发,下列判断正确的是( )
A.③中溶液是饱和溶液
B.②③中溶液质量相等
C.②③中溶液的溶质质量分数相同
D.硝酸钾的溶解度随温度的升高而变大
【分析】A、根据溶液状态的判断方法来分析;
B、根据溶液的质量=溶质的质量+溶剂的质量来分析;
C、根据溶质的质量分数的判断方法来分析;
D、根据温度对硝酸钾溶解度的影响来分析。
【解答】解:A、烧杯②的溶液加热后,其中未溶解的晶体全部溶解,所得③中溶液可能是该温度下的饱和溶液,也可能是不饱和溶液,故A错误;
B、②③中水的质量相等,但是溶解的溶质质量不同,因此溶液质量不相等,故B错误;
C、②③中水的质量相等,但是溶解的溶质质量不同,因此所得溶液中溶质的质量分数不同,故C错误;
D、②中有未溶解的硝酸钾晶体存在,加热后硝酸钾慢慢溶解,说明硝酸钾的溶解度随温度的升高而变大,故D正确。
故选:D。
【点评】本考点考查了饱和溶液与不饱和溶液、质量分数等,要加强记忆,理解应用;本考点主要出现在选择题和填空题中。
10.下列措施中,能够增强蔗糖在水中溶解性的是( )
A.加热 B.搅拌 C.增加水量 D.将蔗糖研碎
【分析】考查影响物质溶解性的因素。
【解答】解:A、加热可以提高蔗糖的溶解性,选项A正确;
B、搅拌可以加快溶解速率,但不会改变溶解性,选项B错误;
C、增加水量可以加快蔗糖溶解,但是不提高溶解性,选项C错误;
D、蔗糖研碎增加溶解速率,不影响溶解性,选项D错误;
故选:A。
【点评】主要根据物质溶解性随温度变化的性质来回答此题。
11.如图为甲、乙两物质的溶解度曲线,下列有关说法中不正确的是( )
A.温度大于t1℃时,甲的溶解度大于乙的溶解度
B.t1℃时,甲的饱和溶液中溶质的质量分数为15%
C.要使接近饱和的乙溶液转化为饱和溶液,可以采用蒸发溶剂的方法
D.t2℃,将50克甲物质放入100克水中,可得到溶质的质量分数为23.1%
【分析】根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较。
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况。
根据物质的溶解度曲线、溶质质量、溶剂质量可以判断配制的溶液质量。
饱和溶液和不饱和溶液之间可以相互转化。
饱和溶液的溶质质量分数=×100%。
溶液中溶质质量分数=×100%。
【解答】解:A、温度大于t1℃时,甲的溶解度大于乙的溶解度,该选项正确。
B、t1℃时甲的溶解度是15g,甲的饱和溶液中溶质的质量分数为×100%≈13.04%,该选项不正确。
C、要使接近饱和的乙溶液转化为饱和溶液,可以采用蒸发溶剂的方法,该选项正确。
D、t2℃甲的溶解度是30g,将50克甲物质放入100克水中,能够完全溶解,可得到溶质的质量分数为×100%≈23.1%,该选项正确。
故选:B。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
12.图1为硝酸钾和氯化钾的溶解度曲线,图2为兴趣小组进行的实验,R物质是硝酸钾或氯化钾中的一种。下列说法不正确的是( )
A.R物质是硝酸钾
B.溶质的质量分数大小依次为②>③>①
C.t1℃时烧杯③中溶质的质量分数为31.6%
D.烧杯③中析出的固体质量一定为28.4克
【分析】根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定物质的溶解性;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断是晶体溶解的方法。
【解答】解:A、蒸发100g水,还能溶解60gR,说明该物质在t2℃的溶解度大于或等于60g,所以R是硝酸钾,故A说法正确;
B、①中是t1℃时硝酸钾的不饱和溶液,③中是t1℃时硝酸钾的饱和溶液,②中是t2℃硝酸钾的饱和溶液,所以溶质的质量分数大小依次为:②>③>①,故B说法正确;
C、t1℃时烧杯③中溶质的质量分数为:≈24%,故C说法错误;
D、烧杯③中析出的固体质量为:60g﹣31.6g=28.4g,故D说法正确。
故选:C。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
13.20℃时,通过增加溶质的方法将硝酸钾的不饱和溶液变为饱和溶液,下列说法错误的是( )
A.溶质的质量增加
B.溶剂的质量不变
C.溶液的质量增加
D.溶液的溶质质量分数不变
【分析】根据20℃时,通过增加溶质的方法将硝酸钾的不饱和溶液变为饱和溶液,溶质质量增加,溶剂质量不变,进行分析判断。
【解答】解:A、20℃时,通过增加溶质的方法将硝酸钾的不饱和溶液变为饱和溶液,溶质质量增加,故选项说法正确。
B、20℃时,通过增加溶质的方法将硝酸钾的不饱和溶液变为饱和溶液,溶质质量增加,溶剂质量不变,故选项说法正确。
C、20℃时,通过增加溶质的方法将硝酸钾的不饱和溶液变为饱和溶液,溶质质量增加,溶剂质量不变,则溶液的质量增加,故选项说法正确。
D、20℃时,通过增加溶质的方法将硝酸钾的不饱和溶液变为饱和溶液,溶质质量增加,溶剂质量不变,溶液的溶质质量分数变大,故选项说法错误。
故选:D。
【点评】本题难度不大,明确硝酸钾溶液组成的变化是正确解答本题的关键。
二.填空题(共4小题)
14.用气泡水机可以自制碳酸饮料。气泡水机中有液态二氧化碳钢瓶,加压将二氧化碳装入钢瓶的微观实质是 压强增大,分子间的间隔变小 。制作碳酸饮料时,为了在水中溶解更多二氧化碳,应选用 冷 (填“冷”或“热”)水,原因是 气体的溶解度随温度的升高而减小 。
【分析】根据分子的基本性质,进行分析解答。
利用气体的溶解度随温度的升高而减小,随着压强的增大而增大,结合事实进行分析解答.
【解答】解:气泡水机中有液态二氧化碳钢瓶,加压将二氧化碳装入钢瓶的微观实质是分子间有间隔,气体受压后,分子间的间隔变小.
利用气体的溶解度随温度的升高而减小,制作碳酸饮料时,为了在水中溶解更多二氧化碳,应选用冷水,原因是气体的溶解度随温度的升高而减小。
故答案为:
压强增大,分子间的间隔变小;冷;气体的溶解度随温度的升高而减小。
【点评】本题难度不大,掌握气体溶解度的两个影响因素(温度、压强)、分子的基本性质是正确解答本题的关键.
15.水是一种常见溶剂,如图为甲、乙两种固体(不含结晶水)溶于水的溶解度曲线。
(1)图中P点含义为 t1℃时,甲、乙的溶解度相等,均为40g ;
(2)将t1℃的甲的不饱和溶液变成饱和溶液的方法: 蒸发溶剂或加溶质 (写一种);
(3)t2℃时90g甲的饱和溶液恒温蒸发20g水,析出 16 g固体。
【分析】(1)根据交点的意义分析;
(2)根据甲的溶解度受温度的影响、不饱和溶液和变成饱和溶液的转化方法;
(3)根据t2℃时甲溶解度的意义分析。
【解答】解:(1)图中P点含义为:t1℃时,甲、乙两种固体溶解度相同;
(2)将t1℃的甲的不饱和溶液变成饱和溶液的方法:蒸发溶剂或加溶质;
(3)由溶解度曲线可知,t2℃时甲的溶解度是80g,由溶解度的含义可知,90克甲的饱和溶液恒温蒸发20克水,析出16克固体;
故答案是:(1)t1℃时,甲、乙的溶解度相等,均为 40g/100g 水;
(2)蒸发溶剂或加溶质;
(3)16。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
16.甲、乙两种物质的溶解度曲线如图所示,试回答以下问题:
(1)m点表示: 20℃时甲乙溶解度相等 。
(2)20℃时,在100g甲物质的饱和溶液中加入10g水,为使溶液重新达到饱和,需加甲物质 4 g。
(3)若将乙的不饱和溶液变成饱和溶液,可采取的方法有 加入乙物质 (填一种即可)。
(4)40℃时,将甲、乙两物质的饱和溶液各100克,分别降温到20℃,所得甲物质溶液的质量 < (选填“>”“<”或“=”)乙物质溶液的质量。
【分析】根据题目信息和溶解度曲线可知:甲固体物质的溶解度,是随温度升高而增大,而乙的溶解度随温度的升高而减少;(1)交点的含义;
(2)有关的计算要准确;
(3)饱和溶液与不饱和溶液的相互转化;
(4)40℃时,将甲、乙两物质的饱和溶液各100克,分别降温到20℃,所得甲物质溶液的质量<乙物质溶液的质量。
【解答】解:(1)m点表示:20℃时甲乙溶解度相等;故答案为:20℃时甲乙溶解度相等;
(2)20℃时,甲的溶解度是40g,在100g甲物质的饱和溶液中加入10g水,为使溶液重新达到饱和,设需加甲物质的质量为x,,x=4g;故答案为:4;
(3)若将乙的不饱和溶液变成饱和溶液,可采取的方法有:加入乙物质、蒸发溶剂、升高温度;故答案为:加入乙物质(合理即可);
(4)40℃时,将甲、乙两物质的饱和溶液各100克,分别降温到20℃,所得甲物质溶液的质量<乙物质溶液的质量,因为甲有固体析出,乙没有固体析出;故答案为:<。
【点评】本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的计算,有关的计算要准确,本考点主要出现在选择题和填空题中.
17.如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:
(1)P点的含义是 t1℃时,a、c物质溶解度相等,且为20g 。
(2)t2℃时,a、b、c三种物质的溶解度由大到小的顺序是 a>b>c (填序号)。
(3)欲将t2℃时c物质的饱和溶液变为不饱和溶液,可采用的方法是 加溶剂 、 降温 。
(4)t2℃时将50g a物质加入到80g水中充分溶解,所得溶液质量为 120 g。
(5)t2℃时,将a、b、c三种物质的饱和溶液各100g,分别降温到t1℃,所得三种溶液的质量大小关系是 Ⅳ (填序号)。
Ⅰ.b>a=c
Ⅱ.a=b>c
Ⅲ.b>a>c
Ⅳ.c>b>a
【分析】(1)依据溶解度曲线中交点含义分析;
(2)依据溶解度曲线中,t2℃时,a、b、c三种物质的溶解度分析;
(3)依据饱和溶液与不饱和溶液的转化方法分析;
(4)依据溶解度曲线中,t2℃时a物质的溶解度分析;
(5)依据a、b、c三种物质的溶解度曲线分析。
【解答】解:(1)P点是t1℃时,a、c物质溶解度曲线的交点,则P点的含义是t1℃时,a、c物质溶解度相等,且为20g,故填:t1℃时,a、c物质溶解度相等,且为20g;
(2)分析溶解度曲线可知,t2℃时,曲线a在曲线b的上方,曲线b在曲线c的上方,则a、b、c三种物质的溶解度由大到小的顺序是a>b>c,故填:a>b>c;
(3)分析溶解度曲线可知,c物质的溶解度随温度的升高而降低,则欲将t2℃时c物质饱和溶液变为不饱和溶液可采用的方法是:加溶剂或降低温度,故填:加溶剂;降温;
(4)分析溶解度曲线可知,t2℃时a物质的溶解度为50g,则t2℃时将50g a物质加入到80g水中充分溶解,所得溶液质量为40g+80g=120g,故填:120;
(5)分析溶解度曲线可知,t2℃时a、b、c三种物质的溶解度是a>b>c,t1℃时a、b、c三种物质的溶解度是b>a=c,a、b物质的解溶度随温度的降低而减小,t2℃时,将a、b两种物质的饱和溶液各100g,分别降温到t1℃,都会有晶体析出,a析出晶体的质量大于b析出晶体的质量,则所得两种溶液的质量a<b<100g,c物质的溶解度解溶度随温度的降低而增大,t2℃时,将c物质的饱和溶液100g,降温到t1℃,不会有晶体析出,则c物质溶液的质量仍为100g,所以t2℃时,将a、b、c三种物质的饱和溶液各100g,分别降温到t1℃,所得三种溶液的质量大小关系是c>b>a,故填:Ⅳ。
【点评】此题主要考查溶解度曲线的应用,主要是利用溶解度曲线的意义来分析和解决有关问题,结合各方面的条件得出正确结论。
三.解答题(共3小题)
18.溶液与人类生产、生活密切相关。
(1)把少量下列物质分别放入水中,充分搅拌,能得到溶液的是 AD (填序号)。
A.氯化钠
B.植物油
C.面粉
D.白糖
(2)下列有关溶液的说法中,正确的是 BD (填序号)。
A.凡是均一的、稳定的液体一定是溶液
B.溶液是均一的、稳定的混合物
C.溶液一定是无色的,且溶剂一定是水
D.海水是溶解有多种溶质的溶液
(3)如图为甲、乙两种固体物质的溶解度曲线。
①溶解度随温度升高而增大的物质是 甲 。
②t1℃时甲物质溶解度 = 乙物质的溶解度(填“>”“=”“<”)。
③t1℃时的乙物质的不饱和溶液,通过 恒温蒸发溶剂 或 加入乙 ,可使其转变为饱和溶液。
④t2℃时,甲物质饱和溶液中溶质与溶剂的质量比为 2:5 (填最简比)。
【分析】(1)氯化钠易溶于水,能够溶于水形成溶液;
植物油不溶于水,不能形成溶液;
面粉不溶于水,不能形成溶液;
白糖易溶于水,能够溶于水形成溶液。
(2)溶液是一种或几种物质分散到另外一种物质里,形成的均一、稳定的混合物。
(3)根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较;
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况;
饱和溶液和不饱和溶液之间可以相互转化;
根据溶解度可以计算饱和溶液中溶质和溶剂的质量比.
【解答】解:(1)A.氯化钠易溶于水,能够溶于水形成溶液;
B.植物油不溶于水,不能形成溶液;
C.面粉不溶于水,不能形成溶液;
D.白糖易溶于水,能够溶于水形成溶液。
故填:AD。
(2)A.均一的、稳定的液体不一定是溶液,例如水是均一的、稳定的液体,不是溶液,该选项说法不正确;
B.溶液是均一的、稳定的混合物,该选项说法正确;
C.溶液不一定是无色的,且溶剂不一定是水,例如硫酸铜溶液是蓝色溶液,碘酒溶液中溶剂是酒精,该选项说法不正确;
D.海水是溶解有多种溶质的溶液,该选项说法正确。
故填:BD。
(3)①溶解度随温度升高而增大的物质是甲。
故填:甲。
②t1℃时甲物质溶解度=乙物质的溶解度。
故填:=。
③t1℃时的乙物质的不饱和溶液,通过恒温蒸发溶剂或加入乙,可使其转变为饱和溶液。
故填:恒温蒸发溶剂;加入乙。
④t2℃时甲溶解度是40g,甲物质饱和溶液中溶质与溶剂的质量比为:40g1:00g=2:5。
故填:2:5。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同.
19.某同学进行了如图溶解实验。
(1)所得溶液一定属于饱和溶液的是 BDE ,饱和溶液转化为不饱和溶液的方法是 加水或升温 。
(2)甲物质在20℃时溶解度的范围是 31.6g≤S甲<45.8g (用“=”“>”“<”“≥”“≤”符号表示),B、C、D、E中溶质质量分数的大小关系是 E>B=D≥C (用“=”“>”“<”“≥”“≤”符号表示)。
(3)t℃时固体恰好完全溶解,则此温度时甲的溶解度为 45.8g/100g水 ,E中溶质的质量分数为 31.4% 。
【分析】(1)根据B、D溶液中含有未溶解的固体,E溶液中在t℃时恰好完全溶解,甲物质的溶解度随温度的升高而减小进行分析;
(2)根据20℃时,100g的水中加入31.6g的甲全部溶解,再次加入14.2g的甲,有晶体剩余,以及结合溶质、溶剂质量进行分析;
(3)根据溶解度的定义,乙饱和溶液的溶质质量分数进行分析。
【解答】解:(1)B、D溶液中含有未溶解的固体,E溶液中在t℃时恰好完全溶解,甲物质的溶解度随温度的升高而减小,所以所得溶液一定属于饱和溶液的是BDE,饱和溶液转化为不饱和溶液的方法是加水或升温;
(2)20℃时,100g的水中加入31.6g的甲全部溶解,再次加入14.2g的甲,有晶体剩余,所以甲物质在20℃时溶解度的范围是31.6g≤S甲<45.8g,B溶液的溶质质量分数小于×100%,C溶液的溶质质量分数为:×100%,D溶液的溶质质量分数小于×100%,E溶液的溶质质量分数为×100%,所以B、C、D、E中溶质质量分数的大小关系是E>B=D≥C;
(3)t℃时固体恰好完全溶解,则此温度时甲的溶解度为45.8g/100g水,E中溶质的质量分数为×100%≈31.4%。
故答案为:(1)BDE;加水或升温;
(2)31.6g≤S甲<45.8g;E>B=D≥C;
(3)45.8g/100g水;31.4%。
【点评】本题难度不是很大,主要考查了固体的溶解度表所表示的意义,及根据固体的溶解度表来解决相关的问题,从而培养分析问题、解决问题的能力。
20.甲、乙、丙三种固体(均不含结晶水)的部分溶解度见下表。
温度(℃) t1 t2 t3
溶解度(g/100g水) 甲 44.9 54.2 107.5
乙 13.0 9.6 5.3
丙 5.0 10.0 40.0
(1)t2℃时,乙的溶解度是 9.6 g/100g水。
(2)如图一所示,t1℃时,甲、乙、丙三种物质各25g放入烧杯中,分别倒入100g水,保持温度不变,充分溶解。
Ⅰ.甲溶液的溶质质量分数是 20% 。
Ⅱ.将三个烧杯中的混合物分别升温至t3℃。溶液质量减少的是 乙 溶液(选填“甲”“乙”或“丙”)。在图二中,绘制丙溶液溶质质量随温度变化的曲线 。
【分析】(1)根据提供数据可以判断某种物质的溶解度。
(2)饱和溶液溶质质量分数=×100%。
根据溶解度随着温度的变化而变化的情况可以判断相关方面的问题。
【解答】解:(1)t2℃时,乙的溶解度是9.6g/100g水。
故填:9.6.
(2)Ⅰ.t1℃时,甲的溶解度是44.9g,因此25g甲完全溶解,甲溶液的溶质质量分数是:×100%=20%。
故填:20%。
Ⅱ.将三个烧杯中的混合物分别升温至t3℃,溶液质量减少的是乙,是因为乙的溶解度随着温度升高而减小。
丙溶液溶质质量随温度变化的曲线如下所示:
。
故填:乙;。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同.
第1页(共1页)
一.选择题(共13小题)
1.相同质量的下列物质分别溶于等质量的水中,所得溶液中溶质的质量分数最大的是( )
A.Na2O B.NaOH C.CuSO4 5H2O D.H2SO4
2.甲、乙两种物质的溶解度曲线如图所示。下列说法错误的是( )
A.甲的溶解度随着温度的升高而增大
B.t1℃时,甲和乙的溶解度相等
C.t2℃时,30g的甲溶于在50g的水中,得到80g的溶液
D.升高温度可以将乙的不饱和溶液转化为饱和溶液
3.T2℃时,将70.0g KNO3、KCl固体分别加入到各盛有200.0g水的两个烧杯中,完全溶解,降温到T1℃,现象如图1所示。下列说法正确的是( )
A.甲中加入的固体是KNO3
B.T1℃时,甲中溶液一定不饱和,乙中溶液一定饱和
C.T1℃时,将甲、乙中的物质混合,充分搅拌,一定有固体剩余
D.T2℃时,KCl溶液由a点转化到b点,可加入KCl或恒温蒸发水
4.R是KNO3和NaNO3两种物质中的一种,两物质的溶解度曲线如图,现用R做如图所示的实验。下列说法不正确的是( )
A.R不可能是KNO3
B.①和②的溶液中,溶质质量相等
C.①②③中,只有③的上层清液是饱和溶液
D.①的溶液中溶质的质量分数比③的上层清液中溶质的质量分数小
5.如图为两种物质的溶解度曲线,下列说法正确的是( )
A.两种物质的溶解度都随温度升高而增大
B.20℃时,Na2Cr2O7饱和溶液的溶质质量分数为80%
C.60℃时,Na2SO4的溶解度大于Na2Cr2O7的溶解度
D.可以配制溶质质量分数相同的Na2Cr2O7、Na2SO4溶液
6.下列有关水与溶液的说法正确的是( )
A.电解水时,负极产生的是氧气
B.熟石灰溶于水达到饱和时还是稀溶液
C.溶液是均一、稳定、无色的混合物
D.溶质可以是固体、液体,不能是气体
7.下列有关溶液的说法,正确的是( )
A.一杯溶液中只可能有一种溶质
B.饱和溶液一定比不饱和溶液浓度大
C.20℃时,100g水中最多能溶解36g NaCl,则 NaCl的溶解度为36g
D.海水晒盐后剩下的母液一定是氯化钠的饱和溶液
8.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
A.20℃时,甲、乙饱和溶液中溶质的质量分数相等
B.将40℃时甲的饱和溶液降温至20℃,溶液质量不变
C.甲的溶解度大于乙的溶解度
D.将20℃时乙的饱和溶液升温至40℃,乙溶液仍为饱和溶液
9.某次硝酸钾溶解实验过程如图所示,不考虑水分蒸发,下列判断正确的是( )
A.③中溶液是饱和溶液
B.②③中溶液质量相等
C.②③中溶液的溶质质量分数相同
D.硝酸钾的溶解度随温度的升高而变大
10.下列措施中,能够增强蔗糖在水中溶解性的是( )
A.加热 B.搅拌 C.增加水量 D.将蔗糖研碎
11.如图为甲、乙两物质的溶解度曲线,下列有关说法中不正确的是( )
A.温度大于t1℃时,甲的溶解度大于乙的溶解度
B.t1℃时,甲的饱和溶液中溶质的质量分数为15%
C.要使接近饱和的乙溶液转化为饱和溶液,可以采用蒸发溶剂的方法
D.t2℃,将50克甲物质放入100克水中,可得到溶质的质量分数为23.1%
12.图1为硝酸钾和氯化钾的溶解度曲线,图2为兴趣小组进行的实验,R物质是硝酸钾或氯化钾中的一种。下列说法不正确的是( )
A.R物质是硝酸钾
B.溶质的质量分数大小依次为②>③>①
C.t1℃时烧杯③中溶质的质量分数为31.6%
D.烧杯③中析出的固体质量一定为28.4克
13.20℃时,通过增加溶质的方法将硝酸钾的不饱和溶液变为饱和溶液,下列说法错误的是( )
A.溶质的质量增加
B.溶剂的质量不变
C.溶液的质量增加
D.溶液的溶质质量分数不变
二.填空题(共4小题)
14.用气泡水机可以自制碳酸饮料。气泡水机中有液态二氧化碳钢瓶,加压将二氧化碳装入钢瓶的微观实质是 。制作碳酸饮料时,为了在水中溶解更多二氧化碳,应选用 (填“冷”或“热”)水,原因是 。
15.水是一种常见溶剂,如图为甲、乙两种固体(不含结晶水)溶于水的溶解度曲线。
(1)图中P点含义为 ;
(2)将t1℃的甲的不饱和溶液变成饱和溶液的方法: (写一种);
(3)t2℃时90g甲的饱和溶液恒温蒸发20g水,析出 g固体。
16.甲、乙两种物质的溶解度曲线如图所示,试回答以下问题:
(1)m点表示: 。
(2)20℃时,在100g甲物质的饱和溶液中加入10g水,为使溶液重新达到饱和,需加甲物质 g。
(3)若将乙的不饱和溶液变成饱和溶液,可采取的方法有 (填一种即可)。
(4)40℃时,将甲、乙两物质的饱和溶液各100克,分别降温到20℃,所得甲物质溶液的质量 (选填“>”“<”或“=”)乙物质溶液的质量。
17.如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:
(1)P点的含义是 。
(2)t2℃时,a、b、c三种物质的溶解度由大到小的顺序是 (填序号)。
(3)欲将t2℃时c物质的饱和溶液变为不饱和溶液,可采用的方法是 、 。
(4)t2℃时将50g a物质加入到80g水中充分溶解,所得溶液质量为 g。
(5)t2℃时,将a、b、c三种物质的饱和溶液各100g,分别降温到t1℃,所得三种溶液的质量大小关系是 (填序号)。
Ⅰ.b>a=c
Ⅱ.a=b>c
Ⅲ.b>a>c
Ⅳ.c>b>a
三.解答题(共3小题)
18.溶液与人类生产、生活密切相关。
(1)把少量下列物质分别放入水中,充分搅拌,能得到溶液的是 (填序号)。
A.氯化钠
B.植物油
C.面粉
D.白糖
(2)下列有关溶液的说法中,正确的是 (填序号)。
A.凡是均一的、稳定的液体一定是溶液
B.溶液是均一的、稳定的混合物
C.溶液一定是无色的,且溶剂一定是水
D.海水是溶解有多种溶质的溶液
(3)如图为甲、乙两种固体物质的溶解度曲线。
①溶解度随温度升高而增大的物质是 。
②t1℃时甲物质溶解度 乙物质的溶解度(填“>”“=”“<”)。
③t1℃时的乙物质的不饱和溶液,通过 或 ,可使其转变为饱和溶液。
④t2℃时,甲物质饱和溶液中溶质与溶剂的质量比为 (填最简比)。
19.某同学进行了如图溶解实验。
(1)所得溶液一定属于饱和溶液的是 ,饱和溶液转化为不饱和溶液的方法是 。
(2)甲物质在20℃时溶解度的范围是 (用“=”“>”“<”“≥”“≤”符号表示),B、C、D、E中溶质质量分数的大小关系是 (用“=”“>”“<”“≥”“≤”符号表示)。
(3)t℃时固体恰好完全溶解,则此温度时甲的溶解度为 ,E中溶质的质量分数为 。
20.甲、乙、丙三种固体(均不含结晶水)的部分溶解度见下表。
温度(℃) t1 t2 t3
溶解度(g/100g水) 甲 44.9 54.2 107.5
乙 13.0 9.6 5.3
丙 5.0 10.0 40.0
(1)t2℃时,乙的溶解度是 g/100g水。
(2)如图一所示,t1℃时,甲、乙、丙三种物质各25g放入烧杯中,分别倒入100g水,保持温度不变,充分溶解。
Ⅰ.甲溶液的溶质质量分数是 。
Ⅱ.将三个烧杯中的混合物分别升温至t3℃。溶液质量减少的是 溶液(选填“甲”“乙”或“丙”)。在图二中,绘制丙溶液溶质质量随温度变化的曲线 。
第三节溶解度分层作业巩固练习第九章溶液2021_2022学年九年级化学(京改版2013)
参考答案与试题解析
一.选择题(共13小题)
1.相同质量的下列物质分别溶于等质量的水中,所得溶液中溶质的质量分数最大的是( )
A.Na2O B.NaOH C.CuSO4 5H2O D.H2SO4
【分析】根据物质的性质以及溶质的质量分数=来分析。
【解答】解:假设四种物质的质量均为mg,水的质量均为ng。相同质量的下列物质分别溶于等质量的水中,所得溶液的质量均为(m+n)g。
A、mg的Na2O放入ng水中后会生成氢氧化钠,生成的氢氧化钠的质量大于mg,则所得溶液中溶质的质量分数大于;
B、mg的氢氧化钠放入ng水中,所得溶液中溶质的质量分数为;
C、mg的CuSO4 5H2O放入ng水中,所得溶液为硫酸铜的水溶液,其中溶质的质量分数小于;
D、mg的H2SO4放入ng水中,所得溶液中溶质的质量分数为;
由以上分析可知,所得溶液中溶质的质量分数最大的是A。
故选:A。
【点评】溶于水能与水反应的物质,反应后溶液中的溶质不再是加入的物质,而是生成的物质。
2.甲、乙两种物质的溶解度曲线如图所示。下列说法错误的是( )
A.甲的溶解度随着温度的升高而增大
B.t1℃时,甲和乙的溶解度相等
C.t2℃时,30g的甲溶于在50g的水中,得到80g的溶液
D.升高温度可以将乙的不饱和溶液转化为饱和溶液
【分析】根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较。
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况。
根据物质的溶解度曲线、溶质质量、溶剂质量可以判断配制的溶液质量。
饱和溶液和不饱和溶液之间可以相互转化。
【解答】解:A、甲的溶解度随着温度的升高而增大,该选项正确。
B、t1℃时,甲和乙的溶解度相等,该选项正确。
C、t2℃时甲的溶解度是50g,30g的甲溶于在50g的水中,能够溶解25g,得到75g的溶液,该选项不正确。
D、乙的溶解度随着温度升高而减小,升高温度可以将乙的不饱和溶液转化为饱和溶液,该选项正确。
故选:C。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
3.T2℃时,将70.0g KNO3、KCl固体分别加入到各盛有200.0g水的两个烧杯中,完全溶解,降温到T1℃,现象如图1所示。下列说法正确的是( )
A.甲中加入的固体是KNO3
B.T1℃时,甲中溶液一定不饱和,乙中溶液一定饱和
C.T1℃时,将甲、乙中的物质混合,充分搅拌,一定有固体剩余
D.T2℃时,KCl溶液由a点转化到b点,可加入KCl或恒温蒸发水
【分析】根据题目信息和溶解度曲线可知:KNO3、KCl两种固体物质的溶解度,都是随温度升高而增大,而硝酸钾的溶解度随温度的升高变化比氯化钾大;
A、判断物质的溶解度曲线;
B、饱和溶液与不饱和溶液的判断;
C、T1℃时,将甲、乙中的物质混合,充分搅拌,一定有固体剩余错误;
D、饱和溶液与不饱和溶液的相互转化。
【解答】解:A、T2℃时,将70.0gKNO3、KCl固体分别加入到各盛有200.0g水的两个烧杯中,完全溶解,降温到T1℃,现象如图1所示,因为在T1℃时,氯化钾的溶解度是35g,硝酸钾的溶解度是25g,因此甲是氯化钾,乙是硝酸钾;故选项错误;
B、T1℃时,甲中溶液一定不饱和,乙中溶液一定饱和错误,因为甲溶液恰好达到饱和状态;故选项错误;
C、T1℃时,将甲、乙中的物质混合,充分搅拌,一定有固体剩余错误,因为甲中的还能继续溶解乙中的固体,因此可能有固体剩余,也可能没有剩余;故选项错误;
D、T2℃时,KCl溶液由a点转化到b点,可加入KCl或恒温蒸发水正确;故选项正确;
故选:D。
【点评】本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关饱和溶液与不饱和溶液的相互转化等,本考点主要出现在选择题和填空题中。
4.R是KNO3和NaNO3两种物质中的一种,两物质的溶解度曲线如图,现用R做如图所示的实验。下列说法不正确的是( )
A.R不可能是KNO3
B.①和②的溶液中,溶质质量相等
C.①②③中,只有③的上层清液是饱和溶液
D.①的溶液中溶质的质量分数比③的上层清液中溶质的质量分数小
【分析】根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较;
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况;
根据物质的溶解度曲线、溶质质量、溶剂质量可以判断配制的溶液质量;
饱和溶液和不饱和溶液之间可以相互转化;
根据物质的溶解度曲线可以判断随着温度的变化,溶质质量分数变化的情况;
根据溶质质量分数的计算方法判断溶质质量分数大小。
【解答】解:A、观察图中t2时的烧杯中有晶体析出,说明100g水中无法溶解50gR,即R物质在t2℃时的溶解度小于50g,据此判断R物质是NaNO3,故A说法正确;
B.①和②的溶液中,溶质质量相等,都是50g,该B说法正确;
C.①②③中,②的溶液和③的上层清液是饱和溶液,故C说法不正确;
D.①的溶液中溶质的质量分数=×100%=20%,③是t2℃时NaNO3的饱和溶液,t2℃时NaNO3的溶解度大于30g,上层清液中溶质的质量分数大于:×100%=23.1%,因此①的溶液中溶质的质量分数比③的上层清液中溶质的质量分数小,故D说法正确。
故选:C。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
5.如图为两种物质的溶解度曲线,下列说法正确的是( )
A.两种物质的溶解度都随温度升高而增大
B.20℃时,Na2Cr2O7饱和溶液的溶质质量分数为80%
C.60℃时,Na2SO4的溶解度大于Na2Cr2O7的溶解度
D.可以配制溶质质量分数相同的Na2Cr2O7、Na2SO4溶液
【分析】根据题目信息和溶解度曲线可知:
A、比较两种物质的溶解度的变化情况;
B、有关的计算要准确;
C、溶解度大小的比较;
D、可以配制溶质质量分数相同的Na2Cr2O7、Na2SO4溶液。
【解答】解:A、两种物质的溶解度都随温度升高而增大错误,因为Na2SO4的溶解度在一定的温度下,随温度的升高而减小;故A错误;
B、20℃时,Na2Cr2O7饱和溶液的溶质质量分数=≈44.4%,故B错误;
C、60℃时,Na2Cr2O7的溶解度大于Na2SO4的溶解度,故C错误;
D、可以配制溶质质量分数相同的Na2Cr2O7、Na2SO4不饱和溶液;故D正确。
故选:D。
【点评】本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的计算,有关的计算要准确,本考点主要出现在选择题和填空题中。
6.下列有关水与溶液的说法正确的是( )
A.电解水时,负极产生的是氧气
B.熟石灰溶于水达到饱和时还是稀溶液
C.溶液是均一、稳定、无色的混合物
D.溶质可以是固体、液体,不能是气体
【分析】A、根据电解水的实验结论,进行分析判断。
B、根据熟石灰微溶于水,进行分析判断。
C、根据溶液的特征,进行分析判断。
D、根据溶质的状态,进行分析判断。
【解答】解:A、电解水时,负极产生的是气体体积多,能燃烧,是氢气,故选项说法错误。
B、熟石灰微溶于水,溶于水达到饱和时还是稀溶液,故选项说法正确。
C、溶液是均一、稳定的混合物,有些溶液是带有颜色的,如硫酸铜溶液是蓝色的;故选项说法错误。
D、溶质可以是固体、液体,也可能是气体,故选项说法错误。
故选:B。
【点评】本题难度不大,了解溶液饱和和溶液浓稀的关系、溶液的特征等是正确解答本题的关键。
7.下列有关溶液的说法,正确的是( )
A.一杯溶液中只可能有一种溶质
B.饱和溶液一定比不饱和溶液浓度大
C.20℃时,100g水中最多能溶解36g NaCl,则 NaCl的溶解度为36g
D.海水晒盐后剩下的母液一定是氯化钠的饱和溶液
【分析】A、根据溶液的特征,进行分析判断。
B、根据选项说法没有指明溶质的种类、温度,进行分析判断。
C、溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量。
D、根据饱和溶液的特征,进行分析判断。
【解答】解:A、一种或几种物质分散到另一种物质中,形成均一的、稳定的混合物叫做溶液,一杯溶液中可能有多种溶质,故选项说法错误。
B、选项说法没有指明溶质的种类、温度,则饱和溶液不一定比不饱和溶液浓度大,故选项说法错误。
C、20℃时,100g水中最多能溶解36gNaCl,则20℃时,NaCl的溶解度为36g,故选项说法错误。
D、海水晒盐后剩下的母液,不能继续溶解氯化钠,一定是氯化钠的饱和溶液,故选项说法正确。
故选:D。
【点评】本题难度不大,掌握饱和溶液的特征、溶解度的含义、溶液的特征等是正确解答本题的关键。
8.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
A.20℃时,甲、乙饱和溶液中溶质的质量分数相等
B.将40℃时甲的饱和溶液降温至20℃,溶液质量不变
C.甲的溶解度大于乙的溶解度
D.将20℃时乙的饱和溶液升温至40℃,乙溶液仍为饱和溶液
【分析】根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较。
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况。
饱和溶液和不饱和溶液之间可以相互转化。
饱和溶液的溶质质量分数=×100%。
【解答】解:A、20℃时甲和乙的溶解度相等,甲、乙饱和溶液中溶质的质量分数相等,该选项正确。
B、将40℃时甲的饱和溶液降温至20℃,析出晶体,溶液质量减小,该选项不正确。
C、不知道温度范围,不能比较两种物质溶解度大小,该选项不正确。
D、乙的溶解度随着温度升高而增大,将20℃时乙的饱和溶液升温至40℃,乙溶液变成不饱和溶液,该选项不正确。
故选:A。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
9.某次硝酸钾溶解实验过程如图所示,不考虑水分蒸发,下列判断正确的是( )
A.③中溶液是饱和溶液
B.②③中溶液质量相等
C.②③中溶液的溶质质量分数相同
D.硝酸钾的溶解度随温度的升高而变大
【分析】A、根据溶液状态的判断方法来分析;
B、根据溶液的质量=溶质的质量+溶剂的质量来分析;
C、根据溶质的质量分数的判断方法来分析;
D、根据温度对硝酸钾溶解度的影响来分析。
【解答】解:A、烧杯②的溶液加热后,其中未溶解的晶体全部溶解,所得③中溶液可能是该温度下的饱和溶液,也可能是不饱和溶液,故A错误;
B、②③中水的质量相等,但是溶解的溶质质量不同,因此溶液质量不相等,故B错误;
C、②③中水的质量相等,但是溶解的溶质质量不同,因此所得溶液中溶质的质量分数不同,故C错误;
D、②中有未溶解的硝酸钾晶体存在,加热后硝酸钾慢慢溶解,说明硝酸钾的溶解度随温度的升高而变大,故D正确。
故选:D。
【点评】本考点考查了饱和溶液与不饱和溶液、质量分数等,要加强记忆,理解应用;本考点主要出现在选择题和填空题中。
10.下列措施中,能够增强蔗糖在水中溶解性的是( )
A.加热 B.搅拌 C.增加水量 D.将蔗糖研碎
【分析】考查影响物质溶解性的因素。
【解答】解:A、加热可以提高蔗糖的溶解性,选项A正确;
B、搅拌可以加快溶解速率,但不会改变溶解性,选项B错误;
C、增加水量可以加快蔗糖溶解,但是不提高溶解性,选项C错误;
D、蔗糖研碎增加溶解速率,不影响溶解性,选项D错误;
故选:A。
【点评】主要根据物质溶解性随温度变化的性质来回答此题。
11.如图为甲、乙两物质的溶解度曲线,下列有关说法中不正确的是( )
A.温度大于t1℃时,甲的溶解度大于乙的溶解度
B.t1℃时,甲的饱和溶液中溶质的质量分数为15%
C.要使接近饱和的乙溶液转化为饱和溶液,可以采用蒸发溶剂的方法
D.t2℃,将50克甲物质放入100克水中,可得到溶质的质量分数为23.1%
【分析】根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较。
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况。
根据物质的溶解度曲线、溶质质量、溶剂质量可以判断配制的溶液质量。
饱和溶液和不饱和溶液之间可以相互转化。
饱和溶液的溶质质量分数=×100%。
溶液中溶质质量分数=×100%。
【解答】解:A、温度大于t1℃时,甲的溶解度大于乙的溶解度,该选项正确。
B、t1℃时甲的溶解度是15g,甲的饱和溶液中溶质的质量分数为×100%≈13.04%,该选项不正确。
C、要使接近饱和的乙溶液转化为饱和溶液,可以采用蒸发溶剂的方法,该选项正确。
D、t2℃甲的溶解度是30g,将50克甲物质放入100克水中,能够完全溶解,可得到溶质的质量分数为×100%≈23.1%,该选项正确。
故选:B。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
12.图1为硝酸钾和氯化钾的溶解度曲线,图2为兴趣小组进行的实验,R物质是硝酸钾或氯化钾中的一种。下列说法不正确的是( )
A.R物质是硝酸钾
B.溶质的质量分数大小依次为②>③>①
C.t1℃时烧杯③中溶质的质量分数为31.6%
D.烧杯③中析出的固体质量一定为28.4克
【分析】根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定物质的溶解性;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断是晶体溶解的方法。
【解答】解:A、蒸发100g水,还能溶解60gR,说明该物质在t2℃的溶解度大于或等于60g,所以R是硝酸钾,故A说法正确;
B、①中是t1℃时硝酸钾的不饱和溶液,③中是t1℃时硝酸钾的饱和溶液,②中是t2℃硝酸钾的饱和溶液,所以溶质的质量分数大小依次为:②>③>①,故B说法正确;
C、t1℃时烧杯③中溶质的质量分数为:≈24%,故C说法错误;
D、烧杯③中析出的固体质量为:60g﹣31.6g=28.4g,故D说法正确。
故选:C。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
13.20℃时,通过增加溶质的方法将硝酸钾的不饱和溶液变为饱和溶液,下列说法错误的是( )
A.溶质的质量增加
B.溶剂的质量不变
C.溶液的质量增加
D.溶液的溶质质量分数不变
【分析】根据20℃时,通过增加溶质的方法将硝酸钾的不饱和溶液变为饱和溶液,溶质质量增加,溶剂质量不变,进行分析判断。
【解答】解:A、20℃时,通过增加溶质的方法将硝酸钾的不饱和溶液变为饱和溶液,溶质质量增加,故选项说法正确。
B、20℃时,通过增加溶质的方法将硝酸钾的不饱和溶液变为饱和溶液,溶质质量增加,溶剂质量不变,故选项说法正确。
C、20℃时,通过增加溶质的方法将硝酸钾的不饱和溶液变为饱和溶液,溶质质量增加,溶剂质量不变,则溶液的质量增加,故选项说法正确。
D、20℃时,通过增加溶质的方法将硝酸钾的不饱和溶液变为饱和溶液,溶质质量增加,溶剂质量不变,溶液的溶质质量分数变大,故选项说法错误。
故选:D。
【点评】本题难度不大,明确硝酸钾溶液组成的变化是正确解答本题的关键。
二.填空题(共4小题)
14.用气泡水机可以自制碳酸饮料。气泡水机中有液态二氧化碳钢瓶,加压将二氧化碳装入钢瓶的微观实质是 压强增大,分子间的间隔变小 。制作碳酸饮料时,为了在水中溶解更多二氧化碳,应选用 冷 (填“冷”或“热”)水,原因是 气体的溶解度随温度的升高而减小 。
【分析】根据分子的基本性质,进行分析解答。
利用气体的溶解度随温度的升高而减小,随着压强的增大而增大,结合事实进行分析解答.
【解答】解:气泡水机中有液态二氧化碳钢瓶,加压将二氧化碳装入钢瓶的微观实质是分子间有间隔,气体受压后,分子间的间隔变小.
利用气体的溶解度随温度的升高而减小,制作碳酸饮料时,为了在水中溶解更多二氧化碳,应选用冷水,原因是气体的溶解度随温度的升高而减小。
故答案为:
压强增大,分子间的间隔变小;冷;气体的溶解度随温度的升高而减小。
【点评】本题难度不大,掌握气体溶解度的两个影响因素(温度、压强)、分子的基本性质是正确解答本题的关键.
15.水是一种常见溶剂,如图为甲、乙两种固体(不含结晶水)溶于水的溶解度曲线。
(1)图中P点含义为 t1℃时,甲、乙的溶解度相等,均为40g ;
(2)将t1℃的甲的不饱和溶液变成饱和溶液的方法: 蒸发溶剂或加溶质 (写一种);
(3)t2℃时90g甲的饱和溶液恒温蒸发20g水,析出 16 g固体。
【分析】(1)根据交点的意义分析;
(2)根据甲的溶解度受温度的影响、不饱和溶液和变成饱和溶液的转化方法;
(3)根据t2℃时甲溶解度的意义分析。
【解答】解:(1)图中P点含义为:t1℃时,甲、乙两种固体溶解度相同;
(2)将t1℃的甲的不饱和溶液变成饱和溶液的方法:蒸发溶剂或加溶质;
(3)由溶解度曲线可知,t2℃时甲的溶解度是80g,由溶解度的含义可知,90克甲的饱和溶液恒温蒸发20克水,析出16克固体;
故答案是:(1)t1℃时,甲、乙的溶解度相等,均为 40g/100g 水;
(2)蒸发溶剂或加溶质;
(3)16。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
16.甲、乙两种物质的溶解度曲线如图所示,试回答以下问题:
(1)m点表示: 20℃时甲乙溶解度相等 。
(2)20℃时,在100g甲物质的饱和溶液中加入10g水,为使溶液重新达到饱和,需加甲物质 4 g。
(3)若将乙的不饱和溶液变成饱和溶液,可采取的方法有 加入乙物质 (填一种即可)。
(4)40℃时,将甲、乙两物质的饱和溶液各100克,分别降温到20℃,所得甲物质溶液的质量 < (选填“>”“<”或“=”)乙物质溶液的质量。
【分析】根据题目信息和溶解度曲线可知:甲固体物质的溶解度,是随温度升高而增大,而乙的溶解度随温度的升高而减少;(1)交点的含义;
(2)有关的计算要准确;
(3)饱和溶液与不饱和溶液的相互转化;
(4)40℃时,将甲、乙两物质的饱和溶液各100克,分别降温到20℃,所得甲物质溶液的质量<乙物质溶液的质量。
【解答】解:(1)m点表示:20℃时甲乙溶解度相等;故答案为:20℃时甲乙溶解度相等;
(2)20℃时,甲的溶解度是40g,在100g甲物质的饱和溶液中加入10g水,为使溶液重新达到饱和,设需加甲物质的质量为x,,x=4g;故答案为:4;
(3)若将乙的不饱和溶液变成饱和溶液,可采取的方法有:加入乙物质、蒸发溶剂、升高温度;故答案为:加入乙物质(合理即可);
(4)40℃时,将甲、乙两物质的饱和溶液各100克,分别降温到20℃,所得甲物质溶液的质量<乙物质溶液的质量,因为甲有固体析出,乙没有固体析出;故答案为:<。
【点评】本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的计算,有关的计算要准确,本考点主要出现在选择题和填空题中.
17.如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:
(1)P点的含义是 t1℃时,a、c物质溶解度相等,且为20g 。
(2)t2℃时,a、b、c三种物质的溶解度由大到小的顺序是 a>b>c (填序号)。
(3)欲将t2℃时c物质的饱和溶液变为不饱和溶液,可采用的方法是 加溶剂 、 降温 。
(4)t2℃时将50g a物质加入到80g水中充分溶解,所得溶液质量为 120 g。
(5)t2℃时,将a、b、c三种物质的饱和溶液各100g,分别降温到t1℃,所得三种溶液的质量大小关系是 Ⅳ (填序号)。
Ⅰ.b>a=c
Ⅱ.a=b>c
Ⅲ.b>a>c
Ⅳ.c>b>a
【分析】(1)依据溶解度曲线中交点含义分析;
(2)依据溶解度曲线中,t2℃时,a、b、c三种物质的溶解度分析;
(3)依据饱和溶液与不饱和溶液的转化方法分析;
(4)依据溶解度曲线中,t2℃时a物质的溶解度分析;
(5)依据a、b、c三种物质的溶解度曲线分析。
【解答】解:(1)P点是t1℃时,a、c物质溶解度曲线的交点,则P点的含义是t1℃时,a、c物质溶解度相等,且为20g,故填:t1℃时,a、c物质溶解度相等,且为20g;
(2)分析溶解度曲线可知,t2℃时,曲线a在曲线b的上方,曲线b在曲线c的上方,则a、b、c三种物质的溶解度由大到小的顺序是a>b>c,故填:a>b>c;
(3)分析溶解度曲线可知,c物质的溶解度随温度的升高而降低,则欲将t2℃时c物质饱和溶液变为不饱和溶液可采用的方法是:加溶剂或降低温度,故填:加溶剂;降温;
(4)分析溶解度曲线可知,t2℃时a物质的溶解度为50g,则t2℃时将50g a物质加入到80g水中充分溶解,所得溶液质量为40g+80g=120g,故填:120;
(5)分析溶解度曲线可知,t2℃时a、b、c三种物质的溶解度是a>b>c,t1℃时a、b、c三种物质的溶解度是b>a=c,a、b物质的解溶度随温度的降低而减小,t2℃时,将a、b两种物质的饱和溶液各100g,分别降温到t1℃,都会有晶体析出,a析出晶体的质量大于b析出晶体的质量,则所得两种溶液的质量a<b<100g,c物质的溶解度解溶度随温度的降低而增大,t2℃时,将c物质的饱和溶液100g,降温到t1℃,不会有晶体析出,则c物质溶液的质量仍为100g,所以t2℃时,将a、b、c三种物质的饱和溶液各100g,分别降温到t1℃,所得三种溶液的质量大小关系是c>b>a,故填:Ⅳ。
【点评】此题主要考查溶解度曲线的应用,主要是利用溶解度曲线的意义来分析和解决有关问题,结合各方面的条件得出正确结论。
三.解答题(共3小题)
18.溶液与人类生产、生活密切相关。
(1)把少量下列物质分别放入水中,充分搅拌,能得到溶液的是 AD (填序号)。
A.氯化钠
B.植物油
C.面粉
D.白糖
(2)下列有关溶液的说法中,正确的是 BD (填序号)。
A.凡是均一的、稳定的液体一定是溶液
B.溶液是均一的、稳定的混合物
C.溶液一定是无色的,且溶剂一定是水
D.海水是溶解有多种溶质的溶液
(3)如图为甲、乙两种固体物质的溶解度曲线。
①溶解度随温度升高而增大的物质是 甲 。
②t1℃时甲物质溶解度 = 乙物质的溶解度(填“>”“=”“<”)。
③t1℃时的乙物质的不饱和溶液,通过 恒温蒸发溶剂 或 加入乙 ,可使其转变为饱和溶液。
④t2℃时,甲物质饱和溶液中溶质与溶剂的质量比为 2:5 (填最简比)。
【分析】(1)氯化钠易溶于水,能够溶于水形成溶液;
植物油不溶于水,不能形成溶液;
面粉不溶于水,不能形成溶液;
白糖易溶于水,能够溶于水形成溶液。
(2)溶液是一种或几种物质分散到另外一种物质里,形成的均一、稳定的混合物。
(3)根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较;
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况;
饱和溶液和不饱和溶液之间可以相互转化;
根据溶解度可以计算饱和溶液中溶质和溶剂的质量比.
【解答】解:(1)A.氯化钠易溶于水,能够溶于水形成溶液;
B.植物油不溶于水,不能形成溶液;
C.面粉不溶于水,不能形成溶液;
D.白糖易溶于水,能够溶于水形成溶液。
故填:AD。
(2)A.均一的、稳定的液体不一定是溶液,例如水是均一的、稳定的液体,不是溶液,该选项说法不正确;
B.溶液是均一的、稳定的混合物,该选项说法正确;
C.溶液不一定是无色的,且溶剂不一定是水,例如硫酸铜溶液是蓝色溶液,碘酒溶液中溶剂是酒精,该选项说法不正确;
D.海水是溶解有多种溶质的溶液,该选项说法正确。
故填:BD。
(3)①溶解度随温度升高而增大的物质是甲。
故填:甲。
②t1℃时甲物质溶解度=乙物质的溶解度。
故填:=。
③t1℃时的乙物质的不饱和溶液,通过恒温蒸发溶剂或加入乙,可使其转变为饱和溶液。
故填:恒温蒸发溶剂;加入乙。
④t2℃时甲溶解度是40g,甲物质饱和溶液中溶质与溶剂的质量比为:40g1:00g=2:5。
故填:2:5。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同.
19.某同学进行了如图溶解实验。
(1)所得溶液一定属于饱和溶液的是 BDE ,饱和溶液转化为不饱和溶液的方法是 加水或升温 。
(2)甲物质在20℃时溶解度的范围是 31.6g≤S甲<45.8g (用“=”“>”“<”“≥”“≤”符号表示),B、C、D、E中溶质质量分数的大小关系是 E>B=D≥C (用“=”“>”“<”“≥”“≤”符号表示)。
(3)t℃时固体恰好完全溶解,则此温度时甲的溶解度为 45.8g/100g水 ,E中溶质的质量分数为 31.4% 。
【分析】(1)根据B、D溶液中含有未溶解的固体,E溶液中在t℃时恰好完全溶解,甲物质的溶解度随温度的升高而减小进行分析;
(2)根据20℃时,100g的水中加入31.6g的甲全部溶解,再次加入14.2g的甲,有晶体剩余,以及结合溶质、溶剂质量进行分析;
(3)根据溶解度的定义,乙饱和溶液的溶质质量分数进行分析。
【解答】解:(1)B、D溶液中含有未溶解的固体,E溶液中在t℃时恰好完全溶解,甲物质的溶解度随温度的升高而减小,所以所得溶液一定属于饱和溶液的是BDE,饱和溶液转化为不饱和溶液的方法是加水或升温;
(2)20℃时,100g的水中加入31.6g的甲全部溶解,再次加入14.2g的甲,有晶体剩余,所以甲物质在20℃时溶解度的范围是31.6g≤S甲<45.8g,B溶液的溶质质量分数小于×100%,C溶液的溶质质量分数为:×100%,D溶液的溶质质量分数小于×100%,E溶液的溶质质量分数为×100%,所以B、C、D、E中溶质质量分数的大小关系是E>B=D≥C;
(3)t℃时固体恰好完全溶解,则此温度时甲的溶解度为45.8g/100g水,E中溶质的质量分数为×100%≈31.4%。
故答案为:(1)BDE;加水或升温;
(2)31.6g≤S甲<45.8g;E>B=D≥C;
(3)45.8g/100g水;31.4%。
【点评】本题难度不是很大,主要考查了固体的溶解度表所表示的意义,及根据固体的溶解度表来解决相关的问题,从而培养分析问题、解决问题的能力。
20.甲、乙、丙三种固体(均不含结晶水)的部分溶解度见下表。
温度(℃) t1 t2 t3
溶解度(g/100g水) 甲 44.9 54.2 107.5
乙 13.0 9.6 5.3
丙 5.0 10.0 40.0
(1)t2℃时,乙的溶解度是 9.6 g/100g水。
(2)如图一所示,t1℃时,甲、乙、丙三种物质各25g放入烧杯中,分别倒入100g水,保持温度不变,充分溶解。
Ⅰ.甲溶液的溶质质量分数是 20% 。
Ⅱ.将三个烧杯中的混合物分别升温至t3℃。溶液质量减少的是 乙 溶液(选填“甲”“乙”或“丙”)。在图二中,绘制丙溶液溶质质量随温度变化的曲线 。
【分析】(1)根据提供数据可以判断某种物质的溶解度。
(2)饱和溶液溶质质量分数=×100%。
根据溶解度随着温度的变化而变化的情况可以判断相关方面的问题。
【解答】解:(1)t2℃时,乙的溶解度是9.6g/100g水。
故填:9.6.
(2)Ⅰ.t1℃时,甲的溶解度是44.9g,因此25g甲完全溶解,甲溶液的溶质质量分数是:×100%=20%。
故填:20%。
Ⅱ.将三个烧杯中的混合物分别升温至t3℃,溶液质量减少的是乙,是因为乙的溶解度随着温度升高而减小。
丙溶液溶质质量随温度变化的曲线如下所示:
。
故填:乙;。
【点评】溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同.
第1页(共1页)
