人教版九年级化学下册 9.3 溶液的浓度第三课时课件(共21张PPT)
文档属性
| 名称 | 人教版九年级化学下册 9.3 溶液的浓度第三课时课件(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 229.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-25 23:07:37 | ||
图片预览





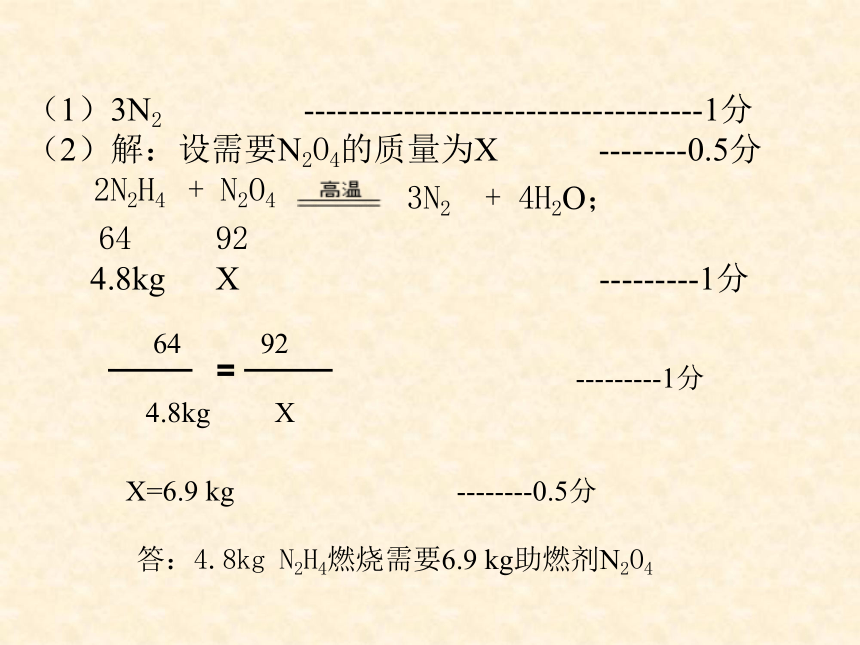

文档简介
(共21张PPT)
(2018河池)30.食用小苏打含有NaHCO3外还含有少量NaCl。为了测定某食用小苏打中NaHCO3的质量分数,某同学做了如下实验:称取一定量该样品于烧杯中,加水使其完全溶解,得到104.4g溶液,再向其中滴加100g稀盐酸,恰好完全反应时得到200g溶质质量分数为3.1%的不饱和溶液(反应的化学方程式为:
NaHCO3+HCl =NaCl+H2O+CO2↑)请计算:
(1)NaHCO3中碳、氧元素的质量比为 ;
(2)生成CO2的质量为 g;
(3)该食用小苏打中NaHCO3的质量分数(写出计算过程)。
(1)NaOH中氧元素和氢元素的质量比
为______________。
(2)求恰好完全反应时,所用NaOH
溶液的质量。(写出计算过程)
(3)求恰好完全反应时溶液中溶质的
质量分数。(写出计算过程,结果
精确到0.1%)
(2019河池)30.将氯化钠和氯化铜的固体混合物20g完全溶于100g水中,再向所得的溶液中加入溶质质量分数为10%的NaOH溶液。有关的变化如图9所示。(反应的化学方程式为:CuCl2+2NaOH=Cu(OH)2↓+2NaCl)请计算:
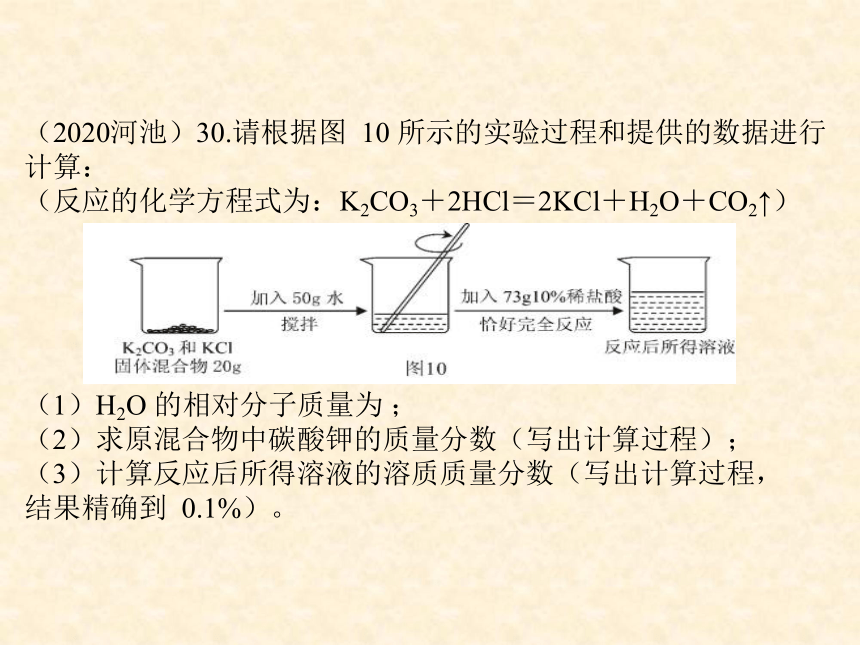
(2020河池)30.请根据图 10 所示的实验过程和提供的数据进行计算:
(反应的化学方程式为:K2CO3+2HCl=2KCl+H2O+CO2↑)
(1)H2O 的相对分子质量为 ;
(2)求原混合物中碳酸钾的质量分数(写出计算过程);
(3)计算反应后所得溶液的溶质质量分数(写出计算过程,结果精确到 0.1%)。
课题3 溶液的浓度
第三课时
学习目标
1.复习利用化学方程式的简单计算和对含有杂质的反应物或生成物进行相关计算;
2.根据化学方程式进行溶质质量分数的综合计算。
[题型一](2012河池)1.我国计划2012年6月发射“神舟九号” 载人航天飞船,所用的燃料有一种叫联氨(N2H4),助燃剂是四氧化二氮(N2O4),它们反应生成的物质不会对大气造成污染。(1)完成化学方程式:
2N2H4 + N2O4
+ 4 H2O。
(2)计算4.8kg N2H4完全燃烧需要多少kg助燃剂N2O4?
(相对原子质量: N-14 H-1 O-16 )
一、利用化学方程式的简单计算
(1)3N2 ------------------------------------1分
(2)解:设需要N2O4的质量为X --------0.5分
2N2H4 + N2O4
3N2 + 4H2O;
64 92
4.8kg X ---------1分
=
答:4.8kg N2H4燃烧需要6.9 kg助燃剂N2O4
X=6.9 kg --------0.5分
64 92
---------1分
4.8kg X
二、有关杂质问题的计算
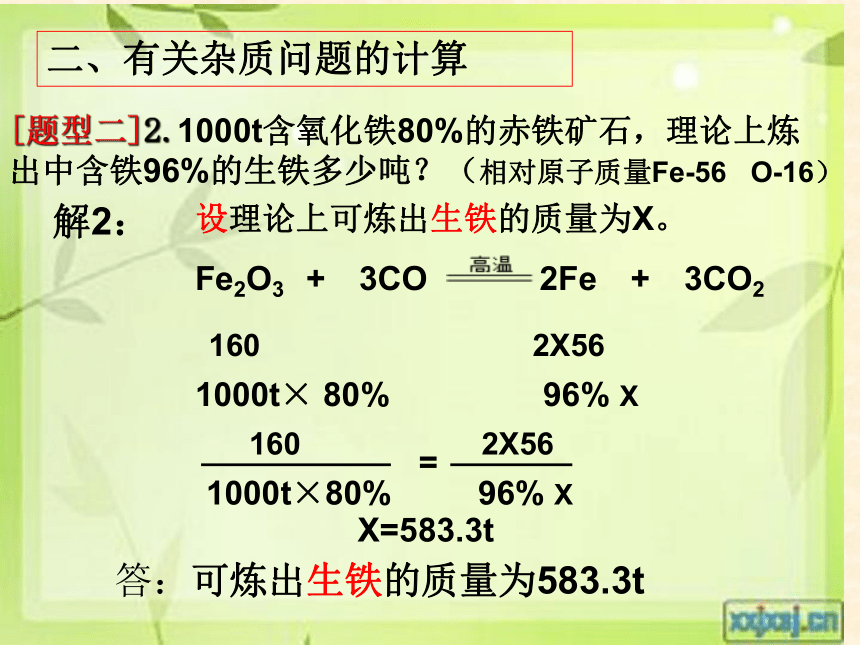
[题型二]2.1000t含氧化铁80%的赤铁矿石,理论上炼出中含铁96%的生铁多少吨?(相对原子质量Fe-56 O-16)
解2:
设理论上可炼出生铁的质量为X。
Fe2O3 + 3CO 2Fe + 3CO2
160 2X56
1000t× 80% 96% X
X=583.3t
160 2X56
1000t×80% 96% X
=
答:可炼出生铁的质量为583.3t
注意:溶液是混合物,溶液的质量不能直 接代入化学方程式中计算,必须换算成溶质的质量。
三:溶质质量分数在化学方程式中的应用
例:100g某硫酸与13g锌恰好完全反应。计算:
(相对原子质量:Zn-65 H-1 S-32 O-16)
(1)生成氢气多少克?
(2)这种硫酸中溶质的质量分数是多少?
(3)反应后形成溶液的溶质质量分数是多少?
[题型三]
解 :设硫酸溶液的质量分数为x,反应生成氢气的质量为y,硫酸锌的质量为z.
13g 100g·x z y
Zn + H2SO4==ZnSO4 + H2
65 98 161 2
65 98 161 2
13g 100g·x z y
=
=
=
x=19.6% z=32.2g y=0.4g
反应后形成溶液的质量:32.2g+(100g-19.6g)=112.6g
(或:100g+13g-0.4g=112.6g )
则溶质的质量分数:
32.2g
112.6g
×100%=28.6%
答:略
巩固练习:40g10%NaOH溶液跟多少克10%盐酸恰好完全反应?反应后溶液的溶质的质量分数是多少?
解:设稀盐酸的质量为X,反应后生成的NaCl的质量为Y
NaOH + HCl = NaCl + H2O
40g×10% X ×10% Y
40 36.5 58.5
X = 36.5g
Y=5.85g
所得溶质质量分数 =
答:略
(NaOH + HCl = NaCl + H2O)
相对原子质量:Na-23 O-16 H-1 Cl-35.5
通过本节课的学习你有哪些收获?
分享收获
课堂小结
结合化学方程式进行一些有关溶质质量分数的计算
1.初步了解计算题的步骤和方法;
2.知道如何应用溶质质量分数在化学方程式中的计算。
中考链接
(2020河池)请根据图 10 所示的实验过程和提供的数据进行计算:
(反应的化学方程式为:K2CO3+2HCl=2KCl+H2O+CO2↑)
(1)H2O 的相对分子质量为 ;
(2)求原混合物中碳酸钾的质量分数(写出计算过程);
(3)计算反应后所得溶液的溶质质量分数(写出计算过程,结果精确到 0.1%)。
(相对原子质量:K-39 C-12 O-16 H-1 Cl-35.5)
解:(1)18
(2)设原混合物中碳酸钾的质量为 x,同时生成氯化钾的质量为 y,二氧化碳的质量为 z。
K2CO3 + 2HCl = 2KCl + H2O + CO2↑
138 73 149 44
x 73g×10% y z
138 73 149 44
x 73g×10% y z
x=13.8 g y=14.9g z=4.4g
13.8g
原混合物中碳酸钾的质量分数是: ×100%=69%
20g
(3)反应后所得溶液的溶质质量分数为 :
(20g-13.8g)+14.9g
× 100%= 15.2%
20g+50g+73g-4.4g
答:(略)
=
=
=
相信你能完成
课后拓展
同步学习P128~129
中考链接
(2016河池)根据图9所示的实验过程和所提供的数据计算(假设恰好完全反应)。
(反应的化学方程式为:K2CO3+CaCl2 = CaCO3↓+2KCl)
(1)CaCl2中钙元素和氯元素的质量比为 。
(2)样品中碳酸钾的质量分数(写出计算过程)。
(3)反应后所得溶液中氯化钾的质量(写出计算过程)。
3.(2019·河池)将氯化钠和氯化铜的固体混合物20 g完全溶于100 g水中,再向所得的溶液中加入溶质质量分数为10%的NaOH溶液。有关的变化如图所示[反应的化学方程式为CuCl2+2NaOH===Cu(OH)2↓+2NaCl]。请计算:
(1)NaOH中氧元素和氢元素的质量比为 。
(2)求恰好完全反应时,所用NaOH溶液的质量。(写出计算过程)
(3)求恰好完全反应时溶液中溶质的质量分数。(写出计算过程,结果精确到0.1%)
解:(1)16:1
设恰好完全反应时,参加反应NaOH的质量为x,生成NaCl的质量为y,参加反应CuCl2的质量为z。
CuCl2+2NaOH===Cu(OH)2 ↓+2NaCl
135 80 98 117
z x 4.9 g y
135 80 98 117
z x 4.9 g y
x=4 g y=5.85 g z=6.75 g
恰好完全反应时,所用NaOH溶液的质量为: =40 g
恰好完全反应时,溶液中溶质质量分数为
×100%=12.3%
答:(2)恰好完全反应时,所用NaOH溶液的质量为40 g;
(3)恰好 完全反应时溶液中溶质的质量分数为12.3%。
=
=
=
4g
10%
5.85 g+(20 g-6.75 g)
20 g+100 g+40 g-4.9 g
(2017河池)向100g BaCl2溶液中滴加Na2SO4溶液至完全反应。反应过程中生成沉淀的质量与滴加Na2SO4溶液的质量关系如下表所示:
滴加Na2SO4溶液的质量/g 10 20 30 40
生成沉淀的质量/g 2.33 4.66 6.99 6.99
(反应的化学方程式:BaCl2+Na2SO4== BaSO4↓+2NaCl) 请计算:
(可能用到的相对原子质量Ba-137 Cl-35.5 Na-23 S-32 O-16)
(1)Na2SO4的相对分子质量为 ;
(2)恰好完全反应时生成BaSO4的质量为 g;
(3)BaCl2溶液中溶质的质量分数(写出计算过程)。
中考链接
解:(1)142(2)6.99
(3)设BaCl2溶液中BaCl2的质量为x。
BaCl2+Na2SO4===BaSO4↓+2NaCl
208 233
x 6.99 g
208 233
=
x 6.99 g
x=6.24g
6.24g
BaCl2溶液中溶质的质量分数为 ×100%=6.24%
100g
答:BaCl2溶液中溶质的质量分数为6.24%。
(2018河池)30.食用小苏打含有NaHCO3外还含有少量NaCl。为了测定某食用小苏打中NaHCO3的质量分数,某同学做了如下实验:称取一定量该样品于烧杯中,加水使其完全溶解,得到104.4g溶液,再向其中滴加100g稀盐酸,恰好完全反应时得到200g溶质质量分数为3.1%的不饱和溶液(反应的化学方程式为:
NaHCO3+HCl =NaCl+H2O+CO2↑)请计算:
(1)NaHCO3中碳、氧元素的质量比为 ;
(2)生成CO2的质量为 g;
(3)该食用小苏打中NaHCO3的质量分数(写出计算过程)。
(1)NaOH中氧元素和氢元素的质量比
为______________。
(2)求恰好完全反应时,所用NaOH
溶液的质量。(写出计算过程)
(3)求恰好完全反应时溶液中溶质的
质量分数。(写出计算过程,结果
精确到0.1%)
(2019河池)30.将氯化钠和氯化铜的固体混合物20g完全溶于100g水中,再向所得的溶液中加入溶质质量分数为10%的NaOH溶液。有关的变化如图9所示。(反应的化学方程式为:CuCl2+2NaOH=Cu(OH)2↓+2NaCl)请计算:
(2020河池)30.请根据图 10 所示的实验过程和提供的数据进行计算:
(反应的化学方程式为:K2CO3+2HCl=2KCl+H2O+CO2↑)
(1)H2O 的相对分子质量为 ;
(2)求原混合物中碳酸钾的质量分数(写出计算过程);
(3)计算反应后所得溶液的溶质质量分数(写出计算过程,结果精确到 0.1%)。
课题3 溶液的浓度
第三课时
学习目标
1.复习利用化学方程式的简单计算和对含有杂质的反应物或生成物进行相关计算;
2.根据化学方程式进行溶质质量分数的综合计算。
[题型一](2012河池)1.我国计划2012年6月发射“神舟九号” 载人航天飞船,所用的燃料有一种叫联氨(N2H4),助燃剂是四氧化二氮(N2O4),它们反应生成的物质不会对大气造成污染。(1)完成化学方程式:
2N2H4 + N2O4
+ 4 H2O。
(2)计算4.8kg N2H4完全燃烧需要多少kg助燃剂N2O4?
(相对原子质量: N-14 H-1 O-16 )
一、利用化学方程式的简单计算
(1)3N2 ------------------------------------1分
(2)解:设需要N2O4的质量为X --------0.5分
2N2H4 + N2O4
3N2 + 4H2O;
64 92
4.8kg X ---------1分
=
答:4.8kg N2H4燃烧需要6.9 kg助燃剂N2O4
X=6.9 kg --------0.5分
64 92
---------1分
4.8kg X
二、有关杂质问题的计算
[题型二]2.1000t含氧化铁80%的赤铁矿石,理论上炼出中含铁96%的生铁多少吨?(相对原子质量Fe-56 O-16)
解2:
设理论上可炼出生铁的质量为X。
Fe2O3 + 3CO 2Fe + 3CO2
160 2X56
1000t× 80% 96% X
X=583.3t
160 2X56
1000t×80% 96% X
=
答:可炼出生铁的质量为583.3t
注意:溶液是混合物,溶液的质量不能直 接代入化学方程式中计算,必须换算成溶质的质量。
三:溶质质量分数在化学方程式中的应用
例:100g某硫酸与13g锌恰好完全反应。计算:
(相对原子质量:Zn-65 H-1 S-32 O-16)
(1)生成氢气多少克?
(2)这种硫酸中溶质的质量分数是多少?
(3)反应后形成溶液的溶质质量分数是多少?
[题型三]
解 :设硫酸溶液的质量分数为x,反应生成氢气的质量为y,硫酸锌的质量为z.
13g 100g·x z y
Zn + H2SO4==ZnSO4 + H2
65 98 161 2
65 98 161 2
13g 100g·x z y
=
=
=
x=19.6% z=32.2g y=0.4g
反应后形成溶液的质量:32.2g+(100g-19.6g)=112.6g
(或:100g+13g-0.4g=112.6g )
则溶质的质量分数:
32.2g
112.6g
×100%=28.6%
答:略
巩固练习:40g10%NaOH溶液跟多少克10%盐酸恰好完全反应?反应后溶液的溶质的质量分数是多少?
解:设稀盐酸的质量为X,反应后生成的NaCl的质量为Y
NaOH + HCl = NaCl + H2O
40g×10% X ×10% Y
40 36.5 58.5
X = 36.5g
Y=5.85g
所得溶质质量分数 =
答:略
(NaOH + HCl = NaCl + H2O)
相对原子质量:Na-23 O-16 H-1 Cl-35.5
通过本节课的学习你有哪些收获?
分享收获
课堂小结
结合化学方程式进行一些有关溶质质量分数的计算
1.初步了解计算题的步骤和方法;
2.知道如何应用溶质质量分数在化学方程式中的计算。
中考链接
(2020河池)请根据图 10 所示的实验过程和提供的数据进行计算:
(反应的化学方程式为:K2CO3+2HCl=2KCl+H2O+CO2↑)
(1)H2O 的相对分子质量为 ;
(2)求原混合物中碳酸钾的质量分数(写出计算过程);
(3)计算反应后所得溶液的溶质质量分数(写出计算过程,结果精确到 0.1%)。
(相对原子质量:K-39 C-12 O-16 H-1 Cl-35.5)
解:(1)18
(2)设原混合物中碳酸钾的质量为 x,同时生成氯化钾的质量为 y,二氧化碳的质量为 z。
K2CO3 + 2HCl = 2KCl + H2O + CO2↑
138 73 149 44
x 73g×10% y z
138 73 149 44
x 73g×10% y z
x=13.8 g y=14.9g z=4.4g
13.8g
原混合物中碳酸钾的质量分数是: ×100%=69%
20g
(3)反应后所得溶液的溶质质量分数为 :
(20g-13.8g)+14.9g
× 100%= 15.2%
20g+50g+73g-4.4g
答:(略)
=
=
=
相信你能完成
课后拓展
同步学习P128~129
中考链接
(2016河池)根据图9所示的实验过程和所提供的数据计算(假设恰好完全反应)。
(反应的化学方程式为:K2CO3+CaCl2 = CaCO3↓+2KCl)
(1)CaCl2中钙元素和氯元素的质量比为 。
(2)样品中碳酸钾的质量分数(写出计算过程)。
(3)反应后所得溶液中氯化钾的质量(写出计算过程)。
3.(2019·河池)将氯化钠和氯化铜的固体混合物20 g完全溶于100 g水中,再向所得的溶液中加入溶质质量分数为10%的NaOH溶液。有关的变化如图所示[反应的化学方程式为CuCl2+2NaOH===Cu(OH)2↓+2NaCl]。请计算:
(1)NaOH中氧元素和氢元素的质量比为 。
(2)求恰好完全反应时,所用NaOH溶液的质量。(写出计算过程)
(3)求恰好完全反应时溶液中溶质的质量分数。(写出计算过程,结果精确到0.1%)
解:(1)16:1
设恰好完全反应时,参加反应NaOH的质量为x,生成NaCl的质量为y,参加反应CuCl2的质量为z。
CuCl2+2NaOH===Cu(OH)2 ↓+2NaCl
135 80 98 117
z x 4.9 g y
135 80 98 117
z x 4.9 g y
x=4 g y=5.85 g z=6.75 g
恰好完全反应时,所用NaOH溶液的质量为: =40 g
恰好完全反应时,溶液中溶质质量分数为
×100%=12.3%
答:(2)恰好完全反应时,所用NaOH溶液的质量为40 g;
(3)恰好 完全反应时溶液中溶质的质量分数为12.3%。
=
=
=
4g
10%
5.85 g+(20 g-6.75 g)
20 g+100 g+40 g-4.9 g
(2017河池)向100g BaCl2溶液中滴加Na2SO4溶液至完全反应。反应过程中生成沉淀的质量与滴加Na2SO4溶液的质量关系如下表所示:
滴加Na2SO4溶液的质量/g 10 20 30 40
生成沉淀的质量/g 2.33 4.66 6.99 6.99
(反应的化学方程式:BaCl2+Na2SO4== BaSO4↓+2NaCl) 请计算:
(可能用到的相对原子质量Ba-137 Cl-35.5 Na-23 S-32 O-16)
(1)Na2SO4的相对分子质量为 ;
(2)恰好完全反应时生成BaSO4的质量为 g;
(3)BaCl2溶液中溶质的质量分数(写出计算过程)。
中考链接
解:(1)142(2)6.99
(3)设BaCl2溶液中BaCl2的质量为x。
BaCl2+Na2SO4===BaSO4↓+2NaCl
208 233
x 6.99 g
208 233
=
x 6.99 g
x=6.24g
6.24g
BaCl2溶液中溶质的质量分数为 ×100%=6.24%
100g
答:BaCl2溶液中溶质的质量分数为6.24%。
同课章节目录
