人教版九年级化学下册 8.2 金属的化学性质(37张PPT)
文档属性
| 名称 | 人教版九年级化学下册 8.2 金属的化学性质(37张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 13.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-26 00:00:00 | ||
图片预览











文档简介
(共37张PPT)
课题二 金属的化学性质
金属世界
黄铜
黄金
根据所学知识想一想可以用什么方法来鉴别真假黄金。
想一想: 1 测密度 2相互刻划,比较硬度
为什么“真金不怕火炼”?
加热铜粉
镁条在空气中燃烧
铝粉在空气中燃烧
铁丝在氧气气中燃烧
一.金属难过“氧气”关
-----金属与氧气的反应
1. 探究目的:
镁、铝、铁、铜、金分别与氧气反应的情况
2. 探究方法:
实物对比;回忆已学知识;联系生活实际等
我会探究
我会探究
在常温能与氧气反应
常温几乎不与氧气反应,高温能与氧气反应
Mg
Al
Fe
Cu
Au
高温也不与氧气反应
金属与氧气的反应
结论1
比较活泼, 次之, _______最不活泼.
Mg、 Al
Fe、Cu
Au
得出判断金属活动性(活泼程度)的方法一:
金属越容易与氧气反应,其活动性越 ;
同等条件下,反应越剧烈,其活动性越 .
强
强
连连看:
二 . 金属“泡泡堂”
1 . 探究目的:
2 . 探究方法:
我会探究
1、金属与稀盐酸、稀硫酸的反应
2、金属与某些金属化合物溶液反应
“真金不怕火炼”?假金更不怕!
实验用具:试管、镊子、铁钉、镁条、铝丝、锌粒、铜丝、铜片、稀盐酸、稀硫酸、硫酸铜溶液、硝酸银溶液、硫酸铝溶液、硫酸锌、砂纸
自主探究:(友情提醒)
现象不是很明显时,可将实验时间延长些。
每次只用一种固体跟一种液体药品反应。
金属表面一般都有氧化物的保护膜,实验前应用砂纸打磨。(镁条已磨好)
小组分好工,注意记录、观察、分析。
将你的预设方案在实验过程中分析、修改,最终找到你认为最佳的实验方案。
金属活动性探究报告
探究的问题 实验方案 小组分工 实验步骤 现象记录 猜想解释和化学方程式
体会及发现
质疑
结论
盐酸
God Save me!!
我有点难受…
为什么受伤的总是我!
我得意的笑,又得意的笑…
金属与盐酸的反应
金属 稀盐酸(稀硫酸) 现象 反应的化学方程式
镁
锌
铝
铁
铜
金属活动性由强到弱
Mg、Zn、Fe Cu
﹖
H
H
放出气泡最迅速,反应最剧烈。
放出气泡速度次之,反应
较为剧烈。
放出气泡速度最慢,反应较为缓和。
不反应
放出气泡速度较慢,反应较为快。
Mg + 2HCl = MgCl2 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
Fe + 2HCl = FeCl2 + H2↑
Fe + H2SO4 = FeSO4 + H2↑
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al +3H2SO4 = Al2(SO4 )3+3H2↑
单质
化合物
化合物
单质
小结:
这种由一种单质与一种化合物反应,生成了另一种单质和另一种化合物的反应叫做置换反应。
Fe + H2SO4 = FeSO4 + H2↑
Fe + 2HCl = FeCl2 + H2 ↑
Zn + H2SO4 = ZnSO4 + H2 ↑
Mg + 2HCl = MgCl2 + H2 ↑
讨论:对于以上的反应,从反应物和生成物物质分类的角度分析,这些反应有何共同特点?
铝与硫酸铜溶液的反应
铜与硝酸银溶液的反应
铜与硝酸银溶液的反应
实验 现象 反应的化学方程式
铝丝浸入硫酸铜溶液中
铜丝浸入硝酸银溶液中
铜丝浸入硫酸铝溶液中
浸入溶液中的铝丝
表面覆盖一层紫红
色物质,溶液由蓝
色逐渐变为无色。
浸入溶液中的铜丝
表面覆盖一层银白
色物质,溶液由无
色逐渐变为蓝色。
不反应
2Al + 3CuSO4= Al2(SO4)3 + 3Cu
Cu +2Ag NO3 =Cu(NO3)2 + 2Ag
根据刚才的实验填写表格
活动性:Al﹥Cu
活动性:Cu﹥Ag
活动性:Cu 镁、铝、铁、锌、铜、银等金属活动性由强到弱的顺序是 .
得到判断金属活动性的方法三:
我会总结
结论3
如果金属A能把金属B从它化合物的溶液中置换出来,则证明金属A比金属B的活动性 。
强
1、在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。
2、在金属活动性顺序里,位于氢前面的金属能置换出稀盐酸.稀硫酸中的氢。
3、在金属活动顺序里,位于前面的金属 能把位于后面的金属从它们化合物的溶液中置换出来。
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
金属活动性顺序
金属活动性由强逐渐减弱
金属活动性顺序
K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au
金属的化学性质
1.大多数金属能与氧气反应
2.大多数金属能与稀HCl或稀H2SO4反应
3.部分金属能与金属化合物的溶液反应
反应越容易,越剧烈,金属越活泼
金属活动性
反应越容易,越剧烈,金属越活泼
金属与能否与金属
化合物的溶液反应
我会总结
判断下列物质能否发生反应?若能,
写出相关化学方程式。
(1)银与稀盐酸 (2)锌与硫酸铜溶液
(3)铜与硫酸锌溶液 (4)铝与硝酸银溶液
(5)银与氯化铜溶液 (6)镁与硫酸亚铁溶液
解答:可发生反应的:(2)(4)(6)
化学方程式:
(2)Zn + CuSO4 = Cu + ZnSO4
(4)Al +3AgNO3 = Al(NO3)3 + 3Ag
(6)Mg + FeSO4 = MgSO4 +Fe
因为铝在空气中与氧气反应,其表面生成一层致密的氧化物薄膜,从而阻止铝进一步氧化,因此,铝具有很好的抗腐蚀性能。
2.为什么出土文物中铜器比铁器多呢?
⑵为什么不宜用钢刷、沙等来擦洗铝制品呢?
铜的活动性比铁弱,不易被氧化。
这样会把铝制品表面的氧化物保护膜除掉。
3.⑴为什么铁器易生锈,而铝制品不易锈蚀呢?
年代
查找资料
商朝司母戊鼎
春秋时期的铁锄和铁削
现代用电解法冶炼铝
分析资料可知:
金属冶炼的早晚与金属活动性的强弱有关。
解析:在金属活动性顺序表中,金排在氢的后面,不与盐酸反应:铜锌合金中的锌能置换出盐酸中的氢,会有气泡产生。铜和锌都比银活泼,能置换出硝酸银溶液中的银,金属表面的颜色发生变化;锌也能置换也硫酸铜溶液中的铜,溶液的颜色会发生变化。故不能与铜锌合金发生反应的为硝酸钠,因此一定不会用D。
五角硬币的外观呈金黄色,它是铜和锌的合金,市面上有人用它制成假金戒指行骗,小明同学用一种试剂揭穿了他.小明一定不会用的试剂是( )
A. 硫酸铜溶液 B. 硝酸银溶液
C. 盐酸 D. 硝酸钠溶液
理由是
★金属在自然界的分布和存在
★绝大多数以化合态存在于自然界。
通过这节课的探究学习,你得到哪些启示和收获?
我会思考
金属世界,奥妙无穷,期待你的探索.
本节课我们学习了哪些内容?
1、大多数金属可与氧气反应
2、金属 + 酸 → 化合物+ H2↑
3、金属 + 化合物 → 另一金属 + 另一化合物
(条件:“前换后,化合物可溶”)
Fe+CuSO4 === Cu + FeSO4
4、常见金属活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
再见
课题二 金属的化学性质
金属世界
黄铜
黄金
根据所学知识想一想可以用什么方法来鉴别真假黄金。
想一想: 1 测密度 2相互刻划,比较硬度
为什么“真金不怕火炼”?
加热铜粉
镁条在空气中燃烧
铝粉在空气中燃烧
铁丝在氧气气中燃烧
一.金属难过“氧气”关
-----金属与氧气的反应
1. 探究目的:
镁、铝、铁、铜、金分别与氧气反应的情况
2. 探究方法:
实物对比;回忆已学知识;联系生活实际等
我会探究
我会探究
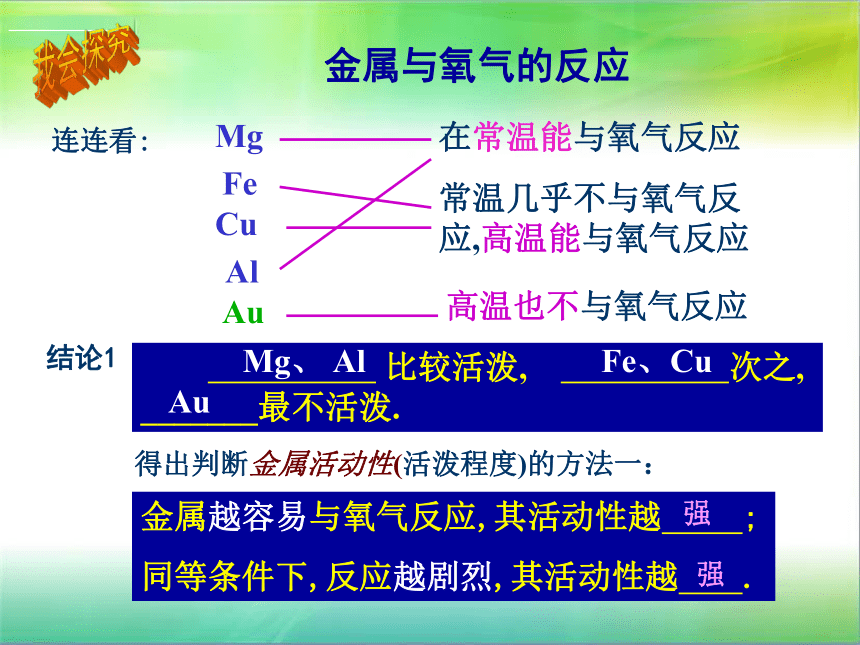
在常温能与氧气反应
常温几乎不与氧气反应,高温能与氧气反应
Mg
Al
Fe
Cu
Au
高温也不与氧气反应
金属与氧气的反应
结论1
比较活泼, 次之, _______最不活泼.
Mg、 Al
Fe、Cu
Au
得出判断金属活动性(活泼程度)的方法一:
金属越容易与氧气反应,其活动性越 ;
同等条件下,反应越剧烈,其活动性越 .
强
强
连连看:
二 . 金属“泡泡堂”
1 . 探究目的:
2 . 探究方法:
我会探究
1、金属与稀盐酸、稀硫酸的反应
2、金属与某些金属化合物溶液反应
“真金不怕火炼”?假金更不怕!
实验用具:试管、镊子、铁钉、镁条、铝丝、锌粒、铜丝、铜片、稀盐酸、稀硫酸、硫酸铜溶液、硝酸银溶液、硫酸铝溶液、硫酸锌、砂纸
自主探究:(友情提醒)
现象不是很明显时,可将实验时间延长些。
每次只用一种固体跟一种液体药品反应。
金属表面一般都有氧化物的保护膜,实验前应用砂纸打磨。(镁条已磨好)
小组分好工,注意记录、观察、分析。
将你的预设方案在实验过程中分析、修改,最终找到你认为最佳的实验方案。
金属活动性探究报告
探究的问题 实验方案 小组分工 实验步骤 现象记录 猜想解释和化学方程式
体会及发现
质疑
结论
盐酸
God Save me!!
我有点难受…
为什么受伤的总是我!
我得意的笑,又得意的笑…
金属与盐酸的反应
金属 稀盐酸(稀硫酸) 现象 反应的化学方程式
镁
锌
铝
铁
铜
金属活动性由强到弱
Mg、Zn、Fe Cu
﹖
H
H
放出气泡最迅速,反应最剧烈。
放出气泡速度次之,反应
较为剧烈。
放出气泡速度最慢,反应较为缓和。
不反应
放出气泡速度较慢,反应较为快。
Mg + 2HCl = MgCl2 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
Fe + 2HCl = FeCl2 + H2↑
Fe + H2SO4 = FeSO4 + H2↑
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al +3H2SO4 = Al2(SO4 )3+3H2↑
单质
化合物
化合物
单质
小结:
这种由一种单质与一种化合物反应,生成了另一种单质和另一种化合物的反应叫做置换反应。
Fe + H2SO4 = FeSO4 + H2↑
Fe + 2HCl = FeCl2 + H2 ↑
Zn + H2SO4 = ZnSO4 + H2 ↑
Mg + 2HCl = MgCl2 + H2 ↑
讨论:对于以上的反应,从反应物和生成物物质分类的角度分析,这些反应有何共同特点?
铝与硫酸铜溶液的反应
铜与硝酸银溶液的反应
铜与硝酸银溶液的反应
实验 现象 反应的化学方程式
铝丝浸入硫酸铜溶液中
铜丝浸入硝酸银溶液中
铜丝浸入硫酸铝溶液中
浸入溶液中的铝丝
表面覆盖一层紫红
色物质,溶液由蓝
色逐渐变为无色。
浸入溶液中的铜丝
表面覆盖一层银白
色物质,溶液由无
色逐渐变为蓝色。
不反应
2Al + 3CuSO4= Al2(SO4)3 + 3Cu
Cu +2Ag NO3 =Cu(NO3)2 + 2Ag
根据刚才的实验填写表格
活动性:Al﹥Cu
活动性:Cu﹥Ag
活动性:Cu
得到判断金属活动性的方法三:
我会总结
结论3
如果金属A能把金属B从它化合物的溶液中置换出来,则证明金属A比金属B的活动性 。
强
1、在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。
2、在金属活动性顺序里,位于氢前面的金属能置换出稀盐酸.稀硫酸中的氢。
3、在金属活动顺序里,位于前面的金属 能把位于后面的金属从它们化合物的溶液中置换出来。
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
金属活动性顺序
金属活动性由强逐渐减弱
金属活动性顺序
K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au
金属的化学性质
1.大多数金属能与氧气反应
2.大多数金属能与稀HCl或稀H2SO4反应
3.部分金属能与金属化合物的溶液反应
反应越容易,越剧烈,金属越活泼
金属活动性
反应越容易,越剧烈,金属越活泼
金属与能否与金属
化合物的溶液反应
我会总结
判断下列物质能否发生反应?若能,
写出相关化学方程式。
(1)银与稀盐酸 (2)锌与硫酸铜溶液
(3)铜与硫酸锌溶液 (4)铝与硝酸银溶液
(5)银与氯化铜溶液 (6)镁与硫酸亚铁溶液
解答:可发生反应的:(2)(4)(6)
化学方程式:
(2)Zn + CuSO4 = Cu + ZnSO4
(4)Al +3AgNO3 = Al(NO3)3 + 3Ag
(6)Mg + FeSO4 = MgSO4 +Fe
因为铝在空气中与氧气反应,其表面生成一层致密的氧化物薄膜,从而阻止铝进一步氧化,因此,铝具有很好的抗腐蚀性能。
2.为什么出土文物中铜器比铁器多呢?
⑵为什么不宜用钢刷、沙等来擦洗铝制品呢?
铜的活动性比铁弱,不易被氧化。
这样会把铝制品表面的氧化物保护膜除掉。
3.⑴为什么铁器易生锈,而铝制品不易锈蚀呢?
年代
查找资料
商朝司母戊鼎
春秋时期的铁锄和铁削
现代用电解法冶炼铝
分析资料可知:
金属冶炼的早晚与金属活动性的强弱有关。
解析:在金属活动性顺序表中,金排在氢的后面,不与盐酸反应:铜锌合金中的锌能置换出盐酸中的氢,会有气泡产生。铜和锌都比银活泼,能置换出硝酸银溶液中的银,金属表面的颜色发生变化;锌也能置换也硫酸铜溶液中的铜,溶液的颜色会发生变化。故不能与铜锌合金发生反应的为硝酸钠,因此一定不会用D。
五角硬币的外观呈金黄色,它是铜和锌的合金,市面上有人用它制成假金戒指行骗,小明同学用一种试剂揭穿了他.小明一定不会用的试剂是( )
A. 硫酸铜溶液 B. 硝酸银溶液
C. 盐酸 D. 硝酸钠溶液
理由是
★金属在自然界的分布和存在
★绝大多数以化合态存在于自然界。
通过这节课的探究学习,你得到哪些启示和收获?
我会思考
金属世界,奥妙无穷,期待你的探索.
本节课我们学习了哪些内容?
1、大多数金属可与氧气反应
2、金属 + 酸 → 化合物+ H2↑
3、金属 + 化合物 → 另一金属 + 另一化合物
(条件:“前换后,化合物可溶”)
Fe+CuSO4 === Cu + FeSO4
4、常见金属活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
再见
同课章节目录
