第11章酸与碱分层作业巩固练习-2021-2022学年九年级化学京改版(2013)下册(word版含解析)
文档属性
| 名称 | 第11章酸与碱分层作业巩固练习-2021-2022学年九年级化学京改版(2013)下册(word版含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 248.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-26 00:00:00 | ||
图片预览


文档简介
第十一章酸与碱分层作业巩固练习2021_2022学年九年级化学(京改版2013)
一.选择题(共13小题)
1.向足量稀硫酸中加入适量的镁粉,如图所示的函数图象横轴表示此化学反应的时间,纵轴表示反应的有关变化情况,正确的是( )
A. B.
C. D.
2.下列物质中,pH小于7的是( )
A.NaOH溶液 B.NaCl溶液 C.稀盐酸 D.石灰水
3.将下列物质滴入酚酞溶液中,能使酚酞溶液变红的是( )
食物 柠檬汁 菠萝汁 生理盐水 炉具清洁剂
pH 2.1~2.8 3.3~5.2 7.0 12~13
A.柠檬汁 B.菠萝汁 C.生理盐水 D.炉具清洁剂
4.小华在验证“CO2能与氢氧化钠溶液反应”时,进行了如下实验:
已知:①20℃、101KPa时,1体积H2O中最多可溶解1体积CO2;1体积酒精中最多可溶解0.3体积CO2;
②20℃,在酒精中,NaOH易溶,Na2CO3难溶;
③气压减小时,水的沸点会降低。
下列说法正确的是( )
①用两套图甲装置进行实验,在第一套装置中注入3mL浓氢氧化钠溶液;在第二套装中注入等体积的H2O,振荡试管。当观察到第一套装置中锥形瓶内水沸腾时,可证明CO2与NaOH发生了反应;
②装置乙中,将胶头滴管内的氢氧化钠溶液挤入试管后,观察的现象是:注射器活塞向右移动,试管内出现白色沉淀;
③装置乙中,若注射器中最终剩余3mL酒精,则与氢氧化钠反应的CO2的体积一定为17mL;
④若将装置乙中的氢氧化钠溶液换成等体积的水,将水挤入试管后,注射器活塞的位置不会发生改变。
A.①② B.①④ C.②③ D.①②④
5.下列溶液能使紫色石蕊溶液变蓝色的是( )
A.氨水 B.氯化钠溶液 C.稀醋酸 D.硫酸钾溶液
6.一些国家下在试用碳酸水浇灌某些植物,这样做不能起到的作用是( )
A.改良酸性土壤 B.促进植物的光合作用
C.提高作物的产量 D.改良碱性土壤
7.下列物质溶于水,能使无色酚酞试液变红的是( )
A.干冰 B.食醋 C.食盐 D.生石灰
8.下列物质常用于改良酸性土壤的是( )
A.Ca(OH)2 B.NaOH C.NaCl D.CaCO3
9.生锈的铁钉放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图,说法正确的是( )
A.C点生成氢气的质量等于D点生成氢气的质量
B.D点反应结束
C.CD段压强变化的主要因素是反应速度减慢
D.E点温度大于A点
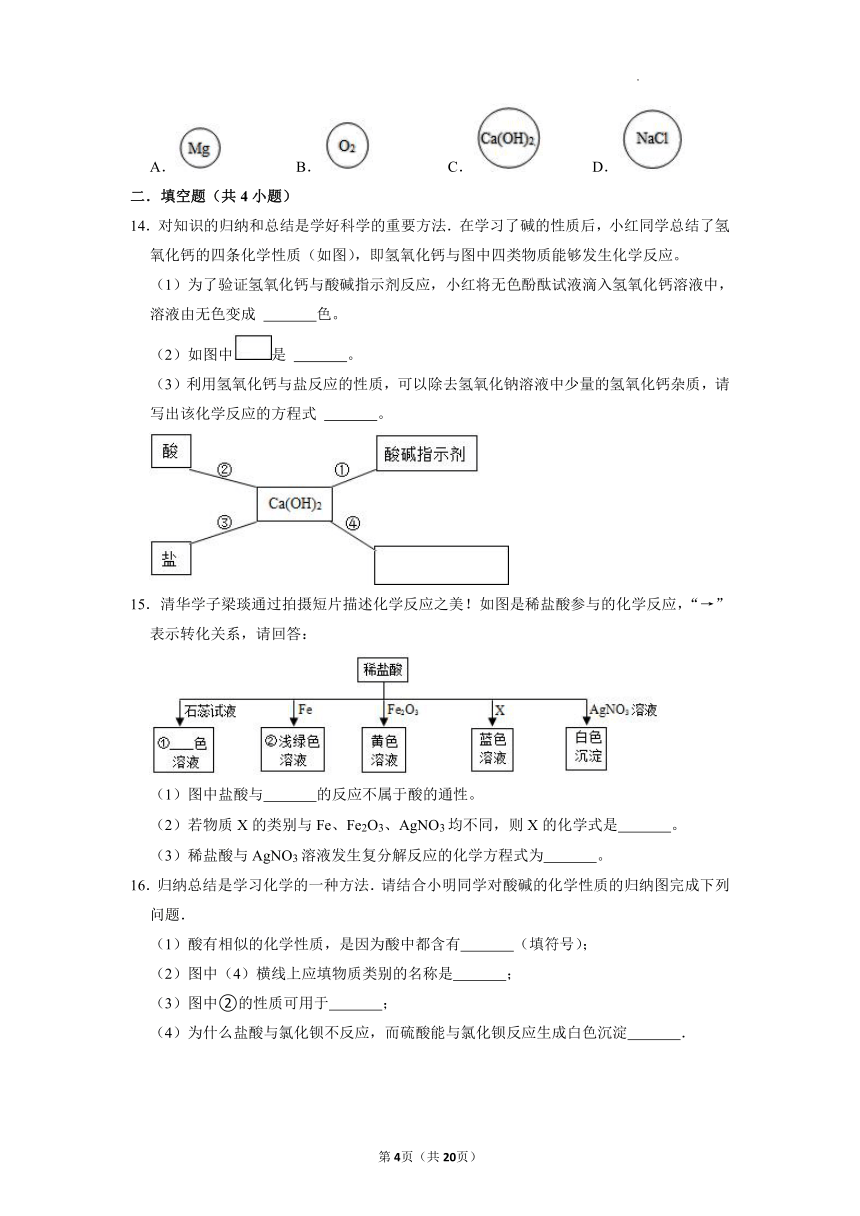
10.向一定量稀硫酸中加入一定量铜粉,无气泡冒出;用导管向稀硫酸中通入空气并加热,铜粉逐渐减少,溶液由无色变为蓝色.测得溶液质量与实验时间的关系如图.下列说法错误的是( )
A.ab段说明Cu不能转换出硫酸中的氢
B.从b点到c点,溶液的pH逐渐增大
C.从c点到d点,溶液中的溶质只可能有一种
D.bc段溶液中有硫酸铜生成
11.滴有酚酞的石灰水与适量的下列物质恰好完全反应后,酚酞仍显红色的是( )
A.稀硫酸 B.氢氧化钠溶液
C.硫酸铜溶液 D.碳酸钾溶液
12.生活中一些物质的pH如下:
物质 白醋 橙子汁 牛奶 厨房油污清洗剂
pH 2~3 3~4 6~7 12~13
其中能使无色酚酞溶液变红的是( )
A.牛奶 B.厨房油污清洗剂
C.白醋 D.橙子汁
13.“化学棋”游戏规则:
①每粒棋子代表一种物质;
②吃子:所选棋子能与棋盘(如图)中的某棋子发生反应,则棋盘中的该棋子被吃掉;
③连吃:前一次反应的生成物能与另一棋子发生反应时,则该棋子也被吃掉。
若一次就可连续吃掉棋盘上的所有棋子,应选择的棋子是( )
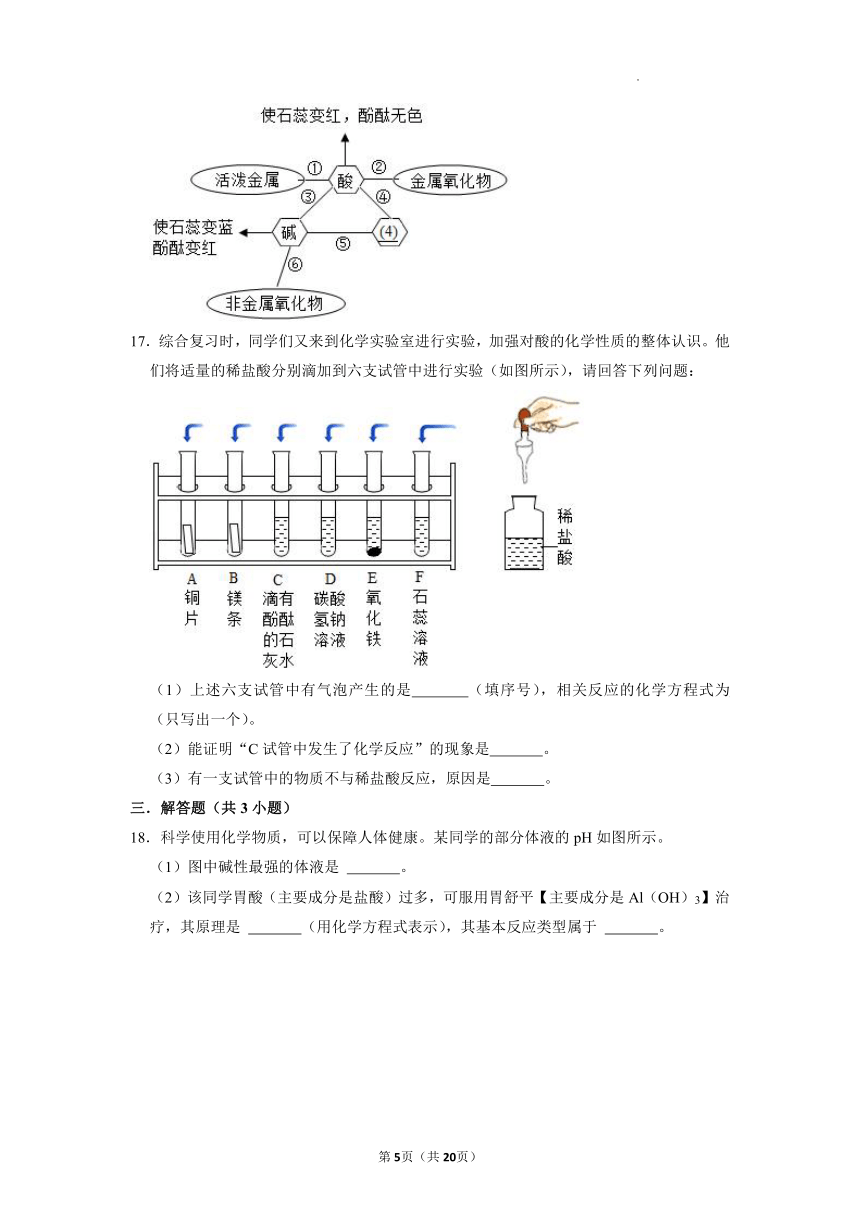
A. B. C. D.
二.填空题(共4小题)
14.对知识的归纳和总结是学好科学的重要方法.在学习了碱的性质后,小红同学总结了氢氧化钙的四条化学性质(如图),即氢氧化钙与图中四类物质能够发生化学反应。
(1)为了验证氢氧化钙与酸碱指示剂反应,小红将无色酚酞试液滴入氢氧化钙溶液中,溶液由无色变成 色。
(2)如图中是 。
(3)利用氢氧化钙与盐反应的性质,可以除去氢氧化钠溶液中少量的氢氧化钙杂质,请写出该化学反应的方程式 。
15.清华学子梁琰通过拍摄短片描述化学反应之美!如图是稀盐酸参与的化学反应,“→”表示转化关系,请回答:
(1)图中盐酸与 的反应不属于酸的通性。
(2)若物质X的类别与Fe、Fe2O3、AgNO3均不同,则X的化学式是 。
(3)稀盐酸与AgNO3溶液发生复分解反应的化学方程式为 。
16.归纳总结是学习化学的一种方法.请结合小明同学对酸碱的化学性质的归纳图完成下列问题.
(1)酸有相似的化学性质,是因为酸中都含有 (填符号);
(2)图中(4)横线上应填物质类别的名称是 ;
(3)图中②的性质可用于 ;
(4)为什么盐酸与氯化钡不反应,而硫酸能与氯化钡反应生成白色沉淀 .
17.综合复习时,同学们又来到化学实验室进行实验,加强对酸的化学性质的整体认识。他们将适量的稀盐酸分别滴加到六支试管中进行实验(如图所示),请回答下列问题:
(1)上述六支试管中有气泡产生的是 (填序号),相关反应的化学方程式为 (只写出一个)。
(2)能证明“C试管中发生了化学反应”的现象是 。
(3)有一支试管中的物质不与稀盐酸反应,原因是 。
三.解答题(共3小题)
18.科学使用化学物质,可以保障人体健康。某同学的部分体液的pH如图所示。
(1)图中碱性最强的体液是 。
(2)该同学胃酸(主要成分是盐酸)过多,可服用胃舒平【主要成分是Al(OH)3】治疗,其原理是 (用化学方程式表示),其基本反应类型属于 。
19.调味剂的主要作用是补充、增强或增加食品的味道。食醋是一种能增强食品酸味的调味剂,主要成分为醋酸(CH3COOH),与我们的生活密切相连。根据所学知识回答:
(1)食醋能作酸味的调味剂,是因为醋酸在水溶液中能解离出CH3COO﹣和 (填离子符号)。
(2)食醋的酸味能促进人胃酸的分泌,胃酸的成分是 (填化学式)。
(3)食醋能软化鱼骨和鸡蛋壳,原因是醋酸能与 (填化学式)反应。
(4)生活中常用酒来制取食醋,原理是酒中的酒精CH3CH2OH在酶的作用下与空气中O2反应得到醋酸和水,请你尝试写出该反应的化学方程式 。
(5)用铁锅炒菜时,放一点食醋能补铁的原因是 。
20.学了酸的化学性质,某同学以稀硫酸为主题,绘制了“多彩酸世界”思维导图。
(1)若用Cu(OH)2实现②,会得到 色溶液。
(2)若想实现③,得到浅绿色溶液,可选用的单质是 。
(3)若选用BaCl2溶液实现⑤,此反应的化学方程式为 。
第十一章酸与碱分层作业巩固练习2021_2022学年九年级化学(京改版2013)
参考答案与试题解析
一.选择题(共13小题)
1.向足量稀硫酸中加入适量的镁粉,如图所示的函数图象横轴表示此化学反应的时间,纵轴表示反应的有关变化情况,正确的是( )
A. B.
C. D.
【分析】稀硫酸和镁反应生成硫酸镁和氢气。
【解答】解:A、随着反应进行,稀硫酸减少,酸性减弱,pH升高,该选项不正确。
B、稀硫酸和镁反应生成硫酸镁和氢气,24分质量的镁反应生成2分质量的氢气,反应后溶液质量增大,完全反应后溶液质量不再变化,该选项正确。
C、稀硫酸和镁反应生成硫酸镁和氢气,溶液导电性几乎不变,该选项不正确。
D、稀硫酸和镁反应生成硫酸镁和氢气,两种物质混合后立即产生氢气,该选项不正确。
故选:B。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
2.下列物质中,pH小于7的是( )
A.NaOH溶液 B.NaCl溶液 C.稀盐酸 D.石灰水
【分析】根据常见物质的酸碱性,结合当溶液的pH进行解答。当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性;当溶液的pH大于7时,呈碱性;进行分析判断即可。
【解答】解:A、氢氧化钠的水溶液呈碱性,其pH大于7,故错误;
B、氯化钠溶液呈中性,其pH等于7,故错误;
C、稀盐酸显酸性,其pH小于7,故正确;
D、石灰水是氢氧化钙溶液,呈碱性,其pH大于7,故错误。
故选:C。
【点评】本题难度不大,掌握常见物质的酸碱性、溶液的酸碱性和溶液pH大小之间的关系是顺利解题的关键。
3.将下列物质滴入酚酞溶液中,能使酚酞溶液变红的是( )
食物 柠檬汁 菠萝汁 生理盐水 炉具清洁剂
pH 2.1~2.8 3.3~5.2 7.0 12~13
A.柠檬汁 B.菠萝汁 C.生理盐水 D.炉具清洁剂
【分析】碱性溶液能使无色酚酞试液变红色,所以酚酞试液溶液变红,说明遇到了碱性的溶液,碱性溶液的pH大于7。
【解答】解:溶液的pH<7,溶液显酸性,pH>7,溶液显碱性,pH=7,溶液呈中性。碱性溶液能使酚酞溶液变红色,即pH大于的溶液符合题意。
A、柠檬汁的pH小于7,说明柠檬汁显酸性,故A错误;
B、菠萝汁的pH小于7,说明柠檬汁显酸性,故B错误;
C、生理盐水的pH等于,说明食盐水呈中性,故C错误;
D、炉具清洁剂的pH大于7,说明炉具清洁剂显碱性,故D正确。
故选:D。
【点评】本题考查了指示剂酚酞在酸碱性溶液中的变色,利用了碱性溶液能使酚酞变红的知识.
4.小华在验证“CO2能与氢氧化钠溶液反应”时,进行了如下实验:
已知:①20℃、101KPa时,1体积H2O中最多可溶解1体积CO2;1体积酒精中最多可溶解0.3体积CO2;
②20℃,在酒精中,NaOH易溶,Na2CO3难溶;
③气压减小时,水的沸点会降低。
下列说法正确的是( )
①用两套图甲装置进行实验,在第一套装置中注入3mL浓氢氧化钠溶液;在第二套装中注入等体积的H2O,振荡试管。当观察到第一套装置中锥形瓶内水沸腾时,可证明CO2与NaOH发生了反应;
②装置乙中,将胶头滴管内的氢氧化钠溶液挤入试管后,观察的现象是:注射器活塞向右移动,试管内出现白色沉淀;
③装置乙中,若注射器中最终剩余3mL酒精,则与氢氧化钠反应的CO2的体积一定为17mL;
④若将装置乙中的氢氧化钠溶液换成等体积的水,将水挤入试管后,注射器活塞的位置不会发生改变。
A.①② B.①④ C.②③ D.①②④
【分析】①根据二氧化碳能与氢氧化钠反应和气压与水的沸点关系分析判断;
②根据二氧化碳与氢氧化钠反应生成碳酸钠和水,而碳酸钠微溶于酒精,因此会部分析出分析判断;
③根据碳酸钠在水中和酒精中的溶解信息分析判断;
④根据二氧化碳能溶于水分析判断。
【解答】解:①浓NaOH溶液溶解并与二氧化碳反应,使装置内气压变小,水的沸点降低,从而造成热水沸腾,该说法正确;
②二氧化碳与氢氧化钠反应生成碳酸钠和水,而碳酸钠微溶于酒精,向右移动酒精不会进入装置,因此不会产生白色沉淀,该说法不正确;
③二氧化碳与氢氧化钠反应生成碳酸钠和水,而碳酸钠微溶于酒精,因此会出现白色沉淀物,注射器中剩余3mL酒精,说明整套装置内CO2体积减小20ml﹣3ml=17ml,酒精溶解17×0.3mL=5.4mL,3mLNaOH溶液溶解3mL,所以与氢氧化钠反应的二氧化碳的体积小于17mL,该说法不正确;
④1体积水最多可溶解1体积CO2,那3mL水溶解了3mLCO2,减少了3mLCO2,但是进去了3mL水,所以试管中压强几乎没有变化,所以注射器活塞位置不会发生改变,该说法正确;
故选:B。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
5.下列溶液能使紫色石蕊溶液变蓝色的是( )
A.氨水 B.氯化钠溶液 C.稀醋酸 D.硫酸钾溶液
【分析】石蕊溶液遇酸性溶液变红色,遇碱性溶液变蓝色,据此结合常见溶液的酸碱性进行分析判断即可。
【解答】解:A、氨水呈碱性,能使紫色石蕊试液变蓝,故说法正确;
B、氯化钠溶液呈中性,不能使石蕊试液变色,故说法错误;
C、稀醋酸呈酸性,能使石蕊试液变红色,故说法错误;
D、硫酸钾溶液呈中性,不能使石蕊试液变色,故说法错误;
故选:A。
【点评】本题难度不大,掌握石蕊溶液的性质、常见溶液的酸碱性是正确解答本题的关键。
6.一些国家下在试用碳酸水浇灌某些植物,这样做不能起到的作用是( )
A.改良酸性土壤 B.促进植物的光合作用
C.提高作物的产量 D.改良碱性土壤
【分析】碳酸属于酸,溶液显酸性;
碳酸容易分解生成水和二氧化碳.
【解答】解:A、碳酸显酸性,不能用来改良酸性土壤;
B、碳酸分解生成的二氧化碳可以用作绿色植物光合作用的原料,从而促进植物的光合作用;
C、碳酸分解生成的二氧化碳可以用作绿色植物光合作用的原料,从而可以提高作物的产量;
D、碳酸显酸性,可以用来改良碱性土壤。
故选:A。
【点评】物质的性质决定物质的用途,根据碳酸的性质可以判断碳酸具有哪些方面的用途.
7.下列物质溶于水,能使无色酚酞试液变红的是( )
A.干冰 B.食醋 C.食盐 D.生石灰
【分析】根据已有的知识进行分析,碱性溶液能使酚酞试液变红.
【解答】解:A、干冰是固体二氧化碳,溶于水与水反应生成碳酸,呈酸性,不能使酚酞试液变红,故A错误;
B、食醋呈酸性,不能使酚酞试液变红,故B错误;
C、食盐的水溶液呈中性,不能使酚酞试液变红,故C错误;
D、生石灰与水反应生成氢氧化钙,氢氧化钙的水溶液呈碱性,能使酚酞试液变红,故D正确;
故选:D。
【点评】本题考查了常见物质水溶液的酸碱性,完成此题,可以依据已有的知识进行.
8.下列物质常用于改良酸性土壤的是( )
A.Ca(OH)2 B.NaOH C.NaCl D.CaCO3
【分析】酸性土壤一般用碱性物质来中和。选择碱性物质时还要综合考虑这种物质的性质,如不能具有很强的腐蚀性,进行分析判断。
【解答】解:A.氢氧化钙显碱性,可用于改良酸性土壤,故选项正确。
B.氢氧化钠是一种常见的碱,能中和酸性物质,但具有很强烈的腐蚀性,故选项错误。
C.氯化钠是一种常见的盐,显中性,不能改良酸性土壤,故选项错误。
D.碳酸钙不能用于改良酸性土壤,故选项错误。
故选:A。
【点评】本题难度不大,掌握中和反应应用、常见物质的酸碱性并能灵活运用是正确解答本题的关键。
9.生锈的铁钉放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图,说法正确的是( )
A.C点生成氢气的质量等于D点生成氢气的质量
B.D点反应结束
C.CD段压强变化的主要因素是反应速度减慢
D.E点温度大于A点
【分析】稀盐酸和氧化铁反应生成氯化铁和水,和铁反应生成氯化亚铁和氢气,过程中放热。
【解答】解:A、C点生成氢气的质量等于D点生成氢气的质量,是因为C点完全反应,C至D过程中温度降低,导致压强减小,该选项说法正确;
B、C点反应结束,该选项说法不正确;
C、CD段压强变化的主要因素是温度降低,该选项说法不正确;
D、E点温度等于A点,都是室温,该选项说法不正确。
故选:A。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
10.向一定量稀硫酸中加入一定量铜粉,无气泡冒出;用导管向稀硫酸中通入空气并加热,铜粉逐渐减少,溶液由无色变为蓝色.测得溶液质量与实验时间的关系如图.下列说法错误的是( )
A.ab段说明Cu不能转换出硫酸中的氢
B.从b点到c点,溶液的pH逐渐增大
C.从c点到d点,溶液中的溶质只可能有一种
D.bc段溶液中有硫酸铜生成
【分析】ab段溶液质量未发生改变,说明此时铜与稀酸未发生反应,即Cu不能转换出硫酸中的氢;
从b点到c点,溶液质量增大,说明铜和氧气、稀硫酸发生了反应,稀硫酸被消耗,酸性减弱,pH增大;
从c点到d点,溶液质量不再发生改变,反应已完全,此时溶液中的溶质一定有硫酸铜,可能存在未反应完全的稀硫酸;
bc段发生的反应为铜、硫酸、氧气反应生成硫酸铜和水.
【解答】解:A、因为ab段溶液质量不变,说明Cu不能转换出硫酸中的氢,该选项说法正确;
B、从b点到c点,溶液质量增大,说明在加热条件下,铜、氧气、稀硫酸发生了反应,稀硫酸被消耗,随着稀硫酸的减少,酸性减弱,PH增大,该选项说法正确;
C、从c点到d点,如果硫酸恰好完全反应,则溶液中的溶质是硫酸铜,如果稀硫酸过量,则溶液中的溶质是硫酸铜和硫酸,该选项说法错误;
D、铜、氧气、硫酸在加热条件下反应的化学方程式为:2Cu+2H2SO4+O22CuSO4+2H2O,该选项说法正确。
故选:C。
【点评】铜排在氢的后面,不能和稀硫酸反应置换反应,但是在一定条件下,铜能和稀硫酸反应,要注意理解.
11.滴有酚酞的石灰水与适量的下列物质恰好完全反应后,酚酞仍显红色的是( )
A.稀硫酸 B.氢氧化钠溶液
C.硫酸铜溶液 D.碳酸钾溶液
【分析】A、氢氧化钙和稀硫酸反应生成硫酸钙和水;
B、氢氧化钠和不能和氢氧化钙反应;
C、硫酸铜和氢氧化钙反应生成硫酸钙和氢氧化铜沉淀;
D、碳酸钾和氢氧化钙反应生成碳酸钙沉淀和氢氧化钾。
【解答】解:A、氢氧化钙和稀硫酸反应生成硫酸钙和水,反应后溶液是无色溶液,该选项不符合题意;
B、氢氧化钠和不能和氢氧化钙反应,该选项不符合题意;
C、硫酸铜和氢氧化钙反应生成硫酸钙和氢氧化铜沉淀,反应后溶液是无色溶液,该选项不符合题意;
D、碳酸钾和氢氧化钙反应生成碳酸钙沉淀和氢氧化钾,氢氧化钾溶液显碱性,能使酚酞试液变红色,因此反应后溶液仍然是红色,该选项符合题意。
故选:D。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
12.生活中一些物质的pH如下:
物质 白醋 橙子汁 牛奶 厨房油污清洗剂
pH 2~3 3~4 6~7 12~13
其中能使无色酚酞溶液变红的是( )
A.牛奶 B.厨房油污清洗剂
C.白醋 D.橙子汁
【分析】根据已有的知识进行分析,酸性溶液的pH小于7,能使石蕊试液变红,不能使酚酞试液变色;碱性溶液的pH大于7,呈碱性,能使石蕊试液变蓝,能使酚酞试液变红;中性溶液的pH等于7,不能使指示剂变色。
【解答】解:A.牛奶的pH6~7,偏酸性,不能使无色酚酞试液变色,不合题意;
B.厨房油污清洗剂的pH>7,显碱性,能使无色酚酞试液变红色,符合题意;
C.白醋的pH<7,显酸性,不能使无色酚酞试液变色,不合题意;
D.橘子汁的pH<7,显酸性,不能使无色酚酞试液变色,不合题意。
故选:B。
【点评】本题考查了溶液的酸碱性与pH的关系,完成此题,可以依据已有的知识进行。
13.“化学棋”游戏规则:
①每粒棋子代表一种物质;
②吃子:所选棋子能与棋盘(如图)中的某棋子发生反应,则棋盘中的该棋子被吃掉;
③连吃:前一次反应的生成物能与另一棋子发生反应时,则该棋子也被吃掉。
若一次就可连续吃掉棋盘上的所有棋子,应选择的棋子是( )
A. B. C. D.
【分析】根据题意,吃子:所选棋子能与棋盘中的某棋子发生反应,则棋盘中的该棋子被吃掉;连吃:前一次反应的生成物能与另一棋子发生反应时,则该棋子也被吃掉,据此结合所涉及的物质进行分析判断。
【解答】解:A、镁能与稀硫酸反应生成硫酸镁和氢气,硫酸镁能与氢氧化钠溶液反应生成氢氧化镁沉淀和硫酸钠,氢氧化镁、硫酸钠均不能与铜反应,故选项错误。
B、铜能与氧气在加热条件反应生成氧化铜,氧化铜能与硫酸反应生成硫酸铜和水,硫酸铜能与氢氧化钠溶液反应生成氢氧化铜沉淀和硫酸钠,故选项正确。
C、氢氧化钙能与硫酸反应生成硫酸钙和水,硫酸钙、水与氢氧化钠、铜均不反应,故选项错误。
D、氯化钠与铜、氢氧化钠、硫酸均不反应,故选项错误。
故选:B。
【点评】本题难度不大,明确吃子、连吃的含义,熟练掌握酸碱盐的化学性质是正确解答本题的关键。
二.填空题(共4小题)
14.对知识的归纳和总结是学好科学的重要方法.在学习了碱的性质后,小红同学总结了氢氧化钙的四条化学性质(如图),即氢氧化钙与图中四类物质能够发生化学反应。
(1)为了验证氢氧化钙与酸碱指示剂反应,小红将无色酚酞试液滴入氢氧化钙溶液中,溶液由无色变成 红 色。
(2)如图中是 某些非金属氧化物 。
(3)利用氢氧化钙与盐反应的性质,可以除去氢氧化钠溶液中少量的氢氧化钙杂质,请写出该化学反应的方程式 Na2CO3+Ca(OH)2═CaCO3↓+2NaOH 。
【分析】氢氧化钙溶液显碱性,能使酚酞试液变红色;
氢氧化钙能和某些非金属氧化物反应,例如氢氧化钙能和二氧化碳反应生成碳酸钙和水;
碳酸钠能和氢氧化钙反应生成白色沉淀碳酸钙和氢氧化钠.
【解答】解:(1)为了验证氢氧化钙与酸碱指示剂反应,小红将无色酚酞试液滴入氢氧化钙溶液中,溶液由无色变成红色.
故填:红.
(2)如图中是某些非金属氧化物.
故填:某些非金属氧化物.
(3)利用氢氧化钙与盐反应的性质,可以除去氢氧化钠溶液中少量的氢氧化钙杂质,因为氢氧化钙能和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
故填:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
【点评】本题主要考查物质的性质,只有掌握了各种物质的性质,才能够判断物质之间相互转化时的反应物和生成物,从而可以进行各方面的判断.
15.清华学子梁琰通过拍摄短片描述化学反应之美!如图是稀盐酸参与的化学反应,“→”表示转化关系,请回答:
(1)图中盐酸与 硝酸银溶液 的反应不属于酸的通性。
(2)若物质X的类别与Fe、Fe2O3、AgNO3均不同,则X的化学式是 Cu(OH)2 。
(3)稀盐酸与AgNO3溶液发生复分解反应的化学方程式为 HCl+AgNO3═HNO3+AgCl↓ 。
【分析】根据酸的化学性质(能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应),进行分析解答。
【解答】解:(1)图中盐酸与硝酸银溶液的反应不属于酸的通性,如硝酸不能与硝酸银溶液反应。
(2)若物质X的类别与Fe、Fe2O3、AgNO3均不同,由酸的化学性质,X应为碱,生成蓝色溶液,说明生成了铜盐的水溶液,则X为氢氧化铜,其化学式为Cu(OH)2。
(3)稀盐酸与AgNO3溶液反应生成氯化银沉淀和硝酸,反应的化学方程式为HCl+AgNO3═HNO3+AgCl↓。
故答案为:
(1)硝酸银溶液;
(2)Cu(OH)2;
(3)HCl+AgNO3═HNO3+AgCl↓。
【点评】本题难度不大,掌握酸的化学性质(能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应)并能灵活运用是正确解答本题的关键。
16.归纳总结是学习化学的一种方法.请结合小明同学对酸碱的化学性质的归纳图完成下列问题.
(1)酸有相似的化学性质,是因为酸中都含有 H+ (填符号);
(2)图中(4)横线上应填物质类别的名称是 盐 ;
(3)图中②的性质可用于 金属表面除锈 ;
(4)为什么盐酸与氯化钡不反应,而硫酸能与氯化钡反应生成白色沉淀 硫酸和盐酸中的酸根离子不同 .
【分析】根据酸的化学性质(能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应)、碱的化学性质(能与酸碱指示剂、非金属氧化物、酸、盐等反应),据此进行分析解答。
【解答】解:(1)酸有相似的化学性质,是因为酸中都含有氢离子,其离子符号为H+。
(2)酸能与盐反应生成新盐和新酸,碱能与盐反应生成新碱和新盐,图中(4)横线上应填物质类别的名称是盐。
(3)图中②的性质是酸与金属氧化物反应生成盐和水,图中②的性质可用于金属表面除锈。
(4)盐酸与氯化钡不反应,而硫酸能与氯化钡反应生成白色沉淀,是因为硫酸和盐酸中的酸根离子不同。
故答案为:
(1)H+;
(2)盐;
(3)金属表面除锈;
(4)硫酸和盐酸中的酸根离子不同。
【点评】本题难度不大,掌握碱的化学性质(能与酸碱指示剂、非金属氧化物、酸、盐等反应)、酸的化学性质(能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应)并能灵活运用是正确解答本题的关键。
17.综合复习时,同学们又来到化学实验室进行实验,加强对酸的化学性质的整体认识。他们将适量的稀盐酸分别滴加到六支试管中进行实验(如图所示),请回答下列问题:
(1)上述六支试管中有气泡产生的是 BD (填序号),相关反应的化学方程式为 Mg+2HCl═MgCl2+H2↑或NaHCO3+HCl=NaCl+H2O+CO2↑ (只写出一个)。
(2)能证明“C试管中发生了化学反应”的现象是 溶液由红色变为无色 。
(3)有一支试管中的物质不与稀盐酸反应,原因是 在金属活动性顺序中,铜位于氢的后面,不与稀盐酸反应 。
【分析】根据酸的化学性质(能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应),据此进行分析解答。
【解答】解:(1)酸能与活泼金属反应生成氢气,镁能与稀盐酸反应生成氯化镁和氢气,稀盐酸与碳酸氢钠溶液反应生成氯化钠、水和二氧化碳气体,上述六支试管中有气泡产生的是BD;反应的化学方程式分别是Mg+2HCl═MgCl2+H2↑、NaHCO3+HCl=NaCl+H2O+CO2↑。
(2)滴有酚酞溶液的石灰水显红色,无色酚酞溶液遇酸性溶液不变色,遇碱性溶液变红,逐滴滴入稀盐酸,至恰好完全反应,溶液显中性,溶液由红色变为无色,证明盐酸和氢氧化钙发生了化学反应。
(3)有一支试管中的物质不与稀盐酸反应,该物质是铜,在金属活动性顺序中,铜位于氢的后面,不与稀盐酸反应。
故答案为:
(1)BD;Mg+2HCl═MgCl2+H2↑或NaHCO3+HCl=NaCl+H2O+CO2↑;
(2)溶液由红色变为无色;
(3)在金属活动性顺序中,铜位于氢的后面,不与稀盐酸反应。
【点评】本题难度不大,掌握酸的化学性质(能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应)并能灵活运用是正确解答本题的关键。
三.解答题(共3小题)
18.科学使用化学物质,可以保障人体健康。某同学的部分体液的pH如图所示。
(1)图中碱性最强的体液是 胰液 。
(2)该同学胃酸(主要成分是盐酸)过多,可服用胃舒平【主要成分是Al(OH)3】治疗,其原理是 Al(OH)3+3HCl═AlCl3+3H2O (用化学方程式表示),其基本反应类型属于 复分解反应 。
【分析】(1)溶液碱性越强,pH越高。
(2)稀盐酸和氢氧化铝反应生成氯化铝和水。
【解答】解:(1)溶液碱性越强,pH越高,图中碱性最强的体液是胰液。
故填:胰液。
(2)稀盐酸和氢氧化铝反应生成氯化铝和水,反应的化学方程式:Al(OH)3+3HCl═AlCl3+3H2O,是复分解反应。
故填:Al(OH)3+3HCl═AlCl3+3H2O;复分解反应。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
19.调味剂的主要作用是补充、增强或增加食品的味道。食醋是一种能增强食品酸味的调味剂,主要成分为醋酸(CH3COOH),与我们的生活密切相连。根据所学知识回答:
(1)食醋能作酸味的调味剂,是因为醋酸在水溶液中能解离出CH3COO﹣和 H+ (填离子符号)。
(2)食醋的酸味能促进人胃酸的分泌,胃酸的成分是 HCl (填化学式)。
(3)食醋能软化鱼骨和鸡蛋壳,原因是醋酸能与 CaCO3 (填化学式)反应。
(4)生活中常用酒来制取食醋,原理是酒中的酒精CH3CH2OH在酶的作用下与空气中O2反应得到醋酸和水,请你尝试写出该反应的化学方程式 CH3CH2OH+O2CH3COOH+H2O 。
(5)用铁锅炒菜时,放一点食醋能补铁的原因是 将铁转为Fe2+ 。
【分析】(1)依据醋酸(CH3COOH)为酸分析;
(2)依据胃酸的成分为盐酸分析;
(3)依据鱼骨和鸡蛋壳主要成分分析;
(4)依据题中信息写出反应方程式;
(5)依据醋酸(CH3COOH)与铁的反应原理分析。
【解答】解:(1)醋酸(CH3COOH)为酸,则电离出的阳离子为H+,故填:H+;
(2)胃酸的成分为盐酸,则化学式为HCl,故填:HCl;
(3)鱼骨和鸡蛋壳主要成分为CaCO3,醋酸能与碳酸钙反应生成能溶于水的醋酸钙、水和二氧化碳,故填:CaCO3;
(4)酒精(CH3CH2OH)在酶的作用下与空气中O2反应得到醋酸和水,则反应方程式CH3CH2OH+O2CH3COOH+H2O,故填:CH3CH2OH+O2CH3COOH+H2O;
(5)醋酸(CH3COOH)与铁反应,生成醋酸亚铁和氢气,则用铁锅炒菜时,放一点食醋能补铁的原因是将铁转为Fe2+,故填:将铁转为Fe2+。
【点评】此题主要考查常见物质的性质,主要利用物质的性质来分析和解决有关问题,结合各方面的条件得出正确结论。
20.学了酸的化学性质,某同学以稀硫酸为主题,绘制了“多彩酸世界”思维导图。
(1)若用Cu(OH)2实现②,会得到 蓝 色溶液。
(2)若想实现③,得到浅绿色溶液,可选用的单质是 铁 。
(3)若选用BaCl2溶液实现⑤,此反应的化学方程式为 BaCl2+H2SO4═BaSO4↓+2HCl 。
【分析】根据酸的化学性质(能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应),据此进行分析解答。
【解答】解:(1)氢氧化铜能与稀硫酸反应生成硫酸铜和水,会得到蓝色溶液。
(2)若想实现③,得到浅绿色溶液,铁能与稀硫酸反应生成硫酸亚铁溶液和氢气,则可选用的单质是铁。
(3)若选用BaCl2溶液实现⑤,氯化钡能与稀硫酸反应生成硫酸钡沉淀和盐酸,反应的化学方程式为BaCl2+H2SO4═BaSO4↓+2HCl。
故答案为:
(1)蓝;
(2)铁;
(3)BaCl2+H2SO4═BaSO4↓+2HCl。
【点评】本题难度不大,掌握酸的化学性质(能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应)并能灵活运用是正确解答本题的关键。
第1页(共1页)
一.选择题(共13小题)
1.向足量稀硫酸中加入适量的镁粉,如图所示的函数图象横轴表示此化学反应的时间,纵轴表示反应的有关变化情况,正确的是( )
A. B.
C. D.
2.下列物质中,pH小于7的是( )
A.NaOH溶液 B.NaCl溶液 C.稀盐酸 D.石灰水
3.将下列物质滴入酚酞溶液中,能使酚酞溶液变红的是( )
食物 柠檬汁 菠萝汁 生理盐水 炉具清洁剂
pH 2.1~2.8 3.3~5.2 7.0 12~13
A.柠檬汁 B.菠萝汁 C.生理盐水 D.炉具清洁剂
4.小华在验证“CO2能与氢氧化钠溶液反应”时,进行了如下实验:
已知:①20℃、101KPa时,1体积H2O中最多可溶解1体积CO2;1体积酒精中最多可溶解0.3体积CO2;
②20℃,在酒精中,NaOH易溶,Na2CO3难溶;
③气压减小时,水的沸点会降低。
下列说法正确的是( )
①用两套图甲装置进行实验,在第一套装置中注入3mL浓氢氧化钠溶液;在第二套装中注入等体积的H2O,振荡试管。当观察到第一套装置中锥形瓶内水沸腾时,可证明CO2与NaOH发生了反应;
②装置乙中,将胶头滴管内的氢氧化钠溶液挤入试管后,观察的现象是:注射器活塞向右移动,试管内出现白色沉淀;
③装置乙中,若注射器中最终剩余3mL酒精,则与氢氧化钠反应的CO2的体积一定为17mL;
④若将装置乙中的氢氧化钠溶液换成等体积的水,将水挤入试管后,注射器活塞的位置不会发生改变。
A.①② B.①④ C.②③ D.①②④
5.下列溶液能使紫色石蕊溶液变蓝色的是( )
A.氨水 B.氯化钠溶液 C.稀醋酸 D.硫酸钾溶液
6.一些国家下在试用碳酸水浇灌某些植物,这样做不能起到的作用是( )
A.改良酸性土壤 B.促进植物的光合作用
C.提高作物的产量 D.改良碱性土壤
7.下列物质溶于水,能使无色酚酞试液变红的是( )
A.干冰 B.食醋 C.食盐 D.生石灰
8.下列物质常用于改良酸性土壤的是( )
A.Ca(OH)2 B.NaOH C.NaCl D.CaCO3
9.生锈的铁钉放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图,说法正确的是( )
A.C点生成氢气的质量等于D点生成氢气的质量
B.D点反应结束
C.CD段压强变化的主要因素是反应速度减慢
D.E点温度大于A点
10.向一定量稀硫酸中加入一定量铜粉,无气泡冒出;用导管向稀硫酸中通入空气并加热,铜粉逐渐减少,溶液由无色变为蓝色.测得溶液质量与实验时间的关系如图.下列说法错误的是( )
A.ab段说明Cu不能转换出硫酸中的氢
B.从b点到c点,溶液的pH逐渐增大
C.从c点到d点,溶液中的溶质只可能有一种
D.bc段溶液中有硫酸铜生成
11.滴有酚酞的石灰水与适量的下列物质恰好完全反应后,酚酞仍显红色的是( )
A.稀硫酸 B.氢氧化钠溶液
C.硫酸铜溶液 D.碳酸钾溶液
12.生活中一些物质的pH如下:
物质 白醋 橙子汁 牛奶 厨房油污清洗剂
pH 2~3 3~4 6~7 12~13
其中能使无色酚酞溶液变红的是( )
A.牛奶 B.厨房油污清洗剂
C.白醋 D.橙子汁
13.“化学棋”游戏规则:
①每粒棋子代表一种物质;
②吃子:所选棋子能与棋盘(如图)中的某棋子发生反应,则棋盘中的该棋子被吃掉;
③连吃:前一次反应的生成物能与另一棋子发生反应时,则该棋子也被吃掉。
若一次就可连续吃掉棋盘上的所有棋子,应选择的棋子是( )
A. B. C. D.
二.填空题(共4小题)
14.对知识的归纳和总结是学好科学的重要方法.在学习了碱的性质后,小红同学总结了氢氧化钙的四条化学性质(如图),即氢氧化钙与图中四类物质能够发生化学反应。
(1)为了验证氢氧化钙与酸碱指示剂反应,小红将无色酚酞试液滴入氢氧化钙溶液中,溶液由无色变成 色。
(2)如图中是 。
(3)利用氢氧化钙与盐反应的性质,可以除去氢氧化钠溶液中少量的氢氧化钙杂质,请写出该化学反应的方程式 。
15.清华学子梁琰通过拍摄短片描述化学反应之美!如图是稀盐酸参与的化学反应,“→”表示转化关系,请回答:
(1)图中盐酸与 的反应不属于酸的通性。
(2)若物质X的类别与Fe、Fe2O3、AgNO3均不同,则X的化学式是 。
(3)稀盐酸与AgNO3溶液发生复分解反应的化学方程式为 。
16.归纳总结是学习化学的一种方法.请结合小明同学对酸碱的化学性质的归纳图完成下列问题.
(1)酸有相似的化学性质,是因为酸中都含有 (填符号);
(2)图中(4)横线上应填物质类别的名称是 ;
(3)图中②的性质可用于 ;
(4)为什么盐酸与氯化钡不反应,而硫酸能与氯化钡反应生成白色沉淀 .
17.综合复习时,同学们又来到化学实验室进行实验,加强对酸的化学性质的整体认识。他们将适量的稀盐酸分别滴加到六支试管中进行实验(如图所示),请回答下列问题:
(1)上述六支试管中有气泡产生的是 (填序号),相关反应的化学方程式为 (只写出一个)。
(2)能证明“C试管中发生了化学反应”的现象是 。
(3)有一支试管中的物质不与稀盐酸反应,原因是 。
三.解答题(共3小题)
18.科学使用化学物质,可以保障人体健康。某同学的部分体液的pH如图所示。
(1)图中碱性最强的体液是 。
(2)该同学胃酸(主要成分是盐酸)过多,可服用胃舒平【主要成分是Al(OH)3】治疗,其原理是 (用化学方程式表示),其基本反应类型属于 。
19.调味剂的主要作用是补充、增强或增加食品的味道。食醋是一种能增强食品酸味的调味剂,主要成分为醋酸(CH3COOH),与我们的生活密切相连。根据所学知识回答:
(1)食醋能作酸味的调味剂,是因为醋酸在水溶液中能解离出CH3COO﹣和 (填离子符号)。
(2)食醋的酸味能促进人胃酸的分泌,胃酸的成分是 (填化学式)。
(3)食醋能软化鱼骨和鸡蛋壳,原因是醋酸能与 (填化学式)反应。
(4)生活中常用酒来制取食醋,原理是酒中的酒精CH3CH2OH在酶的作用下与空气中O2反应得到醋酸和水,请你尝试写出该反应的化学方程式 。
(5)用铁锅炒菜时,放一点食醋能补铁的原因是 。
20.学了酸的化学性质,某同学以稀硫酸为主题,绘制了“多彩酸世界”思维导图。
(1)若用Cu(OH)2实现②,会得到 色溶液。
(2)若想实现③,得到浅绿色溶液,可选用的单质是 。
(3)若选用BaCl2溶液实现⑤,此反应的化学方程式为 。
第十一章酸与碱分层作业巩固练习2021_2022学年九年级化学(京改版2013)
参考答案与试题解析
一.选择题(共13小题)
1.向足量稀硫酸中加入适量的镁粉,如图所示的函数图象横轴表示此化学反应的时间,纵轴表示反应的有关变化情况,正确的是( )
A. B.
C. D.
【分析】稀硫酸和镁反应生成硫酸镁和氢气。
【解答】解:A、随着反应进行,稀硫酸减少,酸性减弱,pH升高,该选项不正确。
B、稀硫酸和镁反应生成硫酸镁和氢气,24分质量的镁反应生成2分质量的氢气,反应后溶液质量增大,完全反应后溶液质量不再变化,该选项正确。
C、稀硫酸和镁反应生成硫酸镁和氢气,溶液导电性几乎不变,该选项不正确。
D、稀硫酸和镁反应生成硫酸镁和氢气,两种物质混合后立即产生氢气,该选项不正确。
故选:B。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
2.下列物质中,pH小于7的是( )
A.NaOH溶液 B.NaCl溶液 C.稀盐酸 D.石灰水
【分析】根据常见物质的酸碱性,结合当溶液的pH进行解答。当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性;当溶液的pH大于7时,呈碱性;进行分析判断即可。
【解答】解:A、氢氧化钠的水溶液呈碱性,其pH大于7,故错误;
B、氯化钠溶液呈中性,其pH等于7,故错误;
C、稀盐酸显酸性,其pH小于7,故正确;
D、石灰水是氢氧化钙溶液,呈碱性,其pH大于7,故错误。
故选:C。
【点评】本题难度不大,掌握常见物质的酸碱性、溶液的酸碱性和溶液pH大小之间的关系是顺利解题的关键。
3.将下列物质滴入酚酞溶液中,能使酚酞溶液变红的是( )
食物 柠檬汁 菠萝汁 生理盐水 炉具清洁剂
pH 2.1~2.8 3.3~5.2 7.0 12~13
A.柠檬汁 B.菠萝汁 C.生理盐水 D.炉具清洁剂
【分析】碱性溶液能使无色酚酞试液变红色,所以酚酞试液溶液变红,说明遇到了碱性的溶液,碱性溶液的pH大于7。
【解答】解:溶液的pH<7,溶液显酸性,pH>7,溶液显碱性,pH=7,溶液呈中性。碱性溶液能使酚酞溶液变红色,即pH大于的溶液符合题意。
A、柠檬汁的pH小于7,说明柠檬汁显酸性,故A错误;
B、菠萝汁的pH小于7,说明柠檬汁显酸性,故B错误;
C、生理盐水的pH等于,说明食盐水呈中性,故C错误;
D、炉具清洁剂的pH大于7,说明炉具清洁剂显碱性,故D正确。
故选:D。
【点评】本题考查了指示剂酚酞在酸碱性溶液中的变色,利用了碱性溶液能使酚酞变红的知识.
4.小华在验证“CO2能与氢氧化钠溶液反应”时,进行了如下实验:
已知:①20℃、101KPa时,1体积H2O中最多可溶解1体积CO2;1体积酒精中最多可溶解0.3体积CO2;
②20℃,在酒精中,NaOH易溶,Na2CO3难溶;
③气压减小时,水的沸点会降低。
下列说法正确的是( )
①用两套图甲装置进行实验,在第一套装置中注入3mL浓氢氧化钠溶液;在第二套装中注入等体积的H2O,振荡试管。当观察到第一套装置中锥形瓶内水沸腾时,可证明CO2与NaOH发生了反应;
②装置乙中,将胶头滴管内的氢氧化钠溶液挤入试管后,观察的现象是:注射器活塞向右移动,试管内出现白色沉淀;
③装置乙中,若注射器中最终剩余3mL酒精,则与氢氧化钠反应的CO2的体积一定为17mL;
④若将装置乙中的氢氧化钠溶液换成等体积的水,将水挤入试管后,注射器活塞的位置不会发生改变。
A.①② B.①④ C.②③ D.①②④
【分析】①根据二氧化碳能与氢氧化钠反应和气压与水的沸点关系分析判断;
②根据二氧化碳与氢氧化钠反应生成碳酸钠和水,而碳酸钠微溶于酒精,因此会部分析出分析判断;
③根据碳酸钠在水中和酒精中的溶解信息分析判断;
④根据二氧化碳能溶于水分析判断。
【解答】解:①浓NaOH溶液溶解并与二氧化碳反应,使装置内气压变小,水的沸点降低,从而造成热水沸腾,该说法正确;
②二氧化碳与氢氧化钠反应生成碳酸钠和水,而碳酸钠微溶于酒精,向右移动酒精不会进入装置,因此不会产生白色沉淀,该说法不正确;
③二氧化碳与氢氧化钠反应生成碳酸钠和水,而碳酸钠微溶于酒精,因此会出现白色沉淀物,注射器中剩余3mL酒精,说明整套装置内CO2体积减小20ml﹣3ml=17ml,酒精溶解17×0.3mL=5.4mL,3mLNaOH溶液溶解3mL,所以与氢氧化钠反应的二氧化碳的体积小于17mL,该说法不正确;
④1体积水最多可溶解1体积CO2,那3mL水溶解了3mLCO2,减少了3mLCO2,但是进去了3mL水,所以试管中压强几乎没有变化,所以注射器活塞位置不会发生改变,该说法正确;
故选:B。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
5.下列溶液能使紫色石蕊溶液变蓝色的是( )
A.氨水 B.氯化钠溶液 C.稀醋酸 D.硫酸钾溶液
【分析】石蕊溶液遇酸性溶液变红色,遇碱性溶液变蓝色,据此结合常见溶液的酸碱性进行分析判断即可。
【解答】解:A、氨水呈碱性,能使紫色石蕊试液变蓝,故说法正确;
B、氯化钠溶液呈中性,不能使石蕊试液变色,故说法错误;
C、稀醋酸呈酸性,能使石蕊试液变红色,故说法错误;
D、硫酸钾溶液呈中性,不能使石蕊试液变色,故说法错误;
故选:A。
【点评】本题难度不大,掌握石蕊溶液的性质、常见溶液的酸碱性是正确解答本题的关键。
6.一些国家下在试用碳酸水浇灌某些植物,这样做不能起到的作用是( )
A.改良酸性土壤 B.促进植物的光合作用
C.提高作物的产量 D.改良碱性土壤
【分析】碳酸属于酸,溶液显酸性;
碳酸容易分解生成水和二氧化碳.
【解答】解:A、碳酸显酸性,不能用来改良酸性土壤;
B、碳酸分解生成的二氧化碳可以用作绿色植物光合作用的原料,从而促进植物的光合作用;
C、碳酸分解生成的二氧化碳可以用作绿色植物光合作用的原料,从而可以提高作物的产量;
D、碳酸显酸性,可以用来改良碱性土壤。
故选:A。
【点评】物质的性质决定物质的用途,根据碳酸的性质可以判断碳酸具有哪些方面的用途.
7.下列物质溶于水,能使无色酚酞试液变红的是( )
A.干冰 B.食醋 C.食盐 D.生石灰
【分析】根据已有的知识进行分析,碱性溶液能使酚酞试液变红.
【解答】解:A、干冰是固体二氧化碳,溶于水与水反应生成碳酸,呈酸性,不能使酚酞试液变红,故A错误;
B、食醋呈酸性,不能使酚酞试液变红,故B错误;
C、食盐的水溶液呈中性,不能使酚酞试液变红,故C错误;
D、生石灰与水反应生成氢氧化钙,氢氧化钙的水溶液呈碱性,能使酚酞试液变红,故D正确;
故选:D。
【点评】本题考查了常见物质水溶液的酸碱性,完成此题,可以依据已有的知识进行.
8.下列物质常用于改良酸性土壤的是( )
A.Ca(OH)2 B.NaOH C.NaCl D.CaCO3
【分析】酸性土壤一般用碱性物质来中和。选择碱性物质时还要综合考虑这种物质的性质,如不能具有很强的腐蚀性,进行分析判断。
【解答】解:A.氢氧化钙显碱性,可用于改良酸性土壤,故选项正确。
B.氢氧化钠是一种常见的碱,能中和酸性物质,但具有很强烈的腐蚀性,故选项错误。
C.氯化钠是一种常见的盐,显中性,不能改良酸性土壤,故选项错误。
D.碳酸钙不能用于改良酸性土壤,故选项错误。
故选:A。
【点评】本题难度不大,掌握中和反应应用、常见物质的酸碱性并能灵活运用是正确解答本题的关键。
9.生锈的铁钉放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图,说法正确的是( )
A.C点生成氢气的质量等于D点生成氢气的质量
B.D点反应结束
C.CD段压强变化的主要因素是反应速度减慢
D.E点温度大于A点
【分析】稀盐酸和氧化铁反应生成氯化铁和水,和铁反应生成氯化亚铁和氢气,过程中放热。
【解答】解:A、C点生成氢气的质量等于D点生成氢气的质量,是因为C点完全反应,C至D过程中温度降低,导致压强减小,该选项说法正确;
B、C点反应结束,该选项说法不正确;
C、CD段压强变化的主要因素是温度降低,该选项说法不正确;
D、E点温度等于A点,都是室温,该选项说法不正确。
故选:A。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
10.向一定量稀硫酸中加入一定量铜粉,无气泡冒出;用导管向稀硫酸中通入空气并加热,铜粉逐渐减少,溶液由无色变为蓝色.测得溶液质量与实验时间的关系如图.下列说法错误的是( )
A.ab段说明Cu不能转换出硫酸中的氢
B.从b点到c点,溶液的pH逐渐增大
C.从c点到d点,溶液中的溶质只可能有一种
D.bc段溶液中有硫酸铜生成
【分析】ab段溶液质量未发生改变,说明此时铜与稀酸未发生反应,即Cu不能转换出硫酸中的氢;
从b点到c点,溶液质量增大,说明铜和氧气、稀硫酸发生了反应,稀硫酸被消耗,酸性减弱,pH增大;
从c点到d点,溶液质量不再发生改变,反应已完全,此时溶液中的溶质一定有硫酸铜,可能存在未反应完全的稀硫酸;
bc段发生的反应为铜、硫酸、氧气反应生成硫酸铜和水.
【解答】解:A、因为ab段溶液质量不变,说明Cu不能转换出硫酸中的氢,该选项说法正确;
B、从b点到c点,溶液质量增大,说明在加热条件下,铜、氧气、稀硫酸发生了反应,稀硫酸被消耗,随着稀硫酸的减少,酸性减弱,PH增大,该选项说法正确;
C、从c点到d点,如果硫酸恰好完全反应,则溶液中的溶质是硫酸铜,如果稀硫酸过量,则溶液中的溶质是硫酸铜和硫酸,该选项说法错误;
D、铜、氧气、硫酸在加热条件下反应的化学方程式为:2Cu+2H2SO4+O22CuSO4+2H2O,该选项说法正确。
故选:C。
【点评】铜排在氢的后面,不能和稀硫酸反应置换反应,但是在一定条件下,铜能和稀硫酸反应,要注意理解.
11.滴有酚酞的石灰水与适量的下列物质恰好完全反应后,酚酞仍显红色的是( )
A.稀硫酸 B.氢氧化钠溶液
C.硫酸铜溶液 D.碳酸钾溶液
【分析】A、氢氧化钙和稀硫酸反应生成硫酸钙和水;
B、氢氧化钠和不能和氢氧化钙反应;
C、硫酸铜和氢氧化钙反应生成硫酸钙和氢氧化铜沉淀;
D、碳酸钾和氢氧化钙反应生成碳酸钙沉淀和氢氧化钾。
【解答】解:A、氢氧化钙和稀硫酸反应生成硫酸钙和水,反应后溶液是无色溶液,该选项不符合题意;
B、氢氧化钠和不能和氢氧化钙反应,该选项不符合题意;
C、硫酸铜和氢氧化钙反应生成硫酸钙和氢氧化铜沉淀,反应后溶液是无色溶液,该选项不符合题意;
D、碳酸钾和氢氧化钙反应生成碳酸钙沉淀和氢氧化钾,氢氧化钾溶液显碱性,能使酚酞试液变红色,因此反应后溶液仍然是红色,该选项符合题意。
故选:D。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
12.生活中一些物质的pH如下:
物质 白醋 橙子汁 牛奶 厨房油污清洗剂
pH 2~3 3~4 6~7 12~13
其中能使无色酚酞溶液变红的是( )
A.牛奶 B.厨房油污清洗剂
C.白醋 D.橙子汁
【分析】根据已有的知识进行分析,酸性溶液的pH小于7,能使石蕊试液变红,不能使酚酞试液变色;碱性溶液的pH大于7,呈碱性,能使石蕊试液变蓝,能使酚酞试液变红;中性溶液的pH等于7,不能使指示剂变色。
【解答】解:A.牛奶的pH6~7,偏酸性,不能使无色酚酞试液变色,不合题意;
B.厨房油污清洗剂的pH>7,显碱性,能使无色酚酞试液变红色,符合题意;
C.白醋的pH<7,显酸性,不能使无色酚酞试液变色,不合题意;
D.橘子汁的pH<7,显酸性,不能使无色酚酞试液变色,不合题意。
故选:B。
【点评】本题考查了溶液的酸碱性与pH的关系,完成此题,可以依据已有的知识进行。
13.“化学棋”游戏规则:
①每粒棋子代表一种物质;
②吃子:所选棋子能与棋盘(如图)中的某棋子发生反应,则棋盘中的该棋子被吃掉;
③连吃:前一次反应的生成物能与另一棋子发生反应时,则该棋子也被吃掉。
若一次就可连续吃掉棋盘上的所有棋子,应选择的棋子是( )
A. B. C. D.
【分析】根据题意,吃子:所选棋子能与棋盘中的某棋子发生反应,则棋盘中的该棋子被吃掉;连吃:前一次反应的生成物能与另一棋子发生反应时,则该棋子也被吃掉,据此结合所涉及的物质进行分析判断。
【解答】解:A、镁能与稀硫酸反应生成硫酸镁和氢气,硫酸镁能与氢氧化钠溶液反应生成氢氧化镁沉淀和硫酸钠,氢氧化镁、硫酸钠均不能与铜反应,故选项错误。
B、铜能与氧气在加热条件反应生成氧化铜,氧化铜能与硫酸反应生成硫酸铜和水,硫酸铜能与氢氧化钠溶液反应生成氢氧化铜沉淀和硫酸钠,故选项正确。
C、氢氧化钙能与硫酸反应生成硫酸钙和水,硫酸钙、水与氢氧化钠、铜均不反应,故选项错误。
D、氯化钠与铜、氢氧化钠、硫酸均不反应,故选项错误。
故选:B。
【点评】本题难度不大,明确吃子、连吃的含义,熟练掌握酸碱盐的化学性质是正确解答本题的关键。
二.填空题(共4小题)
14.对知识的归纳和总结是学好科学的重要方法.在学习了碱的性质后,小红同学总结了氢氧化钙的四条化学性质(如图),即氢氧化钙与图中四类物质能够发生化学反应。
(1)为了验证氢氧化钙与酸碱指示剂反应,小红将无色酚酞试液滴入氢氧化钙溶液中,溶液由无色变成 红 色。
(2)如图中是 某些非金属氧化物 。
(3)利用氢氧化钙与盐反应的性质,可以除去氢氧化钠溶液中少量的氢氧化钙杂质,请写出该化学反应的方程式 Na2CO3+Ca(OH)2═CaCO3↓+2NaOH 。
【分析】氢氧化钙溶液显碱性,能使酚酞试液变红色;
氢氧化钙能和某些非金属氧化物反应,例如氢氧化钙能和二氧化碳反应生成碳酸钙和水;
碳酸钠能和氢氧化钙反应生成白色沉淀碳酸钙和氢氧化钠.
【解答】解:(1)为了验证氢氧化钙与酸碱指示剂反应,小红将无色酚酞试液滴入氢氧化钙溶液中,溶液由无色变成红色.
故填:红.
(2)如图中是某些非金属氧化物.
故填:某些非金属氧化物.
(3)利用氢氧化钙与盐反应的性质,可以除去氢氧化钠溶液中少量的氢氧化钙杂质,因为氢氧化钙能和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
故填:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
【点评】本题主要考查物质的性质,只有掌握了各种物质的性质,才能够判断物质之间相互转化时的反应物和生成物,从而可以进行各方面的判断.
15.清华学子梁琰通过拍摄短片描述化学反应之美!如图是稀盐酸参与的化学反应,“→”表示转化关系,请回答:
(1)图中盐酸与 硝酸银溶液 的反应不属于酸的通性。
(2)若物质X的类别与Fe、Fe2O3、AgNO3均不同,则X的化学式是 Cu(OH)2 。
(3)稀盐酸与AgNO3溶液发生复分解反应的化学方程式为 HCl+AgNO3═HNO3+AgCl↓ 。
【分析】根据酸的化学性质(能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应),进行分析解答。
【解答】解:(1)图中盐酸与硝酸银溶液的反应不属于酸的通性,如硝酸不能与硝酸银溶液反应。
(2)若物质X的类别与Fe、Fe2O3、AgNO3均不同,由酸的化学性质,X应为碱,生成蓝色溶液,说明生成了铜盐的水溶液,则X为氢氧化铜,其化学式为Cu(OH)2。
(3)稀盐酸与AgNO3溶液反应生成氯化银沉淀和硝酸,反应的化学方程式为HCl+AgNO3═HNO3+AgCl↓。
故答案为:
(1)硝酸银溶液;
(2)Cu(OH)2;
(3)HCl+AgNO3═HNO3+AgCl↓。
【点评】本题难度不大,掌握酸的化学性质(能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应)并能灵活运用是正确解答本题的关键。
16.归纳总结是学习化学的一种方法.请结合小明同学对酸碱的化学性质的归纳图完成下列问题.
(1)酸有相似的化学性质,是因为酸中都含有 H+ (填符号);
(2)图中(4)横线上应填物质类别的名称是 盐 ;
(3)图中②的性质可用于 金属表面除锈 ;
(4)为什么盐酸与氯化钡不反应,而硫酸能与氯化钡反应生成白色沉淀 硫酸和盐酸中的酸根离子不同 .
【分析】根据酸的化学性质(能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应)、碱的化学性质(能与酸碱指示剂、非金属氧化物、酸、盐等反应),据此进行分析解答。
【解答】解:(1)酸有相似的化学性质,是因为酸中都含有氢离子,其离子符号为H+。
(2)酸能与盐反应生成新盐和新酸,碱能与盐反应生成新碱和新盐,图中(4)横线上应填物质类别的名称是盐。
(3)图中②的性质是酸与金属氧化物反应生成盐和水,图中②的性质可用于金属表面除锈。
(4)盐酸与氯化钡不反应,而硫酸能与氯化钡反应生成白色沉淀,是因为硫酸和盐酸中的酸根离子不同。
故答案为:
(1)H+;
(2)盐;
(3)金属表面除锈;
(4)硫酸和盐酸中的酸根离子不同。
【点评】本题难度不大,掌握碱的化学性质(能与酸碱指示剂、非金属氧化物、酸、盐等反应)、酸的化学性质(能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应)并能灵活运用是正确解答本题的关键。
17.综合复习时,同学们又来到化学实验室进行实验,加强对酸的化学性质的整体认识。他们将适量的稀盐酸分别滴加到六支试管中进行实验(如图所示),请回答下列问题:
(1)上述六支试管中有气泡产生的是 BD (填序号),相关反应的化学方程式为 Mg+2HCl═MgCl2+H2↑或NaHCO3+HCl=NaCl+H2O+CO2↑ (只写出一个)。
(2)能证明“C试管中发生了化学反应”的现象是 溶液由红色变为无色 。
(3)有一支试管中的物质不与稀盐酸反应,原因是 在金属活动性顺序中,铜位于氢的后面,不与稀盐酸反应 。
【分析】根据酸的化学性质(能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应),据此进行分析解答。
【解答】解:(1)酸能与活泼金属反应生成氢气,镁能与稀盐酸反应生成氯化镁和氢气,稀盐酸与碳酸氢钠溶液反应生成氯化钠、水和二氧化碳气体,上述六支试管中有气泡产生的是BD;反应的化学方程式分别是Mg+2HCl═MgCl2+H2↑、NaHCO3+HCl=NaCl+H2O+CO2↑。
(2)滴有酚酞溶液的石灰水显红色,无色酚酞溶液遇酸性溶液不变色,遇碱性溶液变红,逐滴滴入稀盐酸,至恰好完全反应,溶液显中性,溶液由红色变为无色,证明盐酸和氢氧化钙发生了化学反应。
(3)有一支试管中的物质不与稀盐酸反应,该物质是铜,在金属活动性顺序中,铜位于氢的后面,不与稀盐酸反应。
故答案为:
(1)BD;Mg+2HCl═MgCl2+H2↑或NaHCO3+HCl=NaCl+H2O+CO2↑;
(2)溶液由红色变为无色;
(3)在金属活动性顺序中,铜位于氢的后面,不与稀盐酸反应。
【点评】本题难度不大,掌握酸的化学性质(能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应)并能灵活运用是正确解答本题的关键。
三.解答题(共3小题)
18.科学使用化学物质,可以保障人体健康。某同学的部分体液的pH如图所示。
(1)图中碱性最强的体液是 胰液 。
(2)该同学胃酸(主要成分是盐酸)过多,可服用胃舒平【主要成分是Al(OH)3】治疗,其原理是 Al(OH)3+3HCl═AlCl3+3H2O (用化学方程式表示),其基本反应类型属于 复分解反应 。
【分析】(1)溶液碱性越强,pH越高。
(2)稀盐酸和氢氧化铝反应生成氯化铝和水。
【解答】解:(1)溶液碱性越强,pH越高,图中碱性最强的体液是胰液。
故填:胰液。
(2)稀盐酸和氢氧化铝反应生成氯化铝和水,反应的化学方程式:Al(OH)3+3HCl═AlCl3+3H2O,是复分解反应。
故填:Al(OH)3+3HCl═AlCl3+3H2O;复分解反应。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
19.调味剂的主要作用是补充、增强或增加食品的味道。食醋是一种能增强食品酸味的调味剂,主要成分为醋酸(CH3COOH),与我们的生活密切相连。根据所学知识回答:
(1)食醋能作酸味的调味剂,是因为醋酸在水溶液中能解离出CH3COO﹣和 H+ (填离子符号)。
(2)食醋的酸味能促进人胃酸的分泌,胃酸的成分是 HCl (填化学式)。
(3)食醋能软化鱼骨和鸡蛋壳,原因是醋酸能与 CaCO3 (填化学式)反应。
(4)生活中常用酒来制取食醋,原理是酒中的酒精CH3CH2OH在酶的作用下与空气中O2反应得到醋酸和水,请你尝试写出该反应的化学方程式 CH3CH2OH+O2CH3COOH+H2O 。
(5)用铁锅炒菜时,放一点食醋能补铁的原因是 将铁转为Fe2+ 。
【分析】(1)依据醋酸(CH3COOH)为酸分析;
(2)依据胃酸的成分为盐酸分析;
(3)依据鱼骨和鸡蛋壳主要成分分析;
(4)依据题中信息写出反应方程式;
(5)依据醋酸(CH3COOH)与铁的反应原理分析。
【解答】解:(1)醋酸(CH3COOH)为酸,则电离出的阳离子为H+,故填:H+;
(2)胃酸的成分为盐酸,则化学式为HCl,故填:HCl;
(3)鱼骨和鸡蛋壳主要成分为CaCO3,醋酸能与碳酸钙反应生成能溶于水的醋酸钙、水和二氧化碳,故填:CaCO3;
(4)酒精(CH3CH2OH)在酶的作用下与空气中O2反应得到醋酸和水,则反应方程式CH3CH2OH+O2CH3COOH+H2O,故填:CH3CH2OH+O2CH3COOH+H2O;
(5)醋酸(CH3COOH)与铁反应,生成醋酸亚铁和氢气,则用铁锅炒菜时,放一点食醋能补铁的原因是将铁转为Fe2+,故填:将铁转为Fe2+。
【点评】此题主要考查常见物质的性质,主要利用物质的性质来分析和解决有关问题,结合各方面的条件得出正确结论。
20.学了酸的化学性质,某同学以稀硫酸为主题,绘制了“多彩酸世界”思维导图。
(1)若用Cu(OH)2实现②,会得到 蓝 色溶液。
(2)若想实现③,得到浅绿色溶液,可选用的单质是 铁 。
(3)若选用BaCl2溶液实现⑤,此反应的化学方程式为 BaCl2+H2SO4═BaSO4↓+2HCl 。
【分析】根据酸的化学性质(能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应),据此进行分析解答。
【解答】解:(1)氢氧化铜能与稀硫酸反应生成硫酸铜和水,会得到蓝色溶液。
(2)若想实现③,得到浅绿色溶液,铁能与稀硫酸反应生成硫酸亚铁溶液和氢气,则可选用的单质是铁。
(3)若选用BaCl2溶液实现⑤,氯化钡能与稀硫酸反应生成硫酸钡沉淀和盐酸,反应的化学方程式为BaCl2+H2SO4═BaSO4↓+2HCl。
故答案为:
(1)蓝;
(2)铁;
(3)BaCl2+H2SO4═BaSO4↓+2HCl。
【点评】本题难度不大,掌握酸的化学性质(能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应)并能灵活运用是正确解答本题的关键。
第1页(共1页)
