人教版九年级化学下册 9.3 溶液的浓度课件(共45张PPT)
文档属性
| 名称 | 人教版九年级化学下册 9.3 溶液的浓度课件(共45张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-27 15:48:13 | ||
图片预览







文档简介
(共45张PPT)
课题3 溶液的浓度
相关知识复习
一种或几种物质分散到另一种物质里,形成均一、稳定的混合物。
混合物、
均一性、
稳定性。
溶质:被溶解的物质;
溶剂:溶解其他物质的物质。
溶液的质量=溶质的质量+溶剂的质量
注:概念中溶质的质量是溶解在溶液中的质量,
不包括未溶解的溶质的质量。
溶液定义
溶液特征
溶液的组成
1.掌握一种溶液组成的表示方法——溶质的质量分数。
2.并能进行溶质质量分数的简单计算。
3.掌握溶液稀释的方法和计算
4.掌握有关化学反应方程式与溶质质量分数相结合的计算
5.提升科学素养,形成乐于学习、乐于探索的精神。
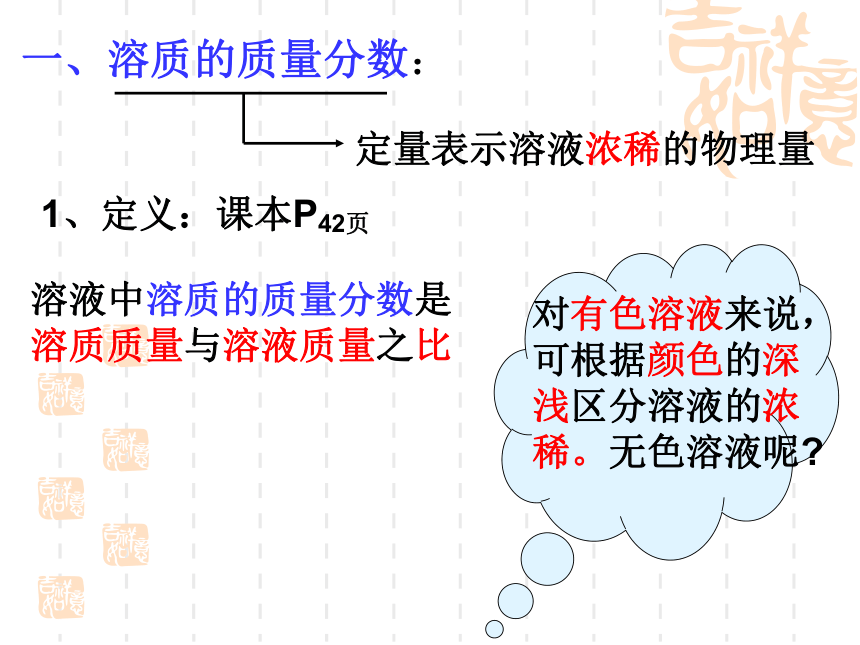
一、溶质的质量分数:
1、定义:课本P42页
定量表示溶液浓稀的物理量
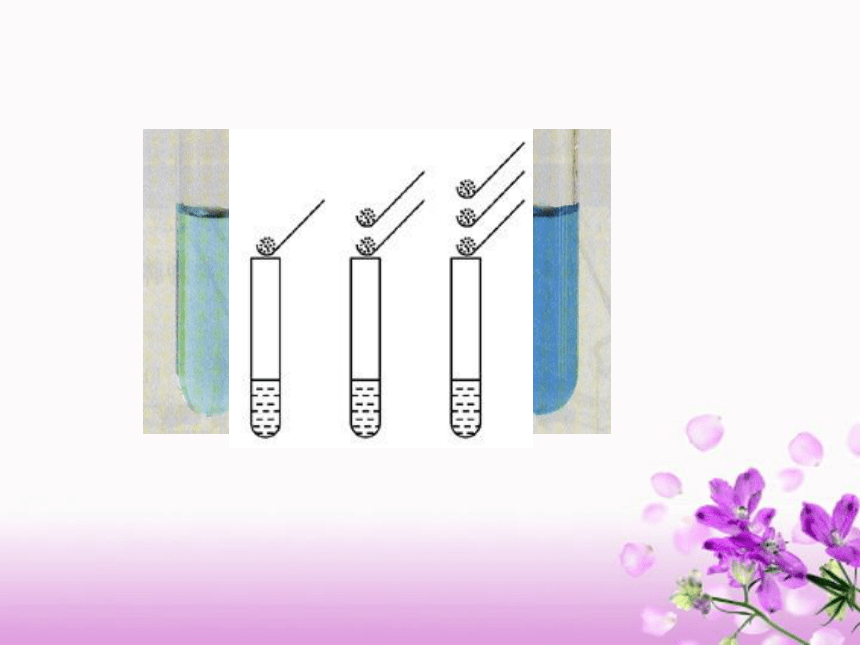
对有色溶液来说,可根据颜色的深浅区分溶液的浓稀。无色溶液呢
溶液中溶质的质量分数是溶质质量与溶液质量之比
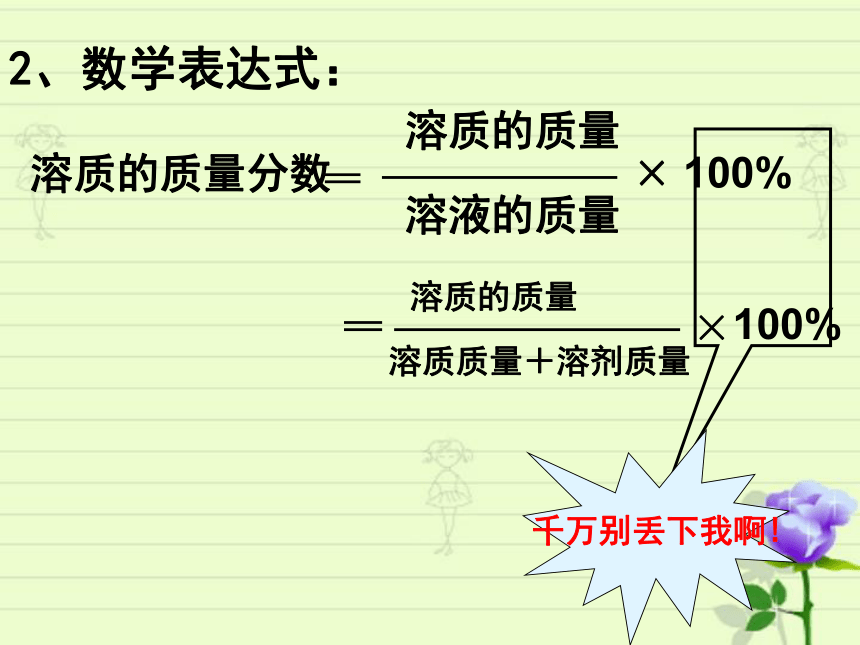
2、数学表达式:
溶质的质量
溶液的质量
×
100%
溶质的质量
溶质质量+溶剂质量
×
100%
溶质的质量分数
千万别丢下我啊!
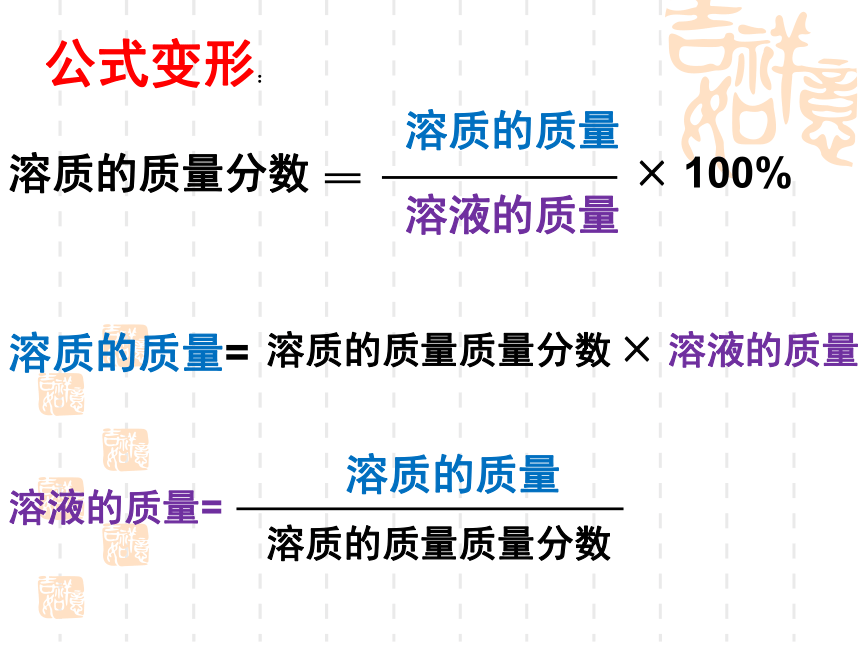
公式变形:
溶质的质量=
溶质的质量质量分数
溶质的质量分数
溶质的质量
溶液的质量
×
100%
×
溶液的质量
溶液的质量=
溶质的质量
溶质的质量质量分数
强调使用该公式时的注意事项
注意:溶质的质量分数是一个百分数
3、计算时上、下单位要统一(质量单位)
1、溶质的质量是指被溶解的那部分溶质,未溶解的溶质不应考虑。(计算饱和溶液溶质质量时要考虑溶解度)
4、饱和溶液的溶质质量分数=
2、溶液的质量包括溶液中所有溶质的质量。
溶解度
100g+溶解度
×100%
10g
10g+90g
×100%
20g
20g+80g
×100%
=10%
=20%
溶质质量分数=
溶质质量分数=
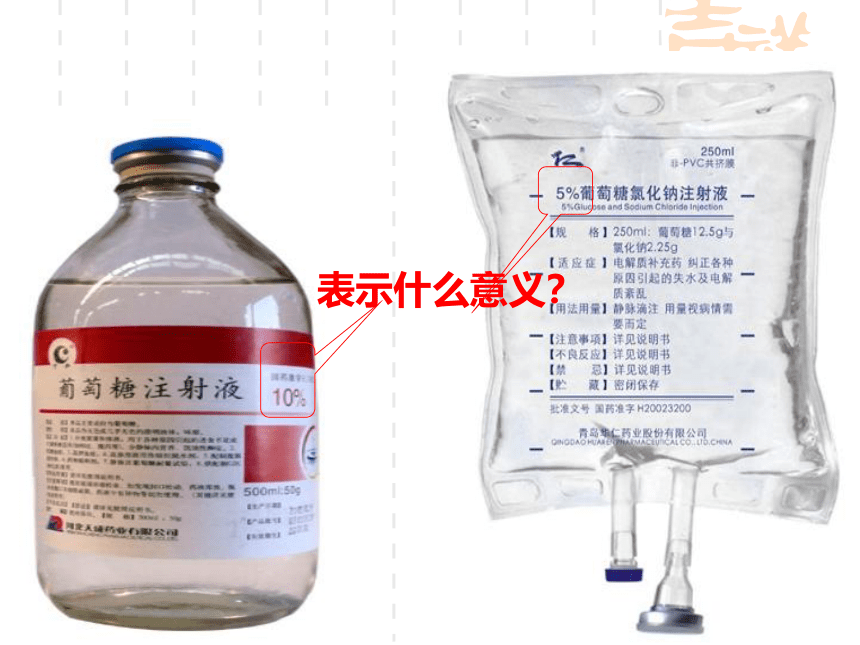
表示什么意义?
3、含义:
练习:如20%的NaCl溶液
每100克NaCl溶液中含有溶质NaCl质量20克
氯化钠溶液的质量分数为16%
意义:每100克的氯化钠溶液中含16克的氯化钠。
溶质的质量分数
溶质的质量
溶液的质量
×
100%
16g
16%=
100g
×
100%
二、有关溶质质量分数的计算
1.简单计算:
例1:蒸干15g NaCI溶液得到1.2g NaCl,计 算原溶液中氯化钠的质量分数。
解:
答:原溶液中氯化钠的质量分数为8%。
算一算:
溶质质量/g 溶剂质量/g 溶液质量/g 溶质的
质量分数
10 200
96 100
150 10%
50 100
190
5%
4%
15
135
150
33.3%
4
M溶液=m溶质+m溶剂 m溶质= m溶液×溶质的质量分数
例2、20g 10%的盐水中放入 2g水或2g食盐,求:所得溶液的溶质质量分数。
例3、20g 10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。
剩余溶液的溶质质量分数不变,仍是 10 %
解:
20g X10%
加水:
20g +2g
=9.1%
加盐:
20g X10%+2g
20g +2g
=18.2%
溶质质量分数=
溶质质量分数=
练习1 将10%的NaCI 溶液150克,再加水
15克,此时溶液溶质的质量分数为多少?
解:
溶质的质量分数=
150g× 10%
150g ﹢15g
≈ 9.1%
答:此时溶液中溶质的质量分数为9.1%。
练习2 将10%的NaCI 溶液150克,再加NaCI15克,无固体剩余,此时溶液溶质的质量分数为多少?
溶质的质量分数=
150g× 10% ﹢15g
=
150g ﹢15g
解:
答:此时溶液中溶质的质量分数为18.2%。
≈18.2%
练习3 将10%的NaCI 溶液150克,再加10%的NaCI溶液15克,此时溶液溶质的质量分数为多少?
解:
浓度相同,溶质的质量分数不变。
练习4 将10%的NaCI 溶液150克,再加20%的NaCI溶液15克,此时溶液溶质的质量分数为多少?
解:
溶质的质量分数=
150g×10%﹢15g×20%
150g ﹢15g
答:此时溶液中溶质的质量分数为10.9 %。
≈10.9%
例4:已知20℃时,硝酸钾的溶解度是31.6g,
求20℃时硝酸钾饱和溶液中溶质的质量
分数。
解:
溶质:31.6g;
解析:
溶剂:100g;
饱和溶液:131.6g
解二:因为200C时,NaCl的溶解度是36克。所以50克水最多溶解18克NaCl
解:
×100% ≈ 26.5%
36g
100g+36g
溶质质量分数=
答:溶液的溶质质量分数为26.5%
例5、200C时,NaCl的溶解度是36克。现有50克水放入20克NaCl,求:所得溶液的溶质质量分数
溶质质量分数=
18g
50g+18g
×100% ≈ 26.5%
练习6:在农业生产上,常用16%的NaCl溶液来选种,现要配制150㎏这种溶液需要NaCl和水各多少㎏? (水多少升? ρ水=1kg/L)
解:
溶质的质量=溶液质量×溶质的质量分数
=150kg ×16%
=24kg
溶剂的质量=溶液质量-溶质质量
=150kg -24kg
=126kg
V水=m水÷ρ水=126kg ÷ 1kg/L =126L
练习7.将20gNaCI溶解多少克水中,就可配制成25℅的NaCI溶液,所得溶液为多少克?
解:
溶液质量=溶质的质量÷溶质的质量分数
=20g ÷ 25%
=80g
溶剂的质量=溶液质量-溶质质量
=80g -20g
=60g
2.溶质的质量分数与浓稀关系:
溶质质量分数越大,溶液越浓;
溶质的质量分数越小,溶液越稀 。
例1:把100g98%的浓H2SO4稀释成20%的稀H2SO4,需加水多少克?
解析:
设需加水的质量为x
加水质量x
100g×98%
(100g+X)×20%
=
X=390 g
答:需加水390克。
解:
100g
98%
20%
100g+X
二、有关溶液的稀释计算
原理:稀释前后溶质的质量不变
例2:配制 20%的稀H2SO4溶液100克,需要98%的浓H2SO4多少克?
解析:
X
98%
20%
100g
X· 98%
100g× 20%
=
X ≈ 20.4g
解:
设需浓硫酸H2SO4 的质量为x
加水
答:需要98%的浓H2SO4 20.4g
强化练习
1、有100g10%的食盐溶液,要使其质量分数变为5%,需加水多少克?
加水质量X
100g
10%
5%
解析:
100g+X
=
结论1:溶质质量分数减少一半,溶液质量增大一倍;
200g
增加(水)溶剂的质量等于原溶液的质量
心算、50g16%的NaCl溶液稀释成8%的NaCl溶液需加水多少g?
加水溶质质量不变.分子不变,分母增大一倍比值缩小一半.
因此加水50g.
蒸发水质量X
50g
10%
20%
解析:
50g-X
25g
2、50g10%的NaCl溶液变成20%的NaCl溶液采取蒸发水分的方法,要蒸发多少克水.
50g × 10% =
(50g-X) × 20%
X = 25g
结论:要使溶质的质量分数增大一倍,溶液质量减少一半, 蒸发水分质量为原溶液质量的一半.
已知溶液的体积进行有关溶质质量分数的计算时,应先将溶液的体积换算成溶液的质量。
换算公式: ,
单位要统一。
不同浓度溶液的体积____相加。
不能
m=ρ×V
例3:配制20%的稀H2SO4溶液100克,需要98%的浓H2SO4多少毫升(浓H2SO4密度=1.84g∕ml )
解析:
98%
20%
Xml
1.84g∕ml
100g
解:设需浓硫酸H2SO4 的体积为x
=
X ≈ 11.1ml
/
%
×98
×
ml
g
1.84
X
答:需要98%的浓H2SO4 11.1ml
ΡV=1.84g∕ml.X
解析:
X
200ml
98%
20%
加水
1.84g∕ml
1.14g∕ml
解:设需浓硫酸H2SO4 的体积为x
强化练习3:配制200ml密度为1.14g∕ml的20%的稀H2SO4 ,需要密度为1.84g∕ml的98%的浓H2SO4多少毫升?(需要加水的体积多少)
=
X× 1.84g∕ml ×98%
200ml× 1.14g∕ml ×20%
X ≈25.3ml
强调:体积不能相加减
V水=
m水
ρ水
=
200ml× 1.14g∕ml-25.3ml × 1.84g∕ml
1g∕ml
≈ 181.4ml
强化练习4.用98%的浓H2SO4(ρ=1.84g/ml)100ml
可配制成多少毫升20%的稀H2SO4 (ρ=1.14g/ml),需要加水多少ml
解:
100ml×1.84g/ml×98%=x ×1.14g/ml×20%
X ≈ 790.9ml
可配成20%的稀硫酸的体积为X
V水=
m水
ρ水
=
790.9ml ×1.14g/ml -100ml×1.84g/ml
1g∕ml
≈ 717.6ml
例5.把200g20%的NaOH溶液变成40%的NaOH 溶液应采取什么方法?
解:
方法二.加NaOH
设需加入NaOH的质量为X
方法一:.蒸发水份100g.
溶质的质量分数=
200g×20%+X
200g+X
X100%=40%
X≈66.7g
方法三.加大于40%的浓溶液
例5.把200g20%的NaOH溶液变成40%的NaOH 溶液应采取什么方法?
解:
方法一.加NaOH
设需加入NaOH的质量为X
方法二:.蒸发水份.
设需蒸发掉水的质量为y
溶质的质量分数=
200g×20%+X
200g+X
X100%=40%
X≈66.7g
溶质的质量分数=
200g×20%
200g-y
X100%=40%
y=100g
三.溶质的质量分数在化学方程式计算中的应用:
强调:代入化学方程式中的量
(1)质量 (2)纯量(3) 溶液必须是溶质的质量。
例1:100g49%的稀硫酸恰好与多少克锌完全反应,同时产生氢气多少克
解:
设锌的质量为X,同时产生氢气的质量为y。
Zn + H2SO4 = ZnSO4 + H2↑
65
98
2
100g×49%
X
y
X=
65× 100g×49%
98
=
32.5g
Y=
2× 100g×49%
98
1g
=
65
X
=
98
100g×49%
100g×49%
98
=
2
y
例2:100g稀硫酸恰好跟6.5g锌完全反应,求稀硫酸中溶质的质量分数?求反应后所得溶液的质量分数?
解:设稀硫酸的溶质质量为X.
Zn + H2SO4 = ZnSO4 + H2↑
65
98
X
6.5g
X=
65
98 ×6.5g
9.8g
=
稀硫酸的溶质的质量分数=
9.8g
100g
×100%
=9.8%
65
6.5g
=
98
X
例2:100g稀硫酸恰好跟6.5g锌完全反应,求稀硫酸中溶质的质量分数?求反应后所得溶液的质量分数?
解:设稀硫酸的溶质质量分数为X.
Zn + H2SO4 = ZnSO4 + H2↑
65
98
161
y
100g×X
6.5g
z
2
X=
y=
=16.1g
100g×65
98 ×6.5g
9.8%
=
161 ×6.5g
65
z=
65
2 ×6.5g
=0.2g
反应后所得溶液的质量分数=
16.1g
100g(1-9.8%)+16.1g
×100%
≈15.1%
生成硫酸锌质量y.
同时放出氢气质量为z.
方法一:
方法二:
反应后所得溶液的质量分数=
16.1g
100g+6.5g-0.2g
×100%
≈15.1%
65
6.5g
=
98
100g×X
65
6.5g
=
161
y
65
6.5g
=
2
z
2. 现有碳酸钙15g与200g的稀盐酸完全反应,求稀盐酸中溶质的质量分数 求反应完全后所得溶液的质量分数
解:设稀盐酸的溶质质量为X.
CaCO3 + 2HCl = CaCl2 + H2O+CO2↑
100
73
15g
X
X=
73 ×15g
100
10.95g
=
稀盐酸的溶质的质量分数=
10.95g
200g
×100%
=5.475%
100
15g
=
73
X
例3:6.5克的锌粒放入100克稀盐酸
中恰好完全反应;
求:①产生氢气的质量;
②稀盐酸溶质的质量分数;
③求反应后溶液的溶质质量分数
解:设产生氢气的质量为X
Zn + 2HCl == ZnCl2 + H2 ↑
稀盐酸中溶质的质量分数为Y
反应后溶液溶质的质量为Z
100g×Y
Z
73
136
6.5g
X
65
2
65
6.5g
=
73
100g×Y
65
6.5g
6.5g
65
=
=
2
X
136
Z
解析:
100g
稀盐酸
6.5gZn
0.2gH2
反应后所得溶液溶质的质量分数
= ×100%
13.6
100g+6.5g-0.2g
≈12.8%
练习:
1.实验室用13g锌与多少克纯硫酸完全反应 如果这种硫酸溶液200g,求硫酸溶液溶质的质量分数
2. 现有碳酸钙15g与200g的稀盐酸完全反应,求稀盐酸中溶质的质量分数 求反应完全后所得溶液的质量分数
3.将20克NaCI溶解多少克水中,就可配制成25℅的NaCI溶液,所得溶液为多少克?
4、50g16%的NaCl溶液变成20%的NaCl溶液有哪些方法 并计算说明.
5.用98%的浓H2SO4(ρ=1.84g/ml)配制成100ml20%的稀H2SO4(ρ=1.14g/ml)需98%的浓H2SO4多少ml
6、实验室用98%(ρ=1.84g/ml)的浓硫酸与水混合,配制1:5的稀硫酸,求所得溶液溶质的质量分数?
8、50℅的某溶液与10℅某溶液混合,得25℅的混合液,求两溶液的质量比。
7、欲将50克90℅的硫酸溶液稀释成10℅的硫酸溶液,应加水多少克,所得溶液为多少克?
9、某硫酸溶液100克与13克锌完全反应,求这种硫酸溶液及所得溶液溶质的质量分数?
课题3 溶液的浓度
相关知识复习
一种或几种物质分散到另一种物质里,形成均一、稳定的混合物。
混合物、
均一性、
稳定性。
溶质:被溶解的物质;
溶剂:溶解其他物质的物质。
溶液的质量=溶质的质量+溶剂的质量
注:概念中溶质的质量是溶解在溶液中的质量,
不包括未溶解的溶质的质量。
溶液定义
溶液特征
溶液的组成
1.掌握一种溶液组成的表示方法——溶质的质量分数。
2.并能进行溶质质量分数的简单计算。
3.掌握溶液稀释的方法和计算
4.掌握有关化学反应方程式与溶质质量分数相结合的计算
5.提升科学素养,形成乐于学习、乐于探索的精神。
一、溶质的质量分数:
1、定义:课本P42页
定量表示溶液浓稀的物理量
对有色溶液来说,可根据颜色的深浅区分溶液的浓稀。无色溶液呢
溶液中溶质的质量分数是溶质质量与溶液质量之比
2、数学表达式:
溶质的质量
溶液的质量
×
100%
溶质的质量
溶质质量+溶剂质量
×
100%
溶质的质量分数
千万别丢下我啊!
公式变形:
溶质的质量=
溶质的质量质量分数
溶质的质量分数
溶质的质量
溶液的质量
×
100%
×
溶液的质量
溶液的质量=
溶质的质量
溶质的质量质量分数
强调使用该公式时的注意事项
注意:溶质的质量分数是一个百分数
3、计算时上、下单位要统一(质量单位)
1、溶质的质量是指被溶解的那部分溶质,未溶解的溶质不应考虑。(计算饱和溶液溶质质量时要考虑溶解度)
4、饱和溶液的溶质质量分数=
2、溶液的质量包括溶液中所有溶质的质量。
溶解度
100g+溶解度
×100%
10g
10g+90g
×100%
20g
20g+80g
×100%
=10%
=20%
溶质质量分数=
溶质质量分数=
表示什么意义?
3、含义:
练习:如20%的NaCl溶液
每100克NaCl溶液中含有溶质NaCl质量20克
氯化钠溶液的质量分数为16%
意义:每100克的氯化钠溶液中含16克的氯化钠。
溶质的质量分数
溶质的质量
溶液的质量
×
100%
16g
16%=
100g
×
100%
二、有关溶质质量分数的计算
1.简单计算:
例1:蒸干15g NaCI溶液得到1.2g NaCl,计 算原溶液中氯化钠的质量分数。
解:
答:原溶液中氯化钠的质量分数为8%。
算一算:
溶质质量/g 溶剂质量/g 溶液质量/g 溶质的
质量分数
10 200
96 100
150 10%
50 100
190
5%
4%
15
135
150
33.3%
4
M溶液=m溶质+m溶剂 m溶质= m溶液×溶质的质量分数
例2、20g 10%的盐水中放入 2g水或2g食盐,求:所得溶液的溶质质量分数。
例3、20g 10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。
剩余溶液的溶质质量分数不变,仍是 10 %
解:
20g X10%
加水:
20g +2g
=9.1%
加盐:
20g X10%+2g
20g +2g
=18.2%
溶质质量分数=
溶质质量分数=
练习1 将10%的NaCI 溶液150克,再加水
15克,此时溶液溶质的质量分数为多少?
解:
溶质的质量分数=
150g× 10%
150g ﹢15g
≈ 9.1%
答:此时溶液中溶质的质量分数为9.1%。
练习2 将10%的NaCI 溶液150克,再加NaCI15克,无固体剩余,此时溶液溶质的质量分数为多少?
溶质的质量分数=
150g× 10% ﹢15g
=
150g ﹢15g
解:
答:此时溶液中溶质的质量分数为18.2%。
≈18.2%
练习3 将10%的NaCI 溶液150克,再加10%的NaCI溶液15克,此时溶液溶质的质量分数为多少?
解:
浓度相同,溶质的质量分数不变。
练习4 将10%的NaCI 溶液150克,再加20%的NaCI溶液15克,此时溶液溶质的质量分数为多少?
解:
溶质的质量分数=
150g×10%﹢15g×20%
150g ﹢15g
答:此时溶液中溶质的质量分数为10.9 %。
≈10.9%
例4:已知20℃时,硝酸钾的溶解度是31.6g,
求20℃时硝酸钾饱和溶液中溶质的质量
分数。
解:
溶质:31.6g;
解析:
溶剂:100g;
饱和溶液:131.6g
解二:因为200C时,NaCl的溶解度是36克。所以50克水最多溶解18克NaCl
解:
×100% ≈ 26.5%
36g
100g+36g
溶质质量分数=
答:溶液的溶质质量分数为26.5%
例5、200C时,NaCl的溶解度是36克。现有50克水放入20克NaCl,求:所得溶液的溶质质量分数
溶质质量分数=
18g
50g+18g
×100% ≈ 26.5%
练习6:在农业生产上,常用16%的NaCl溶液来选种,现要配制150㎏这种溶液需要NaCl和水各多少㎏? (水多少升? ρ水=1kg/L)
解:
溶质的质量=溶液质量×溶质的质量分数
=150kg ×16%
=24kg
溶剂的质量=溶液质量-溶质质量
=150kg -24kg
=126kg
V水=m水÷ρ水=126kg ÷ 1kg/L =126L
练习7.将20gNaCI溶解多少克水中,就可配制成25℅的NaCI溶液,所得溶液为多少克?
解:
溶液质量=溶质的质量÷溶质的质量分数
=20g ÷ 25%
=80g
溶剂的质量=溶液质量-溶质质量
=80g -20g
=60g
2.溶质的质量分数与浓稀关系:
溶质质量分数越大,溶液越浓;
溶质的质量分数越小,溶液越稀 。
例1:把100g98%的浓H2SO4稀释成20%的稀H2SO4,需加水多少克?
解析:
设需加水的质量为x
加水质量x
100g×98%
(100g+X)×20%
=
X=390 g
答:需加水390克。
解:
100g
98%
20%
100g+X
二、有关溶液的稀释计算
原理:稀释前后溶质的质量不变
例2:配制 20%的稀H2SO4溶液100克,需要98%的浓H2SO4多少克?
解析:
X
98%
20%
100g
X· 98%
100g× 20%
=
X ≈ 20.4g
解:
设需浓硫酸H2SO4 的质量为x
加水
答:需要98%的浓H2SO4 20.4g
强化练习
1、有100g10%的食盐溶液,要使其质量分数变为5%,需加水多少克?
加水质量X
100g
10%
5%
解析:
100g+X
=
结论1:溶质质量分数减少一半,溶液质量增大一倍;
200g
增加(水)溶剂的质量等于原溶液的质量
心算、50g16%的NaCl溶液稀释成8%的NaCl溶液需加水多少g?
加水溶质质量不变.分子不变,分母增大一倍比值缩小一半.
因此加水50g.
蒸发水质量X
50g
10%
20%
解析:
50g-X
25g
2、50g10%的NaCl溶液变成20%的NaCl溶液采取蒸发水分的方法,要蒸发多少克水.
50g × 10% =
(50g-X) × 20%
X = 25g
结论:要使溶质的质量分数增大一倍,溶液质量减少一半, 蒸发水分质量为原溶液质量的一半.
已知溶液的体积进行有关溶质质量分数的计算时,应先将溶液的体积换算成溶液的质量。
换算公式: ,
单位要统一。
不同浓度溶液的体积____相加。
不能
m=ρ×V
例3:配制20%的稀H2SO4溶液100克,需要98%的浓H2SO4多少毫升(浓H2SO4密度=1.84g∕ml )
解析:
98%
20%
Xml
1.84g∕ml
100g
解:设需浓硫酸H2SO4 的体积为x
=
X ≈ 11.1ml
/
%
×98
×
ml
g
1.84
X
答:需要98%的浓H2SO4 11.1ml
ΡV=1.84g∕ml.X
解析:
X
200ml
98%
20%
加水
1.84g∕ml
1.14g∕ml
解:设需浓硫酸H2SO4 的体积为x
强化练习3:配制200ml密度为1.14g∕ml的20%的稀H2SO4 ,需要密度为1.84g∕ml的98%的浓H2SO4多少毫升?(需要加水的体积多少)
=
X× 1.84g∕ml ×98%
200ml× 1.14g∕ml ×20%
X ≈25.3ml
强调:体积不能相加减
V水=
m水
ρ水
=
200ml× 1.14g∕ml-25.3ml × 1.84g∕ml
1g∕ml
≈ 181.4ml
强化练习4.用98%的浓H2SO4(ρ=1.84g/ml)100ml
可配制成多少毫升20%的稀H2SO4 (ρ=1.14g/ml),需要加水多少ml
解:
100ml×1.84g/ml×98%=x ×1.14g/ml×20%
X ≈ 790.9ml
可配成20%的稀硫酸的体积为X
V水=
m水
ρ水
=
790.9ml ×1.14g/ml -100ml×1.84g/ml
1g∕ml
≈ 717.6ml
例5.把200g20%的NaOH溶液变成40%的NaOH 溶液应采取什么方法?
解:
方法二.加NaOH
设需加入NaOH的质量为X
方法一:.蒸发水份100g.
溶质的质量分数=
200g×20%+X
200g+X
X100%=40%
X≈66.7g
方法三.加大于40%的浓溶液
例5.把200g20%的NaOH溶液变成40%的NaOH 溶液应采取什么方法?
解:
方法一.加NaOH
设需加入NaOH的质量为X
方法二:.蒸发水份.
设需蒸发掉水的质量为y
溶质的质量分数=
200g×20%+X
200g+X
X100%=40%
X≈66.7g
溶质的质量分数=
200g×20%
200g-y
X100%=40%
y=100g
三.溶质的质量分数在化学方程式计算中的应用:
强调:代入化学方程式中的量
(1)质量 (2)纯量(3) 溶液必须是溶质的质量。
例1:100g49%的稀硫酸恰好与多少克锌完全反应,同时产生氢气多少克
解:
设锌的质量为X,同时产生氢气的质量为y。
Zn + H2SO4 = ZnSO4 + H2↑
65
98
2
100g×49%
X
y
X=
65× 100g×49%
98
=
32.5g
Y=
2× 100g×49%
98
1g
=
65
X
=
98
100g×49%
100g×49%
98
=
2
y
例2:100g稀硫酸恰好跟6.5g锌完全反应,求稀硫酸中溶质的质量分数?求反应后所得溶液的质量分数?
解:设稀硫酸的溶质质量为X.
Zn + H2SO4 = ZnSO4 + H2↑
65
98
X
6.5g
X=
65
98 ×6.5g
9.8g
=
稀硫酸的溶质的质量分数=
9.8g
100g
×100%
=9.8%
65
6.5g
=
98
X
例2:100g稀硫酸恰好跟6.5g锌完全反应,求稀硫酸中溶质的质量分数?求反应后所得溶液的质量分数?
解:设稀硫酸的溶质质量分数为X.
Zn + H2SO4 = ZnSO4 + H2↑
65
98
161
y
100g×X
6.5g
z
2
X=
y=
=16.1g
100g×65
98 ×6.5g
9.8%
=
161 ×6.5g
65
z=
65
2 ×6.5g
=0.2g
反应后所得溶液的质量分数=
16.1g
100g(1-9.8%)+16.1g
×100%
≈15.1%
生成硫酸锌质量y.
同时放出氢气质量为z.
方法一:
方法二:
反应后所得溶液的质量分数=
16.1g
100g+6.5g-0.2g
×100%
≈15.1%
65
6.5g
=
98
100g×X
65
6.5g
=
161
y
65
6.5g
=
2
z
2. 现有碳酸钙15g与200g的稀盐酸完全反应,求稀盐酸中溶质的质量分数 求反应完全后所得溶液的质量分数
解:设稀盐酸的溶质质量为X.
CaCO3 + 2HCl = CaCl2 + H2O+CO2↑
100
73
15g
X
X=
73 ×15g
100
10.95g
=
稀盐酸的溶质的质量分数=
10.95g
200g
×100%
=5.475%
100
15g
=
73
X
例3:6.5克的锌粒放入100克稀盐酸
中恰好完全反应;
求:①产生氢气的质量;
②稀盐酸溶质的质量分数;
③求反应后溶液的溶质质量分数
解:设产生氢气的质量为X
Zn + 2HCl == ZnCl2 + H2 ↑
稀盐酸中溶质的质量分数为Y
反应后溶液溶质的质量为Z
100g×Y
Z
73
136
6.5g
X
65
2
65
6.5g
=
73
100g×Y
65
6.5g
6.5g
65
=
=
2
X
136
Z
解析:
100g
稀盐酸
6.5gZn
0.2gH2
反应后所得溶液溶质的质量分数
= ×100%
13.6
100g+6.5g-0.2g
≈12.8%
练习:
1.实验室用13g锌与多少克纯硫酸完全反应 如果这种硫酸溶液200g,求硫酸溶液溶质的质量分数
2. 现有碳酸钙15g与200g的稀盐酸完全反应,求稀盐酸中溶质的质量分数 求反应完全后所得溶液的质量分数
3.将20克NaCI溶解多少克水中,就可配制成25℅的NaCI溶液,所得溶液为多少克?
4、50g16%的NaCl溶液变成20%的NaCl溶液有哪些方法 并计算说明.
5.用98%的浓H2SO4(ρ=1.84g/ml)配制成100ml20%的稀H2SO4(ρ=1.14g/ml)需98%的浓H2SO4多少ml
6、实验室用98%(ρ=1.84g/ml)的浓硫酸与水混合,配制1:5的稀硫酸,求所得溶液溶质的质量分数?
8、50℅的某溶液与10℅某溶液混合,得25℅的混合液,求两溶液的质量比。
7、欲将50克90℅的硫酸溶液稀释成10℅的硫酸溶液,应加水多少克,所得溶液为多少克?
9、某硫酸溶液100克与13克锌完全反应,求这种硫酸溶液及所得溶液溶质的质量分数?
同课章节目录
