第九单元第一节常见的金属材料课后作业-2021-2022学年九年级化学鲁教版下册(word版含解析)
文档属性
| 名称 | 第九单元第一节常见的金属材料课后作业-2021-2022学年九年级化学鲁教版下册(word版含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 343.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-28 09:31:04 | ||
图片预览




文档简介
第一节常见的金属材料第九单元金属课后作业2021_2022学年九年级化学(鲁教版)
一.选择题(共13小题)
1.生活中的下列物品,其制作材料属于合金的是( )
A.单晶硅半导体 B.金刚石钻头
C.不锈钢锅 D.青花瓷器
2.我国科学家研制出一种新型镁锂合金。该材料具有超轻、强度高等特性。下列关于该镁锂合金的说法正确的是( )
A.是一种新型化合物
B.镁锂合金中镁、锂原子不再运动
C.可以用于制造卫星、减轻卫星重量
D.镁锂合金属于合成材料
3.制取合金常用的方法是将两种或多种金属(或金属与非金属)加热到某一温度,使其全部熔化,再冷却成为合金。根据表中的数据判断(其他条件均满足),下列合金不宜采用上述方法制取的是( )
金属 Na Mg Al Cu Fe
熔点 97.5 649 660 1083 1535
沸点 883 1090 2467 2567 2750
A.Fe﹣Cu B.Mg﹣Fe C.Na﹣Al D.Al﹣Cu
4.关于下列说法正确的是( )
A.玉石俱焚﹣﹣说明玉石是可燃物
B.风助火威﹣﹣为燃烧提供足够多的氧气
C.钻木取火﹣﹣为了提高可燃物的着火点
D.百炼成钢﹣﹣说明生铁经多次煅炼转化为纯铁
5.铜可以做导线,其中利用了铜的( )
A.导热性 B.有金属光泽 C.导电性 D.抗腐蚀性
6.铜可用于制造传统的铜火锅,下列性质与此用途无关的是( )
A.熔点高 B.导热性好 C.延展性好 D.导电性好
7.下列对有关事实的解释中,错误的是( )
A.生铁和钢的机械性能不同﹣﹣含碳量不同
B.氯和磷的元素种类不同﹣﹣最外层电子数不同
C.金刚石和石墨的硬度不同﹣﹣碳原子的排列方式不同
D.硫在空气和氧气中燃烧的火焰颜色不同﹣﹣氧气浓度不同
8.《天工开物》中记载“每金七厘造方寸金一千片”,体现了黄金具有良好的( )
A.磁性 B.延展性 C.导热性 D.导电性
9.“铜锅涮肉”是老北京的传统美食,其中利用了铜的( )
A.导热性 B.延展性 C.导电性 D.抗腐蚀性
10.生活中的下列物品,其制作材料属于合金的是( )
A.金刚石钻头 B.钢化玻璃杯 C.不锈钢锅 D.瓷器
11.钛和钛合金是21世纪的重要金属材料,它们具有优良的性质,如熔点高、密度小,可塑性好,机械能力强,钛合金与人体有很好的“相容性”。根据它们的主要性能,不合实际的用途是( )
A.用于核潜艇设备的制造 B.用于制造航天设备
C.用来做保险丝 D.可用来制造人造骨
12.金属材料在人类活动中已得到越来越广泛的应用.下列性质属于金属共性的是( )
A.硬度很大,熔点很高
B.有良好的导电性、导热性
C.是银白色固体
D.易于盐酸反应产生氢气
13.生铁和钢在组成上的主要区别在于( )
A.含杂质种类不同 B.含碳量多少不同
C.机械加工性能不同 D.耐腐蚀性不同
二.填空题(共4小题)
14.诗人陆游的笔记中记载“书灯勿用铜盏,惟瓷盏最省油。蜀中有夹瓷盏,…可省油之半”。夹瓷盏被称为省油灯,用棉绳做炷(灯芯),上层盏盛油,下层盏盛水。其结构如图所示。
(1)省油灯中的炷和 是可燃物。
(2)“书灯勿用铜盏”是因为铜具有良好的 性,易造成油的挥发。
(3)熄灭省油灯的方法是 。
(4)省油灯能省油的原因是利用了下层盏内水的作用,其原理是 。
15.下列是某种金属的部分性质。
颜色、状态 硬度 密度 熔点 延展性 导电、导热 耐腐蚀
银白色固体 较硬 4.5g/cm3 高 好 好 好
该金属加入到稀盐酸中无气泡产生。(各写一点)
①试推断该金属的化学性质是
②该金属可能有的几种用途是 。
16.从下列选项中选填符合要求的序号:
a、原子的最外层电子数不同
b、原子的排列不同
c、分子构成不同
d、组成元素含量不同
(1)金刚石和石墨物理性质不同 。
(2)金属和稀有气体化学性质不同 。
(3)CO、CO2化学性质不同 。
(4)生铁和钢的机械性能不同 。
17.由于符合“低碳出行”的理念,“共享单车”颇受年轻人的喜爱。
(1)“低碳出行”主要减少的环境问题是 ;
(2)采用钛合金车架的“共享单车”质量轻便,承重强度高。钛原子的结构示意图为,其中x= ;
(3)工业上冶炼钛的过程如下:①12FeTiO3+6C+7Cl22TiCl4+2FeCl3+6CO.②在氩气环境和高温条件下,利用金属镁和TiCl4反应生成氯化镁和金属钛,该反应的方程式为 。
(4)采用实体轮胎的“共享单车”可有效防止爆胎。而普通自行车夏天易爆胎,请用分子的观点解释“夏天易爆胎”的原因 ;
(5)钢是铁合金的一种,工业上冶炼所需气体是 (填化学式)。
三.解答题(共3小题)
18.生活中蕴含着丰富的化学知识。请回答下列问题:
(1)请将下列物质和对应的用途连线。
物质 用途
钛合金 人造骨
石墨 制作霓虹灯
稀有气体 作电极
(2)全球能源结构正在向多元、清洁、低碳转型。下表是我国能源结构变化的调整表,请依据表中数据回答相关问题:
能源占比年份 石油 天然气 煤炭 水电 核电 其它可再生能源
2015年 33% 23% 30% 7% 4% 3%
2030年 31% 26% 24% 7% 5% 7%
2050年 27% 27% 18% 7% 5% 16%
注:其它可再生能源是指太阳能、风能等能源。
①化石燃料是目前应用最广泛的能源,但其不可再生且燃烧会对环境造成污染。在2015年我国能源结构中,占比最小的化石燃料是 。
②从2015、2030、2050年能源结构变化看出,占比增加最多的能源是 。
(3)新冠肺炎是一种急性感染性肺炎,做好自身防护是防止感染的重要措施。家庭和学校常备洗手液、酒精、一次性口罩、温度计等。温度计有多种,常用的体温计有水银温度计,温度升高,水银柱会上升,从微观角度来解释是 。
(4)以下是人们在应对“新型冠状病毒肺炎”时的一些认识,你认为不符合科学道理的是 。
A.家庭消毒时,消毒液越浓越好
B.多饮水,保证身体充足的水分
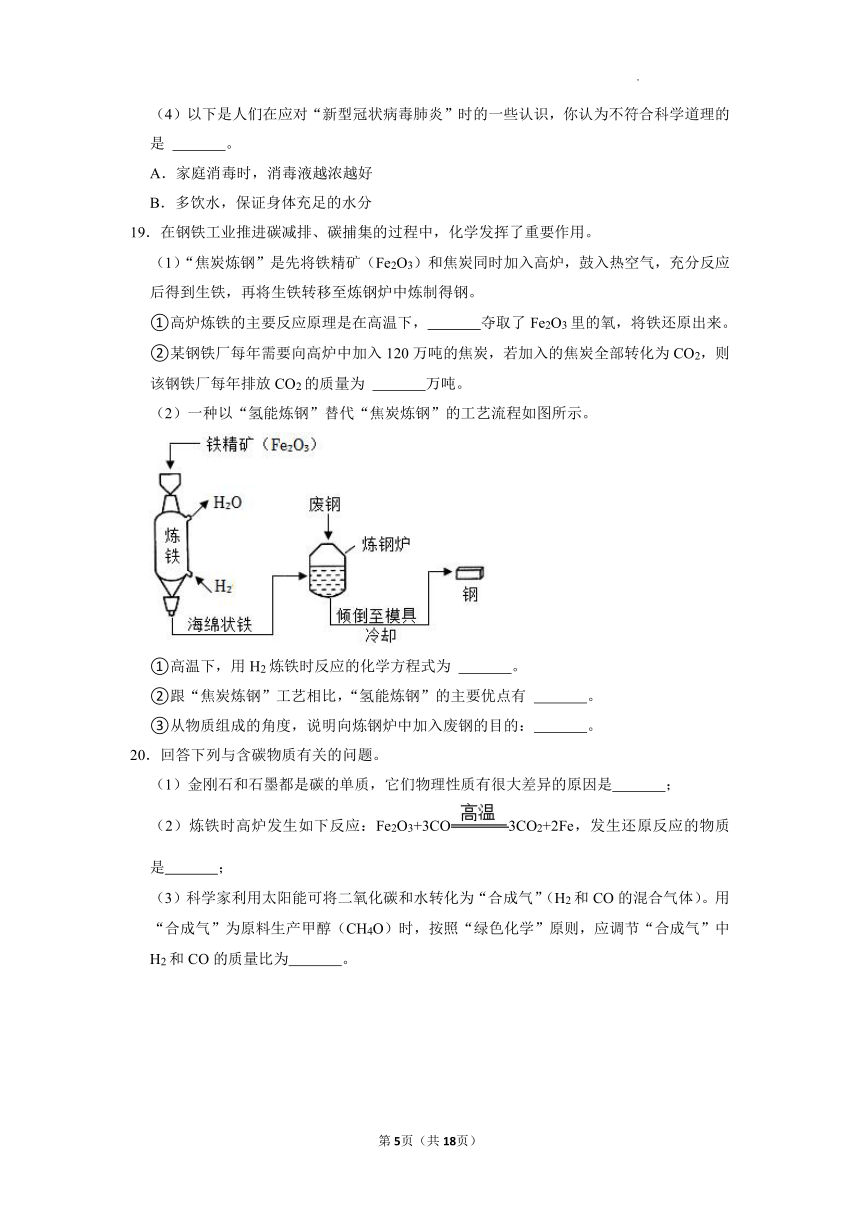
19.在钢铁工业推进碳减排、碳捕集的过程中,化学发挥了重要作用。
(1)“焦炭炼钢”是先将铁精矿(Fe2O3)和焦炭同时加入高炉,鼓入热空气,充分反应后得到生铁,再将生铁转移至炼钢炉中炼制得钢。
①高炉炼铁的主要反应原理是在高温下, 夺取了Fe2O3里的氧,将铁还原出来。
②某钢铁厂每年需要向高炉中加入120万吨的焦炭,若加入的焦炭全部转化为CO2,则该钢铁厂每年排放CO2的质量为 万吨。
(2)一种以“氢能炼钢”替代“焦炭炼钢”的工艺流程如图所示。
①高温下,用H2炼铁时反应的化学方程式为 。
②跟“焦炭炼钢”工艺相比,“氢能炼钢”的主要优点有 。
③从物质组成的角度,说明向炼钢炉中加入废钢的目的: 。
20.回答下列与含碳物质有关的问题。
(1)金刚石和石墨都是碳的单质,它们物理性质有很大差异的原因是 ;
(2)炼铁时高炉发生如下反应:Fe2O3+3CO3CO2+2Fe,发生还原反应的物质是 ;
(3)科学家利用太阳能可将二氧化碳和水转化为“合成气”(H2和CO的混合气体)。用“合成气”为原料生产甲醇(CH4O)时,按照“绿色化学”原则,应调节“合成气”中H2和CO的质量比为 。
第一节常见的金属材料第九单元金属课后作业2021_2022学年九年级化学(鲁教版)
参考答案与试题解析
一.选择题(共13小题)
1.生活中的下列物品,其制作材料属于合金的是( )
A.单晶硅半导体 B.金刚石钻头
C.不锈钢锅 D.青花瓷器
【分析】合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质;合金具有以下特点:①一定是混合物;②合金中至少有一种金属等。
【解答】解:A、单晶硅属于固态非金属单质,不属于合金,故选项错误。
B、金刚石是碳元素形成的单质,属于固态非金属单质,不属于合金,故选项错误。
C、不锈钢是钢的一种,是铁的合金,故选项正确。
D、青花瓷器是用瓷土烧制而成的,属于无机非金属材料,故选项错误。
故选:C。
【点评】本题难度不大,主要考查合金的特征,掌握合金的特征是正确解答本题的关键。
2.我国科学家研制出一种新型镁锂合金。该材料具有超轻、强度高等特性。下列关于该镁锂合金的说法正确的是( )
A.是一种新型化合物
B.镁锂合金中镁、锂原子不再运动
C.可以用于制造卫星、减轻卫星重量
D.镁锂合金属于合成材料
【分析】根据题意,我国科学家研制出一种新型镁锂合金,该材料具有超轻、强度高等特性,结合合金的特征和性质,进行分析判断。
【解答】解:A、该镁锂合金中含有镁、锂,属于混合物,故选项说法错误。
B、镁锂合金中镁、锂原子仍是在不断运动的,故选项说法错误。
C、新型镁锂合金具有超轻、强度高等特性,可以用于制造卫星、减轻卫星重量,故选项说法正确。
D、镁锂合金是合金中的一种,属于金属材料,故选项说法错误。
故选:C。
【点评】本题难度不大,理解题意,了解合金的特征和性质。金属材料等是正确解答本题的关键。
3.制取合金常用的方法是将两种或多种金属(或金属与非金属)加热到某一温度,使其全部熔化,再冷却成为合金。根据表中的数据判断(其他条件均满足),下列合金不宜采用上述方法制取的是( )
金属 Na Mg Al Cu Fe
熔点 97.5 649 660 1083 1535
沸点 883 1090 2467 2567 2750
A.Fe﹣Cu B.Mg﹣Fe C.Na﹣Al D.Al﹣Cu
【分析】制取合金常用的方法是将两种或多种金属(也可为金属和非金属)加热到某一温度,使其全部熔化,再冷却成合金;在合金中一种金属的熔点应低于另一种金属的沸点才能使两种金属熔合在一起,据此进行分析判断即可。
【解答】解:制取合金常用的方法是将两种或多种金属(或非金属)加热到某一定温度,使其全部熔化,再冷却成为合金;说明两者可以同时处于熔化状态下,一种金属的熔点应低于另一种金属的沸点才能使两种金属熔合在一起。
A、当熔点较高的铁开始熔化时,铜也处于液体状态,能采用上述方法制取,故选项错误。
B、铁的熔点(1535℃)比镁的沸点(1090℃)还高,当熔点较高的铁开始熔化时,镁已经处于气体状态,不宜采用上述方法制取,故选项正确。
C、当熔点较高的铝开始熔化时,钠也处于液体状态,能采用上述方法制取,故选项错误。
D、当熔点较高的铜开始熔化时,铝也处于液体状态,能采用上述方法制取,故选项错误。
故选:B。
【点评】本题难度不大,考查了同学们新信息获取、处理能力,理解两种金属必须都是液态才能制成合金(一种液态、一种气态不能制成合金)是正确解答本题的关键。
4.关于下列说法正确的是( )
A.玉石俱焚﹣﹣说明玉石是可燃物
B.风助火威﹣﹣为燃烧提供足够多的氧气
C.钻木取火﹣﹣为了提高可燃物的着火点
D.百炼成钢﹣﹣说明生铁经多次煅炼转化为纯铁
【分析】A.根据物质的性质来分析;
B.根据促进燃料燃烧的方法来分析;
C.根据燃烧的条件来分析;
D.根据炼钢的原理来分析。
【解答】解:A.玉石俱焚的含义是美玉和石头一样烧坏,不一定玉石是可燃物,若石头是石灰石,也可能是石灰石等的主要成分发生了分解反应等,故选项说法错误。
B.风助火威是为燃烧提供足够多的氧气,使燃烧更加旺盛,故选项说法正确。
C.钻木取火是为了提高可燃物的温度,达到可燃物的着火点,而不是提高着火点,故选项说法错误。
D.生铁和钢的主要区别在于含碳量不同,钢的碳含量低,百炼成钢目的是让碳和氧气反应生成二氧化碳,从而降低含碳量,得到钢中仍含有少量的碳,并不是纯铁,故选项说法错误。
故选:B。
【点评】本题难度不大,掌握燃烧的条件、生铁和钢的组成成分、成语的含义等是正确解答本题的关键。
5.铜可以做导线,其中利用了铜的( )
A.导热性 B.有金属光泽 C.导电性 D.抗腐蚀性
【分析】物质的性质决定物质的用途,根据常见金属的性质与用途,进行分析判断。
【解答】解:铜可以做导线,其中利用了铜具有良好的导电性。
故选:C。
【点评】本题难度不大,物质的性质决定物质的用途,掌握常见金属的性质和用途是正确解答此类题的关键.
6.铜可用于制造传统的铜火锅,下列性质与此用途无关的是( )
A.熔点高 B.导热性好 C.延展性好 D.导电性好
【分析】物质的性质决定物质的用途,根据常见金属的性质与用途,进行分析判断。
【解答】解:A、铜可用于制造传统的铜火锅,能用燃料燃烧放出的热量加热火锅的饭菜,而火锅火锅不熔化,利用了铜熔点高的性质,故选项错误。
B、铜可用于制造传统的铜火锅,能加热火锅的饭菜,利用了铜导热性好的性质,故选项错误。
C、铜可用于制造传统的铜火锅,利用了铜延展性好的性质,故选项错误。
D、铜可用于制造传统的铜火锅,与导电性无关,故选项正确。
故选:D。
【点评】本题难度不大,物质的性质决定物质的用途,掌握常见金属的性质和用途是正确解答此类题的关键.
7.下列对有关事实的解释中,错误的是( )
A.生铁和钢的机械性能不同﹣﹣含碳量不同
B.氯和磷的元素种类不同﹣﹣最外层电子数不同
C.金刚石和石墨的硬度不同﹣﹣碳原子的排列方式不同
D.硫在空气和氧气中燃烧的火焰颜色不同﹣﹣氧气浓度不同
【分析】A.根据生铁和钢都是铁的合金,二者的含碳量不同进行解答;
B.根据元素的种类是由质子数决定的来分析;
C.根据金刚石和石墨的硬度不同是因为碳原子的排列方式不同进行分析判断;
D.根据硫在氧气中和在空气中燃烧现象不同是因为氧气含量不同进行解答。
【解答】解:A.生铁和钢的机械性能不同是因为含碳量不同,铁的含碳量为2%~4.3%,钢中的含碳量为0.03%~2%,故A正确;
B.元素的种类是由质子数决定的,氯和磷的元素种类不同是因为质子数不同,而不是因为最外层电子数不同,故B错误;
C.金刚石和石墨的硬度不同是因为碳原子的排列方式不同,故C正确;
D.硫在氧气中和在空气中燃烧现象不同是因为氧气含量不同,氧气浓度越大,物质燃烧越剧烈,故D正确。
故选:B。
【点评】本题难度不大,掌握生铁和钢的组成成分、元素的特征、氧气的化学性质等是正确解答本题的关键。
8.《天工开物》中记载“每金七厘造方寸金一千片”,体现了黄金具有良好的( )
A.磁性 B.延展性 C.导热性 D.导电性
【分析】根据金属的物理性质来分析。
【解答】解:“每金七厘造方寸金一千片”,体现了黄金具有良好的延展性;
故选:B。
【点评】考查学生对密度、熔点、导热性能及导电性能等物理性质的理解运用,侧重考查了学生的筛选信息的能力。
9.“铜锅涮肉”是老北京的传统美食,其中利用了铜的( )
A.导热性 B.延展性 C.导电性 D.抗腐蚀性
【分析】物质的性质决定物质的用途,根据金属的物理性质与用途,进行分析判断。
【解答】解:A、铜锅涮肉,是利用了铜的导热性,故选项正确。
B、铜锅涮肉,是利用了铜的导热性,而不是延展性,故选项错误。
C、铜锅涮肉,是利用了铜的导热性,而不是导电性,故选项错误。
D、铜锅涮肉,是利用了铜的导热性,而不是抗腐蚀性,故选项错误。
故选:A。
故选:A。
【点评】本题难度不大,物质的性质决定物质的用途,掌握金属的性质和用途是正确解答此类题的关键。
10.生活中的下列物品,其制作材料属于合金的是( )
A.金刚石钻头 B.钢化玻璃杯 C.不锈钢锅 D.瓷器
【分析】根据材料的特点进行分析。合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质;合金具有以下特点:①一定是混合物;②合金中至少有一种金属等。
【解答】解:A、金刚石是单质,属于纯净物,不属于合金,故选项错误。
B、玻璃钢为复合材料,不属于合金,故选项错误。
C、不锈钢是钢的一种,是铁的合金,故选项正确。
D、瓷器是用泥土烧制而成的,属于无机非金属材料,不属于合金,故选项错误。
故选:C。
故选:C。
【点评】本题难度不大,主要考查合金的特征,掌握合金的特征(①一定是混合物;②合金中至少有一种金属等)是正确解答本题的关键。
11.钛和钛合金是21世纪的重要金属材料,它们具有优良的性质,如熔点高、密度小,可塑性好,机械能力强,钛合金与人体有很好的“相容性”。根据它们的主要性能,不合实际的用途是( )
A.用于核潜艇设备的制造 B.用于制造航天设备
C.用来做保险丝 D.可用来制造人造骨
【分析】物质的结构决定物质的性质,物质的性质决定物质的用途。
【解答】解:A、用于潜艇设备的制造是因为它的密度小、可塑性好、机械性能好、抗腐蚀性强,故A正确。
B、用于制造航天设备是因为它的熔点高、密度小、可塑性好、机械性能好、抗腐蚀性强,故B正确。
C、不能做保险丝,因为它的熔点高,故C错误。
D、用于制造人骨替代品是因为它的合金与人体有良好的“相容性”,故D正确。
故选:C。
【点评】本题主要考查了钛和钛合金的性质和用途方面的知识。
12.金属材料在人类活动中已得到越来越广泛的应用.下列性质属于金属共性的是( )
A.硬度很大,熔点很高
B.有良好的导电性、导热性
C.是银白色固体
D.易于盐酸反应产生氢气
【分析】可以根据金属的性质方面进行分析、判断,从而得出正确的结论.例如,一些金属较软,一些金属熔点较低.都有良好的导电性、导热性.颜色不都是银白色的.一些金属不能和酸反应.
【解答】解:A.一些金属的硬度很小,熔点较低,如钠等,故错误;
B.金属都有良好的导电性、传热性,故正确。
C.一些金属的颜色不是银白色的,例如铜是红色的,故错误;
D.铜不能和稀盐酸反应,故错误;
故选:B。
【点评】解答本题的关键是要充分了解金属的性质,只有这样才能对问题做出正确的判断.
13.生铁和钢在组成上的主要区别在于( )
A.含杂质种类不同 B.含碳量多少不同
C.机械加工性能不同 D.耐腐蚀性不同
【分析】根据生铁和钢都是铁的合金,根据它们的组成进行分析解答即可.
【解答】解:生铁是含碳量为2%~4.3%的铁合金,钢是含碳量为0.03%~2%的铁合金,生铁和钢主要成分都是铁,主要区别是含碳量不同。
A、生铁和钢在组成上的主要区别在于含碳量不同,不是含杂质种类不同,故选项错误。
B、生铁和钢在组成上的主要区别在于含碳量不同,故选项正确。
C、生铁和钢在组成上的主要区别在于含碳量不同,不是机械加工性能不同,故选项错误。
D、生铁和钢在组成上的主要区别在于含碳量不同,不是氖腐蚀性不同,故选项错误。
故选:B。
【点评】本题难度不大,掌握生铁和钢都是铁的合金、生铁和钢的组成与区别是正确金属本题的关键.
二.填空题(共4小题)
14.诗人陆游的笔记中记载“书灯勿用铜盏,惟瓷盏最省油。蜀中有夹瓷盏,…可省油之半”。夹瓷盏被称为省油灯,用棉绳做炷(灯芯),上层盏盛油,下层盏盛水。其结构如图所示。
(1)省油灯中的炷和 油 是可燃物。
(2)“书灯勿用铜盏”是因为铜具有良好的 导热 性,易造成油的挥发。
(3)熄灭省油灯的方法是 吹灭或扇灭 。
(4)省油灯能省油的原因是利用了下层盏内水的作用,其原理是 水吸热降低油温,防止油挥发 。
【分析】(1)根据物质的性质来分析;
(2)根据物质的性质来分析;
(3)根据灭火的方法来分析;
(4)根据防止油挥发的方法来分析。
【解答】解:(1)省油灯中的炷和油是可燃物;故答案为:油;
(2)“书灯勿用铜盏”是因为铜具有良好的导热性,易造成油的挥发;故答案为:导热;
(3)熄灭省油灯的方法是吹灭或扇灭;故答案为:吹灭或扇灭;
(4)省油灯能省油的原因是利用了下层盏内水的作用,其原理是水吸热降低油温,防止油挥发;故答案为:水吸热降低油温,防止油挥发。
【点评】本题考查了物质的性质、灭火的方法等,难度不大。
15.下列是某种金属的部分性质。
颜色、状态 硬度 密度 熔点 延展性 导电、导热 耐腐蚀
银白色固体 较硬 4.5g/cm3 高 好 好 好
该金属加入到稀盐酸中无气泡产生。(各写一点)
①试推断该金属的化学性质是 该金属不与酸反应(该金属的活动性较弱或该金属排在H的后面)
②该金属可能有的几种用途是 做炊具;武器 。
【分析】①根据实验现象推测该金属是否能与酸反应;
②根据该金属的物理性质来推测其用途。
【解答】解:①由金属加入到稀盐酸中无气泡产生,说明金属不能与盐酸反应,即排在了氢的后面;
②导电性好可以做导线,导热性好可以做炊具等。
故答案为:①该金属不与酸反应(该金属的活动性较弱或该金属排在H的后面);
②做炊具;武器。(答案合理即可)
【点评】通过回答本题知道了通过现象推测物质性质的方法,通过性质推测用途的方法。
16.从下列选项中选填符合要求的序号:
a、原子的最外层电子数不同
b、原子的排列不同
c、分子构成不同
d、组成元素含量不同
(1)金刚石和石墨物理性质不同 b 。
(2)金属和稀有气体化学性质不同 a 。
(3)CO、CO2化学性质不同 c 。
(4)生铁和钢的机械性能不同 d 。
【分析】(1)根据碳单质的结构来分析;
(2)根据原子结构来分析;
(3)根据分子结构来分析;
(4)根据铁合金的含碳量来分析。
【解答】解:(1)金刚石、石墨都是由碳元素组成的物质,但是碳原子排列的方法不同,导致其物理性质存在差异,故填:b;
(2)金属元素得原子最外层电子数少于4个,在化学反应中易失去最外层的电子;稀有气体元素的原子最外层电子数为8个(氦为2个),属于稳定结构。所以金属和稀有气体化学性质不同是因为原子的最外层电子数不同;故填:a;
(3)分子是保持物质化学性质的最小粒子,一氧化碳和二氧化碳的元素组成相同,但是分子构成不同,所以化学性质不同,故填:c;
(4)生铁和钢都是铁的合金,生铁和钢主要成分都是铁,生铁是含碳量为2%~4.3%的铁合金,钢是含碳量为0.03%~2%的铁合金,钢的性能比生铁优越,主要是钢的含碳量比铁低。故填:d。
【点评】掌握物质的构成是解答本题的关键。
17.由于符合“低碳出行”的理念,“共享单车”颇受年轻人的喜爱。
(1)“低碳出行”主要减少的环境问题是 温室效应 ;
(2)采用钛合金车架的“共享单车”质量轻便,承重强度高。钛原子的结构示意图为,其中x= 10 ;
(3)工业上冶炼钛的过程如下:①12FeTiO3+6C+7Cl22TiCl4+2FeCl3+6CO.②在氩气环境和高温条件下,利用金属镁和TiCl4反应生成氯化镁和金属钛,该反应的方程式为 2Mg+TiCl42MgCl2+Ti 。
(4)采用实体轮胎的“共享单车”可有效防止爆胎。而普通自行车夏天易爆胎,请用分子的观点解释“夏天易爆胎”的原因 夏天温度高,分子间间隔变大 ;
(5)钢是铁合金的一种,工业上冶炼所需气体是 O2 (填化学式)。
【分析】(1)根据二氧化碳含量的升高对环境的影响来分析;
(2)根据原子结构来分析;
(3)根据化学反应的原理来分析;
(4)根据分子的性质来分析;
(5)根据炼钢的原理来分析。
【解答】解:(1)“低碳出行”就是减少二氧化碳的排放,主要减少的环境问题是温室效应;故填:温室效应;
(2)在原子中,质子数=核外电子数,所以x=22﹣2﹣8﹣2=10;故填:10;
(3)在氩气环境和高温条件下,利用金属镁和TiCl4反应生成氯化镁和金属钛,该反应的方程式为2Mg+TiCl42MgCl2+Ti,故填:2Mg+TiCl42MgCl2+Ti;
(4)夏天,温度升高,分子的能量增大,运动速率加快,间隔变大,故夏天易爆胎;故填:夏天温度高,分子间间隔变大;
(5)用生铁炼钢就是降低碳的含量,用氧气与生铁中的碳反应生成二氧化碳,所以需要用到氧气;故填:O2。
【点评】本题难度不大,考查了低碳的含义、原子结构、分子的性质、方程式的写法等知识,灵活运用所学知识解答实际问题是解题的关键。
三.解答题(共3小题)
18.生活中蕴含着丰富的化学知识。请回答下列问题:
(1)请将下列物质和对应的用途连线。
物质 用途
钛合金 人造骨
石墨 制作霓虹灯
稀有气体 作电极
(2)全球能源结构正在向多元、清洁、低碳转型。下表是我国能源结构变化的调整表,请依据表中数据回答相关问题:
能源占比年份 石油 天然气 煤炭 水电 核电 其它可再生能源
2015年 33% 23% 30% 7% 4% 3%
2030年 31% 26% 24% 7% 5% 7%
2050年 27% 27% 18% 7% 5% 16%
注:其它可再生能源是指太阳能、风能等能源。
①化石燃料是目前应用最广泛的能源,但其不可再生且燃烧会对环境造成污染。在2015年我国能源结构中,占比最小的化石燃料是 天然气 。
②从2015、2030、2050年能源结构变化看出,占比增加最多的能源是 其他可再生能源 。
(3)新冠肺炎是一种急性感染性肺炎,做好自身防护是防止感染的重要措施。家庭和学校常备洗手液、酒精、一次性口罩、温度计等。温度计有多种,常用的体温计有水银温度计,温度升高,水银柱会上升,从微观角度来解释是 温度越高,汞原子之间间隙越大 。
(4)以下是人们在应对“新型冠状病毒肺炎”时的一些认识,你认为不符合科学道理的是 A 。
A.家庭消毒时,消毒液越浓越好
B.多饮水,保证身体充足的水分
【分析】(1)根据各物质的用途进行分析。
(2)根据通过信息分析。
(3)根据微粒性质分析。
(4)家庭消毒时,消毒液要适当;多饮水,保证身体充足的水分。
【解答】解:(1)钛合金的弹性模量跟人体骨骼相似,且钛合金的耐腐蚀性能非常强,另外重要一点是钛合金植入人体与人体的生物相容性非常好,所以可用人造骨:石墨具有导电性,可以做电极:稀有气体通电时会发出有色光,所以可以制成霓虹灯,
(2)①由表格中数据可知,在2015年我国能源结构中,比最小的化石燃料是天然气;
②从2015、2030、2050年能源结构变化看出,占比增加最多的能源是其他可再生能源;
(3)在水银温度计中,温度升高,水银柱会上升,从微观的角度来讲,是由于汞原子之间的间隙受温度的影响,温度越高汞原子之间间隙越大。所以宏观体现出来的就是温度升高,水银柱会上升;
(4)A、家庭消毒时,并不是消毒液越浓越好,而是浓度要适当,故A错误,符合题意;
B、饮水保证身体充足的水分,可以有利于身体健康,故B正确,不符合题意;
故选:A。
故答案为:
(1)
(2)天然气;其他可再生能源;
(3)温度越高,汞原子之间间隙越大;
(4)A。
【点评】本题考察了的知识点较多,解题时根据物质的性质与用途,有关能源的知识来分析解答即可。
19.在钢铁工业推进碳减排、碳捕集的过程中,化学发挥了重要作用。
(1)“焦炭炼钢”是先将铁精矿(Fe2O3)和焦炭同时加入高炉,鼓入热空气,充分反应后得到生铁,再将生铁转移至炼钢炉中炼制得钢。
①高炉炼铁的主要反应原理是在高温下, 一氧化碳或CO 夺取了Fe2O3里的氧,将铁还原出来。
②某钢铁厂每年需要向高炉中加入120万吨的焦炭,若加入的焦炭全部转化为CO2,则该钢铁厂每年排放CO2的质量为 440 万吨。
(2)一种以“氢能炼钢”替代“焦炭炼钢”的工艺流程如图所示。
①高温下,用H2炼铁时反应的化学方程式为 3H2+Fe2O33H2O+2Fe 。
②跟“焦炭炼钢”工艺相比,“氢能炼钢”的主要优点有 不排放二氧化碳,无污染 。
③从物质组成的角度,说明向炼钢炉中加入废钢的目的: 调节钢中的含碳量 。
【分析】(1)根据在高温条件下用还原剂CO 将铁从铁的氧化物中还原出来,质量守恒定律,反应前后元素的种类不变进行分析;
(2)根据高温条件下,氢气和氧化铁反应生成铁和水进行分析。
【解答】解:(1)①高炉炼铁的原理是在高温条件下用还原剂CO 将铁从铁的氧化物中还原出来,故答案为:一氧化碳或CO。
②根据质量守恒定律,反应前后元素的种类不变,二氧化碳中碳元素的质量等于焦炭的质量,则二氧化碳的质量为,故答案为:440。
(2)①高温下,用H2炼铁,该反应是高温条件下,氢气和氧化铁反应生成铁和水,因此反应的化学方程式为的化学方程式为3H2+Fe2O33H2O+2Fe,故答案为:3H2+Fe2O33H2O+2Fe。
②跟“焦炭炼钢”工艺相比,“氢能炼钢”的主要优点有不排放二氧化碳,生成水,无污染,故答案为:不排放二氧化碳,无污染。
③钢中含碳量比生铁中的低,因此炼钢的本质就是降低生铁的含碳量从物质组成的角度,说明向炼钢炉中加入废钢的目的是调节钢中的含碳量,故答案为:调节钢中的含碳量。
【点评】本题主要考查铁的冶炼及相关计算等,注意书写化学方程式的规范性。
20.回答下列与含碳物质有关的问题。
(1)金刚石和石墨都是碳的单质,它们物理性质有很大差异的原因是 碳原子的排列方式不同 ;
(2)炼铁时高炉发生如下反应:Fe2O3+3CO3CO2+2Fe,发生还原反应的物质是 Fe2O3 ;
(3)科学家利用太阳能可将二氧化碳和水转化为“合成气”(H2和CO的混合气体)。用“合成气”为原料生产甲醇(CH4O)时,按照“绿色化学”原则,应调节“合成气”中H2和CO的质量比为 1:7 。
【分析】(1)根据金刚石和石墨物理性质有很大差异的原因,进行分析解答。
(2)根据还原反应是指含氧化合物里的氧被夺去的反应,进行分析解答。
(3)根据“绿色化学”原则,力图使所有作为原料的原子都被产品所消纳,实现“零排放”,进行分析解答。
【解答】解:(1)金刚石和石墨都是碳的单质,它们物理性质有很大差异的原因是碳原子的排列方式不同。
(2)炼铁时高炉发生如下反应:Fe2O3+3CO3CO2+2Fe,氧化铁失去了氧,发生了还原反应。
(3)由“绿色化学”原则,力图使所有作为原料的原子都被产品所消纳,实现“零排放”。“合成气”是H2和CO的混合气体,用“合成气”为原料生产甲醇(CH4O),则应调节“合成气”中H2和CO的个数比为2:1,则质量比为(2×2):28=1:7。
故答案为:
(1)碳原子的排列方式不同;
(2)Fe2O3;
(3)1:7。
【点评】本题难度不大,掌握还原反应的特征、金刚石和石墨物理性质有很大差异的原因、“绿色化学”原则等是正确解答本题的关键。
第1页(共1页)
一.选择题(共13小题)
1.生活中的下列物品,其制作材料属于合金的是( )
A.单晶硅半导体 B.金刚石钻头
C.不锈钢锅 D.青花瓷器
2.我国科学家研制出一种新型镁锂合金。该材料具有超轻、强度高等特性。下列关于该镁锂合金的说法正确的是( )
A.是一种新型化合物
B.镁锂合金中镁、锂原子不再运动
C.可以用于制造卫星、减轻卫星重量
D.镁锂合金属于合成材料
3.制取合金常用的方法是将两种或多种金属(或金属与非金属)加热到某一温度,使其全部熔化,再冷却成为合金。根据表中的数据判断(其他条件均满足),下列合金不宜采用上述方法制取的是( )
金属 Na Mg Al Cu Fe
熔点 97.5 649 660 1083 1535
沸点 883 1090 2467 2567 2750
A.Fe﹣Cu B.Mg﹣Fe C.Na﹣Al D.Al﹣Cu
4.关于下列说法正确的是( )
A.玉石俱焚﹣﹣说明玉石是可燃物
B.风助火威﹣﹣为燃烧提供足够多的氧气
C.钻木取火﹣﹣为了提高可燃物的着火点
D.百炼成钢﹣﹣说明生铁经多次煅炼转化为纯铁
5.铜可以做导线,其中利用了铜的( )
A.导热性 B.有金属光泽 C.导电性 D.抗腐蚀性
6.铜可用于制造传统的铜火锅,下列性质与此用途无关的是( )
A.熔点高 B.导热性好 C.延展性好 D.导电性好
7.下列对有关事实的解释中,错误的是( )
A.生铁和钢的机械性能不同﹣﹣含碳量不同
B.氯和磷的元素种类不同﹣﹣最外层电子数不同
C.金刚石和石墨的硬度不同﹣﹣碳原子的排列方式不同
D.硫在空气和氧气中燃烧的火焰颜色不同﹣﹣氧气浓度不同
8.《天工开物》中记载“每金七厘造方寸金一千片”,体现了黄金具有良好的( )
A.磁性 B.延展性 C.导热性 D.导电性
9.“铜锅涮肉”是老北京的传统美食,其中利用了铜的( )
A.导热性 B.延展性 C.导电性 D.抗腐蚀性
10.生活中的下列物品,其制作材料属于合金的是( )
A.金刚石钻头 B.钢化玻璃杯 C.不锈钢锅 D.瓷器
11.钛和钛合金是21世纪的重要金属材料,它们具有优良的性质,如熔点高、密度小,可塑性好,机械能力强,钛合金与人体有很好的“相容性”。根据它们的主要性能,不合实际的用途是( )
A.用于核潜艇设备的制造 B.用于制造航天设备
C.用来做保险丝 D.可用来制造人造骨
12.金属材料在人类活动中已得到越来越广泛的应用.下列性质属于金属共性的是( )
A.硬度很大,熔点很高
B.有良好的导电性、导热性
C.是银白色固体
D.易于盐酸反应产生氢气
13.生铁和钢在组成上的主要区别在于( )
A.含杂质种类不同 B.含碳量多少不同
C.机械加工性能不同 D.耐腐蚀性不同
二.填空题(共4小题)
14.诗人陆游的笔记中记载“书灯勿用铜盏,惟瓷盏最省油。蜀中有夹瓷盏,…可省油之半”。夹瓷盏被称为省油灯,用棉绳做炷(灯芯),上层盏盛油,下层盏盛水。其结构如图所示。
(1)省油灯中的炷和 是可燃物。
(2)“书灯勿用铜盏”是因为铜具有良好的 性,易造成油的挥发。
(3)熄灭省油灯的方法是 。
(4)省油灯能省油的原因是利用了下层盏内水的作用,其原理是 。
15.下列是某种金属的部分性质。
颜色、状态 硬度 密度 熔点 延展性 导电、导热 耐腐蚀
银白色固体 较硬 4.5g/cm3 高 好 好 好
该金属加入到稀盐酸中无气泡产生。(各写一点)
①试推断该金属的化学性质是
②该金属可能有的几种用途是 。
16.从下列选项中选填符合要求的序号:
a、原子的最外层电子数不同
b、原子的排列不同
c、分子构成不同
d、组成元素含量不同
(1)金刚石和石墨物理性质不同 。
(2)金属和稀有气体化学性质不同 。
(3)CO、CO2化学性质不同 。
(4)生铁和钢的机械性能不同 。
17.由于符合“低碳出行”的理念,“共享单车”颇受年轻人的喜爱。
(1)“低碳出行”主要减少的环境问题是 ;
(2)采用钛合金车架的“共享单车”质量轻便,承重强度高。钛原子的结构示意图为,其中x= ;
(3)工业上冶炼钛的过程如下:①12FeTiO3+6C+7Cl22TiCl4+2FeCl3+6CO.②在氩气环境和高温条件下,利用金属镁和TiCl4反应生成氯化镁和金属钛,该反应的方程式为 。
(4)采用实体轮胎的“共享单车”可有效防止爆胎。而普通自行车夏天易爆胎,请用分子的观点解释“夏天易爆胎”的原因 ;
(5)钢是铁合金的一种,工业上冶炼所需气体是 (填化学式)。
三.解答题(共3小题)
18.生活中蕴含着丰富的化学知识。请回答下列问题:
(1)请将下列物质和对应的用途连线。
物质 用途
钛合金 人造骨
石墨 制作霓虹灯
稀有气体 作电极
(2)全球能源结构正在向多元、清洁、低碳转型。下表是我国能源结构变化的调整表,请依据表中数据回答相关问题:
能源占比年份 石油 天然气 煤炭 水电 核电 其它可再生能源
2015年 33% 23% 30% 7% 4% 3%
2030年 31% 26% 24% 7% 5% 7%
2050年 27% 27% 18% 7% 5% 16%
注:其它可再生能源是指太阳能、风能等能源。
①化石燃料是目前应用最广泛的能源,但其不可再生且燃烧会对环境造成污染。在2015年我国能源结构中,占比最小的化石燃料是 。
②从2015、2030、2050年能源结构变化看出,占比增加最多的能源是 。
(3)新冠肺炎是一种急性感染性肺炎,做好自身防护是防止感染的重要措施。家庭和学校常备洗手液、酒精、一次性口罩、温度计等。温度计有多种,常用的体温计有水银温度计,温度升高,水银柱会上升,从微观角度来解释是 。
(4)以下是人们在应对“新型冠状病毒肺炎”时的一些认识,你认为不符合科学道理的是 。
A.家庭消毒时,消毒液越浓越好
B.多饮水,保证身体充足的水分
19.在钢铁工业推进碳减排、碳捕集的过程中,化学发挥了重要作用。
(1)“焦炭炼钢”是先将铁精矿(Fe2O3)和焦炭同时加入高炉,鼓入热空气,充分反应后得到生铁,再将生铁转移至炼钢炉中炼制得钢。
①高炉炼铁的主要反应原理是在高温下, 夺取了Fe2O3里的氧,将铁还原出来。
②某钢铁厂每年需要向高炉中加入120万吨的焦炭,若加入的焦炭全部转化为CO2,则该钢铁厂每年排放CO2的质量为 万吨。
(2)一种以“氢能炼钢”替代“焦炭炼钢”的工艺流程如图所示。
①高温下,用H2炼铁时反应的化学方程式为 。
②跟“焦炭炼钢”工艺相比,“氢能炼钢”的主要优点有 。
③从物质组成的角度,说明向炼钢炉中加入废钢的目的: 。
20.回答下列与含碳物质有关的问题。
(1)金刚石和石墨都是碳的单质,它们物理性质有很大差异的原因是 ;
(2)炼铁时高炉发生如下反应:Fe2O3+3CO3CO2+2Fe,发生还原反应的物质是 ;
(3)科学家利用太阳能可将二氧化碳和水转化为“合成气”(H2和CO的混合气体)。用“合成气”为原料生产甲醇(CH4O)时,按照“绿色化学”原则,应调节“合成气”中H2和CO的质量比为 。
第一节常见的金属材料第九单元金属课后作业2021_2022学年九年级化学(鲁教版)
参考答案与试题解析
一.选择题(共13小题)
1.生活中的下列物品,其制作材料属于合金的是( )
A.单晶硅半导体 B.金刚石钻头
C.不锈钢锅 D.青花瓷器
【分析】合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质;合金具有以下特点:①一定是混合物;②合金中至少有一种金属等。
【解答】解:A、单晶硅属于固态非金属单质,不属于合金,故选项错误。
B、金刚石是碳元素形成的单质,属于固态非金属单质,不属于合金,故选项错误。
C、不锈钢是钢的一种,是铁的合金,故选项正确。
D、青花瓷器是用瓷土烧制而成的,属于无机非金属材料,故选项错误。
故选:C。
【点评】本题难度不大,主要考查合金的特征,掌握合金的特征是正确解答本题的关键。
2.我国科学家研制出一种新型镁锂合金。该材料具有超轻、强度高等特性。下列关于该镁锂合金的说法正确的是( )
A.是一种新型化合物
B.镁锂合金中镁、锂原子不再运动
C.可以用于制造卫星、减轻卫星重量
D.镁锂合金属于合成材料
【分析】根据题意,我国科学家研制出一种新型镁锂合金,该材料具有超轻、强度高等特性,结合合金的特征和性质,进行分析判断。
【解答】解:A、该镁锂合金中含有镁、锂,属于混合物,故选项说法错误。
B、镁锂合金中镁、锂原子仍是在不断运动的,故选项说法错误。
C、新型镁锂合金具有超轻、强度高等特性,可以用于制造卫星、减轻卫星重量,故选项说法正确。
D、镁锂合金是合金中的一种,属于金属材料,故选项说法错误。
故选:C。
【点评】本题难度不大,理解题意,了解合金的特征和性质。金属材料等是正确解答本题的关键。
3.制取合金常用的方法是将两种或多种金属(或金属与非金属)加热到某一温度,使其全部熔化,再冷却成为合金。根据表中的数据判断(其他条件均满足),下列合金不宜采用上述方法制取的是( )
金属 Na Mg Al Cu Fe
熔点 97.5 649 660 1083 1535
沸点 883 1090 2467 2567 2750
A.Fe﹣Cu B.Mg﹣Fe C.Na﹣Al D.Al﹣Cu
【分析】制取合金常用的方法是将两种或多种金属(也可为金属和非金属)加热到某一温度,使其全部熔化,再冷却成合金;在合金中一种金属的熔点应低于另一种金属的沸点才能使两种金属熔合在一起,据此进行分析判断即可。
【解答】解:制取合金常用的方法是将两种或多种金属(或非金属)加热到某一定温度,使其全部熔化,再冷却成为合金;说明两者可以同时处于熔化状态下,一种金属的熔点应低于另一种金属的沸点才能使两种金属熔合在一起。
A、当熔点较高的铁开始熔化时,铜也处于液体状态,能采用上述方法制取,故选项错误。
B、铁的熔点(1535℃)比镁的沸点(1090℃)还高,当熔点较高的铁开始熔化时,镁已经处于气体状态,不宜采用上述方法制取,故选项正确。
C、当熔点较高的铝开始熔化时,钠也处于液体状态,能采用上述方法制取,故选项错误。
D、当熔点较高的铜开始熔化时,铝也处于液体状态,能采用上述方法制取,故选项错误。
故选:B。
【点评】本题难度不大,考查了同学们新信息获取、处理能力,理解两种金属必须都是液态才能制成合金(一种液态、一种气态不能制成合金)是正确解答本题的关键。
4.关于下列说法正确的是( )
A.玉石俱焚﹣﹣说明玉石是可燃物
B.风助火威﹣﹣为燃烧提供足够多的氧气
C.钻木取火﹣﹣为了提高可燃物的着火点
D.百炼成钢﹣﹣说明生铁经多次煅炼转化为纯铁
【分析】A.根据物质的性质来分析;
B.根据促进燃料燃烧的方法来分析;
C.根据燃烧的条件来分析;
D.根据炼钢的原理来分析。
【解答】解:A.玉石俱焚的含义是美玉和石头一样烧坏,不一定玉石是可燃物,若石头是石灰石,也可能是石灰石等的主要成分发生了分解反应等,故选项说法错误。
B.风助火威是为燃烧提供足够多的氧气,使燃烧更加旺盛,故选项说法正确。
C.钻木取火是为了提高可燃物的温度,达到可燃物的着火点,而不是提高着火点,故选项说法错误。
D.生铁和钢的主要区别在于含碳量不同,钢的碳含量低,百炼成钢目的是让碳和氧气反应生成二氧化碳,从而降低含碳量,得到钢中仍含有少量的碳,并不是纯铁,故选项说法错误。
故选:B。
【点评】本题难度不大,掌握燃烧的条件、生铁和钢的组成成分、成语的含义等是正确解答本题的关键。
5.铜可以做导线,其中利用了铜的( )
A.导热性 B.有金属光泽 C.导电性 D.抗腐蚀性
【分析】物质的性质决定物质的用途,根据常见金属的性质与用途,进行分析判断。
【解答】解:铜可以做导线,其中利用了铜具有良好的导电性。
故选:C。
【点评】本题难度不大,物质的性质决定物质的用途,掌握常见金属的性质和用途是正确解答此类题的关键.
6.铜可用于制造传统的铜火锅,下列性质与此用途无关的是( )
A.熔点高 B.导热性好 C.延展性好 D.导电性好
【分析】物质的性质决定物质的用途,根据常见金属的性质与用途,进行分析判断。
【解答】解:A、铜可用于制造传统的铜火锅,能用燃料燃烧放出的热量加热火锅的饭菜,而火锅火锅不熔化,利用了铜熔点高的性质,故选项错误。
B、铜可用于制造传统的铜火锅,能加热火锅的饭菜,利用了铜导热性好的性质,故选项错误。
C、铜可用于制造传统的铜火锅,利用了铜延展性好的性质,故选项错误。
D、铜可用于制造传统的铜火锅,与导电性无关,故选项正确。
故选:D。
【点评】本题难度不大,物质的性质决定物质的用途,掌握常见金属的性质和用途是正确解答此类题的关键.
7.下列对有关事实的解释中,错误的是( )
A.生铁和钢的机械性能不同﹣﹣含碳量不同
B.氯和磷的元素种类不同﹣﹣最外层电子数不同
C.金刚石和石墨的硬度不同﹣﹣碳原子的排列方式不同
D.硫在空气和氧气中燃烧的火焰颜色不同﹣﹣氧气浓度不同
【分析】A.根据生铁和钢都是铁的合金,二者的含碳量不同进行解答;
B.根据元素的种类是由质子数决定的来分析;
C.根据金刚石和石墨的硬度不同是因为碳原子的排列方式不同进行分析判断;
D.根据硫在氧气中和在空气中燃烧现象不同是因为氧气含量不同进行解答。
【解答】解:A.生铁和钢的机械性能不同是因为含碳量不同,铁的含碳量为2%~4.3%,钢中的含碳量为0.03%~2%,故A正确;
B.元素的种类是由质子数决定的,氯和磷的元素种类不同是因为质子数不同,而不是因为最外层电子数不同,故B错误;
C.金刚石和石墨的硬度不同是因为碳原子的排列方式不同,故C正确;
D.硫在氧气中和在空气中燃烧现象不同是因为氧气含量不同,氧气浓度越大,物质燃烧越剧烈,故D正确。
故选:B。
【点评】本题难度不大,掌握生铁和钢的组成成分、元素的特征、氧气的化学性质等是正确解答本题的关键。
8.《天工开物》中记载“每金七厘造方寸金一千片”,体现了黄金具有良好的( )
A.磁性 B.延展性 C.导热性 D.导电性
【分析】根据金属的物理性质来分析。
【解答】解:“每金七厘造方寸金一千片”,体现了黄金具有良好的延展性;
故选:B。
【点评】考查学生对密度、熔点、导热性能及导电性能等物理性质的理解运用,侧重考查了学生的筛选信息的能力。
9.“铜锅涮肉”是老北京的传统美食,其中利用了铜的( )
A.导热性 B.延展性 C.导电性 D.抗腐蚀性
【分析】物质的性质决定物质的用途,根据金属的物理性质与用途,进行分析判断。
【解答】解:A、铜锅涮肉,是利用了铜的导热性,故选项正确。
B、铜锅涮肉,是利用了铜的导热性,而不是延展性,故选项错误。
C、铜锅涮肉,是利用了铜的导热性,而不是导电性,故选项错误。
D、铜锅涮肉,是利用了铜的导热性,而不是抗腐蚀性,故选项错误。
故选:A。
故选:A。
【点评】本题难度不大,物质的性质决定物质的用途,掌握金属的性质和用途是正确解答此类题的关键。
10.生活中的下列物品,其制作材料属于合金的是( )
A.金刚石钻头 B.钢化玻璃杯 C.不锈钢锅 D.瓷器
【分析】根据材料的特点进行分析。合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质;合金具有以下特点:①一定是混合物;②合金中至少有一种金属等。
【解答】解:A、金刚石是单质,属于纯净物,不属于合金,故选项错误。
B、玻璃钢为复合材料,不属于合金,故选项错误。
C、不锈钢是钢的一种,是铁的合金,故选项正确。
D、瓷器是用泥土烧制而成的,属于无机非金属材料,不属于合金,故选项错误。
故选:C。
故选:C。
【点评】本题难度不大,主要考查合金的特征,掌握合金的特征(①一定是混合物;②合金中至少有一种金属等)是正确解答本题的关键。
11.钛和钛合金是21世纪的重要金属材料,它们具有优良的性质,如熔点高、密度小,可塑性好,机械能力强,钛合金与人体有很好的“相容性”。根据它们的主要性能,不合实际的用途是( )
A.用于核潜艇设备的制造 B.用于制造航天设备
C.用来做保险丝 D.可用来制造人造骨
【分析】物质的结构决定物质的性质,物质的性质决定物质的用途。
【解答】解:A、用于潜艇设备的制造是因为它的密度小、可塑性好、机械性能好、抗腐蚀性强,故A正确。
B、用于制造航天设备是因为它的熔点高、密度小、可塑性好、机械性能好、抗腐蚀性强,故B正确。
C、不能做保险丝,因为它的熔点高,故C错误。
D、用于制造人骨替代品是因为它的合金与人体有良好的“相容性”,故D正确。
故选:C。
【点评】本题主要考查了钛和钛合金的性质和用途方面的知识。
12.金属材料在人类活动中已得到越来越广泛的应用.下列性质属于金属共性的是( )
A.硬度很大,熔点很高
B.有良好的导电性、导热性
C.是银白色固体
D.易于盐酸反应产生氢气
【分析】可以根据金属的性质方面进行分析、判断,从而得出正确的结论.例如,一些金属较软,一些金属熔点较低.都有良好的导电性、导热性.颜色不都是银白色的.一些金属不能和酸反应.
【解答】解:A.一些金属的硬度很小,熔点较低,如钠等,故错误;
B.金属都有良好的导电性、传热性,故正确。
C.一些金属的颜色不是银白色的,例如铜是红色的,故错误;
D.铜不能和稀盐酸反应,故错误;
故选:B。
【点评】解答本题的关键是要充分了解金属的性质,只有这样才能对问题做出正确的判断.
13.生铁和钢在组成上的主要区别在于( )
A.含杂质种类不同 B.含碳量多少不同
C.机械加工性能不同 D.耐腐蚀性不同
【分析】根据生铁和钢都是铁的合金,根据它们的组成进行分析解答即可.
【解答】解:生铁是含碳量为2%~4.3%的铁合金,钢是含碳量为0.03%~2%的铁合金,生铁和钢主要成分都是铁,主要区别是含碳量不同。
A、生铁和钢在组成上的主要区别在于含碳量不同,不是含杂质种类不同,故选项错误。
B、生铁和钢在组成上的主要区别在于含碳量不同,故选项正确。
C、生铁和钢在组成上的主要区别在于含碳量不同,不是机械加工性能不同,故选项错误。
D、生铁和钢在组成上的主要区别在于含碳量不同,不是氖腐蚀性不同,故选项错误。
故选:B。
【点评】本题难度不大,掌握生铁和钢都是铁的合金、生铁和钢的组成与区别是正确金属本题的关键.
二.填空题(共4小题)
14.诗人陆游的笔记中记载“书灯勿用铜盏,惟瓷盏最省油。蜀中有夹瓷盏,…可省油之半”。夹瓷盏被称为省油灯,用棉绳做炷(灯芯),上层盏盛油,下层盏盛水。其结构如图所示。
(1)省油灯中的炷和 油 是可燃物。
(2)“书灯勿用铜盏”是因为铜具有良好的 导热 性,易造成油的挥发。
(3)熄灭省油灯的方法是 吹灭或扇灭 。
(4)省油灯能省油的原因是利用了下层盏内水的作用,其原理是 水吸热降低油温,防止油挥发 。
【分析】(1)根据物质的性质来分析;
(2)根据物质的性质来分析;
(3)根据灭火的方法来分析;
(4)根据防止油挥发的方法来分析。
【解答】解:(1)省油灯中的炷和油是可燃物;故答案为:油;
(2)“书灯勿用铜盏”是因为铜具有良好的导热性,易造成油的挥发;故答案为:导热;
(3)熄灭省油灯的方法是吹灭或扇灭;故答案为:吹灭或扇灭;
(4)省油灯能省油的原因是利用了下层盏内水的作用,其原理是水吸热降低油温,防止油挥发;故答案为:水吸热降低油温,防止油挥发。
【点评】本题考查了物质的性质、灭火的方法等,难度不大。
15.下列是某种金属的部分性质。
颜色、状态 硬度 密度 熔点 延展性 导电、导热 耐腐蚀
银白色固体 较硬 4.5g/cm3 高 好 好 好
该金属加入到稀盐酸中无气泡产生。(各写一点)
①试推断该金属的化学性质是 该金属不与酸反应(该金属的活动性较弱或该金属排在H的后面)
②该金属可能有的几种用途是 做炊具;武器 。
【分析】①根据实验现象推测该金属是否能与酸反应;
②根据该金属的物理性质来推测其用途。
【解答】解:①由金属加入到稀盐酸中无气泡产生,说明金属不能与盐酸反应,即排在了氢的后面;
②导电性好可以做导线,导热性好可以做炊具等。
故答案为:①该金属不与酸反应(该金属的活动性较弱或该金属排在H的后面);
②做炊具;武器。(答案合理即可)
【点评】通过回答本题知道了通过现象推测物质性质的方法,通过性质推测用途的方法。
16.从下列选项中选填符合要求的序号:
a、原子的最外层电子数不同
b、原子的排列不同
c、分子构成不同
d、组成元素含量不同
(1)金刚石和石墨物理性质不同 b 。
(2)金属和稀有气体化学性质不同 a 。
(3)CO、CO2化学性质不同 c 。
(4)生铁和钢的机械性能不同 d 。
【分析】(1)根据碳单质的结构来分析;
(2)根据原子结构来分析;
(3)根据分子结构来分析;
(4)根据铁合金的含碳量来分析。
【解答】解:(1)金刚石、石墨都是由碳元素组成的物质,但是碳原子排列的方法不同,导致其物理性质存在差异,故填:b;
(2)金属元素得原子最外层电子数少于4个,在化学反应中易失去最外层的电子;稀有气体元素的原子最外层电子数为8个(氦为2个),属于稳定结构。所以金属和稀有气体化学性质不同是因为原子的最外层电子数不同;故填:a;
(3)分子是保持物质化学性质的最小粒子,一氧化碳和二氧化碳的元素组成相同,但是分子构成不同,所以化学性质不同,故填:c;
(4)生铁和钢都是铁的合金,生铁和钢主要成分都是铁,生铁是含碳量为2%~4.3%的铁合金,钢是含碳量为0.03%~2%的铁合金,钢的性能比生铁优越,主要是钢的含碳量比铁低。故填:d。
【点评】掌握物质的构成是解答本题的关键。
17.由于符合“低碳出行”的理念,“共享单车”颇受年轻人的喜爱。
(1)“低碳出行”主要减少的环境问题是 温室效应 ;
(2)采用钛合金车架的“共享单车”质量轻便,承重强度高。钛原子的结构示意图为,其中x= 10 ;
(3)工业上冶炼钛的过程如下:①12FeTiO3+6C+7Cl22TiCl4+2FeCl3+6CO.②在氩气环境和高温条件下,利用金属镁和TiCl4反应生成氯化镁和金属钛,该反应的方程式为 2Mg+TiCl42MgCl2+Ti 。
(4)采用实体轮胎的“共享单车”可有效防止爆胎。而普通自行车夏天易爆胎,请用分子的观点解释“夏天易爆胎”的原因 夏天温度高,分子间间隔变大 ;
(5)钢是铁合金的一种,工业上冶炼所需气体是 O2 (填化学式)。
【分析】(1)根据二氧化碳含量的升高对环境的影响来分析;
(2)根据原子结构来分析;
(3)根据化学反应的原理来分析;
(4)根据分子的性质来分析;
(5)根据炼钢的原理来分析。
【解答】解:(1)“低碳出行”就是减少二氧化碳的排放,主要减少的环境问题是温室效应;故填:温室效应;
(2)在原子中,质子数=核外电子数,所以x=22﹣2﹣8﹣2=10;故填:10;
(3)在氩气环境和高温条件下,利用金属镁和TiCl4反应生成氯化镁和金属钛,该反应的方程式为2Mg+TiCl42MgCl2+Ti,故填:2Mg+TiCl42MgCl2+Ti;
(4)夏天,温度升高,分子的能量增大,运动速率加快,间隔变大,故夏天易爆胎;故填:夏天温度高,分子间间隔变大;
(5)用生铁炼钢就是降低碳的含量,用氧气与生铁中的碳反应生成二氧化碳,所以需要用到氧气;故填:O2。
【点评】本题难度不大,考查了低碳的含义、原子结构、分子的性质、方程式的写法等知识,灵活运用所学知识解答实际问题是解题的关键。
三.解答题(共3小题)
18.生活中蕴含着丰富的化学知识。请回答下列问题:
(1)请将下列物质和对应的用途连线。
物质 用途
钛合金 人造骨
石墨 制作霓虹灯
稀有气体 作电极
(2)全球能源结构正在向多元、清洁、低碳转型。下表是我国能源结构变化的调整表,请依据表中数据回答相关问题:
能源占比年份 石油 天然气 煤炭 水电 核电 其它可再生能源
2015年 33% 23% 30% 7% 4% 3%
2030年 31% 26% 24% 7% 5% 7%
2050年 27% 27% 18% 7% 5% 16%
注:其它可再生能源是指太阳能、风能等能源。
①化石燃料是目前应用最广泛的能源,但其不可再生且燃烧会对环境造成污染。在2015年我国能源结构中,占比最小的化石燃料是 天然气 。
②从2015、2030、2050年能源结构变化看出,占比增加最多的能源是 其他可再生能源 。
(3)新冠肺炎是一种急性感染性肺炎,做好自身防护是防止感染的重要措施。家庭和学校常备洗手液、酒精、一次性口罩、温度计等。温度计有多种,常用的体温计有水银温度计,温度升高,水银柱会上升,从微观角度来解释是 温度越高,汞原子之间间隙越大 。
(4)以下是人们在应对“新型冠状病毒肺炎”时的一些认识,你认为不符合科学道理的是 A 。
A.家庭消毒时,消毒液越浓越好
B.多饮水,保证身体充足的水分
【分析】(1)根据各物质的用途进行分析。
(2)根据通过信息分析。
(3)根据微粒性质分析。
(4)家庭消毒时,消毒液要适当;多饮水,保证身体充足的水分。
【解答】解:(1)钛合金的弹性模量跟人体骨骼相似,且钛合金的耐腐蚀性能非常强,另外重要一点是钛合金植入人体与人体的生物相容性非常好,所以可用人造骨:石墨具有导电性,可以做电极:稀有气体通电时会发出有色光,所以可以制成霓虹灯,
(2)①由表格中数据可知,在2015年我国能源结构中,比最小的化石燃料是天然气;
②从2015、2030、2050年能源结构变化看出,占比增加最多的能源是其他可再生能源;
(3)在水银温度计中,温度升高,水银柱会上升,从微观的角度来讲,是由于汞原子之间的间隙受温度的影响,温度越高汞原子之间间隙越大。所以宏观体现出来的就是温度升高,水银柱会上升;
(4)A、家庭消毒时,并不是消毒液越浓越好,而是浓度要适当,故A错误,符合题意;
B、饮水保证身体充足的水分,可以有利于身体健康,故B正确,不符合题意;
故选:A。
故答案为:
(1)
(2)天然气;其他可再生能源;
(3)温度越高,汞原子之间间隙越大;
(4)A。
【点评】本题考察了的知识点较多,解题时根据物质的性质与用途,有关能源的知识来分析解答即可。
19.在钢铁工业推进碳减排、碳捕集的过程中,化学发挥了重要作用。
(1)“焦炭炼钢”是先将铁精矿(Fe2O3)和焦炭同时加入高炉,鼓入热空气,充分反应后得到生铁,再将生铁转移至炼钢炉中炼制得钢。
①高炉炼铁的主要反应原理是在高温下, 一氧化碳或CO 夺取了Fe2O3里的氧,将铁还原出来。
②某钢铁厂每年需要向高炉中加入120万吨的焦炭,若加入的焦炭全部转化为CO2,则该钢铁厂每年排放CO2的质量为 440 万吨。
(2)一种以“氢能炼钢”替代“焦炭炼钢”的工艺流程如图所示。
①高温下,用H2炼铁时反应的化学方程式为 3H2+Fe2O33H2O+2Fe 。
②跟“焦炭炼钢”工艺相比,“氢能炼钢”的主要优点有 不排放二氧化碳,无污染 。
③从物质组成的角度,说明向炼钢炉中加入废钢的目的: 调节钢中的含碳量 。
【分析】(1)根据在高温条件下用还原剂CO 将铁从铁的氧化物中还原出来,质量守恒定律,反应前后元素的种类不变进行分析;
(2)根据高温条件下,氢气和氧化铁反应生成铁和水进行分析。
【解答】解:(1)①高炉炼铁的原理是在高温条件下用还原剂CO 将铁从铁的氧化物中还原出来,故答案为:一氧化碳或CO。
②根据质量守恒定律,反应前后元素的种类不变,二氧化碳中碳元素的质量等于焦炭的质量,则二氧化碳的质量为,故答案为:440。
(2)①高温下,用H2炼铁,该反应是高温条件下,氢气和氧化铁反应生成铁和水,因此反应的化学方程式为的化学方程式为3H2+Fe2O33H2O+2Fe,故答案为:3H2+Fe2O33H2O+2Fe。
②跟“焦炭炼钢”工艺相比,“氢能炼钢”的主要优点有不排放二氧化碳,生成水,无污染,故答案为:不排放二氧化碳,无污染。
③钢中含碳量比生铁中的低,因此炼钢的本质就是降低生铁的含碳量从物质组成的角度,说明向炼钢炉中加入废钢的目的是调节钢中的含碳量,故答案为:调节钢中的含碳量。
【点评】本题主要考查铁的冶炼及相关计算等,注意书写化学方程式的规范性。
20.回答下列与含碳物质有关的问题。
(1)金刚石和石墨都是碳的单质,它们物理性质有很大差异的原因是 碳原子的排列方式不同 ;
(2)炼铁时高炉发生如下反应:Fe2O3+3CO3CO2+2Fe,发生还原反应的物质是 Fe2O3 ;
(3)科学家利用太阳能可将二氧化碳和水转化为“合成气”(H2和CO的混合气体)。用“合成气”为原料生产甲醇(CH4O)时,按照“绿色化学”原则,应调节“合成气”中H2和CO的质量比为 1:7 。
【分析】(1)根据金刚石和石墨物理性质有很大差异的原因,进行分析解答。
(2)根据还原反应是指含氧化合物里的氧被夺去的反应,进行分析解答。
(3)根据“绿色化学”原则,力图使所有作为原料的原子都被产品所消纳,实现“零排放”,进行分析解答。
【解答】解:(1)金刚石和石墨都是碳的单质,它们物理性质有很大差异的原因是碳原子的排列方式不同。
(2)炼铁时高炉发生如下反应:Fe2O3+3CO3CO2+2Fe,氧化铁失去了氧,发生了还原反应。
(3)由“绿色化学”原则,力图使所有作为原料的原子都被产品所消纳,实现“零排放”。“合成气”是H2和CO的混合气体,用“合成气”为原料生产甲醇(CH4O),则应调节“合成气”中H2和CO的个数比为2:1,则质量比为(2×2):28=1:7。
故答案为:
(1)碳原子的排列方式不同;
(2)Fe2O3;
(3)1:7。
【点评】本题难度不大,掌握还原反应的特征、金刚石和石墨物理性质有很大差异的原因、“绿色化学”原则等是正确解答本题的关键。
第1页(共1页)
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
