第九单元第二节金属的化学性质课后作业—2021-2022学年九年级化学人鲁教版下册(word版含解析)
文档属性
| 名称 | 第九单元第二节金属的化学性质课后作业—2021-2022学年九年级化学人鲁教版下册(word版含解析) | 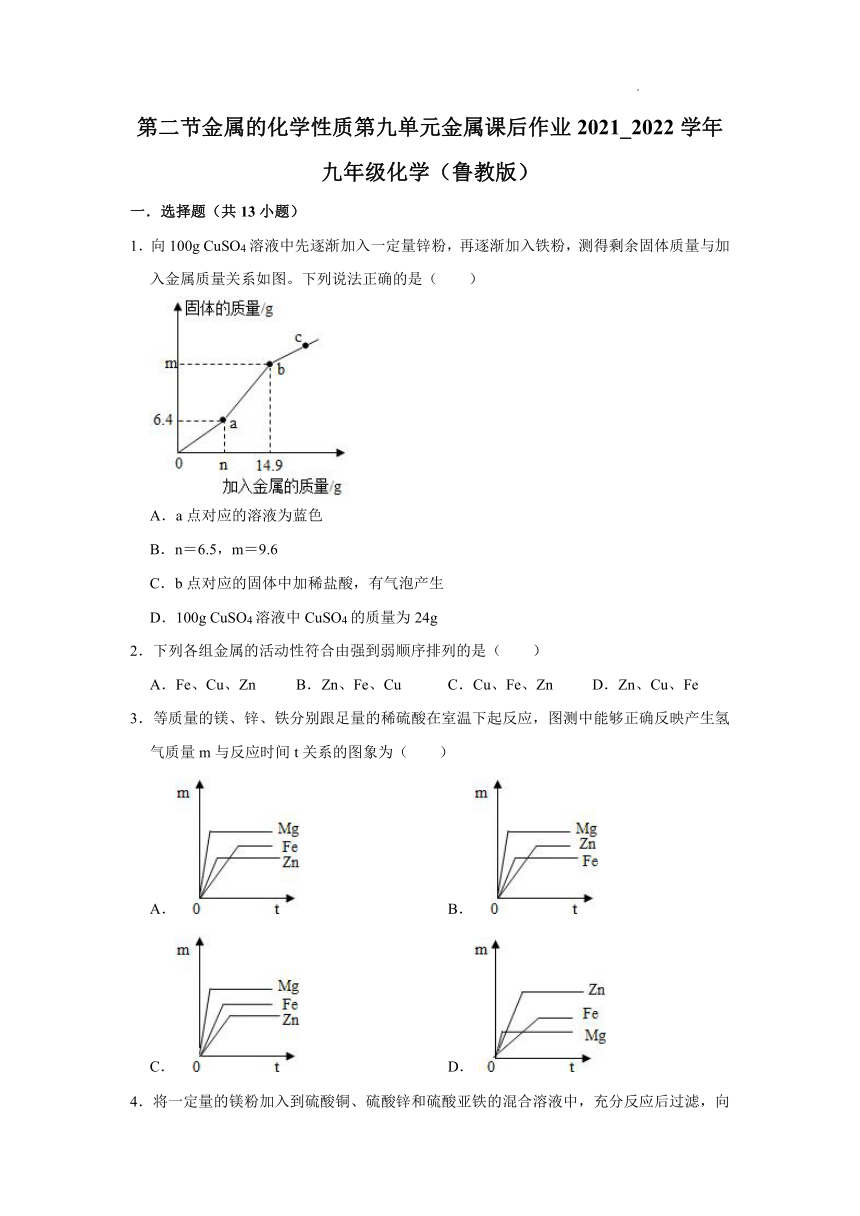 | |
| 格式 | docx | ||
| 文件大小 | 579.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-28 09:55:56 | ||
图片预览




文档简介
第二节金属的化学性质第九单元金属课后作业2021_2022学年九年级化学(鲁教版)
一.选择题(共13小题)
1.向100g CuSO4溶液中先逐渐加入一定量锌粉,再逐渐加入铁粉,测得剩余固体质量与加入金属质量关系如图。下列说法正确的是( )
A.a点对应的溶液为蓝色
B.n=6.5,m=9.6
C.b点对应的固体中加稀盐酸,有气泡产生
D.100g CuSO4溶液中CuSO4的质量为24g
2.下列各组金属的活动性符合由强到弱顺序排列的是( )
A.Fe、Cu、Zn B.Zn、Fe、Cu C.Cu、Fe、Zn D.Zn、Cu、Fe
3.等质量的镁、锌、铁分别跟足量的稀硫酸在室温下起反应,图测中能够正确反映产生氢气质量m与反应时间t关系的图象为( )
A. B.
C. D.
4.将一定量的镁粉加入到硫酸铜、硫酸锌和硫酸亚铁的混合溶液中,充分反应后过滤,向滤渣中加入稀盐酸有气泡产生,下列叙述中正确的是( )
①滤渣里一定有镁
②滤渣里一定有铜
③向滤渣里加入稀盐酸,所得溶液会变成浅绿色
④滤液中溶质一定含有硫酸镁和硫酸锌
⑤滤液的颜色不可能为蓝色
A.①②④ B.②③⑤ C.②③④ D.①④⑤
5.有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,Y溶解并产生氢气,而X不反应;如果把X和Z分别放入硝酸银溶液中,过一会儿,在X表面有银析出,而Z没有变化。根据以上实验事实,判断X、Y和z的金属活动顺序正确的是( )
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Z>X>Y
6.利用如图所示实验装置模拟工业炼铁。下列说法正确的是( )
A.反应前后Fe元素的化合价由+2价变为0价
B.充分加热,a处固体由黑色变为红色
C.b处可以用澄清石灰水检验生成的CO2
D.可用水吸收尾气中的CO
7.将铁丝、铜丝分别伸入盛有同种试剂的两支试管中,能迅速比较出铁、铜金属活动性强弱的是( )
A.蒸馏水 B.稀硫酸
C.硫酸钠溶液 D.氢氧化钠溶液
8.将X,Y,Z三种金属分别投入足量的稀硫酸中,只有X,Z能发生反应,并放出氢气.将Z投入X的硝酸盐溶液中,有金属X产生.则X,Y,Z三种金属的活动性由强到弱的顺序为( )
A.Z>Y>X B.Z>X>Y C.X>Z>Y D.Y>Z>X
9.明代科学家宋应星所著的《天工开物》中,详细记述了金、铜、铁、锌等金属的开采和冶炼方法,记述的四种金属中金属活动性最强的是( )
A.铁 B.金 C.铜 D.锌
10.能用金属与同一种稀酸反应制取的化合物是( )
A.ZnCl2、CuCl2 B.KCl、FeCl2
C.Fe2(SO4)3、FeSO4 D.K2SO3、Na2SO4
11.将一定量的锌粉加入到氯化亚铁、氯化铜和氯化镁的混合溶液中,反应一段时间后过滤,向滤渣中加入稀硫酸有气泡产生,则下列叙述正确的是( )
①滤渣中可能含有锌
②滤渣中一定含有铜和铁
③向滤渣中加入足量稀硫酸,最后溶液一定变成浅绿色
④滤液中溶质一定含有氯化锌和氯化镁
⑤滤液中一定不含铜离子
A.①③④⑤ B.①②③④⑤ C.①②③④ D.①②③⑤
12.金属与盐酸反应的示意图如图所示。下列说法错误的是( )
A.图中有三种金属可与盐酸反应
B.镁可以把铜从硫酸铜溶液中置换出来
C.产生的气体要进一步证明才能确定是否为氢气
D.铁与盐酸反应的化学方程式为:2Fe+6HCl═2FeCl3+3H2↑
13.向AgNO3和Mg(NO3)2的混合溶液中加入一定质量的Al和Fe的混合粉末,充分反应后过滤,得到滤渣和浅绿色滤液。关于该滤渣和滤液有下列四种说法,正确的是( )
A.向滤渣中加入稀盐酸,一定有气泡产生
B.滤渣中一定含有Ag、Fe,一定不含Al
C.滤渣中一定含有Ag,可能含有Fe,一定不含Al
D.滤液中一定含有Fe(NO3)2和Mg(NO3)2,一定不含AgNO3,可能含有Al(NO3)3
二.填空题(共4小题)
14.如图是某化学老师设计的一氧化碳还原氧化铁的实验装置(支持装置未画出)。
(1)实验前,应该先通入CO的目的是为了 。
(2)装置A中现象是 ,发生反应的化学方程式为 。
(3)反应结束后熄灭酒精喷灯,继续通CO至装置冷却,此时B装置的作用是 。
15.某课外学习小组的同学为进一步探究活泼金属与酸反应的情况,做了以下两组对比实验(如图)。请根据实验Ⅰ、Ⅱ回答下列问题。
(1)实验Ⅰ反映了 的剧烈程度不同;实验Ⅱ则表明了不同种金属与同种酸反应的剧烈程度不同,原因是 ;写出实验Ⅱ中锌片与稀盐酸反应的化学方程式: 。
(2)按照实验Ⅰ和Ⅱ的设计思路,请你再设计一组对比实验,简述实验方案: 。
16.置换反应是化学反应的基本类型之一.
(1)金属与盐溶液之间的置换反应,一般是活动性较强的金属可把活动性较弱的金属从其盐溶液中置换出来.如铜和硝酸银溶液的化学方程式为 .
(2)非金属单质也具有类似金属与盐溶液之间的置换反应的规律,即活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来,如在溶液中可发生下列反应:Cl2+2NaBr═2NaCl+Br2,I2+Na2S═2NaI+S↓,Br2+2KI═2KBr+I2 由此可判断:S、Cl2、I2、Br2非金属活动性由强到弱顺序是 .
17.如图是课堂中模拟炼铁的实验装置.
(1)实验过程中,先要进行的是 .(填I或Ⅱ)
I.加热Ⅱ.通一氧化碳
(2)A中反应的化学方程式是 .B中反应的化学方程式是 ,B中观察到的现象是 .
(3)该装置的不足之处是 .
三.解答题(共3小题)
18.《天工开物》是明朝科学家宋应星编写的中国首部关于农业和手工业生产技术的百科全书,其中记载着采矿和冶炼金属锡的场景。
(1)采矿(如图1):“凡锡有山锡、水锡两种……水锡衡、永出溪中…愈经淘取,其砂日长,百年不竭”,锡主要以 (填“单质”或“化合物”)的形态存在于锡砂(锡矿石)中;水中淘取锡砂与 操作的原理相似,所用容器的孔径需 (填“大于”或“小于”)锡砂颗粒大小。
(2)冶炼(如图2):“凡炼煎亦用洪炉。入砂数百斤,丛架木炭亦数百斤。鼓鞴(鼓入空气)熔化。火力已到,砂不即溶。用铅少许勾引,方始沛然流注”。炼锡时的关键步骤“点铅勾锡”指的是加铅能使锡较易熔化流出,其原因是 。
(3)①糖果等食品常用银白色的被称为“锡纸”的材料进行包装,“锡纸”实际上是铝箔纸。铝可以制成铝箔,是因为它具有良好的 性。
②将砂纸打磨过的“锡纸”放入 (填标号)中,根据实验现象,结合金属活动性可证明“锡纸”非锡。
A.稀盐酸
B.稀硫酸
C.硫酸铜溶液
D.硫酸亚铁溶液
19.为了探究铜、锌、铁三种金属的活动性,康康把等表面积的铁片和锌片放入硫酸铜溶液中(如图所示)。请回答:
(1)如何判断它们是否发生了化学反应? 。
(2)甲试管中反应前后溶液的质量 (填“增重”、“不变”或“减轻”),乙中发生反应的化学方程式为 。
(3)上述实验不能够完全证明三种金属的活动性,需要补充的实验操作是 。
20.2021年10月16日,搭载神舟十三号载人飞船的长征二号F遥十三运载火箭成功发射,将3位宇航员送入中国天宫空间站。飞行乘组将在轨驻留长达6个月时间,这是我国迄今为止时间最长的一次载人飞行。
(1)空间站的建设用到特殊规格的铝合金、钛合金等金属材料,他们具备很多优良性能是 (填序号);
A.密度大、熔点高
B.强度好、硬度大
C.耐腐蚀、硬度小
(2)为了保障航天员的生命健康,科学家们精心研制出最新的环境控制和生命保障系统。早期空间站内二氧化碳可以由氢氧化锂(LiOH)吸收,其反应原理类似于实验室检验二氧化碳,写出该反应的化学方程式 ;
(3)铝合金中主要含有铝、铜、镁三种金属,为验证这三种金属的活动性顺序,某同学设计了如图实验,甲中铝丝表面会出现的现象是 ;某位同学认为实验乙、丙中均无明显现象,对完整的结论没有用都可以省去。你的看法是 (填序号)。
A.乙、丙都不能省去
B.丙可以省去,乙不能省
C.乙可以省去,丙不能省
第二节金属的化学性质第九单元金属课后作业2021_2022学年九年级化学(鲁教版)
参考答案与试题解析
一.选择题(共13小题)
1.向100g CuSO4溶液中先逐渐加入一定量锌粉,再逐渐加入铁粉,测得剩余固体质量与加入金属质量关系如图。下列说法正确的是( )
A.a点对应的溶液为蓝色
B.n=6.5,m=9.6
C.b点对应的固体中加稀盐酸,有气泡产生
D.100g CuSO4溶液中CuSO4的质量为24g
【分析】向100gCuSO4溶液中先逐渐加入一定量锌粉,锌和硫酸铜反应生成硫酸锌和铜,反应后固体质量减小,再逐渐加入铁粉,铁和硫酸铜反应生成硫酸亚铁和铜,反应后固体质量增大。
【解答】解:A、a点时硫酸铜有剩余,对应的溶液为蓝色,该选项正确。
B、反应生成6.4g铜时消耗6.5g锌,n=6.5,反应的铁质量是14.9g﹣6.5g=8.4g时,生成铜质量是9.6g,m=9.6+6.4=16,该选项不正确。
C、b点对应的固体是铜,加稀盐酸,没有气泡产生,该选项不正确。
D、100gCuSO4溶液中CuSO4的质量为16g,该选项不正确。
故选:A。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
2.下列各组金属的活动性符合由强到弱顺序排列的是( )
A.Fe、Cu、Zn B.Zn、Fe、Cu C.Cu、Fe、Zn D.Zn、Cu、Fe
【分析】在金属活动性顺序中,金属的位置越靠前,金属的活动性越强,据此进行分析解答即可.
【解答】解:常见金属活动性顺序为K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
A、Fe、Cu、Zn三种金属由强到弱顺序排列顺序是Zn、Fe、Cu,故选项错误。
B、Fe、Cu、Zn三种金属由强到弱顺序排列顺序是Zn、Fe、Cu,故选项正确。
C、Fe、Cu、Zn三种金属由强到弱顺序排列顺序是Zn、Fe、Cu,故选项错误。
D、Fe、Cu、Zn三种金属由强到弱顺序排列顺序是Zn、Fe、Cu,故选项错误。
故选:B。
【点评】本题难度不大,考查了金属活动性顺序的应用,掌握金属活动性顺序并能灵活运用是正确解答此类题的关键所在.
3.等质量的镁、锌、铁分别跟足量的稀硫酸在室温下起反应,图测中能够正确反映产生氢气质量m与反应时间t关系的图象为( )
A. B.
C. D.
【分析】在金属活动性顺序中,氢前的金属能与酸反应生成氢气,且位置越靠前,反应的速率越快.
【解答】解:在金属活动性顺序中,镁>锌>铁,与硫酸反应时镁的速率最快,在坐标中斜线最陡,铁的反应速率最慢,在坐标中斜线最平缓,观察图象,排除BC,等质量的镁,锌,铁,分别跟足量的稀硫酸在室温下起反应,则镁生成的氢气最多,锌生成的氢气最少,观察图象,排除D,
故选:A。
【点评】本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.
4.将一定量的镁粉加入到硫酸铜、硫酸锌和硫酸亚铁的混合溶液中,充分反应后过滤,向滤渣中加入稀盐酸有气泡产生,下列叙述中正确的是( )
①滤渣里一定有镁
②滤渣里一定有铜
③向滤渣里加入稀盐酸,所得溶液会变成浅绿色
④滤液中溶质一定含有硫酸镁和硫酸锌
⑤滤液的颜色不可能为蓝色
A.①②④ B.②③⑤ C.②③④ D.①④⑤
【分析】镁的金属活动性比铜、铁、锌强,将一定量的镁粉加入到硫酸铜、硫酸锌和硫酸亚铁的混合溶液中,镁先与硫酸铜反应生成硫酸镁和铜,硫酸铜反应完,若还有镁粉,镁才能与硫酸亚铁反应生成硫酸镁和铁,硫酸亚铁反应完,若还有镁粉,镁才能与硫酸锌反应生成硝酸镁和锌,据此进行分析解答。
【解答】解:镁的金属活动性比铜、铁、锌强,将一定量的镁粉加入到硫酸铜、硫酸锌和硫酸亚铁的混合溶液中,镁先与硫酸铜反应生成硫酸镁和铜,硫酸铜反应完,若还有镁粉,镁才能与硫酸亚铁反应生成硫酸镁和铁,硫酸亚铁反应完,若还有镁粉,镁才能与硫酸锌反应生成硝酸镁和锌。充分反应后过滤,向滤渣中加入稀盐酸有气泡产生,说明滤渣中一定含有铁,可能含有锌、镁。
①滤渣里不一定有镁,故说法错误。
②滤渣里一定有铜,故说法正确。
③滤渣中一定含有铜、铁,向滤渣里加入稀盐酸,铁能与稀盐酸反应生成氯化亚铁溶液和氢气,所得溶液会变成浅绿色,故说法正确。
④滤液中溶质一定含有硫酸镁,不一定含有硫酸锌,故说法错误。
⑤滤渣中含有铁,则滤液中一定不含硫酸铜,滤液的颜色不可能为蓝色,故说法正确。
故②③⑤说法正确。
故选:B。
【点评】本题有一定难度,熟练掌握金属的化学性质、确定能发生的反应、综合考虑各种出现的情况是正确解答此类题的关键。
5.有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,Y溶解并产生氢气,而X不反应;如果把X和Z分别放入硝酸银溶液中,过一会儿,在X表面有银析出,而Z没有变化。根据以上实验事实,判断X、Y和z的金属活动顺序正确的是( )
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Z>X>Y
【分析】在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,据此判断能否发生反应,进而可确定三种金属活动性由强到弱的顺序。
【解答】解:有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,Y溶解并产生氢气,而X不反应,说明Y的位置排在氢的前面,X的位置排在氢的后面,即Y>H>X;如果把X和Z分别放入硝酸银溶液中,过一会儿,在X表面有银析出,而Z没有变化,说明X的金属活动性比银强,Z的金属活动性比银弱,即X>Ag>Z;则X、Y和Z的金属活动性顺序为:Y>X>Z。
故选:C。
【点评】本题难度不大,考查金属活动性应用,掌握金属活动性应用“反应则活泼、不反应则不活泼”是正确解答此类题的关键。
6.利用如图所示实验装置模拟工业炼铁。下列说法正确的是( )
A.反应前后Fe元素的化合价由+2价变为0价
B.充分加热,a处固体由黑色变为红色
C.b处可以用澄清石灰水检验生成的CO2
D.可用水吸收尾气中的CO
【分析】一氧化碳难溶于水,高温条件下红棕色固体氧化铁和一氧化碳反应生成黑色固体铁和二氧化碳,二氧化碳能使澄清石灰水变浑浊。
【解答】解:A、氧化铁中铁元素化合价是+3,反应后铁中铁元素化合价是0,该选项说法不正确;
B、氧化铁是红棕色固体,铁是黑色固体,充分加热,a处固体由红棕色变黑色,该选项说法不正确;
C、b处可以用澄清石灰水检验生成的CO2,该选项说法正确;
D、一氧化碳难溶于水,不能用水吸收一氧化碳,该选项说法不正确。
故选:C。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
7.将铁丝、铜丝分别伸入盛有同种试剂的两支试管中,能迅速比较出铁、铜金属活动性强弱的是( )
A.蒸馏水 B.稀硫酸
C.硫酸钠溶液 D.氢氧化钠溶液
【分析】在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,据此判断能否发生反应,进而可确定两种金属活动性由强到弱的顺序.
【解答】解:A、铁丝、铜丝在蒸馏水中均能生锈,但反应速率较慢,不能迅速比较出铁、铜金属活动性强弱,故选项错误;
B、将铁丝、铜丝分别伸入盛有稀硫酸的两支试管中,铁丝能与稀硫酸反应生成氢气,铜丝不能,说明活动性铁>氢>铜,能迅速比较出铁、铜金属活动性强弱,故选项正确;
C、将铁丝、铜丝分别伸入盛有硫酸钠溶液的两支试管中,均无明显变化,说明活动性钠>铁,钠>铜,无法确定铁和铜的活动性强弱,故选项错误;
D、将铁丝、铜丝分别伸入盛有氢氧化钠溶液的两支试管中,均无明显变化,无法确定铁和铜的活动性强弱,故选项错误。
故选:B。
【点评】本题难度不大,考查金属活动性应用,掌握金属活动性应用“反应则活泼、不反应则不活泼”是正确解答此类题的关键.
8.将X,Y,Z三种金属分别投入足量的稀硫酸中,只有X,Z能发生反应,并放出氢气.将Z投入X的硝酸盐溶液中,有金属X产生.则X,Y,Z三种金属的活动性由强到弱的顺序为( )
A.Z>Y>X B.Z>X>Y C.X>Z>Y D.Y>Z>X
【分析】因为“X,Z能发生反应,并放出氢气”,说明X、Z的金属活动性大于Y;“将Z投入X的硝酸盐溶液中,有金属X产生”,说明Z>X,则可知X,Y,Z三种金属的活动性由强到弱的顺序.
【解答】解:由题意“X,Z能发生反应,并放出氢气”,说明X、Z的金属活动性大于Y;“将Z投入X的硝酸盐溶液中,有金属X产生”,说明Z>X,则可知X,Y,Z三种金属的活动性由强到弱的顺序为:Z>X>Y。
故选:B。
【点评】利用金属活动性顺序,可知金属的活动性;学会利用它们处理和解释问题.
9.明代科学家宋应星所著的《天工开物》中,详细记述了金、铜、铁、锌等金属的开采和冶炼方法,记述的四种金属中金属活动性最强的是( )
A.铁 B.金 C.铜 D.锌
【分析】根据金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au,进行分析比较。
【解答】解:由根据金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au,则可知,金属活动性大小为:锌>铁>铜>金,所以D符合题意。
故选:D。
【点评】本题考查了常见金属的活动性顺序,完成此题,可以依据金属活动性顺序表进行。
10.能用金属与同一种稀酸反应制取的化合物是( )
A.ZnCl2、CuCl2 B.KCl、FeCl2
C.Fe2(SO4)3、FeSO4 D.K2SO3、Na2SO4
【分析】A、锌和稀盐酸反应生成氯化锌和氢气,铜不能和稀盐酸反应;
B、稀盐酸和钾反应生成氯化钾和氢气,和铁反应生成氯化亚铁和氢气;
C、铁和稀硫酸反应生成硫酸亚铁和氢气,氧化铁和稀硫酸反应生成硫酸铁和水;
D、钾和亚硫酸反应生成亚硫酸钾和氢气,钠和稀硫酸反应生成硫酸钠和氢气。
【解答】解:A、锌和稀盐酸反应生成氯化锌和氢气,铜不能和稀盐酸反应,该选项不符合题意;
B、稀盐酸和钾反应生成氯化钾和氢气,和铁反应生成氯化亚铁和氢气,该选项符合题意;
C、铁和稀硫酸反应生成硫酸亚铁和氢气,氧化铁和稀硫酸反应生成硫酸铁和水,该选项不符合题意;
D、钾和亚硫酸反应生成亚硫酸钾和氢气,钠和稀硫酸反应生成硫酸钠和氢气,该选项不符合题意。
故选:B。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
11.将一定量的锌粉加入到氯化亚铁、氯化铜和氯化镁的混合溶液中,反应一段时间后过滤,向滤渣中加入稀硫酸有气泡产生,则下列叙述正确的是( )
①滤渣中可能含有锌
②滤渣中一定含有铜和铁
③向滤渣中加入足量稀硫酸,最后溶液一定变成浅绿色
④滤液中溶质一定含有氯化锌和氯化镁
⑤滤液中一定不含铜离子
A.①③④⑤ B.①②③④⑤ C.①②③④ D.①②③⑤
【分析】金属活动性顺序中,排在氢前面的金属,能和稀盐酸或稀硫酸反应生成盐和氢气,排在前面的金属,能把排在后面的金属从它的盐溶液中置换出来。
【解答】解:将一定量的锌粉加入到氯化亚铁、氯化铜和氯化镁的混合溶液中,锌不能和氯化镁反应,先和氯化铜反应生成氯化锌和铜,后和氯化亚铁反应生成氯化锌和铁,反应一段时间后过滤,向滤渣中加入稀硫酸有气泡产生,说明滤渣中一定含有铁,可能含有锌,氯化铜完全反应;
①滤渣中可能含有锌,该选项说法正确;
②滤渣中一定含有铜和铁,该选项说法正确;
③向滤渣中加入足量稀硫酸,最后溶液一定变成浅绿色,该选项说法正确;
④滤液中溶质一定含有氯化锌和氯化镁,该选项说法正确;
⑤滤液中一定不含铜离子,是因为氯化铜完全反应,该选项说法正确。
故选:B。
【点评】要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.
12.金属与盐酸反应的示意图如图所示。下列说法错误的是( )
A.图中有三种金属可与盐酸反应
B.镁可以把铜从硫酸铜溶液中置换出来
C.产生的气体要进一步证明才能确定是否为氢气
D.铁与盐酸反应的化学方程式为:2Fe+6HCl═2FeCl3+3H2↑
【分析】金属活动性顺序中,排在氢前面的金属,能和稀盐酸或稀硫酸反应生成盐和氢气,排在前面的金属,能把排在后面的金属从它的盐溶液中置换出来。
【解答】解:A、图中有三种金属可与盐酸反应,即镁、锌、铁,该选项说法正确;
B、镁和硫酸铜反应生成硫酸镁和铜,该选项说法正确;
C、产生的气体要进一步证明才能确定是否为氢气,该选项说法正确;
D、铁与盐酸反应生成氯化亚铁和氢气,反应的化学方程式为:Fe+2HCl═FeCl2+H2↑,该选项说法不正确。
故选:D。
【点评】要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.
13.向AgNO3和Mg(NO3)2的混合溶液中加入一定质量的Al和Fe的混合粉末,充分反应后过滤,得到滤渣和浅绿色滤液。关于该滤渣和滤液有下列四种说法,正确的是( )
A.向滤渣中加入稀盐酸,一定有气泡产生
B.滤渣中一定含有Ag、Fe,一定不含Al
C.滤渣中一定含有Ag,可能含有Fe,一定不含Al
D.滤液中一定含有Fe(NO3)2和Mg(NO3)2,一定不含AgNO3,可能含有Al(NO3)3
【分析】镁最活泼,铝和铁与硝酸银溶液混合时,铝先和硝酸银反应,当铝完全反应后,铁再和硝酸银反应,再根据实验现象进行相关方面的判断.
【解答】解:根据金属活动性顺序,四种金属中镁最活泼,不能被Al和Fe从溶液中置换出来,Al先跟AgNO3溶液反应生成Ag和Al(NO3)3,滤渣中一定有Ag;
由于得到浅绿色滤液,说明有Fe2+离子存在,所以Al反应完全,且Fe与AgNO3溶液反应生成浅绿色的Fe(NO3)2溶液,是否反应完全不能肯定(即可能Fe与AgNO3中一种有剩余或恰好完全反应都不剩)。
A、如果滤渣中不含有没有反应的铁,则加入稀盐酸时没有气泡产生。不正确。
B、滤渣中一定含有银,Al反应完全,是否含有铁无法确定。不正确。
C、滤渣中一定含有Ag,可能含有Fe,一定不含Al。正确。
滤液中一定含有硝酸亚铁、硝酸铝、,可能含有没有反应的硝酸银。正确。
D、滤液中一定含有Fe(NO3)2、Mg(NO3)2、Al(NO3)3,可能含有硝酸银,也可能不含有硝酸银。不正确。
故选:C。
【点评】本题主要考查金属活动性顺序,因此要熟记金属活动性的内容,难度较大.
二.填空题(共4小题)
14.如图是某化学老师设计的一氧化碳还原氧化铁的实验装置(支持装置未画出)。
(1)实验前,应该先通入CO的目的是为了 排出装置内空气,防止点燃时发生爆炸 。
(2)装置A中现象是 红棕色固体变黑 ,发生反应的化学方程式为 Fe2O3+3CO2Fe+3CO2 。
(3)反应结束后熄灭酒精喷灯,继续通CO至装置冷却,此时B装置的作用是 吸收二氧化碳,收集尾气CO或处理尾气CO 。
【分析】(1)根据一氧化碳和空气的混合气点燃可能发生爆炸进行分析;
(2)根据A中一氧化碳还原氧化铁生成铁和二氧化碳来分析;
(3)根据氢氧化钙会与二氧化碳反应生成碳酸钙和水,一氧化碳有毒,需要尾气处理进行分析。
【解答】解:(1)一氧化碳和空气的混合气点燃可能发生爆炸,所以在加热氧化铁前需先通一会儿一氧化碳;
(2)A中一氧化碳还原氧化铁生成铁和二氧化碳,实验现象是红棕色固体变黑,反应的化学方程式是Fe2O3+3CO2Fe+3CO2;
(3)反应结束后熄灭酒精喷灯,继续通CO至装置冷却,此时B装置的作用是吸收二氧化碳,收集尾气CO或处理尾气CO;
故答案为:
(1)排出装置内空气,防止点燃时发生爆炸;
(2)红棕色固体变黑;Fe2O3+3CO2Fe+3CO2;
(3)吸收二氧化碳,收集尾气CO或处理尾气CO。
【点评】本题考查一氧化碳和氧化铁的反应现象和实验中操作注意事项,侧重实验能力和化学知识的综合应用.
15.某课外学习小组的同学为进一步探究活泼金属与酸反应的情况,做了以下两组对比实验(如图)。请根据实验Ⅰ、Ⅱ回答下列问题。
(1)实验Ⅰ反映了 同种金属与不同酸的反应 的剧烈程度不同;实验Ⅱ则表明了不同种金属与同种酸反应的剧烈程度不同,原因是 锌的金属活动性强于铁 ;写出实验Ⅱ中锌片与稀盐酸反应的化学方程式: Zn+2HCl=ZnCl2+H2↑ 。
(2)按照实验Ⅰ和Ⅱ的设计思路,请你再设计一组对比实验,简述实验方案: 取大小一致的锌片,分别插入10%的稀盐酸和5%的稀盐酸中,观察实验现象 。
【分析】(1)根据对比实验只有一个实验变量,在金属活动性顺序中,排在氢前面的金属能与盐酸或稀硫酸发生置换反应进行分析;
(2)根据探究同种金属与不同浓度的酸反应的剧烈程度,实验变量是酸的浓度不同进行分析。
【解答】解:(1)对比实验只有一个实验变量,实验Ⅰ的实验变量是酸的种类不同,所以反映了同种金属与不同酸反
应的剧烈程度不同;在金属活动性顺序中,排在氢前面的金属能与盐酸或稀硫酸发生置换反应,金属活动性越强,其与酸反应越剧烈,实验Ⅱ的实验变量是金属种类不同,表明了不同种金属与同种酸反应的剧烈程度不同,原因是锌的金属活动性强于铁;锌与稀盐酸反应生成氯化锌和氢气,该反应的化学方程式:Zn+2HCl=ZnCl2+H2↑,故答案为:同种金属与不同酸的反应;锌的金属活动性强于铁;Zn+2HCl=ZnCl2+H2↑。
(2)如果探究同种金属与不同浓度的酸反应的剧烈程度,实验变量是酸的浓度不同,实验方案是取大小相同的锌片,分别插入10%的稀盐酸和5%的稀盐酸中,观察现象,故答案为:酸的浓度不同,实验方案是取大小相同的锌片,分别插入10%的稀盐酸和5%的稀盐酸中,观察现象。
【点评】本题主要考查金属的化学性质等,注意化学方程式的规范书写。
16.置换反应是化学反应的基本类型之一.
(1)金属与盐溶液之间的置换反应,一般是活动性较强的金属可把活动性较弱的金属从其盐溶液中置换出来.如铜和硝酸银溶液的化学方程式为 Cu+2AgNO3=2Ag+Cu(NO3)2 .
(2)非金属单质也具有类似金属与盐溶液之间的置换反应的规律,即活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来,如在溶液中可发生下列反应:Cl2+2NaBr═2NaCl+Br2,I2+Na2S═2NaI+S↓,Br2+2KI═2KBr+I2 由此可判断:S、Cl2、I2、Br2非金属活动性由强到弱顺序是 Cl2>Br2>I2>S .
【分析】(1)根据化学反应的原理以及化学方程式的书写方法来分析;
(2)在金属活动性顺序中,排在前面的金属能够把排在后面的金属从它的盐溶液中置换出来;根据非金属单质也具有类似金属与盐溶液之间的置换反应规律,再结合化学方程式可以判断非金属单质的活泼性.
【解答】解:(1)铜与硝酸银反应生成银和硝酸铜;故填:Cu+2AgNO3=2Ag+Cu(NO3)2;
(2)因为活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来,由Cl2+2NaBr=2NaCl+Br2;I2+Na2S=2NaI+S↓;Br2+2KI=2KBr+I2可以判断出S、Cl2、I2、Br2活动性由强到弱的顺序是Cl2>Br2>I2>S.故填:Cl2>Br2>I2>S.
【点评】解答本题要充分理解金属活动性顺序的内容,只有这样才能对相关方面的问题做出正确的判断.
17.如图是课堂中模拟炼铁的实验装置.
(1)实验过程中,先要进行的是 II .(填I或Ⅱ)
I.加热Ⅱ.通一氧化碳
(2)A中反应的化学方程式是 3CO+Fe2O32Fe+3CO2 .B中反应的化学方程式是 Ca(OH)2+CO2═CaCO3↓+H2O ,B中观察到的现象是 澄清石灰水变浑浊 .
(3)该装置的不足之处是 C处没有尾气处理装置 .
【分析】(1)根据可燃性气体与空气混合后点燃可能发生爆炸进行分析判断.
(2)根据工业上炼铁的反应原理书写出反应的化学方程式即可.
(3)根据一氧化碳有毒,直接排放到空气中会造成空气污染,进行分析解答.
【解答】解:(1)一氧化碳具有可燃性,为防止CO与空气混合加热时引起爆炸,进行加热前要先通入CO排出装置内空气.
(2)装置A中盛放的红色粉末是氧化铁;工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为3CO+Fe2O32Fe+3CO2.
生成的二氧化碳与氢氧化钙反应生成不溶于水的白色沉淀碳酸钙,会使澄清石灰水变浑浊,反应方程式为:Ca(OH)2+CO2═CaCO3↓+H2O.
(3)一氧化碳有毒,不能直接排放到空气中去,应加装尾气处理装置.
故答案为:(1)II;(2)3CO+Fe2O32Fe+3CO2;Ca(OH)2+CO2═CaCO3↓+H2O;澄清石灰水变浑浊;(3)C处没有尾气处理装置.
【点评】本题难度不大,掌握工业上炼铁的反应原理、二氧化碳的检验方法等是正确解答本题的关键.
三.解答题(共3小题)
18.《天工开物》是明朝科学家宋应星编写的中国首部关于农业和手工业生产技术的百科全书,其中记载着采矿和冶炼金属锡的场景。
(1)采矿(如图1):“凡锡有山锡、水锡两种……水锡衡、永出溪中…愈经淘取,其砂日长,百年不竭”,锡主要以 化合物 (填“单质”或“化合物”)的形态存在于锡砂(锡矿石)中;水中淘取锡砂与 过滤 操作的原理相似,所用容器的孔径需 小于 (填“大于”或“小于”)锡砂颗粒大小。
(2)冶炼(如图2):“凡炼煎亦用洪炉。入砂数百斤,丛架木炭亦数百斤。鼓鞴(鼓入空气)熔化。火力已到,砂不即溶。用铅少许勾引,方始沛然流注”。炼锡时的关键步骤“点铅勾锡”指的是加铅能使锡较易熔化流出,其原因是 形成合金,使其熔点降低 。
(3)①糖果等食品常用银白色的被称为“锡纸”的材料进行包装,“锡纸”实际上是铝箔纸。铝可以制成铝箔,是因为它具有良好的 延展 性。
②将砂纸打磨过的“锡纸”放入 D (填标号)中,根据实验现象,结合金属活动性可证明“锡纸”非锡。
A.稀盐酸
B.稀硫酸
C.硫酸铜溶液
D.硫酸亚铁溶液
【分析】(1)根据混合物是由多种物质组成,单质是由一种元素组成的纯净物分析;
(2)根据合金的特性进行分析;
(3)根据金属的特性及金属活动性顺序中,前面的金属能把后面的金属从其盐溶液中置换出来进行分析。
【解答】解:(1)锡在自然界中主要以化合物的形态存在,水中淘取锡砂主要是固液分离,与过滤的操作相似,所用容器的孔径需小于锡砂颗粒大小,故答案为:化合物;过滤;小于;
(2)炼锡时的关键步骤“点铅勾锡”指的是加铅能使锡较易熔化流出,其原因是形成合金,使其熔点降低,故答案为:形成合金,使其熔点降低;
(3)①铝可以制成铝箔,是因为它具有良好的延展性;故答案为:延展性;
②A、铝和锡都能和稀盐酸反应,不能证明,错误;
B、铝和锡都能和稀硫酸反应,不能证明,错误;
C、两种金属都能置换出硫酸铜中的铜,不能证明,错误;
D、硫酸亚铁只与铝反应,和锡不反应,能证明,正确;
故选:D
【点评】氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来。
19.为了探究铜、锌、铁三种金属的活动性,康康把等表面积的铁片和锌片放入硫酸铜溶液中(如图所示)。请回答:
(1)如何判断它们是否发生了化学反应? 观察锌片和铁片表面是否有紫红色固体析出 。
(2)甲试管中反应前后溶液的质量 增重 (填“增重”、“不变”或“减轻”),乙中发生反应的化学方程式为 Fe+CuSO4=FeSO4+Cu 。
(3)上述实验不能够完全证明三种金属的活动性,需要补充的实验操作是 把锌片放入硫酸亚铁溶液中,观察现象 。
【分析】(1)从在金属活动顺序表中,由于铁和锌都排在铜的前面,都可以把铜从铜的盐溶液中置换出来,因此判断是否发生反应可以看金属表面是否有红色的铜出现去分析解答;
(2)从由于反应前后水的质量是不变的,反应前后溶液的质量的改变取决于溶质的质量变化、乙试管内发生的反应是铁和硫酸铜反应生成硫酸亚铁和铜去分析解答;
(3)从上述实验只能得出以下结论:Fe>Cu,不能得出铁的锌之间的关系,不能够完全证明三种金属的活动性,需要补充比较铁的锌之间的关系的实验去分析解答;
【解答】(1)把等表面积的铁片和锌片放入硫酸铜溶液中,在金属活动顺序表中,由于铁和锌都排在铜的前面,都可以把铜从铜的盐溶液中置换出来,因此判断是否发生反应可以看金属表面是否有红色的铜出现;故答案为:观察锌片和铁片表面是否有紫红色固体析出;
(2)甲试管中发生的是锌和硫酸铜的反应,反应后生成硫酸锌和铜,化学方程式为:Zn+CuSO4═ZnSO4+Cu;假如二者恰好完全反应,由于反应前后水的质量是不变的,反应前后溶液的质量的改变取决于溶质的质量变化,反应前溶质CuSO4是,它的相对分子质量为160,反应后的溶质ZnSO4是,它的相对分子质量为161;故反应后溶液的质量增加;乙试管内发生的反应是铁和硫酸铜反应生成硫酸亚铁和铜,其化学方程式为:Fe+CuSO4=FeSO4+Cu;故答案为:增重;Fe+CuSO4=FeSO4+Cu;
(3)上述实验只能得出以下结论:Fe>Cu,不能得出铁的锌之间的关系,不能够完全证明三种金属的活动性,需要补充比较铁的锌之间的关系的实验,可把把锌片放入硫酸亚铁溶液中,观察现象得出:Zn>Fe,故答案为:把锌片放入硫酸亚铁溶液中,观察现象。
【点评】本题主要考查测定空气里氧气含量的探究实验及金属的化学性质,综合性较强,能够体现学生的分析问题能力和解决问题能力.
20.2021年10月16日,搭载神舟十三号载人飞船的长征二号F遥十三运载火箭成功发射,将3位宇航员送入中国天宫空间站。飞行乘组将在轨驻留长达6个月时间,这是我国迄今为止时间最长的一次载人飞行。
(1)空间站的建设用到特殊规格的铝合金、钛合金等金属材料,他们具备很多优良性能是 B (填序号);
A.密度大、熔点高
B.强度好、硬度大
C.耐腐蚀、硬度小
(2)为了保障航天员的生命健康,科学家们精心研制出最新的环境控制和生命保障系统。早期空间站内二氧化碳可以由氢氧化锂(LiOH)吸收,其反应原理类似于实验室检验二氧化碳,写出该反应的化学方程式 2LiOH+CO2=Li2CO3+H2O ;
(3)铝合金中主要含有铝、铜、镁三种金属,为验证这三种金属的活动性顺序,某同学设计了如图实验,甲中铝丝表面会出现的现象是 有红色固体产生 ;某位同学认为实验乙、丙中均无明显现象,对完整的结论没有用都可以省去。你的看法是 B (填序号)。
A.乙、丙都不能省去
B.丙可以省去,乙不能省
C.乙可以省去,丙不能省
【分析】(1)根据合金的性质及优点进行分析;
(2)根据二氧化碳和碱溶液的反应进行分析;
(3)根据金属活动性进行分析。
【解答】解:(1)空间站的建设用到特殊规格的铝合金、钛合金等金属材料,优点是强度大,硬度大,故答案为:B;
(2)二氧化碳和氢氧化锂反应生成碳酸锂和水,化学方程式为2LiOH+CO2=Li2CO3+H2O,故答案为:2LiOH+CO2=Li2CO3+H2O;
(3)铝和硫酸铜反应生成铜和硫酸铝,实验现象是铝丝表面有红色固体产生,溶液由蓝色逐渐变为无色;丙实验和甲实验得出的结论是一样的,可以省略,乙实验中铝不能置换处镁,可以得出,镁和铝的金属活动性,不能省略,故选B,故答案为:有红色固体产生;B。
【点评】金属活动性顺序中,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来。
一.选择题(共13小题)
1.向100g CuSO4溶液中先逐渐加入一定量锌粉,再逐渐加入铁粉,测得剩余固体质量与加入金属质量关系如图。下列说法正确的是( )
A.a点对应的溶液为蓝色
B.n=6.5,m=9.6
C.b点对应的固体中加稀盐酸,有气泡产生
D.100g CuSO4溶液中CuSO4的质量为24g
2.下列各组金属的活动性符合由强到弱顺序排列的是( )
A.Fe、Cu、Zn B.Zn、Fe、Cu C.Cu、Fe、Zn D.Zn、Cu、Fe
3.等质量的镁、锌、铁分别跟足量的稀硫酸在室温下起反应,图测中能够正确反映产生氢气质量m与反应时间t关系的图象为( )
A. B.
C. D.
4.将一定量的镁粉加入到硫酸铜、硫酸锌和硫酸亚铁的混合溶液中,充分反应后过滤,向滤渣中加入稀盐酸有气泡产生,下列叙述中正确的是( )
①滤渣里一定有镁
②滤渣里一定有铜
③向滤渣里加入稀盐酸,所得溶液会变成浅绿色
④滤液中溶质一定含有硫酸镁和硫酸锌
⑤滤液的颜色不可能为蓝色
A.①②④ B.②③⑤ C.②③④ D.①④⑤
5.有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,Y溶解并产生氢气,而X不反应;如果把X和Z分别放入硝酸银溶液中,过一会儿,在X表面有银析出,而Z没有变化。根据以上实验事实,判断X、Y和z的金属活动顺序正确的是( )
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Z>X>Y
6.利用如图所示实验装置模拟工业炼铁。下列说法正确的是( )
A.反应前后Fe元素的化合价由+2价变为0价
B.充分加热,a处固体由黑色变为红色
C.b处可以用澄清石灰水检验生成的CO2
D.可用水吸收尾气中的CO
7.将铁丝、铜丝分别伸入盛有同种试剂的两支试管中,能迅速比较出铁、铜金属活动性强弱的是( )
A.蒸馏水 B.稀硫酸
C.硫酸钠溶液 D.氢氧化钠溶液
8.将X,Y,Z三种金属分别投入足量的稀硫酸中,只有X,Z能发生反应,并放出氢气.将Z投入X的硝酸盐溶液中,有金属X产生.则X,Y,Z三种金属的活动性由强到弱的顺序为( )
A.Z>Y>X B.Z>X>Y C.X>Z>Y D.Y>Z>X
9.明代科学家宋应星所著的《天工开物》中,详细记述了金、铜、铁、锌等金属的开采和冶炼方法,记述的四种金属中金属活动性最强的是( )
A.铁 B.金 C.铜 D.锌
10.能用金属与同一种稀酸反应制取的化合物是( )
A.ZnCl2、CuCl2 B.KCl、FeCl2
C.Fe2(SO4)3、FeSO4 D.K2SO3、Na2SO4
11.将一定量的锌粉加入到氯化亚铁、氯化铜和氯化镁的混合溶液中,反应一段时间后过滤,向滤渣中加入稀硫酸有气泡产生,则下列叙述正确的是( )
①滤渣中可能含有锌
②滤渣中一定含有铜和铁
③向滤渣中加入足量稀硫酸,最后溶液一定变成浅绿色
④滤液中溶质一定含有氯化锌和氯化镁
⑤滤液中一定不含铜离子
A.①③④⑤ B.①②③④⑤ C.①②③④ D.①②③⑤
12.金属与盐酸反应的示意图如图所示。下列说法错误的是( )
A.图中有三种金属可与盐酸反应
B.镁可以把铜从硫酸铜溶液中置换出来
C.产生的气体要进一步证明才能确定是否为氢气
D.铁与盐酸反应的化学方程式为:2Fe+6HCl═2FeCl3+3H2↑
13.向AgNO3和Mg(NO3)2的混合溶液中加入一定质量的Al和Fe的混合粉末,充分反应后过滤,得到滤渣和浅绿色滤液。关于该滤渣和滤液有下列四种说法,正确的是( )
A.向滤渣中加入稀盐酸,一定有气泡产生
B.滤渣中一定含有Ag、Fe,一定不含Al
C.滤渣中一定含有Ag,可能含有Fe,一定不含Al
D.滤液中一定含有Fe(NO3)2和Mg(NO3)2,一定不含AgNO3,可能含有Al(NO3)3
二.填空题(共4小题)
14.如图是某化学老师设计的一氧化碳还原氧化铁的实验装置(支持装置未画出)。
(1)实验前,应该先通入CO的目的是为了 。
(2)装置A中现象是 ,发生反应的化学方程式为 。
(3)反应结束后熄灭酒精喷灯,继续通CO至装置冷却,此时B装置的作用是 。
15.某课外学习小组的同学为进一步探究活泼金属与酸反应的情况,做了以下两组对比实验(如图)。请根据实验Ⅰ、Ⅱ回答下列问题。
(1)实验Ⅰ反映了 的剧烈程度不同;实验Ⅱ则表明了不同种金属与同种酸反应的剧烈程度不同,原因是 ;写出实验Ⅱ中锌片与稀盐酸反应的化学方程式: 。
(2)按照实验Ⅰ和Ⅱ的设计思路,请你再设计一组对比实验,简述实验方案: 。
16.置换反应是化学反应的基本类型之一.
(1)金属与盐溶液之间的置换反应,一般是活动性较强的金属可把活动性较弱的金属从其盐溶液中置换出来.如铜和硝酸银溶液的化学方程式为 .
(2)非金属单质也具有类似金属与盐溶液之间的置换反应的规律,即活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来,如在溶液中可发生下列反应:Cl2+2NaBr═2NaCl+Br2,I2+Na2S═2NaI+S↓,Br2+2KI═2KBr+I2 由此可判断:S、Cl2、I2、Br2非金属活动性由强到弱顺序是 .
17.如图是课堂中模拟炼铁的实验装置.
(1)实验过程中,先要进行的是 .(填I或Ⅱ)
I.加热Ⅱ.通一氧化碳
(2)A中反应的化学方程式是 .B中反应的化学方程式是 ,B中观察到的现象是 .
(3)该装置的不足之处是 .
三.解答题(共3小题)
18.《天工开物》是明朝科学家宋应星编写的中国首部关于农业和手工业生产技术的百科全书,其中记载着采矿和冶炼金属锡的场景。
(1)采矿(如图1):“凡锡有山锡、水锡两种……水锡衡、永出溪中…愈经淘取,其砂日长,百年不竭”,锡主要以 (填“单质”或“化合物”)的形态存在于锡砂(锡矿石)中;水中淘取锡砂与 操作的原理相似,所用容器的孔径需 (填“大于”或“小于”)锡砂颗粒大小。
(2)冶炼(如图2):“凡炼煎亦用洪炉。入砂数百斤,丛架木炭亦数百斤。鼓鞴(鼓入空气)熔化。火力已到,砂不即溶。用铅少许勾引,方始沛然流注”。炼锡时的关键步骤“点铅勾锡”指的是加铅能使锡较易熔化流出,其原因是 。
(3)①糖果等食品常用银白色的被称为“锡纸”的材料进行包装,“锡纸”实际上是铝箔纸。铝可以制成铝箔,是因为它具有良好的 性。
②将砂纸打磨过的“锡纸”放入 (填标号)中,根据实验现象,结合金属活动性可证明“锡纸”非锡。
A.稀盐酸
B.稀硫酸
C.硫酸铜溶液
D.硫酸亚铁溶液
19.为了探究铜、锌、铁三种金属的活动性,康康把等表面积的铁片和锌片放入硫酸铜溶液中(如图所示)。请回答:
(1)如何判断它们是否发生了化学反应? 。
(2)甲试管中反应前后溶液的质量 (填“增重”、“不变”或“减轻”),乙中发生反应的化学方程式为 。
(3)上述实验不能够完全证明三种金属的活动性,需要补充的实验操作是 。
20.2021年10月16日,搭载神舟十三号载人飞船的长征二号F遥十三运载火箭成功发射,将3位宇航员送入中国天宫空间站。飞行乘组将在轨驻留长达6个月时间,这是我国迄今为止时间最长的一次载人飞行。
(1)空间站的建设用到特殊规格的铝合金、钛合金等金属材料,他们具备很多优良性能是 (填序号);
A.密度大、熔点高
B.强度好、硬度大
C.耐腐蚀、硬度小
(2)为了保障航天员的生命健康,科学家们精心研制出最新的环境控制和生命保障系统。早期空间站内二氧化碳可以由氢氧化锂(LiOH)吸收,其反应原理类似于实验室检验二氧化碳,写出该反应的化学方程式 ;
(3)铝合金中主要含有铝、铜、镁三种金属,为验证这三种金属的活动性顺序,某同学设计了如图实验,甲中铝丝表面会出现的现象是 ;某位同学认为实验乙、丙中均无明显现象,对完整的结论没有用都可以省去。你的看法是 (填序号)。
A.乙、丙都不能省去
B.丙可以省去,乙不能省
C.乙可以省去,丙不能省
第二节金属的化学性质第九单元金属课后作业2021_2022学年九年级化学(鲁教版)
参考答案与试题解析
一.选择题(共13小题)
1.向100g CuSO4溶液中先逐渐加入一定量锌粉,再逐渐加入铁粉,测得剩余固体质量与加入金属质量关系如图。下列说法正确的是( )
A.a点对应的溶液为蓝色
B.n=6.5,m=9.6
C.b点对应的固体中加稀盐酸,有气泡产生
D.100g CuSO4溶液中CuSO4的质量为24g
【分析】向100gCuSO4溶液中先逐渐加入一定量锌粉,锌和硫酸铜反应生成硫酸锌和铜,反应后固体质量减小,再逐渐加入铁粉,铁和硫酸铜反应生成硫酸亚铁和铜,反应后固体质量增大。
【解答】解:A、a点时硫酸铜有剩余,对应的溶液为蓝色,该选项正确。
B、反应生成6.4g铜时消耗6.5g锌,n=6.5,反应的铁质量是14.9g﹣6.5g=8.4g时,生成铜质量是9.6g,m=9.6+6.4=16,该选项不正确。
C、b点对应的固体是铜,加稀盐酸,没有气泡产生,该选项不正确。
D、100gCuSO4溶液中CuSO4的质量为16g,该选项不正确。
故选:A。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
2.下列各组金属的活动性符合由强到弱顺序排列的是( )
A.Fe、Cu、Zn B.Zn、Fe、Cu C.Cu、Fe、Zn D.Zn、Cu、Fe
【分析】在金属活动性顺序中,金属的位置越靠前,金属的活动性越强,据此进行分析解答即可.
【解答】解:常见金属活动性顺序为K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
A、Fe、Cu、Zn三种金属由强到弱顺序排列顺序是Zn、Fe、Cu,故选项错误。
B、Fe、Cu、Zn三种金属由强到弱顺序排列顺序是Zn、Fe、Cu,故选项正确。
C、Fe、Cu、Zn三种金属由强到弱顺序排列顺序是Zn、Fe、Cu,故选项错误。
D、Fe、Cu、Zn三种金属由强到弱顺序排列顺序是Zn、Fe、Cu,故选项错误。
故选:B。
【点评】本题难度不大,考查了金属活动性顺序的应用,掌握金属活动性顺序并能灵活运用是正确解答此类题的关键所在.
3.等质量的镁、锌、铁分别跟足量的稀硫酸在室温下起反应,图测中能够正确反映产生氢气质量m与反应时间t关系的图象为( )
A. B.
C. D.
【分析】在金属活动性顺序中,氢前的金属能与酸反应生成氢气,且位置越靠前,反应的速率越快.
【解答】解:在金属活动性顺序中,镁>锌>铁,与硫酸反应时镁的速率最快,在坐标中斜线最陡,铁的反应速率最慢,在坐标中斜线最平缓,观察图象,排除BC,等质量的镁,锌,铁,分别跟足量的稀硫酸在室温下起反应,则镁生成的氢气最多,锌生成的氢气最少,观察图象,排除D,
故选:A。
【点评】本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.
4.将一定量的镁粉加入到硫酸铜、硫酸锌和硫酸亚铁的混合溶液中,充分反应后过滤,向滤渣中加入稀盐酸有气泡产生,下列叙述中正确的是( )
①滤渣里一定有镁
②滤渣里一定有铜
③向滤渣里加入稀盐酸,所得溶液会变成浅绿色
④滤液中溶质一定含有硫酸镁和硫酸锌
⑤滤液的颜色不可能为蓝色
A.①②④ B.②③⑤ C.②③④ D.①④⑤
【分析】镁的金属活动性比铜、铁、锌强,将一定量的镁粉加入到硫酸铜、硫酸锌和硫酸亚铁的混合溶液中,镁先与硫酸铜反应生成硫酸镁和铜,硫酸铜反应完,若还有镁粉,镁才能与硫酸亚铁反应生成硫酸镁和铁,硫酸亚铁反应完,若还有镁粉,镁才能与硫酸锌反应生成硝酸镁和锌,据此进行分析解答。
【解答】解:镁的金属活动性比铜、铁、锌强,将一定量的镁粉加入到硫酸铜、硫酸锌和硫酸亚铁的混合溶液中,镁先与硫酸铜反应生成硫酸镁和铜,硫酸铜反应完,若还有镁粉,镁才能与硫酸亚铁反应生成硫酸镁和铁,硫酸亚铁反应完,若还有镁粉,镁才能与硫酸锌反应生成硝酸镁和锌。充分反应后过滤,向滤渣中加入稀盐酸有气泡产生,说明滤渣中一定含有铁,可能含有锌、镁。
①滤渣里不一定有镁,故说法错误。
②滤渣里一定有铜,故说法正确。
③滤渣中一定含有铜、铁,向滤渣里加入稀盐酸,铁能与稀盐酸反应生成氯化亚铁溶液和氢气,所得溶液会变成浅绿色,故说法正确。
④滤液中溶质一定含有硫酸镁,不一定含有硫酸锌,故说法错误。
⑤滤渣中含有铁,则滤液中一定不含硫酸铜,滤液的颜色不可能为蓝色,故说法正确。
故②③⑤说法正确。
故选:B。
【点评】本题有一定难度,熟练掌握金属的化学性质、确定能发生的反应、综合考虑各种出现的情况是正确解答此类题的关键。
5.有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,Y溶解并产生氢气,而X不反应;如果把X和Z分别放入硝酸银溶液中,过一会儿,在X表面有银析出,而Z没有变化。根据以上实验事实,判断X、Y和z的金属活动顺序正确的是( )
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Z>X>Y
【分析】在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,据此判断能否发生反应,进而可确定三种金属活动性由强到弱的顺序。
【解答】解:有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,Y溶解并产生氢气,而X不反应,说明Y的位置排在氢的前面,X的位置排在氢的后面,即Y>H>X;如果把X和Z分别放入硝酸银溶液中,过一会儿,在X表面有银析出,而Z没有变化,说明X的金属活动性比银强,Z的金属活动性比银弱,即X>Ag>Z;则X、Y和Z的金属活动性顺序为:Y>X>Z。
故选:C。
【点评】本题难度不大,考查金属活动性应用,掌握金属活动性应用“反应则活泼、不反应则不活泼”是正确解答此类题的关键。
6.利用如图所示实验装置模拟工业炼铁。下列说法正确的是( )
A.反应前后Fe元素的化合价由+2价变为0价
B.充分加热,a处固体由黑色变为红色
C.b处可以用澄清石灰水检验生成的CO2
D.可用水吸收尾气中的CO
【分析】一氧化碳难溶于水,高温条件下红棕色固体氧化铁和一氧化碳反应生成黑色固体铁和二氧化碳,二氧化碳能使澄清石灰水变浑浊。
【解答】解:A、氧化铁中铁元素化合价是+3,反应后铁中铁元素化合价是0,该选项说法不正确;
B、氧化铁是红棕色固体,铁是黑色固体,充分加热,a处固体由红棕色变黑色,该选项说法不正确;
C、b处可以用澄清石灰水检验生成的CO2,该选项说法正确;
D、一氧化碳难溶于水,不能用水吸收一氧化碳,该选项说法不正确。
故选:C。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
7.将铁丝、铜丝分别伸入盛有同种试剂的两支试管中,能迅速比较出铁、铜金属活动性强弱的是( )
A.蒸馏水 B.稀硫酸
C.硫酸钠溶液 D.氢氧化钠溶液
【分析】在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,据此判断能否发生反应,进而可确定两种金属活动性由强到弱的顺序.
【解答】解:A、铁丝、铜丝在蒸馏水中均能生锈,但反应速率较慢,不能迅速比较出铁、铜金属活动性强弱,故选项错误;
B、将铁丝、铜丝分别伸入盛有稀硫酸的两支试管中,铁丝能与稀硫酸反应生成氢气,铜丝不能,说明活动性铁>氢>铜,能迅速比较出铁、铜金属活动性强弱,故选项正确;
C、将铁丝、铜丝分别伸入盛有硫酸钠溶液的两支试管中,均无明显变化,说明活动性钠>铁,钠>铜,无法确定铁和铜的活动性强弱,故选项错误;
D、将铁丝、铜丝分别伸入盛有氢氧化钠溶液的两支试管中,均无明显变化,无法确定铁和铜的活动性强弱,故选项错误。
故选:B。
【点评】本题难度不大,考查金属活动性应用,掌握金属活动性应用“反应则活泼、不反应则不活泼”是正确解答此类题的关键.
8.将X,Y,Z三种金属分别投入足量的稀硫酸中,只有X,Z能发生反应,并放出氢气.将Z投入X的硝酸盐溶液中,有金属X产生.则X,Y,Z三种金属的活动性由强到弱的顺序为( )
A.Z>Y>X B.Z>X>Y C.X>Z>Y D.Y>Z>X
【分析】因为“X,Z能发生反应,并放出氢气”,说明X、Z的金属活动性大于Y;“将Z投入X的硝酸盐溶液中,有金属X产生”,说明Z>X,则可知X,Y,Z三种金属的活动性由强到弱的顺序.
【解答】解:由题意“X,Z能发生反应,并放出氢气”,说明X、Z的金属活动性大于Y;“将Z投入X的硝酸盐溶液中,有金属X产生”,说明Z>X,则可知X,Y,Z三种金属的活动性由强到弱的顺序为:Z>X>Y。
故选:B。
【点评】利用金属活动性顺序,可知金属的活动性;学会利用它们处理和解释问题.
9.明代科学家宋应星所著的《天工开物》中,详细记述了金、铜、铁、锌等金属的开采和冶炼方法,记述的四种金属中金属活动性最强的是( )
A.铁 B.金 C.铜 D.锌
【分析】根据金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au,进行分析比较。
【解答】解:由根据金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au,则可知,金属活动性大小为:锌>铁>铜>金,所以D符合题意。
故选:D。
【点评】本题考查了常见金属的活动性顺序,完成此题,可以依据金属活动性顺序表进行。
10.能用金属与同一种稀酸反应制取的化合物是( )
A.ZnCl2、CuCl2 B.KCl、FeCl2
C.Fe2(SO4)3、FeSO4 D.K2SO3、Na2SO4
【分析】A、锌和稀盐酸反应生成氯化锌和氢气,铜不能和稀盐酸反应;
B、稀盐酸和钾反应生成氯化钾和氢气,和铁反应生成氯化亚铁和氢气;
C、铁和稀硫酸反应生成硫酸亚铁和氢气,氧化铁和稀硫酸反应生成硫酸铁和水;
D、钾和亚硫酸反应生成亚硫酸钾和氢气,钠和稀硫酸反应生成硫酸钠和氢气。
【解答】解:A、锌和稀盐酸反应生成氯化锌和氢气,铜不能和稀盐酸反应,该选项不符合题意;
B、稀盐酸和钾反应生成氯化钾和氢气,和铁反应生成氯化亚铁和氢气,该选项符合题意;
C、铁和稀硫酸反应生成硫酸亚铁和氢气,氧化铁和稀硫酸反应生成硫酸铁和水,该选项不符合题意;
D、钾和亚硫酸反应生成亚硫酸钾和氢气,钠和稀硫酸反应生成硫酸钠和氢气,该选项不符合题意。
故选:B。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
11.将一定量的锌粉加入到氯化亚铁、氯化铜和氯化镁的混合溶液中,反应一段时间后过滤,向滤渣中加入稀硫酸有气泡产生,则下列叙述正确的是( )
①滤渣中可能含有锌
②滤渣中一定含有铜和铁
③向滤渣中加入足量稀硫酸,最后溶液一定变成浅绿色
④滤液中溶质一定含有氯化锌和氯化镁
⑤滤液中一定不含铜离子
A.①③④⑤ B.①②③④⑤ C.①②③④ D.①②③⑤
【分析】金属活动性顺序中,排在氢前面的金属,能和稀盐酸或稀硫酸反应生成盐和氢气,排在前面的金属,能把排在后面的金属从它的盐溶液中置换出来。
【解答】解:将一定量的锌粉加入到氯化亚铁、氯化铜和氯化镁的混合溶液中,锌不能和氯化镁反应,先和氯化铜反应生成氯化锌和铜,后和氯化亚铁反应生成氯化锌和铁,反应一段时间后过滤,向滤渣中加入稀硫酸有气泡产生,说明滤渣中一定含有铁,可能含有锌,氯化铜完全反应;
①滤渣中可能含有锌,该选项说法正确;
②滤渣中一定含有铜和铁,该选项说法正确;
③向滤渣中加入足量稀硫酸,最后溶液一定变成浅绿色,该选项说法正确;
④滤液中溶质一定含有氯化锌和氯化镁,该选项说法正确;
⑤滤液中一定不含铜离子,是因为氯化铜完全反应,该选项说法正确。
故选:B。
【点评】要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.
12.金属与盐酸反应的示意图如图所示。下列说法错误的是( )
A.图中有三种金属可与盐酸反应
B.镁可以把铜从硫酸铜溶液中置换出来
C.产生的气体要进一步证明才能确定是否为氢气
D.铁与盐酸反应的化学方程式为:2Fe+6HCl═2FeCl3+3H2↑
【分析】金属活动性顺序中,排在氢前面的金属,能和稀盐酸或稀硫酸反应生成盐和氢气,排在前面的金属,能把排在后面的金属从它的盐溶液中置换出来。
【解答】解:A、图中有三种金属可与盐酸反应,即镁、锌、铁,该选项说法正确;
B、镁和硫酸铜反应生成硫酸镁和铜,该选项说法正确;
C、产生的气体要进一步证明才能确定是否为氢气,该选项说法正确;
D、铁与盐酸反应生成氯化亚铁和氢气,反应的化学方程式为:Fe+2HCl═FeCl2+H2↑,该选项说法不正确。
故选:D。
【点评】要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.
13.向AgNO3和Mg(NO3)2的混合溶液中加入一定质量的Al和Fe的混合粉末,充分反应后过滤,得到滤渣和浅绿色滤液。关于该滤渣和滤液有下列四种说法,正确的是( )
A.向滤渣中加入稀盐酸,一定有气泡产生
B.滤渣中一定含有Ag、Fe,一定不含Al
C.滤渣中一定含有Ag,可能含有Fe,一定不含Al
D.滤液中一定含有Fe(NO3)2和Mg(NO3)2,一定不含AgNO3,可能含有Al(NO3)3
【分析】镁最活泼,铝和铁与硝酸银溶液混合时,铝先和硝酸银反应,当铝完全反应后,铁再和硝酸银反应,再根据实验现象进行相关方面的判断.
【解答】解:根据金属活动性顺序,四种金属中镁最活泼,不能被Al和Fe从溶液中置换出来,Al先跟AgNO3溶液反应生成Ag和Al(NO3)3,滤渣中一定有Ag;
由于得到浅绿色滤液,说明有Fe2+离子存在,所以Al反应完全,且Fe与AgNO3溶液反应生成浅绿色的Fe(NO3)2溶液,是否反应完全不能肯定(即可能Fe与AgNO3中一种有剩余或恰好完全反应都不剩)。
A、如果滤渣中不含有没有反应的铁,则加入稀盐酸时没有气泡产生。不正确。
B、滤渣中一定含有银,Al反应完全,是否含有铁无法确定。不正确。
C、滤渣中一定含有Ag,可能含有Fe,一定不含Al。正确。
滤液中一定含有硝酸亚铁、硝酸铝、,可能含有没有反应的硝酸银。正确。
D、滤液中一定含有Fe(NO3)2、Mg(NO3)2、Al(NO3)3,可能含有硝酸银,也可能不含有硝酸银。不正确。
故选:C。
【点评】本题主要考查金属活动性顺序,因此要熟记金属活动性的内容,难度较大.
二.填空题(共4小题)
14.如图是某化学老师设计的一氧化碳还原氧化铁的实验装置(支持装置未画出)。
(1)实验前,应该先通入CO的目的是为了 排出装置内空气,防止点燃时发生爆炸 。
(2)装置A中现象是 红棕色固体变黑 ,发生反应的化学方程式为 Fe2O3+3CO2Fe+3CO2 。
(3)反应结束后熄灭酒精喷灯,继续通CO至装置冷却,此时B装置的作用是 吸收二氧化碳,收集尾气CO或处理尾气CO 。
【分析】(1)根据一氧化碳和空气的混合气点燃可能发生爆炸进行分析;
(2)根据A中一氧化碳还原氧化铁生成铁和二氧化碳来分析;
(3)根据氢氧化钙会与二氧化碳反应生成碳酸钙和水,一氧化碳有毒,需要尾气处理进行分析。
【解答】解:(1)一氧化碳和空气的混合气点燃可能发生爆炸,所以在加热氧化铁前需先通一会儿一氧化碳;
(2)A中一氧化碳还原氧化铁生成铁和二氧化碳,实验现象是红棕色固体变黑,反应的化学方程式是Fe2O3+3CO2Fe+3CO2;
(3)反应结束后熄灭酒精喷灯,继续通CO至装置冷却,此时B装置的作用是吸收二氧化碳,收集尾气CO或处理尾气CO;
故答案为:
(1)排出装置内空气,防止点燃时发生爆炸;
(2)红棕色固体变黑;Fe2O3+3CO2Fe+3CO2;
(3)吸收二氧化碳,收集尾气CO或处理尾气CO。
【点评】本题考查一氧化碳和氧化铁的反应现象和实验中操作注意事项,侧重实验能力和化学知识的综合应用.
15.某课外学习小组的同学为进一步探究活泼金属与酸反应的情况,做了以下两组对比实验(如图)。请根据实验Ⅰ、Ⅱ回答下列问题。
(1)实验Ⅰ反映了 同种金属与不同酸的反应 的剧烈程度不同;实验Ⅱ则表明了不同种金属与同种酸反应的剧烈程度不同,原因是 锌的金属活动性强于铁 ;写出实验Ⅱ中锌片与稀盐酸反应的化学方程式: Zn+2HCl=ZnCl2+H2↑ 。
(2)按照实验Ⅰ和Ⅱ的设计思路,请你再设计一组对比实验,简述实验方案: 取大小一致的锌片,分别插入10%的稀盐酸和5%的稀盐酸中,观察实验现象 。
【分析】(1)根据对比实验只有一个实验变量,在金属活动性顺序中,排在氢前面的金属能与盐酸或稀硫酸发生置换反应进行分析;
(2)根据探究同种金属与不同浓度的酸反应的剧烈程度,实验变量是酸的浓度不同进行分析。
【解答】解:(1)对比实验只有一个实验变量,实验Ⅰ的实验变量是酸的种类不同,所以反映了同种金属与不同酸反
应的剧烈程度不同;在金属活动性顺序中,排在氢前面的金属能与盐酸或稀硫酸发生置换反应,金属活动性越强,其与酸反应越剧烈,实验Ⅱ的实验变量是金属种类不同,表明了不同种金属与同种酸反应的剧烈程度不同,原因是锌的金属活动性强于铁;锌与稀盐酸反应生成氯化锌和氢气,该反应的化学方程式:Zn+2HCl=ZnCl2+H2↑,故答案为:同种金属与不同酸的反应;锌的金属活动性强于铁;Zn+2HCl=ZnCl2+H2↑。
(2)如果探究同种金属与不同浓度的酸反应的剧烈程度,实验变量是酸的浓度不同,实验方案是取大小相同的锌片,分别插入10%的稀盐酸和5%的稀盐酸中,观察现象,故答案为:酸的浓度不同,实验方案是取大小相同的锌片,分别插入10%的稀盐酸和5%的稀盐酸中,观察现象。
【点评】本题主要考查金属的化学性质等,注意化学方程式的规范书写。
16.置换反应是化学反应的基本类型之一.
(1)金属与盐溶液之间的置换反应,一般是活动性较强的金属可把活动性较弱的金属从其盐溶液中置换出来.如铜和硝酸银溶液的化学方程式为 Cu+2AgNO3=2Ag+Cu(NO3)2 .
(2)非金属单质也具有类似金属与盐溶液之间的置换反应的规律,即活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来,如在溶液中可发生下列反应:Cl2+2NaBr═2NaCl+Br2,I2+Na2S═2NaI+S↓,Br2+2KI═2KBr+I2 由此可判断:S、Cl2、I2、Br2非金属活动性由强到弱顺序是 Cl2>Br2>I2>S .
【分析】(1)根据化学反应的原理以及化学方程式的书写方法来分析;
(2)在金属活动性顺序中,排在前面的金属能够把排在后面的金属从它的盐溶液中置换出来;根据非金属单质也具有类似金属与盐溶液之间的置换反应规律,再结合化学方程式可以判断非金属单质的活泼性.
【解答】解:(1)铜与硝酸银反应生成银和硝酸铜;故填:Cu+2AgNO3=2Ag+Cu(NO3)2;
(2)因为活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来,由Cl2+2NaBr=2NaCl+Br2;I2+Na2S=2NaI+S↓;Br2+2KI=2KBr+I2可以判断出S、Cl2、I2、Br2活动性由强到弱的顺序是Cl2>Br2>I2>S.故填:Cl2>Br2>I2>S.
【点评】解答本题要充分理解金属活动性顺序的内容,只有这样才能对相关方面的问题做出正确的判断.
17.如图是课堂中模拟炼铁的实验装置.
(1)实验过程中,先要进行的是 II .(填I或Ⅱ)
I.加热Ⅱ.通一氧化碳
(2)A中反应的化学方程式是 3CO+Fe2O32Fe+3CO2 .B中反应的化学方程式是 Ca(OH)2+CO2═CaCO3↓+H2O ,B中观察到的现象是 澄清石灰水变浑浊 .
(3)该装置的不足之处是 C处没有尾气处理装置 .
【分析】(1)根据可燃性气体与空气混合后点燃可能发生爆炸进行分析判断.
(2)根据工业上炼铁的反应原理书写出反应的化学方程式即可.
(3)根据一氧化碳有毒,直接排放到空气中会造成空气污染,进行分析解答.
【解答】解:(1)一氧化碳具有可燃性,为防止CO与空气混合加热时引起爆炸,进行加热前要先通入CO排出装置内空气.
(2)装置A中盛放的红色粉末是氧化铁;工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为3CO+Fe2O32Fe+3CO2.
生成的二氧化碳与氢氧化钙反应生成不溶于水的白色沉淀碳酸钙,会使澄清石灰水变浑浊,反应方程式为:Ca(OH)2+CO2═CaCO3↓+H2O.
(3)一氧化碳有毒,不能直接排放到空气中去,应加装尾气处理装置.
故答案为:(1)II;(2)3CO+Fe2O32Fe+3CO2;Ca(OH)2+CO2═CaCO3↓+H2O;澄清石灰水变浑浊;(3)C处没有尾气处理装置.
【点评】本题难度不大,掌握工业上炼铁的反应原理、二氧化碳的检验方法等是正确解答本题的关键.
三.解答题(共3小题)
18.《天工开物》是明朝科学家宋应星编写的中国首部关于农业和手工业生产技术的百科全书,其中记载着采矿和冶炼金属锡的场景。
(1)采矿(如图1):“凡锡有山锡、水锡两种……水锡衡、永出溪中…愈经淘取,其砂日长,百年不竭”,锡主要以 化合物 (填“单质”或“化合物”)的形态存在于锡砂(锡矿石)中;水中淘取锡砂与 过滤 操作的原理相似,所用容器的孔径需 小于 (填“大于”或“小于”)锡砂颗粒大小。
(2)冶炼(如图2):“凡炼煎亦用洪炉。入砂数百斤,丛架木炭亦数百斤。鼓鞴(鼓入空气)熔化。火力已到,砂不即溶。用铅少许勾引,方始沛然流注”。炼锡时的关键步骤“点铅勾锡”指的是加铅能使锡较易熔化流出,其原因是 形成合金,使其熔点降低 。
(3)①糖果等食品常用银白色的被称为“锡纸”的材料进行包装,“锡纸”实际上是铝箔纸。铝可以制成铝箔,是因为它具有良好的 延展 性。
②将砂纸打磨过的“锡纸”放入 D (填标号)中,根据实验现象,结合金属活动性可证明“锡纸”非锡。
A.稀盐酸
B.稀硫酸
C.硫酸铜溶液
D.硫酸亚铁溶液
【分析】(1)根据混合物是由多种物质组成,单质是由一种元素组成的纯净物分析;
(2)根据合金的特性进行分析;
(3)根据金属的特性及金属活动性顺序中,前面的金属能把后面的金属从其盐溶液中置换出来进行分析。
【解答】解:(1)锡在自然界中主要以化合物的形态存在,水中淘取锡砂主要是固液分离,与过滤的操作相似,所用容器的孔径需小于锡砂颗粒大小,故答案为:化合物;过滤;小于;
(2)炼锡时的关键步骤“点铅勾锡”指的是加铅能使锡较易熔化流出,其原因是形成合金,使其熔点降低,故答案为:形成合金,使其熔点降低;
(3)①铝可以制成铝箔,是因为它具有良好的延展性;故答案为:延展性;
②A、铝和锡都能和稀盐酸反应,不能证明,错误;
B、铝和锡都能和稀硫酸反应,不能证明,错误;
C、两种金属都能置换出硫酸铜中的铜,不能证明,错误;
D、硫酸亚铁只与铝反应,和锡不反应,能证明,正确;
故选:D
【点评】氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来。
19.为了探究铜、锌、铁三种金属的活动性,康康把等表面积的铁片和锌片放入硫酸铜溶液中(如图所示)。请回答:
(1)如何判断它们是否发生了化学反应? 观察锌片和铁片表面是否有紫红色固体析出 。
(2)甲试管中反应前后溶液的质量 增重 (填“增重”、“不变”或“减轻”),乙中发生反应的化学方程式为 Fe+CuSO4=FeSO4+Cu 。
(3)上述实验不能够完全证明三种金属的活动性,需要补充的实验操作是 把锌片放入硫酸亚铁溶液中,观察现象 。
【分析】(1)从在金属活动顺序表中,由于铁和锌都排在铜的前面,都可以把铜从铜的盐溶液中置换出来,因此判断是否发生反应可以看金属表面是否有红色的铜出现去分析解答;
(2)从由于反应前后水的质量是不变的,反应前后溶液的质量的改变取决于溶质的质量变化、乙试管内发生的反应是铁和硫酸铜反应生成硫酸亚铁和铜去分析解答;
(3)从上述实验只能得出以下结论:Fe>Cu,不能得出铁的锌之间的关系,不能够完全证明三种金属的活动性,需要补充比较铁的锌之间的关系的实验去分析解答;
【解答】(1)把等表面积的铁片和锌片放入硫酸铜溶液中,在金属活动顺序表中,由于铁和锌都排在铜的前面,都可以把铜从铜的盐溶液中置换出来,因此判断是否发生反应可以看金属表面是否有红色的铜出现;故答案为:观察锌片和铁片表面是否有紫红色固体析出;
(2)甲试管中发生的是锌和硫酸铜的反应,反应后生成硫酸锌和铜,化学方程式为:Zn+CuSO4═ZnSO4+Cu;假如二者恰好完全反应,由于反应前后水的质量是不变的,反应前后溶液的质量的改变取决于溶质的质量变化,反应前溶质CuSO4是,它的相对分子质量为160,反应后的溶质ZnSO4是,它的相对分子质量为161;故反应后溶液的质量增加;乙试管内发生的反应是铁和硫酸铜反应生成硫酸亚铁和铜,其化学方程式为:Fe+CuSO4=FeSO4+Cu;故答案为:增重;Fe+CuSO4=FeSO4+Cu;
(3)上述实验只能得出以下结论:Fe>Cu,不能得出铁的锌之间的关系,不能够完全证明三种金属的活动性,需要补充比较铁的锌之间的关系的实验,可把把锌片放入硫酸亚铁溶液中,观察现象得出:Zn>Fe,故答案为:把锌片放入硫酸亚铁溶液中,观察现象。
【点评】本题主要考查测定空气里氧气含量的探究实验及金属的化学性质,综合性较强,能够体现学生的分析问题能力和解决问题能力.
20.2021年10月16日,搭载神舟十三号载人飞船的长征二号F遥十三运载火箭成功发射,将3位宇航员送入中国天宫空间站。飞行乘组将在轨驻留长达6个月时间,这是我国迄今为止时间最长的一次载人飞行。
(1)空间站的建设用到特殊规格的铝合金、钛合金等金属材料,他们具备很多优良性能是 B (填序号);
A.密度大、熔点高
B.强度好、硬度大
C.耐腐蚀、硬度小
(2)为了保障航天员的生命健康,科学家们精心研制出最新的环境控制和生命保障系统。早期空间站内二氧化碳可以由氢氧化锂(LiOH)吸收,其反应原理类似于实验室检验二氧化碳,写出该反应的化学方程式 2LiOH+CO2=Li2CO3+H2O ;
(3)铝合金中主要含有铝、铜、镁三种金属,为验证这三种金属的活动性顺序,某同学设计了如图实验,甲中铝丝表面会出现的现象是 有红色固体产生 ;某位同学认为实验乙、丙中均无明显现象,对完整的结论没有用都可以省去。你的看法是 B (填序号)。
A.乙、丙都不能省去
B.丙可以省去,乙不能省
C.乙可以省去,丙不能省
【分析】(1)根据合金的性质及优点进行分析;
(2)根据二氧化碳和碱溶液的反应进行分析;
(3)根据金属活动性进行分析。
【解答】解:(1)空间站的建设用到特殊规格的铝合金、钛合金等金属材料,优点是强度大,硬度大,故答案为:B;
(2)二氧化碳和氢氧化锂反应生成碳酸锂和水,化学方程式为2LiOH+CO2=Li2CO3+H2O,故答案为:2LiOH+CO2=Li2CO3+H2O;
(3)铝和硫酸铜反应生成铜和硫酸铝,实验现象是铝丝表面有红色固体产生,溶液由蓝色逐渐变为无色;丙实验和甲实验得出的结论是一样的,可以省略,乙实验中铝不能置换处镁,可以得出,镁和铝的金属活动性,不能省略,故选B,故答案为:有红色固体产生;B。
【点评】金属活动性顺序中,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
