人教版九年级化学《 第三单元 物质构成的奥秘》复习课件(23张PPT)
文档属性
| 名称 | 人教版九年级化学《 第三单元 物质构成的奥秘》复习课件(23张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-28 16:17:53 | ||
图片预览





文档简介
(共23张PPT)
第三单元 物质构成的奥秘
【复习目标】
1、知道原子是由原子核和核外电子构成的。
2、知道分子、原子、离子的区别。
3、知道原子可以结合成分子、同一元素的原子、离子可以相互转化。
4、会用微粒的观点解释生活中的现象。
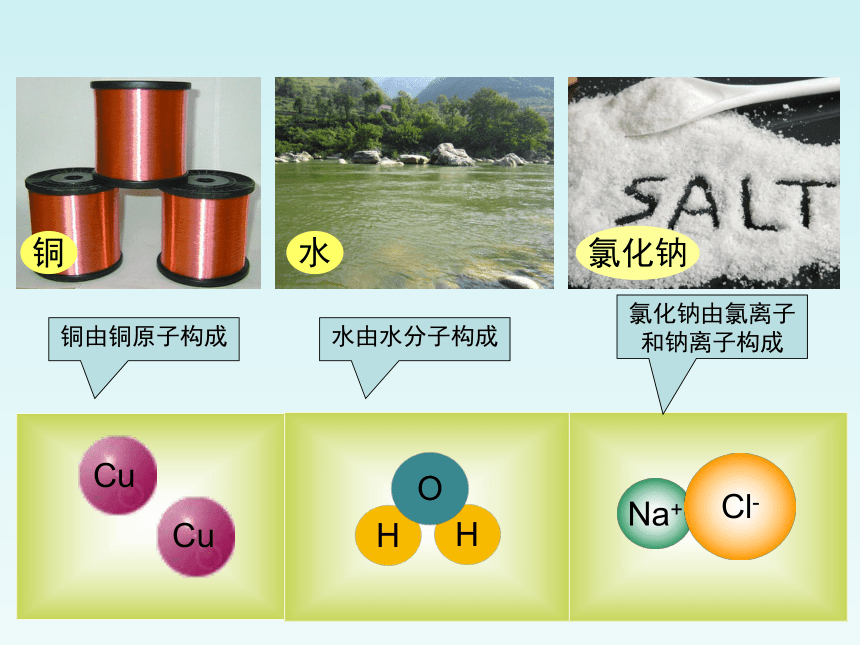
氯化钠
水
Na
Na+
Cl-
Cu
Cu
铜
H
H
O
铜由铜原子构成
水由水分子构成
氯化钠由氯离子和钠离子构成
-----分子是一种保特物质化学性质的最小粒子。
分子有哪些基本性质呢?
1、同种分子化学性质相同;
2、分子体积小,质量小;
4、分子间存在相互作用,在不停地运动。
3、分子之间有间隙;
【分子】
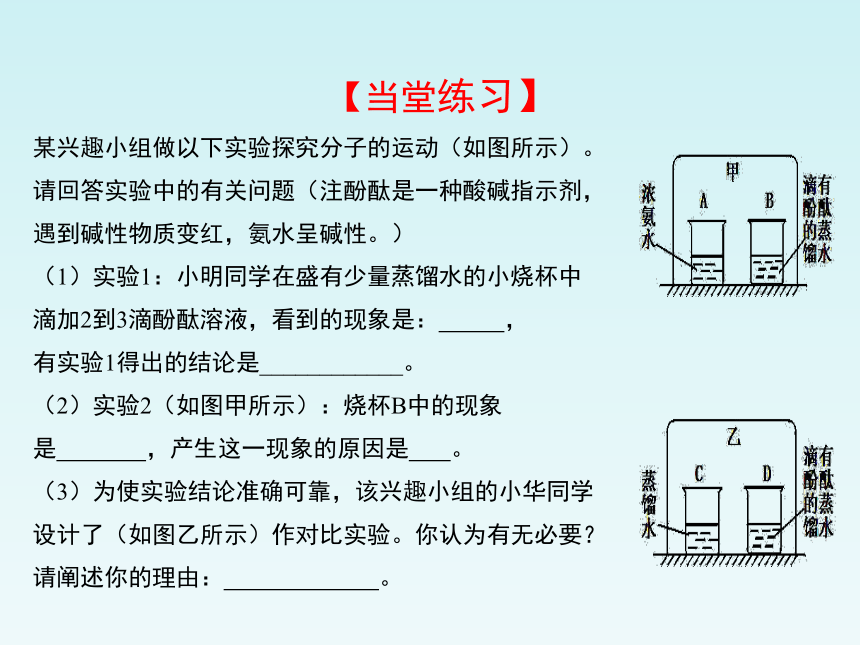
某兴趣小组做以下实验探究分子的运动(如图所示)。
请回答实验中的有关问题(注酚酞是一种酸碱指示剂,
遇到碱性物质变红,氨水呈碱性。)
(1)实验1:小明同学在盛有少量蒸馏水的小烧杯中
滴加2到3滴酚酞溶液,看到的现象是: ,
有实验1得出的结论是____________。
(2)实验2(如图甲所示):烧杯B中的现象
是 ,产生这一现象的原因是 。
(3)为使实验结论准确可靠,该兴趣小组的小华同学
设计了(如图乙所示)作对比实验。你认为有无必要?
请阐述你的理由: 。
【当堂练习】
原子的特点:
1、原子体积和质量都很小
2、原子之间有间隙
3、 原子都在不停的运动
【原子】
----化学变化中最小的粒子
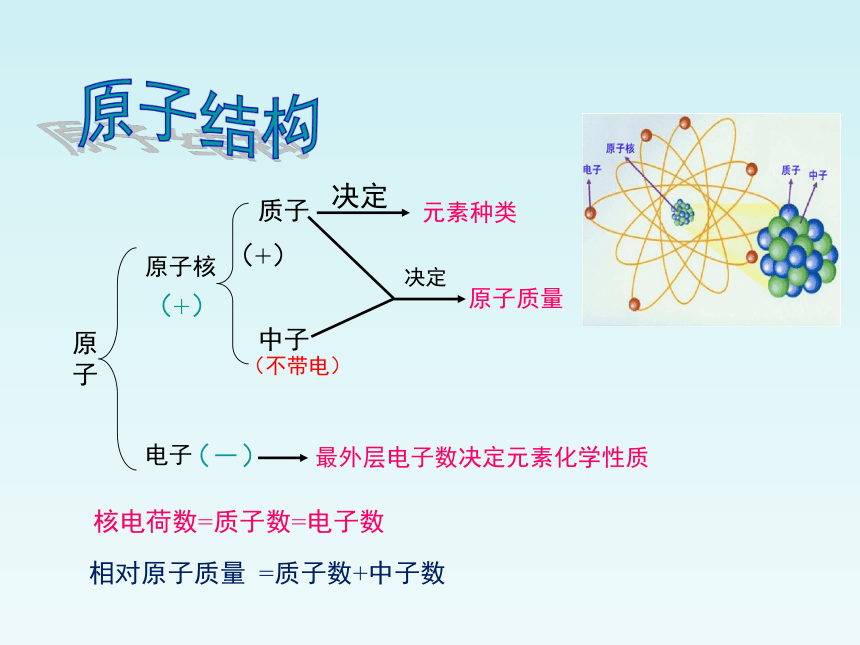
原子核
电子
质子
中子
决定
元素种类
最外层电子数决定元素化学性质
决定
原子质量
(+)
(-)
(+)
(不带电)
核电荷数=质子数=电子数
相对原子质量 =质子数+中子数
原子
【原子构成的规律】
(1)原子核所带的电荷数简称为核电荷数;
(2)核电荷数 = 质子数 = 核外电子数;
(3)质子数不一定等于中子数;
(4)原子中不一定含有中子;
(5)不同种类的原子,其核内质子数和核外电子数都不相同。
原 子 的 质 量 主 要 集 中 在 原 子 核 上
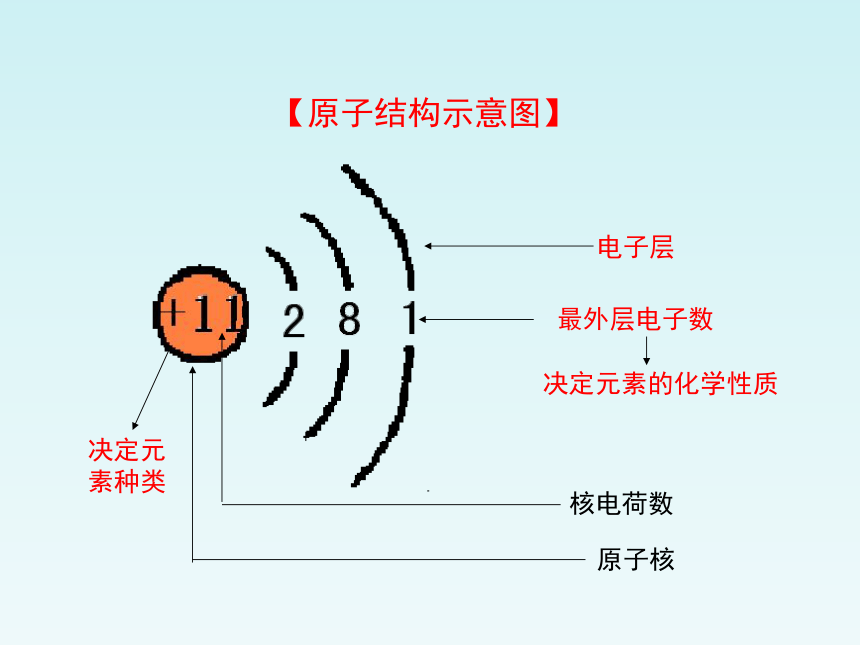
【原子结构示意图】
电子层
最外层电子数
核电荷数
原子核
决定元素种类
决定元素的化学性质
1、铀235(其原子核内有92个质子,相对原子质量为235)是核电站的 主要燃料。下列有关说法正确的是( )
A.铀属于非金属元素 B.该原子的核电荷数为92
C.该原子核内有51个中子 D.该原子核外有143个电子
2.如图为某元素一种粒子的结构示意图,下列说法错误的是( )
A.该粒子是原子
B.该粒子的核电荷数为11
C.该元素属于非金属元素
D.该粒子在化学反应中容易失去电子
【当堂练习】
离子就是带电的原子或原子团。是原子得失电子而形成一种的粒子。跟原子、分子一样,离子也是构成物质的一种粒子。
粒子种类 核内质子数与核外电子数的关系
原子
阳离子
阴离子
核内质子数 = 核外电子数
核内质子数 > 核外电子数
核内质子数 < 核外电子数
【离子】
2、元素X核电荷数为a,它的阳离子Xm+与Y的阴离子Yn-的电子层结相同,则元素Y的核电荷数( )
A.m+n+a B.m-n-a C.m+n-a D.a-m-n
1、原子得到或失去电子后形成离子。某粒子的结构示意图为:
①当a= 时,该粒子是原子,该原子位于
元素周期表中第 周期。
②当a=8时,该粒子是 (填“原子”、
“阳离子”或 “阴离子”)。
【当堂练习】
物质的构成
物质
分子
构 成
离子
构 成
原子
构
成
构 成
组 成
元素
总 称
宏观概念
微观概念
(只讲种类
不讲个数)
(既讲种类
又讲个数)
分 裂
得失电子
失得电子
1.元素就是具有相同核电荷数(即核内质子数)的一类原子的总称。
地壳里各种元素的含量(质量分数)
元素只论种类,不论个数;元素的种类决定于原子中的质子数。
【元素】
2、元素分类:
金属元素:铁、镁、铝、钠、钾、铜、锰、锌、银、钡、汞、金等
非金属元素:氧、氢、氮、氯、碳、硫、磷、硅、碘等
稀有气体元素:氦、氖、氩等
元素的分类 最外层电子数 得失电子趋势 化学性质 结论
一般小于4
易失去电子
一般大于4
易得到电子
易发生化学反应
等于8(氦等于2)
稳定结构
极难发生化学反应
元素的化学性质与原子最外层电子数关系密切
金属元素
非金属元素
稀有气体元素
元素原子的化学性质与原子最外层电子数的关系
化学用语
元素符号的书写及其意义
离子符号的书写及其意义
化学式及其意义
原子(离子)结构示意图
表示粒子个数
表示元素的正负化合价
一个离子所带的正负电荷值
一个分子中所含原子的个数
+
(-)
m
a
n
+
(-)
b
R
元 素 原 子
区
别 ①具有相同核电荷数的一类原子的总称
②只有种类,没有个数
③宏观概念
④能组成物质,不能构成分子,原子
⑤任何化学反应元素种类不变,质量守恒 ①化学变化中的最小粒子
②既有种类,又有个数
③微观概念
④可以直接构成物质,也可构成分子
⑤化学变化中原子种类不变,可重组成分子
联系 元素是具有相同核电荷数(或质子数)的同一类原子的总称 原子是元素的个体,体现元素性质的最小单位
元素与原子的比较
下表是元素周期表中的部分元素的一些信息,请据表回答问题:
(1)氯原子的质子数是 ,它属于 (填“金属”或“非金属”)元素。
(2)原子序数为3的元素与第三周期中的 (填名称)元素具有相似的化学性质,在化学反应中都比较容易 (填“得到”或“失去”)电子。
(3)写出原子序数为3的元素形成的氧化物的化学式 。
【当堂练习】
(1)原子序数:按元素原子_________递增的顺序给元素编号。
(2)横行(周期):每一个横行叫做一个周期,共有___个周期。其特点为:从左到右,最外层电子数依次增加,但电子层数相同。
核电荷数
7
【元素周期表简介】
(3)纵行(族):每一个纵行叫做_______,共有___个纵行,___个族,其中__________三个纵行共同组成一个族。其特点为:从上到下,电子层数依次增加,但原子最外层电子数相同。
(4)元素周期表中的一格
一个族
18
16
8、9、10
①周期表中同一横行的元素,原子的电子层数相同;
②周期表中同一纵行的元素,原子最外层电子数相同,电子层数从上到下逐渐增多;
③同一周期(第一周期除外)元素的最外层电子数从左到右由1逐渐递增至8;
④同一周期(第一周期除外)元素由金属元素开始→非金属元素→稀有气体元素结束。
元素周期表的理解
【课堂小结】
1、分子、原子、离子都可以构成物质,它们的定义、性质等内容。
2、元素的定义、分类、意义;元素、原子的区别和联系。
3、元素周期表的特点。
祝同学们学习愉快!
第三单元 物质构成的奥秘
【复习目标】
1、知道原子是由原子核和核外电子构成的。
2、知道分子、原子、离子的区别。
3、知道原子可以结合成分子、同一元素的原子、离子可以相互转化。
4、会用微粒的观点解释生活中的现象。
氯化钠
水
Na
Na+
Cl-
Cu
Cu
铜
H
H
O
铜由铜原子构成
水由水分子构成
氯化钠由氯离子和钠离子构成
-----分子是一种保特物质化学性质的最小粒子。
分子有哪些基本性质呢?
1、同种分子化学性质相同;
2、分子体积小,质量小;
4、分子间存在相互作用,在不停地运动。
3、分子之间有间隙;
【分子】
某兴趣小组做以下实验探究分子的运动(如图所示)。
请回答实验中的有关问题(注酚酞是一种酸碱指示剂,
遇到碱性物质变红,氨水呈碱性。)
(1)实验1:小明同学在盛有少量蒸馏水的小烧杯中
滴加2到3滴酚酞溶液,看到的现象是: ,
有实验1得出的结论是____________。
(2)实验2(如图甲所示):烧杯B中的现象
是 ,产生这一现象的原因是 。
(3)为使实验结论准确可靠,该兴趣小组的小华同学
设计了(如图乙所示)作对比实验。你认为有无必要?
请阐述你的理由: 。
【当堂练习】
原子的特点:
1、原子体积和质量都很小
2、原子之间有间隙
3、 原子都在不停的运动
【原子】
----化学变化中最小的粒子
原子核
电子
质子
中子
决定
元素种类
最外层电子数决定元素化学性质
决定
原子质量
(+)
(-)
(+)
(不带电)
核电荷数=质子数=电子数
相对原子质量 =质子数+中子数
原子
【原子构成的规律】
(1)原子核所带的电荷数简称为核电荷数;
(2)核电荷数 = 质子数 = 核外电子数;
(3)质子数不一定等于中子数;
(4)原子中不一定含有中子;
(5)不同种类的原子,其核内质子数和核外电子数都不相同。
原 子 的 质 量 主 要 集 中 在 原 子 核 上
【原子结构示意图】
电子层
最外层电子数
核电荷数
原子核
决定元素种类
决定元素的化学性质
1、铀235(其原子核内有92个质子,相对原子质量为235)是核电站的 主要燃料。下列有关说法正确的是( )
A.铀属于非金属元素 B.该原子的核电荷数为92
C.该原子核内有51个中子 D.该原子核外有143个电子
2.如图为某元素一种粒子的结构示意图,下列说法错误的是( )
A.该粒子是原子
B.该粒子的核电荷数为11
C.该元素属于非金属元素
D.该粒子在化学反应中容易失去电子
【当堂练习】
离子就是带电的原子或原子团。是原子得失电子而形成一种的粒子。跟原子、分子一样,离子也是构成物质的一种粒子。
粒子种类 核内质子数与核外电子数的关系
原子
阳离子
阴离子
核内质子数 = 核外电子数
核内质子数 > 核外电子数
核内质子数 < 核外电子数
【离子】
2、元素X核电荷数为a,它的阳离子Xm+与Y的阴离子Yn-的电子层结相同,则元素Y的核电荷数( )
A.m+n+a B.m-n-a C.m+n-a D.a-m-n
1、原子得到或失去电子后形成离子。某粒子的结构示意图为:
①当a= 时,该粒子是原子,该原子位于
元素周期表中第 周期。
②当a=8时,该粒子是 (填“原子”、
“阳离子”或 “阴离子”)。
【当堂练习】
物质的构成
物质
分子
构 成
离子
构 成
原子
构
成
构 成
组 成
元素
总 称
宏观概念
微观概念
(只讲种类
不讲个数)
(既讲种类
又讲个数)
分 裂
得失电子
失得电子
1.元素就是具有相同核电荷数(即核内质子数)的一类原子的总称。
地壳里各种元素的含量(质量分数)
元素只论种类,不论个数;元素的种类决定于原子中的质子数。
【元素】
2、元素分类:
金属元素:铁、镁、铝、钠、钾、铜、锰、锌、银、钡、汞、金等
非金属元素:氧、氢、氮、氯、碳、硫、磷、硅、碘等
稀有气体元素:氦、氖、氩等
元素的分类 最外层电子数 得失电子趋势 化学性质 结论
一般小于4
易失去电子
一般大于4
易得到电子
易发生化学反应
等于8(氦等于2)
稳定结构
极难发生化学反应
元素的化学性质与原子最外层电子数关系密切
金属元素
非金属元素
稀有气体元素
元素原子的化学性质与原子最外层电子数的关系
化学用语
元素符号的书写及其意义
离子符号的书写及其意义
化学式及其意义
原子(离子)结构示意图
表示粒子个数
表示元素的正负化合价
一个离子所带的正负电荷值
一个分子中所含原子的个数
+
(-)
m
a
n
+
(-)
b
R
元 素 原 子
区
别 ①具有相同核电荷数的一类原子的总称
②只有种类,没有个数
③宏观概念
④能组成物质,不能构成分子,原子
⑤任何化学反应元素种类不变,质量守恒 ①化学变化中的最小粒子
②既有种类,又有个数
③微观概念
④可以直接构成物质,也可构成分子
⑤化学变化中原子种类不变,可重组成分子
联系 元素是具有相同核电荷数(或质子数)的同一类原子的总称 原子是元素的个体,体现元素性质的最小单位
元素与原子的比较
下表是元素周期表中的部分元素的一些信息,请据表回答问题:
(1)氯原子的质子数是 ,它属于 (填“金属”或“非金属”)元素。
(2)原子序数为3的元素与第三周期中的 (填名称)元素具有相似的化学性质,在化学反应中都比较容易 (填“得到”或“失去”)电子。
(3)写出原子序数为3的元素形成的氧化物的化学式 。
【当堂练习】
(1)原子序数:按元素原子_________递增的顺序给元素编号。
(2)横行(周期):每一个横行叫做一个周期,共有___个周期。其特点为:从左到右,最外层电子数依次增加,但电子层数相同。
核电荷数
7
【元素周期表简介】
(3)纵行(族):每一个纵行叫做_______,共有___个纵行,___个族,其中__________三个纵行共同组成一个族。其特点为:从上到下,电子层数依次增加,但原子最外层电子数相同。
(4)元素周期表中的一格
一个族
18
16
8、9、10
①周期表中同一横行的元素,原子的电子层数相同;
②周期表中同一纵行的元素,原子最外层电子数相同,电子层数从上到下逐渐增多;
③同一周期(第一周期除外)元素的最外层电子数从左到右由1逐渐递增至8;
④同一周期(第一周期除外)元素由金属元素开始→非金属元素→稀有气体元素结束。
元素周期表的理解
【课堂小结】
1、分子、原子、离子都可以构成物质,它们的定义、性质等内容。
2、元素的定义、分类、意义;元素、原子的区别和联系。
3、元素周期表的特点。
祝同学们学习愉快!
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
