人教版九年级化学第四单元 自然界的水 学习要点总结课件(共58张PPT)
文档属性
| 名称 | 人教版九年级化学第四单元 自然界的水 学习要点总结课件(共58张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-28 16:37:12 | ||
图片预览






文档简介
(共58张PPT)
第四单元 自然界的水
学习要点
一、人类拥有的水资源
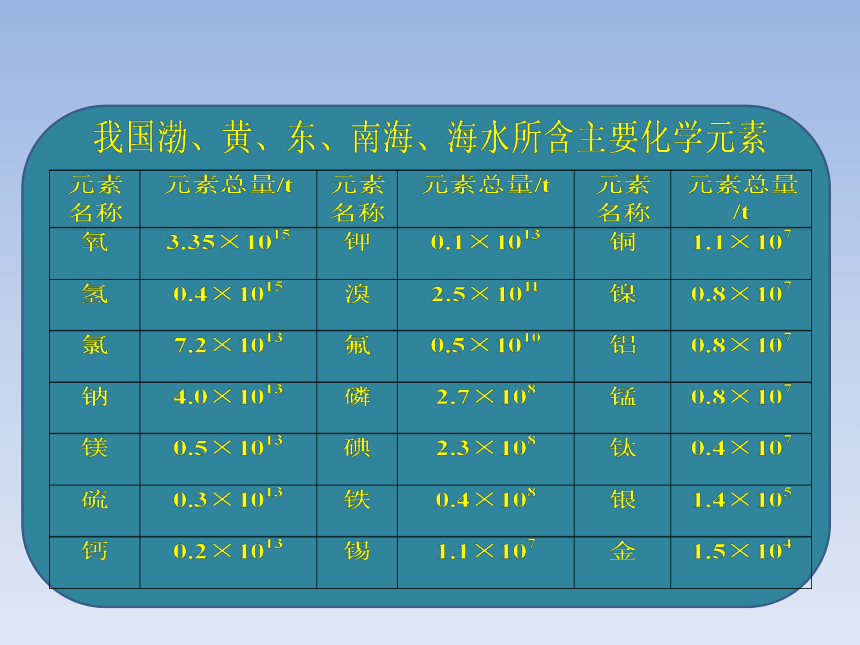
地球表面约71%被水覆盖着。海洋是地球最大的储水库,海水中含有的化学元素有80多种,水是一种重要的化学资源。
课题1 爱护水资源
1、海水成分: 海水中平均含盐3.5%,含多种矿物质,如钠、钙、钾、溴、碘、锶等。海洋中还有大量的生物,是人类食物的来源之一;
2、海水资源包括:能量、生物、化学、矿物、及空间资源。利用潮汐能发电,各种化学物质被综合利用;
3、海水还是人类未来重要的淡水来源。
地球上的总储水量虽然很大,但淡水很少。
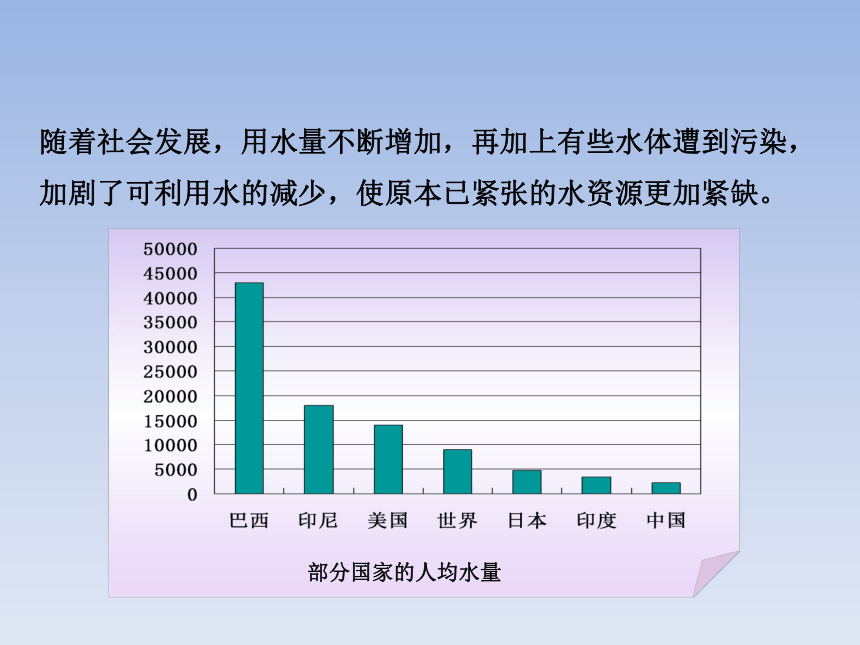
随着社会发展,用水量不断增加,再加上有些水体遭到污染,加剧了可利用水的减少,使原本已紧张的水资源更加紧缺。
部分国家的人均水量
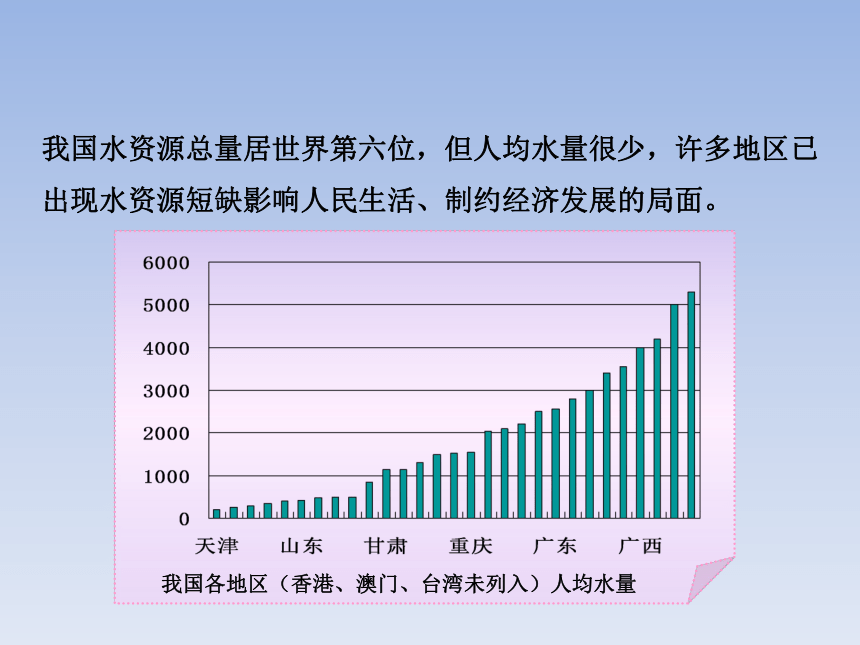
我国水资源总量居世界第六位,但人均水量很少,许多地区已出现水资源短缺影响人民生活、制约经济发展的局面。
我国各地区(香港、澳门、台湾未列入)人均水量
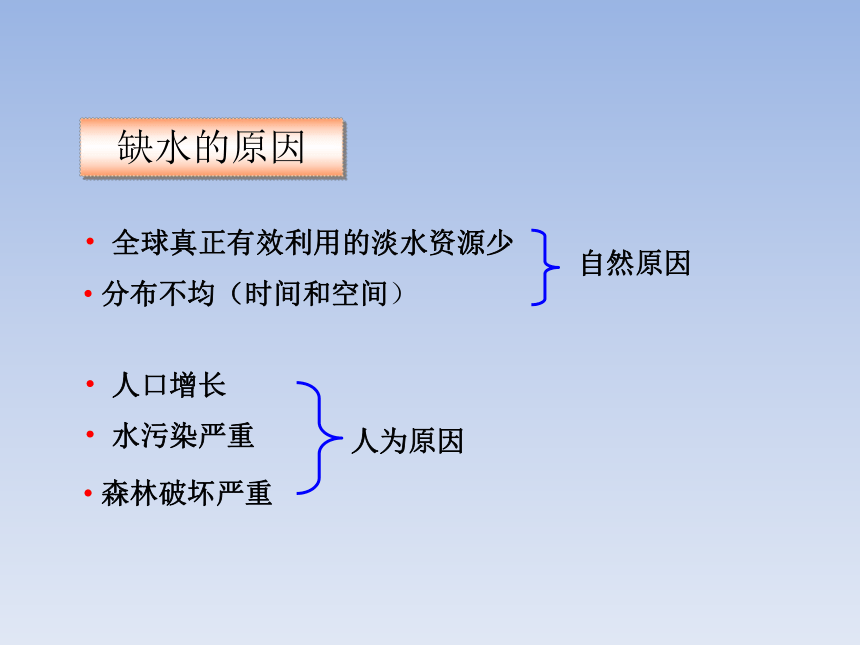
自然原因
全球真正有效利用的淡水资源少
人为原因
人口增长
缺水的原因
分布不均(时间和空间)
水污染严重
森林破坏严重
二、爱护水资源
(1)节约用水
农业和园林改大水漫灌为喷灌、滴灌,
分别可节水40%和70%以上。
国家节水标志
由水滴、人手和地球变形构成。
绿色的圆形代表地球,象征节约用水是保护地球生态的重要措施。
标志留白部分像一只手托起一滴水,手是拼音字母 JS的变形,寓意节水,人人动手节约每一滴水。
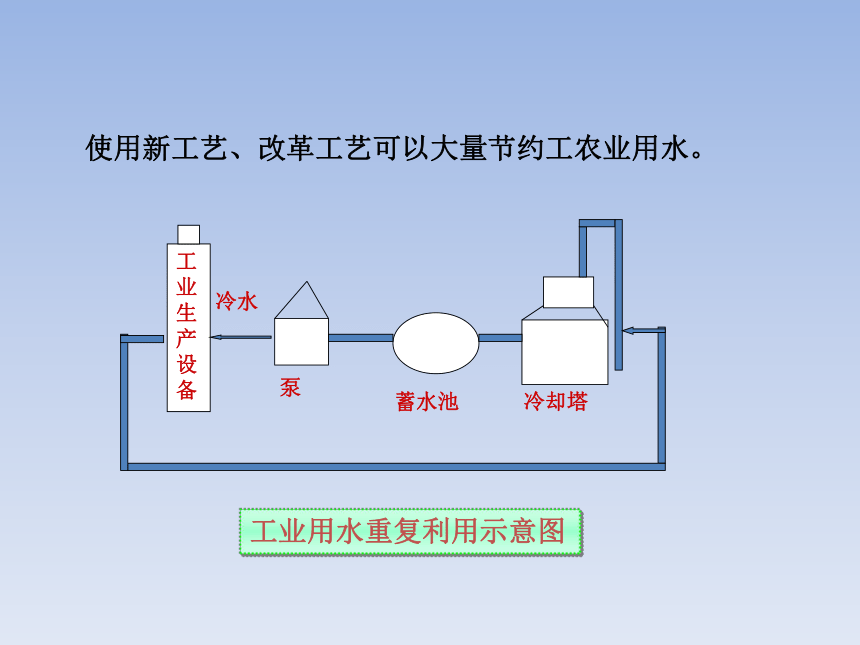
工业生产设备
冷水
泵
蓄水池
冷却塔
工业用水重复利用示意图
使用新工艺、改革工艺可以大量节约工农业用水。
(二)防止水体污染
水体污染:指大量污染物质排入水体,超过水体的自净化能力使水质恶化,水体及其周围的生态平衡遭到破坏,对人类健康、生活和生产活动等造成损失和威胁的情况。
水体污染的来源:工业污染、农业污染、生活污染
水体污染来源示意图
水体污染,不仅影响工农业、渔业生产,破坏水生生态环境,还会直接危害人体健康。因此,必须采取各种措施,预防和治理水污染,保护和改善水质。
防治水体污染的措施:
工业上,通过应用新技术、新工艺减少污染物的产生,同时对污染的水体作处理使之符合排放标准;
农业上,提倡使用农家肥,合理使用农药和化肥;
生活中,生活污水应集中处理和排放。
课题2 水的净化
一、纯水和天然水
1、纯水
是无色、无臭、清澈透明的液体,属于纯净物
(化学式: H2O )。
2、天然水
自然界中的河水、湖水、井水、海水等等,由
于含有许多可溶性和不溶性杂质,常呈浑浊,
属于混合物。
自来水厂净水过程图
除去不溶性杂质
除去不溶性杂质、部分可溶性杂质,颜色、异味
杀死残存的细菌
吸附水中悬浮的杂质
沉降杂质
取水
沉淀
过滤(物理变化)
活性炭
吸附(物理变化)
消毒(化学变化)
配水泵
加絮凝剂
自来水厂净水过程:
二、水的净化方法
1、静置、沉淀
吸附沉淀法:向水中加入某些净水剂如明矾,利用明矾溶于水后生成的胶状物对杂质进行吸附,使杂质沉降来达到净水的目的。
吸附悬浮物,浑水变澄清
2、过滤
过滤:分离液体与不溶于液体
的固态物质的一种操作。
玻璃棒
烧杯
漏斗
铁架台
过滤器
一贴:
二低:
三靠:
滤纸紧贴漏斗内壁
滤纸边缘低于漏斗边缘
液面低于滤纸边缘
烧杯口紧靠玻璃棒
玻璃棒斜靠三层滤纸一边漏斗颈紧靠烧杯内壁
在过滤实验中,有时得到的液体仍然是浑浊的,可能原因为:
(1)滤纸破损
(2) 漏斗内液面高于滤纸边缘
(3) 仪器不干净
利用活性炭来吸附、过滤水中的杂质
活性炭具有吸附作用。
活性炭不仅可以滤去液体中的不溶性物质,还可以吸附掉一些溶解的杂质,如:颜色,异味。
3、吸附
(吸附剂:活性炭)
三、硬水和软水
硬水:含有较多可溶性钙、镁化合物
软水:不含或含较少量可溶性钙、镁化合物
2、硬水和软水的区分方法:
(1)加热或长久放置后有水垢产生的水是硬水。
(2)向水中加肥皂水,泡沫很少的水是硬水,
有大量泡沫出现的水是软水。
1、概念:
3、降低水的硬度方法:
煮沸
蒸馏
蒸馏的操作方法
凝结
水蒸气
沸腾
不纯净的水
进水
出水
蒸馏水
冷凝管
作用:可使硬水中的钙、镁化合物留在容器内,降低水的硬度,去除不可溶物质和微生物。
蒸馏操作注意事项:
1、在蒸馏瓶里放几粒沸石,以防暴沸;
2、蒸馏烧瓶中液体的量是烧瓶容量的1/3—1/2;
3、调整温度计的位置,使水银球的上限恰好处于蒸馏烧瓶支管的下限;
4、蒸馏前冷凝管应通入冷凝水,加热时要控制温度缓慢上升。
5. 装置的气密性要好
水的净化方法小结
沉淀 过滤 吸附 蒸馏
除去不溶性杂质
沉淀
吸附
过滤
仪器
过滤器的准备
过滤操作及注意事项
除去可溶性杂质
按钙、镁的含量
软水
硬水
检验
蒸馏
仪器
装置
操作注意事项
净水方法:
一、氢气的性质
1、氢气的物理性质
氢气是一种无色、无臭、难溶于水、密度比空气小的气体。(自然界最轻的气体)
2、氢气的化学性质
氢气能燃烧,具有可燃性。
课题3 水的组成
3.氢气的验纯
1、收集一试管氢气,用拇指堵住试管口;
2、管口朝下,靠近火焰,移开拇指点火。
如发出尖锐爆鸣声表明氢气不纯。
如听到声音很小,则表示氢气较纯。
4.氢气在空气中燃烧
现象:纯净的氢气在空气中安静地燃烧,发出淡蓝色火焰,放出大量的热,罩在火焰上方的烧杯内壁出现无色液滴。
5.要点诠释
①经检验不纯需要用排空气法再重新收集时,要用拇指按住试管口一会,否则试管内的氢气火焰可能还未熄灭,有可能使气体发生器内不纯的氢气燃烧发生爆炸。
②点燃任何可燃性气体之前都必须检验气体的纯度,以防止发生爆炸。
③由于氢气具有可燃性,泄漏时若遇到明火容易发生爆炸,所以现在人们往往用性质稳定的氦气来代替氢气填充气球。
④当前发展氢能源所面临的主要问题有:高效、经济的制氢方法;贮存、运输氢气的安全问题等。
二、水的电解
1.实验装置
2.实验现象
现象
两电极
正极端的
玻璃管
负极端的
玻璃管
比较两玻璃中
现象差异
两极均出现气泡
有气体
产生
有气体
产生
产生气体较多,体积是正极玻璃管的2倍.
产生气体较少,体积是负极玻璃管的1/2.
3.检验气体
用带火星的木条和燃着的木条分别检验两极产生的气体
现象
解释
正极端玻璃管
负极端玻璃管
带火星的木条复燃,燃着的木条燃烧得更旺
带火星的木条不复燃,玻璃管内的气体能燃烧,产生淡蓝色火焰
能使带火星的木条复燃的气体是氧气
能燃烧并产生淡蓝色火焰的气体是氢气
4.实验结论
分析水生成和分解实验,证明水不是一种元素,而是由氢、氧两种元素组成的。
反应物只有水一种,而生成物有氧气和氢气
两种,属于分解反应。
氢气+氧气
水
通电
(H2)
(O2)
(H2O)
5.要点诠释
①理论上与正、负两极相连的试管内汇集的气体体积比应是1∶2,但在实验操作中两试管汇集的气体体积比往往小于l∶2。这是因为:
(1)氧气在水中溶解性比氢气稍大。
(2)氧气氧化性很强,有时在电极上就与电极发生了氧化反应。
②电解时通常在水中加入少量氢氧化钠(或稀硫酸)是为了增强水的导电性。它们本身并未参加反应。
③水是由氢、氧两种元素组成,不能说水是由氢气和氧气组成。因为水中没有氢气,也没有氧气,是一种物质组成的纯净物。
④电解水所用电源为直流电。
三、单质、化合物、氧化物
单质:由同种元素组成的纯净物叫做单质。
例:氢气、氧气、氮气、铁、碳 等
H2 O2 N2 Fe C
化合物:由不同种元素组成的纯净物叫做化合物。
例:二氧化碳、氧化铁、高锰酸钾
CO2 Fe2O3 KMnO4
由两种元素组成的化合物中,其中一种元素是
氧元素的叫做氧化物,如CO2 、 Fe2O3 等。
要点诠释:
①把物质分成混合物和纯净物的依据是:组成物质的种类;把纯净物分成单质和化合物的依据是:组成元素的种类。
②氧化物与“含氧化合物”不一样,后者包含着前者。化合物中只要含有氧元素,含氧化合物,如氯酸钾、高锰酸钾都含有氧元素,属于含氧化合物但不属于氧化物。
③“由同种元素组成的物质叫单质”的说法都是错误的。如:氧气(O2)和臭氧(O3)都是由氧元素组成的,两者混合组成的物质是混合物,而不是单质。这说明同种元素组成的物质,可能是纯净物单质,也可能是混合物。
课题4 化学式与化合价
一、化学式
1.概念:用元素符号和数字的组合表示物质组成的式子。
如: 水 H2O
氧气 O2
二氧化碳 CO2
【注意】每种纯净物的组成是固定不变的,
所以,一种物质的化学式只有一个。
2. 意义
化学式
宏观
微观
①表示一种物质
②表示该物质的元素组成
①物质的一个分子
②物质的分子构成
注意:要考虑到构成物质的粒子是分子还是原子。
例:H2O表示的意义:
表示水这种物质
表示一个水分子
表示水由氢元素和氧元素组成
表示一个水分子由2个氢原子和1个氧原子构成
宏观意义
微观意义
(1)化学式的写法
金属单质:铁(Fe) 铝(Al)
固态非金属单质:硫(S) 磷(P)
稀有气体:氖气(Ne) 氦气(He)
①单质
用元素符号直接
表示化学式
氧气(O2) 氢气(H2)
氮气(N2) 氯气Cl2)
气体非金属单质
在元素符号右下角加2表示化学式
3.化学式的书写和命名
②化合物
氧化物:氧在后,其他元素在前。
例如:CO2、SO2、H2O等。
其他两种元素形成的化合物:金属在前,非金属在后。
例如:NaCl、FeCl3等。
通常正价元素在前,负价元素在后
原则:顺写反读
读作:某化某
一般从右向左读作“某化某”,如NaCl,读作氯化钠;
有时还需要读出化学式中各种元素的原子的个数,如P2O5,读作五氧化二磷。
(2)化学式的读法
二、化合价
(1)在任何化合物里,正负化合价的代数和为零。
(2)在化合物里氢通常显+1价,氧通常显-2价。
(3)金属元素通常显正价,非金属元素通常显负价。
(4)单质里元素的化合价为零。
(5)许多元素具有可变化合价,同种元素在不同的化合物里可显不同的化合价,如:FeO,Fe2O3中铁元素的化合价分别为+2和+3。
1.化合价的有关规律
原子团:作为一个整体参加反应的原子集团(就好像一个原子一样),原子团也叫做根。
注意:①原子团不能单独存在;
②带电荷的原子团也是离子。
NaOH、 Ca(OH)2 、Cu(NO3)2、NH4NO3、BaSO4、CaCO3、 H3PO4
根:
离子:
OH-:
NH4+:
NO3-:
CO32-:
SO42-:
PO43-:
氢氧根离子
铵根离子
硝酸根离子
碳酸根离子
硫酸根离子
磷酸根离子
(1)根据化学式求某一元素化合价
原则:化合物里正负化合价的代数和为零
例1:试确定氯酸钾(KClO3)中氯元素的化合价
解:设氯元素的化合价为x,则
(+1)+ x +(-2)×3=0
x = +5
所以,在氯酸钾中,氯元素的化合价为+5价
2.化学式与化合价的关系
(2)根据化合价求化学式
步骤:(数字交叉法)
① 写符号
② 标化合价
③ 化合价绝对值交叉放置在元素符号右下角
④ 约简
⑤ 检查
例 已知磷元素有两种氧化物,其中磷的化合价分别为+3和+5,写出这两种磷的氧化物的化学式
【思路】
(1)先写元素符号(正前负后)
(2)标出各元素的化合价(正上)
(3)把化合价数值化为最简
(4)把化简后的数字交叉写出(求最小公倍数)
P O
P O
+3 -2
P O
P2O3
P O
P2O5
+3 -2
+3 -2
P2O3
P O
+5 -2
P O
+ 5 -2
省略
P2O5
+ 5 -2
相对分子质量的理解
三、有关相对分子质量的计算
H2O的意义:1个水分子是由2个氢原子和1个氧原子构成的。
真实质量:1个水分子的质量=2个氢原子的质量+1个氧原子的质量
相对分子质量:1个水分子的相对分子质量=2个氢原子的相对原子质量+1个氧原子的相对原子质量
所以H2O的相对分子质量=1×2+16×1=18
1.计算相对分子质量
定义:化学式中各原子的相对原子质量的总和,就是相对分子质量。
例:计算 (NH4)2SO4的相对分子质量
【解】(NH4)2SO4的相对分子质量
=(14+1×4)×2+32+16×4=132
2.计算物质组成元素的质量比
各元素之间的质量比=各原子的相对原子质量总和之比
例:求Fe2O3中铁元素和氧元素的质量比。
Fe2O3中铁元素和氧元素的质量比
Fe:O=(56×2):(16×3)=112:48=7:3
3.计算物质中某元素的质量分数
某元素的质量分数=
该元素相对原子质量×原子个数
化合物的相对分子质量
× 100﹪
注意事项:
①质量分数——用百分数来表示
每100克该物质中含有某元素的质量分数
②意义:
例:⑴计算二氧化硫中硫元素的质量分数
⑵计算64t二氧化硫中硫元素的质量。
解:⑴SO2的相对分子质量=32+16×2=64
SO2中硫元素的质量分数=
S的相对原子质量×1
SO2的相对分子质量
×100%
=
32
64
=50%
×100%
⑵64t二氧化硫中硫元素的质量=64t×50%=32t
化合价
化学式
读写方法
意义
有关计算
宏观意义
微观意义
判断
书写
小结:
第四单元 自然界的水
学习要点
一、人类拥有的水资源
地球表面约71%被水覆盖着。海洋是地球最大的储水库,海水中含有的化学元素有80多种,水是一种重要的化学资源。
课题1 爱护水资源
1、海水成分: 海水中平均含盐3.5%,含多种矿物质,如钠、钙、钾、溴、碘、锶等。海洋中还有大量的生物,是人类食物的来源之一;
2、海水资源包括:能量、生物、化学、矿物、及空间资源。利用潮汐能发电,各种化学物质被综合利用;
3、海水还是人类未来重要的淡水来源。
地球上的总储水量虽然很大,但淡水很少。
随着社会发展,用水量不断增加,再加上有些水体遭到污染,加剧了可利用水的减少,使原本已紧张的水资源更加紧缺。
部分国家的人均水量
我国水资源总量居世界第六位,但人均水量很少,许多地区已出现水资源短缺影响人民生活、制约经济发展的局面。
我国各地区(香港、澳门、台湾未列入)人均水量
自然原因
全球真正有效利用的淡水资源少
人为原因
人口增长
缺水的原因
分布不均(时间和空间)
水污染严重
森林破坏严重
二、爱护水资源
(1)节约用水
农业和园林改大水漫灌为喷灌、滴灌,
分别可节水40%和70%以上。
国家节水标志
由水滴、人手和地球变形构成。
绿色的圆形代表地球,象征节约用水是保护地球生态的重要措施。
标志留白部分像一只手托起一滴水,手是拼音字母 JS的变形,寓意节水,人人动手节约每一滴水。
工业生产设备
冷水
泵
蓄水池
冷却塔
工业用水重复利用示意图
使用新工艺、改革工艺可以大量节约工农业用水。
(二)防止水体污染
水体污染:指大量污染物质排入水体,超过水体的自净化能力使水质恶化,水体及其周围的生态平衡遭到破坏,对人类健康、生活和生产活动等造成损失和威胁的情况。
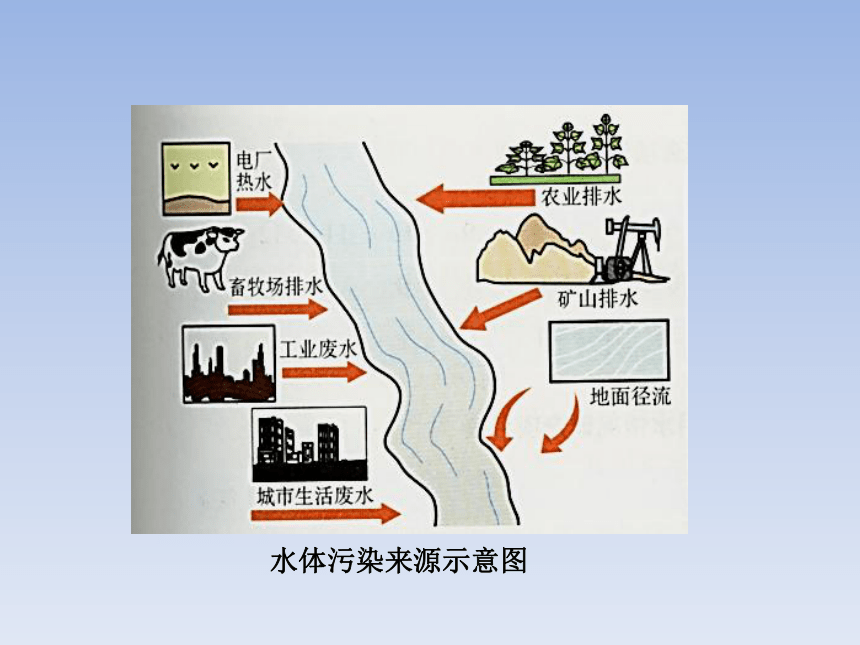
水体污染的来源:工业污染、农业污染、生活污染
水体污染来源示意图
水体污染,不仅影响工农业、渔业生产,破坏水生生态环境,还会直接危害人体健康。因此,必须采取各种措施,预防和治理水污染,保护和改善水质。
防治水体污染的措施:
工业上,通过应用新技术、新工艺减少污染物的产生,同时对污染的水体作处理使之符合排放标准;
农业上,提倡使用农家肥,合理使用农药和化肥;
生活中,生活污水应集中处理和排放。
课题2 水的净化
一、纯水和天然水
1、纯水
是无色、无臭、清澈透明的液体,属于纯净物
(化学式: H2O )。
2、天然水
自然界中的河水、湖水、井水、海水等等,由
于含有许多可溶性和不溶性杂质,常呈浑浊,
属于混合物。
自来水厂净水过程图
除去不溶性杂质
除去不溶性杂质、部分可溶性杂质,颜色、异味
杀死残存的细菌
吸附水中悬浮的杂质
沉降杂质
取水
沉淀
过滤(物理变化)
活性炭
吸附(物理变化)
消毒(化学变化)
配水泵
加絮凝剂
自来水厂净水过程:
二、水的净化方法
1、静置、沉淀
吸附沉淀法:向水中加入某些净水剂如明矾,利用明矾溶于水后生成的胶状物对杂质进行吸附,使杂质沉降来达到净水的目的。
吸附悬浮物,浑水变澄清
2、过滤
过滤:分离液体与不溶于液体
的固态物质的一种操作。
玻璃棒
烧杯
漏斗
铁架台
过滤器
一贴:
二低:
三靠:
滤纸紧贴漏斗内壁
滤纸边缘低于漏斗边缘
液面低于滤纸边缘
烧杯口紧靠玻璃棒
玻璃棒斜靠三层滤纸一边漏斗颈紧靠烧杯内壁
在过滤实验中,有时得到的液体仍然是浑浊的,可能原因为:
(1)滤纸破损
(2) 漏斗内液面高于滤纸边缘
(3) 仪器不干净
利用活性炭来吸附、过滤水中的杂质
活性炭具有吸附作用。
活性炭不仅可以滤去液体中的不溶性物质,还可以吸附掉一些溶解的杂质,如:颜色,异味。
3、吸附
(吸附剂:活性炭)
三、硬水和软水
硬水:含有较多可溶性钙、镁化合物
软水:不含或含较少量可溶性钙、镁化合物
2、硬水和软水的区分方法:
(1)加热或长久放置后有水垢产生的水是硬水。
(2)向水中加肥皂水,泡沫很少的水是硬水,
有大量泡沫出现的水是软水。
1、概念:
3、降低水的硬度方法:
煮沸
蒸馏
蒸馏的操作方法
凝结
水蒸气
沸腾
不纯净的水
进水
出水
蒸馏水
冷凝管
作用:可使硬水中的钙、镁化合物留在容器内,降低水的硬度,去除不可溶物质和微生物。
蒸馏操作注意事项:
1、在蒸馏瓶里放几粒沸石,以防暴沸;
2、蒸馏烧瓶中液体的量是烧瓶容量的1/3—1/2;
3、调整温度计的位置,使水银球的上限恰好处于蒸馏烧瓶支管的下限;
4、蒸馏前冷凝管应通入冷凝水,加热时要控制温度缓慢上升。
5. 装置的气密性要好
水的净化方法小结
沉淀 过滤 吸附 蒸馏
除去不溶性杂质
沉淀
吸附
过滤
仪器
过滤器的准备
过滤操作及注意事项
除去可溶性杂质
按钙、镁的含量
软水
硬水
检验
蒸馏
仪器
装置
操作注意事项
净水方法:
一、氢气的性质
1、氢气的物理性质
氢气是一种无色、无臭、难溶于水、密度比空气小的气体。(自然界最轻的气体)
2、氢气的化学性质
氢气能燃烧,具有可燃性。
课题3 水的组成
3.氢气的验纯
1、收集一试管氢气,用拇指堵住试管口;
2、管口朝下,靠近火焰,移开拇指点火。
如发出尖锐爆鸣声表明氢气不纯。
如听到声音很小,则表示氢气较纯。
4.氢气在空气中燃烧
现象:纯净的氢气在空气中安静地燃烧,发出淡蓝色火焰,放出大量的热,罩在火焰上方的烧杯内壁出现无色液滴。
5.要点诠释
①经检验不纯需要用排空气法再重新收集时,要用拇指按住试管口一会,否则试管内的氢气火焰可能还未熄灭,有可能使气体发生器内不纯的氢气燃烧发生爆炸。
②点燃任何可燃性气体之前都必须检验气体的纯度,以防止发生爆炸。
③由于氢气具有可燃性,泄漏时若遇到明火容易发生爆炸,所以现在人们往往用性质稳定的氦气来代替氢气填充气球。
④当前发展氢能源所面临的主要问题有:高效、经济的制氢方法;贮存、运输氢气的安全问题等。
二、水的电解
1.实验装置
2.实验现象
现象
两电极
正极端的
玻璃管
负极端的
玻璃管
比较两玻璃中
现象差异
两极均出现气泡
有气体
产生
有气体
产生
产生气体较多,体积是正极玻璃管的2倍.
产生气体较少,体积是负极玻璃管的1/2.
3.检验气体
用带火星的木条和燃着的木条分别检验两极产生的气体
现象
解释
正极端玻璃管
负极端玻璃管
带火星的木条复燃,燃着的木条燃烧得更旺
带火星的木条不复燃,玻璃管内的气体能燃烧,产生淡蓝色火焰
能使带火星的木条复燃的气体是氧气
能燃烧并产生淡蓝色火焰的气体是氢气
4.实验结论
分析水生成和分解实验,证明水不是一种元素,而是由氢、氧两种元素组成的。
反应物只有水一种,而生成物有氧气和氢气
两种,属于分解反应。
氢气+氧气
水
通电
(H2)
(O2)
(H2O)
5.要点诠释
①理论上与正、负两极相连的试管内汇集的气体体积比应是1∶2,但在实验操作中两试管汇集的气体体积比往往小于l∶2。这是因为:
(1)氧气在水中溶解性比氢气稍大。
(2)氧气氧化性很强,有时在电极上就与电极发生了氧化反应。
②电解时通常在水中加入少量氢氧化钠(或稀硫酸)是为了增强水的导电性。它们本身并未参加反应。
③水是由氢、氧两种元素组成,不能说水是由氢气和氧气组成。因为水中没有氢气,也没有氧气,是一种物质组成的纯净物。
④电解水所用电源为直流电。
三、单质、化合物、氧化物
单质:由同种元素组成的纯净物叫做单质。
例:氢气、氧气、氮气、铁、碳 等
H2 O2 N2 Fe C
化合物:由不同种元素组成的纯净物叫做化合物。
例:二氧化碳、氧化铁、高锰酸钾
CO2 Fe2O3 KMnO4
由两种元素组成的化合物中,其中一种元素是
氧元素的叫做氧化物,如CO2 、 Fe2O3 等。
要点诠释:
①把物质分成混合物和纯净物的依据是:组成物质的种类;把纯净物分成单质和化合物的依据是:组成元素的种类。
②氧化物与“含氧化合物”不一样,后者包含着前者。化合物中只要含有氧元素,含氧化合物,如氯酸钾、高锰酸钾都含有氧元素,属于含氧化合物但不属于氧化物。
③“由同种元素组成的物质叫单质”的说法都是错误的。如:氧气(O2)和臭氧(O3)都是由氧元素组成的,两者混合组成的物质是混合物,而不是单质。这说明同种元素组成的物质,可能是纯净物单质,也可能是混合物。
课题4 化学式与化合价
一、化学式
1.概念:用元素符号和数字的组合表示物质组成的式子。
如: 水 H2O
氧气 O2
二氧化碳 CO2
【注意】每种纯净物的组成是固定不变的,
所以,一种物质的化学式只有一个。
2. 意义
化学式
宏观
微观
①表示一种物质
②表示该物质的元素组成
①物质的一个分子
②物质的分子构成
注意:要考虑到构成物质的粒子是分子还是原子。
例:H2O表示的意义:
表示水这种物质
表示一个水分子
表示水由氢元素和氧元素组成
表示一个水分子由2个氢原子和1个氧原子构成
宏观意义
微观意义
(1)化学式的写法
金属单质:铁(Fe) 铝(Al)
固态非金属单质:硫(S) 磷(P)
稀有气体:氖气(Ne) 氦气(He)
①单质
用元素符号直接
表示化学式
氧气(O2) 氢气(H2)
氮气(N2) 氯气Cl2)
气体非金属单质
在元素符号右下角加2表示化学式
3.化学式的书写和命名
②化合物
氧化物:氧在后,其他元素在前。
例如:CO2、SO2、H2O等。
其他两种元素形成的化合物:金属在前,非金属在后。
例如:NaCl、FeCl3等。
通常正价元素在前,负价元素在后
原则:顺写反读
读作:某化某
一般从右向左读作“某化某”,如NaCl,读作氯化钠;
有时还需要读出化学式中各种元素的原子的个数,如P2O5,读作五氧化二磷。
(2)化学式的读法
二、化合价
(1)在任何化合物里,正负化合价的代数和为零。
(2)在化合物里氢通常显+1价,氧通常显-2价。
(3)金属元素通常显正价,非金属元素通常显负价。
(4)单质里元素的化合价为零。
(5)许多元素具有可变化合价,同种元素在不同的化合物里可显不同的化合价,如:FeO,Fe2O3中铁元素的化合价分别为+2和+3。
1.化合价的有关规律
原子团:作为一个整体参加反应的原子集团(就好像一个原子一样),原子团也叫做根。
注意:①原子团不能单独存在;
②带电荷的原子团也是离子。
NaOH、 Ca(OH)2 、Cu(NO3)2、NH4NO3、BaSO4、CaCO3、 H3PO4
根:
离子:
OH-:
NH4+:
NO3-:
CO32-:
SO42-:
PO43-:
氢氧根离子
铵根离子
硝酸根离子
碳酸根离子
硫酸根离子
磷酸根离子
(1)根据化学式求某一元素化合价
原则:化合物里正负化合价的代数和为零
例1:试确定氯酸钾(KClO3)中氯元素的化合价
解:设氯元素的化合价为x,则
(+1)+ x +(-2)×3=0
x = +5
所以,在氯酸钾中,氯元素的化合价为+5价
2.化学式与化合价的关系
(2)根据化合价求化学式
步骤:(数字交叉法)
① 写符号
② 标化合价
③ 化合价绝对值交叉放置在元素符号右下角
④ 约简
⑤ 检查
例 已知磷元素有两种氧化物,其中磷的化合价分别为+3和+5,写出这两种磷的氧化物的化学式
【思路】
(1)先写元素符号(正前负后)
(2)标出各元素的化合价(正上)
(3)把化合价数值化为最简
(4)把化简后的数字交叉写出(求最小公倍数)
P O
P O
+3 -2
P O
P2O3
P O
P2O5
+3 -2
+3 -2
P2O3
P O
+5 -2
P O
+ 5 -2
省略
P2O5
+ 5 -2
相对分子质量的理解
三、有关相对分子质量的计算
H2O的意义:1个水分子是由2个氢原子和1个氧原子构成的。
真实质量:1个水分子的质量=2个氢原子的质量+1个氧原子的质量
相对分子质量:1个水分子的相对分子质量=2个氢原子的相对原子质量+1个氧原子的相对原子质量
所以H2O的相对分子质量=1×2+16×1=18
1.计算相对分子质量
定义:化学式中各原子的相对原子质量的总和,就是相对分子质量。
例:计算 (NH4)2SO4的相对分子质量
【解】(NH4)2SO4的相对分子质量
=(14+1×4)×2+32+16×4=132
2.计算物质组成元素的质量比
各元素之间的质量比=各原子的相对原子质量总和之比
例:求Fe2O3中铁元素和氧元素的质量比。
Fe2O3中铁元素和氧元素的质量比
Fe:O=(56×2):(16×3)=112:48=7:3
3.计算物质中某元素的质量分数
某元素的质量分数=
该元素相对原子质量×原子个数
化合物的相对分子质量
× 100﹪
注意事项:
①质量分数——用百分数来表示
每100克该物质中含有某元素的质量分数
②意义:
例:⑴计算二氧化硫中硫元素的质量分数
⑵计算64t二氧化硫中硫元素的质量。
解:⑴SO2的相对分子质量=32+16×2=64
SO2中硫元素的质量分数=
S的相对原子质量×1
SO2的相对分子质量
×100%
=
32
64
=50%
×100%
⑵64t二氧化硫中硫元素的质量=64t×50%=32t
化合价
化学式
读写方法
意义
有关计算
宏观意义
微观意义
判断
书写
小结:
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
