人教版九年级化学《第三单元 物质构成的奥秘》复习课件(38张PPT)
文档属性
| 名称 | 人教版九年级化学《第三单元 物质构成的奥秘》复习课件(38张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 572.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-28 17:17:20 | ||
图片预览








文档简介
(共38张PPT)
物质构成的奥秘
复习与巩固
专项突破
1
知识回顾
2
知识回顾
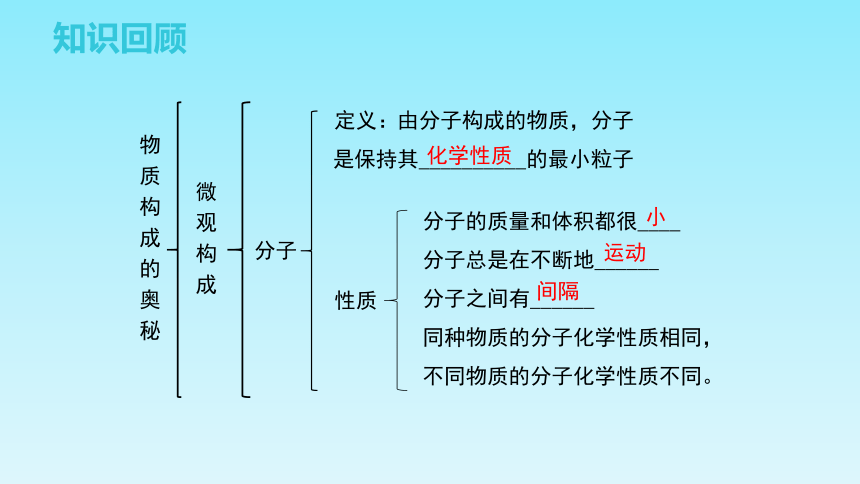
物质构成的奥秘
微观构成
由分子构成的物质,分子
是保持其__________的最小粒子
分子
分子的质量和体积都很____
分子总是在不断地______
分子之间有______
同种物质的分子化学性质相同,
不同物质的分子化学性质不同。
定义:
性质
化学性质
小
运动
间隔
元素的化学性质与原子
的_____________关系密切
物质构成的奥秘
微观构成
原子是___________中的最小粒子
质子(带正电)
中子(不带电)
原子
定义:
原子的结构
相对原子质量(见下页)
原子的构成
_________
_________(带负电)
第一层最多容纳___个电子,
第二层最多容纳___个电子,最外层不超过___个电子
与元素化学性质的关系:
化学变化
原子核
核外电子
核外电子的排布规律:
2
8
8
最外层电子数
相对原子质量的单位为“1”,一般省略不写
以一种__________________为标准,
其他原子的质量与它相比较所得到的比
某原子的
相对原子质量
定义:
相对原子
质量
表达式:
相对原子质量≈_________+_________
(原子的质量主要集中在原子核上)
一个碳12原子质量的
该原子的质量
=
碳原子质量的
质子数
中子数
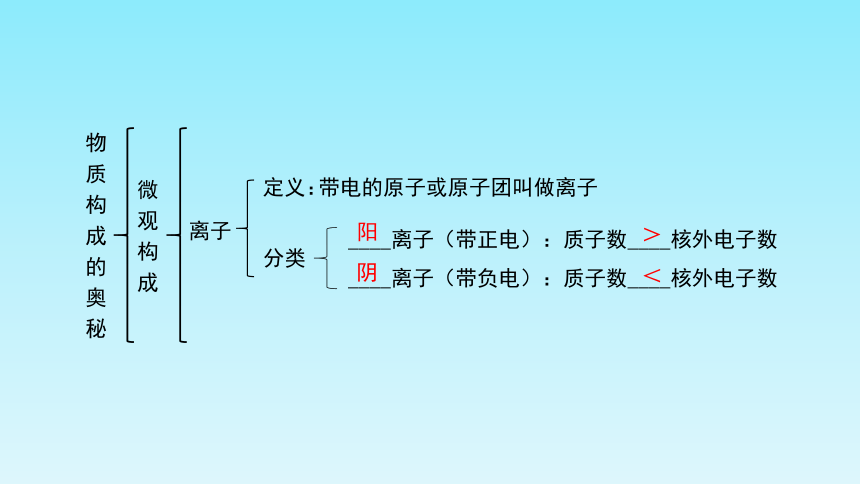
物质构成的奥秘
微观构成
____离子(带正电):质子数____核外电子数
____离子(带负电):质子数____核外电子数
带电的原子或原子团叫做离子
离子
定义:
阳
>
阴
<
分类
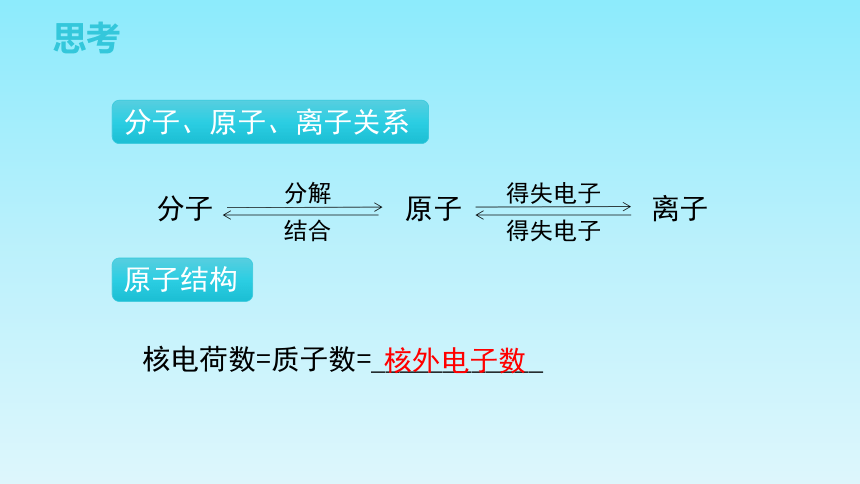
思考
核电荷数=质子数=____________
分子、原子、离子关系
分子
原子
离子
分解
结合
得失电子
得失电子
核外电子数
原子结构
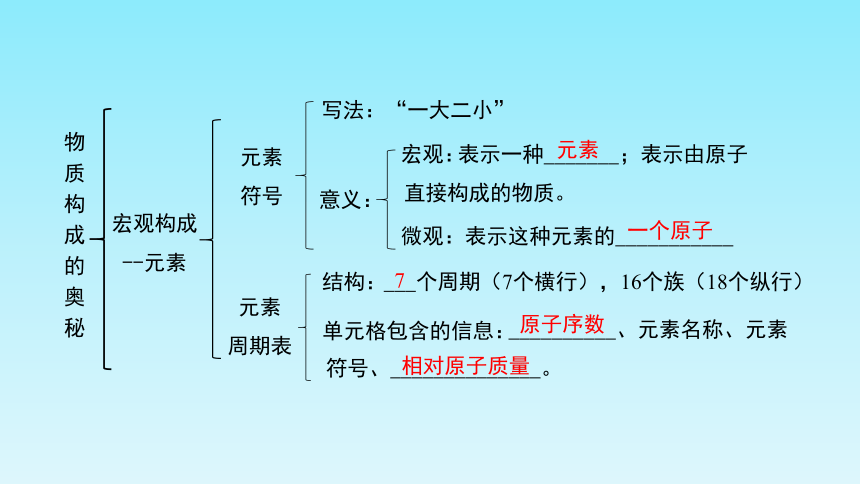
物质构成的奥秘
宏观构成
--元素
元素是________(即__________)
相同的一类原子的总称
________元素
________元素(包括稀有气体元素)
定义:
分类
存在形式:单质或化合物中
元素周期表
(结构:____个周期(7个横行),16个族(18个纵行)
单元格包含的信息:__________、元素名称、元素符号、_______________
地壳中含量居前四位的元素:O、Si、Al、Fe
质子数
核电荷数
金属
非金属
知识回顾
表示这种元素的___________
元素
符号
__________、元素名称、元素
符号、______________。
写法:“一大二小”
意义:
表示一种_______;表示由原子
直接构成的物质。
元素
周期表
结构:
___个周期(7个横行),16个族(18个纵行)
单元格包含的信息:
元素
一个原子
7
原子序数
相对原子质量
物质构成的奥秘
宏观构成
--元素
宏观:
微观:
1.下列有关分子、原子和离子的说法中,正确的是( )
A.带电的粒子一定是离子
B.分子可以再分,原子不可以再分
C.原子是化学变化中的最小粒子
D.分子是保持物质化学性质的最小粒子
2.下列关于分子的说法不正确的是( )
A.分子在不断运动 B.分子之间有间隔
C.分子构成所有的物质 D.水分子保持水的化学性质
C
C
专项突破
专项一:构成物质的粒子--分子、原子、离子
3.(2020 张家界)我市盛产多种野生菌。行走在大山里,能闻到某些野生菌散发出的特殊香味,主要是因为( )
A.分子可以再分
B.分子之间有间隔
C.分子在不断运动
D.分子的质量和体积都很小
C
4.关于分子、原子、离子的下列说法中,错误的是( )
A.分子、原子、离子都是在不断运动的粒子
B.分子是由原子构成的一种粒子
C.分子、原子、离子都是不显电性的粒子
D.分子、原子、离子都是构成物质的基本粒子
C
5.下列说法不正确的是( )
A.分子和原子的本质区别:在化学变化中,分子可分,而原子不可分
B.原子得失电子变成离子后,元素的种类发生了改变
C.同种原子可以构成不同的分子
D.原子的质量主要集中在原子核上
6.构成物质的粒子有分子、原子和离子,下列有关这三种粒子的说法错误的是( )
A.分子和原子都在不断地运动,而离子是静止的
B.分子一定比构成它的原子大
C.同一元素的两种粒子,其原子核内质子数一定相同
D.当原子失去或者得到电子后,其性质发生了改变
B
A
7.下列事实的微观解释错误的是( )
A
选项 事实 微观解释
A 温度降低,汽油的密度增大 分子的体积变小
B 春天公园里散发出阵阵花香 分子在不断运动
C 10 mL酒精与10 mL水混合后体积小于20 mL 分子之间有间隙
D 一滴水中含有约1.67×1021个水分子 水分子的体积和质量都很小
8.用水壶烧水,水开时壶盖被顶开。对这一现象的解释正确的是( )
A.水沸腾时掀起壶盖,说明分子大小随温度升高而增大
B.水受热时分子间间隔变大,所占体积变大
C.水分解成氢气和氧气
D.水分子分解成氢原子和氧原子,粒子数目增多了
B
9.请从微观角度解释以下现象、变化或说法。
(1)酒精需要密封保存,是因为______________________。
(2)冰水共存物属于纯净物,是因为______________________。
(3)过氧化氢和水的组成元素相同,但二者化学性质不同,
是因为构成两种物质的____________不同。
酒精分子在不断地运动
只含有水分子一种分子
分子的构成
是某粒子的结构示意图,该粒子在化学反应中容
易_______(填“得到”或“失去”)电子,变成______(填
“阳”或“阴”)离子。
10.初中化学学习中,我们初步认识了物质的微观结构。
(1)氯化钠、金刚石、二氧化碳三种物质中,由离子构成的
物质是____________。
氯化钠
失去
阳
(2)
(3)如图是CO与O2反应的微观示意图,反应前后没有
发生变化的粒子是________(填序号)。
④⑤
回答下面问题:
(1)实验中,E所起的作用是____________。
(2)实验中观察到B、C试管内的溶液都变成红色,但C试管内液
体变色速率较快,由此实验现象得出的结论是(写两条)
①____________________;②______________________________。
作为对照
分子是不断运动的
温度越高,分子运动速率越快
11.浓氨水有一股难闻的刺激性气味,在老师指导下,同学们对教材上的实验装置进行了改进,改进后的装置如图所示:
12.(2020 潍坊)科学家发现一种只有四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。它与天体中的中子星构成类似。有关该粒子的说法不正确的是( )
A.不显电性
B.失去一个中子后显+1价
C.质量相当于一个氦(He) 原子的质量
D.在现有的周期表中不可能有它的位置
D
专项二:粒子的结构与性质
14.下列四种粒子的结构示意图中,表示金属离子的是( )
13.据报道,某医院正在研究用放射性碘原子治疗肿瘤。这种
碘原子的核电荷数为53,相对原子质量为125。下列关于这种
原子的说法中,错误的是( )
A.中子数为72 B.质子数为72
C.电子数为53 D.质子数和中子数之和为125
B
D
A B C D
15.如图为甲、乙两种微观粒子的结构示意图,下列关于
这两种粒子的说法中,不正确的是( )
A.甲粒子不显电性,乙粒子带正电荷
B.甲、乙粒子代表的元素都属于金属元素
C.乙粒子比甲粒子的化学性质稳定
D.乙粒子是阳离子,甲粒子容易形成阴离子
D
16.以下是四种微粒的结构示意图,下列有关各微粒的
说法中,错误的是( )
A.①的化学性质比较稳定
B.③失去个电子变成④
C.④是一种阴离子
D.②容易得到电子
C
17.下列有关原子结构的说法正确的是( )
A.原子核中都含有质子和中子
B.Na和Na+含有相同的质子数
C.具有相对稳定结构的粒子,一定是稀有气体元素的原子
D.阴离子中,电子数比核电荷数少
B
18.已知元素周期表中第三周期各元素原子结构示意图如下,下列分析错误的是( )
A.以上原子的核外都有三个电子层
B.Na+和Mg2+的核外电子数不相同
C.Na2S是由Na+与S2-形成的化合物
D.在化学反应中氯原子容易得到电子
B
(1)若n=3,则m=_____。
(2)若该粒子呈电中性,则n=_________。
(3)若n=6,则该原子是__________(填“金属”或“非金属”)
原子,它在化学化中容易______(填“得到”或“失去”)电子。
19.某粒子(原子或离子)的结构示意图为 。请回答下
列问题:
13
m-10
非金属
得到
(1)氯原子的结构示意图中x的数值是_____。
(2)氧和硫两种元素的化学性质具有相似性的原因是
它们原子的__________________相同。
(3)氧和氯两种元素最本质的区别是它们原子
______________________不同。
7
最外层电子数
质子数(或核电荷数)
20.下图是氧、硫、氯三种元素的原子结构示意图。
(1)A、B、C、D四种粒子共表示_____种元素。
(2)D粒子在化学反应中容易______(填“得到”或“失去”)电子。
(3)当x=_____时,E粒子是原子。当x=8时,E粒子是_________(填
“原子”“阳离子”或“阴离子”),其符号是_____
(4)上述几种粒子中达到相对稳定结构的是_______(填字母序号)。
三
得到
10
阴离子
O2-
AEF
21.根据下列粒子结构示意图,回答问题。
23.(2020 福建)“加铁酱油”、“高锌奶粉”、“富硒茶叶”中,“铁、锌、硒”指的是( )
A.单质 B.元素
C.金属 D.维生素
22.下列元素符号书写正确且与名称相一致的是( )
A.钠NA B.硫S
C.铜cu D.碳N
B
B
专项三:元素及元素周期表的应用
24.下列有关元素的说法不正确的是( )
A.原子的质子数不同,则元素种类不同
B.Cl与Cl-可以相互转化
C.元素可分为金属元素和非金属元素
D.混合物中一定含有多种元素
D
25.钪(Sc)是一种“工业的维生素”。如图为钪在元素
周期表中的相关信息及其原子的结构示意图。下列说法
正确的是( )
A.钪属于非金属元素
B.钪的相对原子质量是21
C.原子结构示意图中x=10
D.钪原子核外有四个电子层
D
26.如图为元素周期表的一部分(X元素信息不全),
下列说法正确的是( )
A.碳的相对原子质量为12.01 g
B.X表示N2
C.氧原子的质子数是8
D.三种元素原子的核外电子数相同
C
27.根据下表提供的信息,下列判断正确的是( )
A.钠离子核外有三个电子层
B.元素所在的周期数等于其原子的电子层数
C.第二、三周期元素的原子从左至右最外层电子数逐渐减少
D.在化学变化中镁原子容易失去最外层2个电子形成镁离子,其离子符号是Mg+2
B
(1)锂的相对原子质量为_______。
(2)与锂元素具有相似化学性质的是____(填“A”“B”
或“C”)。
(3)在A、B、C三种粒子中属于同种元素的是_______。
6.941
A
AC
28.锂电池新能源汽车的使用,能有效改善空质量。如图是
锂元素在元素周期表中的信息:
29.学习化学使我们的思维更严谨。如图甲是钨元素在元素周期表中的信息,图乙是硫原子的原子结构示意图,图丙是元素周期表的一部分,①~⑤代表五种不同元素。
(1)图甲中183.8表示钨元素的_____________,钨元素
的原子序数是______。
(2)图乙方框内的数字是______。
(3)下列有关图丙的说法,正确的是____(填字母序号)。
A.原子序数:③>②
B.核外电子数:①=④
C.④与⑤处在同一周期
相对原子质量
74
6
AC
族 周期 ⅠA 0
一 1 H 1.008 Ⅱ A Ⅲ A Ⅳ A Ⅴ A Ⅵ A Ⅶ A 2 He
4.003
二 3 Li 6.941 4 Be 9.012 5 B 10.81 6 C 12.01 7 N 14.01 8 O 16.00 9 F 19.00 10 Ne
20.18
三 11 Na 22.99 12 Mg 24.31 13 Al 26.98 14 Si 28.09 15 P 30.97 16 S 32.06 17 Cl 35.45 18 Ar
39.95
30.下表是元素周期表的一部分:
(1)12号元素的元素符号为_____;Be元素的相对原子质量为______。
(2)相对原子质量为22.99的元素属于_______(填“金属”或“非金
属”)元素;
Ne的化学性质_______;F原子的最外层电子数为_____。
(3)表中不同种元素最本质的区别是______(填字母序号)。
A.质子数不同 B.相对原子质量不同 C.中子数不同
(4)如图为某元素的原子结构示意图,该元素位于周期表中第____周
期第ⅢA族。
Mg
9.012
金属
稳定
7
A
三
退出
物质构成的奥秘
复习与巩固
专项突破
1
知识回顾
2
知识回顾
物质构成的奥秘
微观构成
由分子构成的物质,分子
是保持其__________的最小粒子
分子
分子的质量和体积都很____
分子总是在不断地______
分子之间有______
同种物质的分子化学性质相同,
不同物质的分子化学性质不同。
定义:
性质
化学性质
小
运动
间隔
元素的化学性质与原子
的_____________关系密切
物质构成的奥秘
微观构成
原子是___________中的最小粒子
质子(带正电)
中子(不带电)
原子
定义:
原子的结构
相对原子质量(见下页)
原子的构成
_________
_________(带负电)
第一层最多容纳___个电子,
第二层最多容纳___个电子,最外层不超过___个电子
与元素化学性质的关系:
化学变化
原子核
核外电子
核外电子的排布规律:
2
8
8
最外层电子数
相对原子质量的单位为“1”,一般省略不写
以一种__________________为标准,
其他原子的质量与它相比较所得到的比
某原子的
相对原子质量
定义:
相对原子
质量
表达式:
相对原子质量≈_________+_________
(原子的质量主要集中在原子核上)
一个碳12原子质量的
该原子的质量
=
碳原子质量的
质子数
中子数
物质构成的奥秘
微观构成
____离子(带正电):质子数____核外电子数
____离子(带负电):质子数____核外电子数
带电的原子或原子团叫做离子
离子
定义:
阳
>
阴
<
分类
思考
核电荷数=质子数=____________
分子、原子、离子关系
分子
原子
离子
分解
结合
得失电子
得失电子
核外电子数
原子结构
物质构成的奥秘
宏观构成
--元素
元素是________(即__________)
相同的一类原子的总称
________元素
________元素(包括稀有气体元素)
定义:
分类
存在形式:单质或化合物中
元素周期表
(结构:____个周期(7个横行),16个族(18个纵行)
单元格包含的信息:__________、元素名称、元素符号、_______________
地壳中含量居前四位的元素:O、Si、Al、Fe
质子数
核电荷数
金属
非金属
知识回顾
表示这种元素的___________
元素
符号
__________、元素名称、元素
符号、______________。
写法:“一大二小”
意义:
表示一种_______;表示由原子
直接构成的物质。
元素
周期表
结构:
___个周期(7个横行),16个族(18个纵行)
单元格包含的信息:
元素
一个原子
7
原子序数
相对原子质量
物质构成的奥秘
宏观构成
--元素
宏观:
微观:
1.下列有关分子、原子和离子的说法中,正确的是( )
A.带电的粒子一定是离子
B.分子可以再分,原子不可以再分
C.原子是化学变化中的最小粒子
D.分子是保持物质化学性质的最小粒子
2.下列关于分子的说法不正确的是( )
A.分子在不断运动 B.分子之间有间隔
C.分子构成所有的物质 D.水分子保持水的化学性质
C
C
专项突破
专项一:构成物质的粒子--分子、原子、离子
3.(2020 张家界)我市盛产多种野生菌。行走在大山里,能闻到某些野生菌散发出的特殊香味,主要是因为( )
A.分子可以再分
B.分子之间有间隔
C.分子在不断运动
D.分子的质量和体积都很小
C
4.关于分子、原子、离子的下列说法中,错误的是( )
A.分子、原子、离子都是在不断运动的粒子
B.分子是由原子构成的一种粒子
C.分子、原子、离子都是不显电性的粒子
D.分子、原子、离子都是构成物质的基本粒子
C
5.下列说法不正确的是( )
A.分子和原子的本质区别:在化学变化中,分子可分,而原子不可分
B.原子得失电子变成离子后,元素的种类发生了改变
C.同种原子可以构成不同的分子
D.原子的质量主要集中在原子核上
6.构成物质的粒子有分子、原子和离子,下列有关这三种粒子的说法错误的是( )
A.分子和原子都在不断地运动,而离子是静止的
B.分子一定比构成它的原子大
C.同一元素的两种粒子,其原子核内质子数一定相同
D.当原子失去或者得到电子后,其性质发生了改变
B
A
7.下列事实的微观解释错误的是( )
A
选项 事实 微观解释
A 温度降低,汽油的密度增大 分子的体积变小
B 春天公园里散发出阵阵花香 分子在不断运动
C 10 mL酒精与10 mL水混合后体积小于20 mL 分子之间有间隙
D 一滴水中含有约1.67×1021个水分子 水分子的体积和质量都很小
8.用水壶烧水,水开时壶盖被顶开。对这一现象的解释正确的是( )
A.水沸腾时掀起壶盖,说明分子大小随温度升高而增大
B.水受热时分子间间隔变大,所占体积变大
C.水分解成氢气和氧气
D.水分子分解成氢原子和氧原子,粒子数目增多了
B
9.请从微观角度解释以下现象、变化或说法。
(1)酒精需要密封保存,是因为______________________。
(2)冰水共存物属于纯净物,是因为______________________。
(3)过氧化氢和水的组成元素相同,但二者化学性质不同,
是因为构成两种物质的____________不同。
酒精分子在不断地运动
只含有水分子一种分子
分子的构成
是某粒子的结构示意图,该粒子在化学反应中容
易_______(填“得到”或“失去”)电子,变成______(填
“阳”或“阴”)离子。
10.初中化学学习中,我们初步认识了物质的微观结构。
(1)氯化钠、金刚石、二氧化碳三种物质中,由离子构成的
物质是____________。
氯化钠
失去
阳
(2)
(3)如图是CO与O2反应的微观示意图,反应前后没有
发生变化的粒子是________(填序号)。
④⑤
回答下面问题:
(1)实验中,E所起的作用是____________。
(2)实验中观察到B、C试管内的溶液都变成红色,但C试管内液
体变色速率较快,由此实验现象得出的结论是(写两条)
①____________________;②______________________________。
作为对照
分子是不断运动的
温度越高,分子运动速率越快
11.浓氨水有一股难闻的刺激性气味,在老师指导下,同学们对教材上的实验装置进行了改进,改进后的装置如图所示:
12.(2020 潍坊)科学家发现一种只有四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。它与天体中的中子星构成类似。有关该粒子的说法不正确的是( )
A.不显电性
B.失去一个中子后显+1价
C.质量相当于一个氦(He) 原子的质量
D.在现有的周期表中不可能有它的位置
D
专项二:粒子的结构与性质
14.下列四种粒子的结构示意图中,表示金属离子的是( )
13.据报道,某医院正在研究用放射性碘原子治疗肿瘤。这种
碘原子的核电荷数为53,相对原子质量为125。下列关于这种
原子的说法中,错误的是( )
A.中子数为72 B.质子数为72
C.电子数为53 D.质子数和中子数之和为125
B
D
A B C D
15.如图为甲、乙两种微观粒子的结构示意图,下列关于
这两种粒子的说法中,不正确的是( )
A.甲粒子不显电性,乙粒子带正电荷
B.甲、乙粒子代表的元素都属于金属元素
C.乙粒子比甲粒子的化学性质稳定
D.乙粒子是阳离子,甲粒子容易形成阴离子
D
16.以下是四种微粒的结构示意图,下列有关各微粒的
说法中,错误的是( )
A.①的化学性质比较稳定
B.③失去个电子变成④
C.④是一种阴离子
D.②容易得到电子
C
17.下列有关原子结构的说法正确的是( )
A.原子核中都含有质子和中子
B.Na和Na+含有相同的质子数
C.具有相对稳定结构的粒子,一定是稀有气体元素的原子
D.阴离子中,电子数比核电荷数少
B
18.已知元素周期表中第三周期各元素原子结构示意图如下,下列分析错误的是( )
A.以上原子的核外都有三个电子层
B.Na+和Mg2+的核外电子数不相同
C.Na2S是由Na+与S2-形成的化合物
D.在化学反应中氯原子容易得到电子
B
(1)若n=3,则m=_____。
(2)若该粒子呈电中性,则n=_________。
(3)若n=6,则该原子是__________(填“金属”或“非金属”)
原子,它在化学化中容易______(填“得到”或“失去”)电子。
19.某粒子(原子或离子)的结构示意图为 。请回答下
列问题:
13
m-10
非金属
得到
(1)氯原子的结构示意图中x的数值是_____。
(2)氧和硫两种元素的化学性质具有相似性的原因是
它们原子的__________________相同。
(3)氧和氯两种元素最本质的区别是它们原子
______________________不同。
7
最外层电子数
质子数(或核电荷数)
20.下图是氧、硫、氯三种元素的原子结构示意图。
(1)A、B、C、D四种粒子共表示_____种元素。
(2)D粒子在化学反应中容易______(填“得到”或“失去”)电子。
(3)当x=_____时,E粒子是原子。当x=8时,E粒子是_________(填
“原子”“阳离子”或“阴离子”),其符号是_____
(4)上述几种粒子中达到相对稳定结构的是_______(填字母序号)。
三
得到
10
阴离子
O2-
AEF
21.根据下列粒子结构示意图,回答问题。
23.(2020 福建)“加铁酱油”、“高锌奶粉”、“富硒茶叶”中,“铁、锌、硒”指的是( )
A.单质 B.元素
C.金属 D.维生素
22.下列元素符号书写正确且与名称相一致的是( )
A.钠NA B.硫S
C.铜cu D.碳N
B
B
专项三:元素及元素周期表的应用
24.下列有关元素的说法不正确的是( )
A.原子的质子数不同,则元素种类不同
B.Cl与Cl-可以相互转化
C.元素可分为金属元素和非金属元素
D.混合物中一定含有多种元素
D
25.钪(Sc)是一种“工业的维生素”。如图为钪在元素
周期表中的相关信息及其原子的结构示意图。下列说法
正确的是( )
A.钪属于非金属元素
B.钪的相对原子质量是21
C.原子结构示意图中x=10
D.钪原子核外有四个电子层
D
26.如图为元素周期表的一部分(X元素信息不全),
下列说法正确的是( )
A.碳的相对原子质量为12.01 g
B.X表示N2
C.氧原子的质子数是8
D.三种元素原子的核外电子数相同
C
27.根据下表提供的信息,下列判断正确的是( )
A.钠离子核外有三个电子层
B.元素所在的周期数等于其原子的电子层数
C.第二、三周期元素的原子从左至右最外层电子数逐渐减少
D.在化学变化中镁原子容易失去最外层2个电子形成镁离子,其离子符号是Mg+2
B
(1)锂的相对原子质量为_______。
(2)与锂元素具有相似化学性质的是____(填“A”“B”
或“C”)。
(3)在A、B、C三种粒子中属于同种元素的是_______。
6.941
A
AC
28.锂电池新能源汽车的使用,能有效改善空质量。如图是
锂元素在元素周期表中的信息:
29.学习化学使我们的思维更严谨。如图甲是钨元素在元素周期表中的信息,图乙是硫原子的原子结构示意图,图丙是元素周期表的一部分,①~⑤代表五种不同元素。
(1)图甲中183.8表示钨元素的_____________,钨元素
的原子序数是______。
(2)图乙方框内的数字是______。
(3)下列有关图丙的说法,正确的是____(填字母序号)。
A.原子序数:③>②
B.核外电子数:①=④
C.④与⑤处在同一周期
相对原子质量
74
6
AC
族 周期 ⅠA 0
一 1 H 1.008 Ⅱ A Ⅲ A Ⅳ A Ⅴ A Ⅵ A Ⅶ A 2 He
4.003
二 3 Li 6.941 4 Be 9.012 5 B 10.81 6 C 12.01 7 N 14.01 8 O 16.00 9 F 19.00 10 Ne
20.18
三 11 Na 22.99 12 Mg 24.31 13 Al 26.98 14 Si 28.09 15 P 30.97 16 S 32.06 17 Cl 35.45 18 Ar
39.95
30.下表是元素周期表的一部分:
(1)12号元素的元素符号为_____;Be元素的相对原子质量为______。
(2)相对原子质量为22.99的元素属于_______(填“金属”或“非金
属”)元素;
Ne的化学性质_______;F原子的最外层电子数为_____。
(3)表中不同种元素最本质的区别是______(填字母序号)。
A.质子数不同 B.相对原子质量不同 C.中子数不同
(4)如图为某元素的原子结构示意图,该元素位于周期表中第____周
期第ⅢA族。
Mg
9.012
金属
稳定
7
A
三
退出
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
