2021-2022学年九年级化学人教版下册第八单元实验活动4金属的物理性质和某些化学性质课件(共20张PPT)
文档属性
| 名称 | 2021-2022学年九年级化学人教版下册第八单元实验活动4金属的物理性质和某些化学性质课件(共20张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 174.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-28 23:23:01 | ||
图片预览






文档简介
(共20张PPT)
实验活动4 金属的物理性质和某些化学性质
三维目标
知识 与技能 巩固和加深对金属物理性质和化学性质的认识;培养实验设计能力
过程 与方法 做好实验预习工作,根据金属的化学性质进行实验设计;通过实验探究促进对金属性质的理解
情感态度与价值观 培养敢于质疑、勤于动手的科学精神,激发求知欲和探究激情;感受科学探究对知识构建的重要意义
重点难点
重点 金属的物理性质;金属的化学性质及活动性强弱探究
难点 金属活动性强弱探究的设计
课前思考
1.将铁丝、铜丝分别伸入盛有同种试剂的两支试管
中,能比较出铁、铜金属活动性强弱的是( )
A.蒸馏水 B.稀硫酸
C.硫酸钠溶液 D.硝酸银溶液
B
2.写出下列化学方程式。
(1)铁和稀硫酸:______________________。
(2)铁和硫酸铜溶液:______________________。
(3)铜和硝酸银溶液:____________________________。
Fe+H2SO4 === FeSO4+H2↑
Fe+CuSO4 === FeSO4+Cu
Cu+2AgNO3 === Cu(NO3)2+2Ag
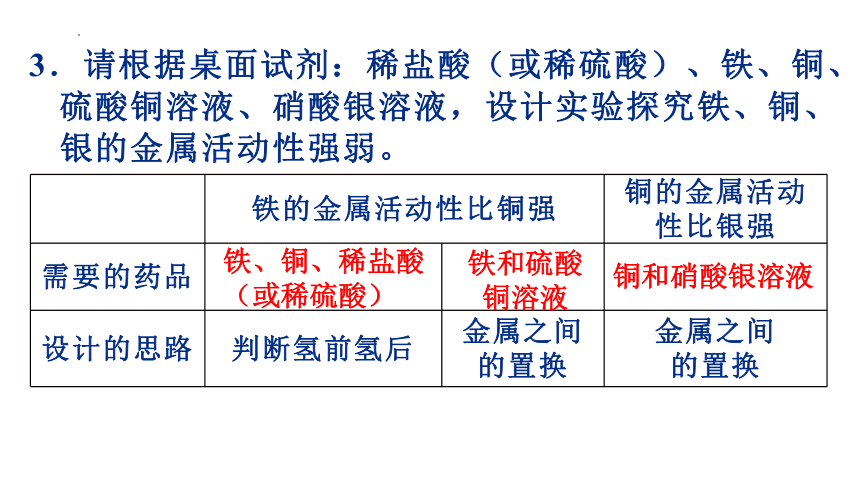
3.请根据桌面试剂:稀盐酸(或稀硫酸)、铁、铜、
硫酸铜溶液、硝酸银溶液,设计实验探究铁、铜、
银的金属活动性强弱。
铁的金属活动性比铜强 铜的金属活动性比银强
需要的药品
设计的思路 判断氢前氢后 金属之间的置换 金属之间
的置换
铁、铜、稀盐酸(或稀硫酸)
铁和硫酸铜溶液
铜和硝酸银溶液
课堂互动
【课堂活动】完成课本第24页“实验活动4”。
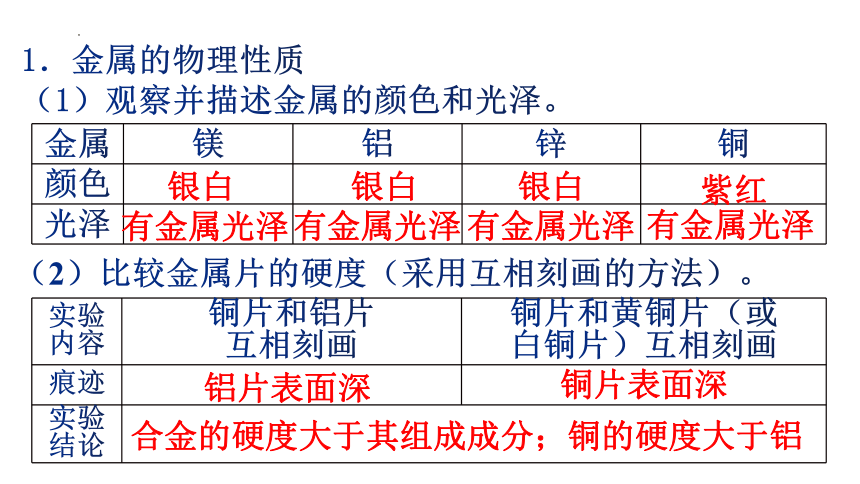
1.金属的物理性质
(1)观察并描述金属的颜色和光泽。
金属 镁 铝 锌 铜
颜色
光泽
银白
银白
银白
紫红
有金属光泽
有金属光泽
有金属光泽
有金属光泽
(2)比较金属片的硬度(采用互相刻画的方法)。
实验 内容 铜片和铝片 互相刻画 铜片和黄铜片(或
白铜片)互相刻画
痕迹
实验 结论
铝片表面深
铜片表面深
合金的硬度大于其组成成分;铜的硬度大于铝
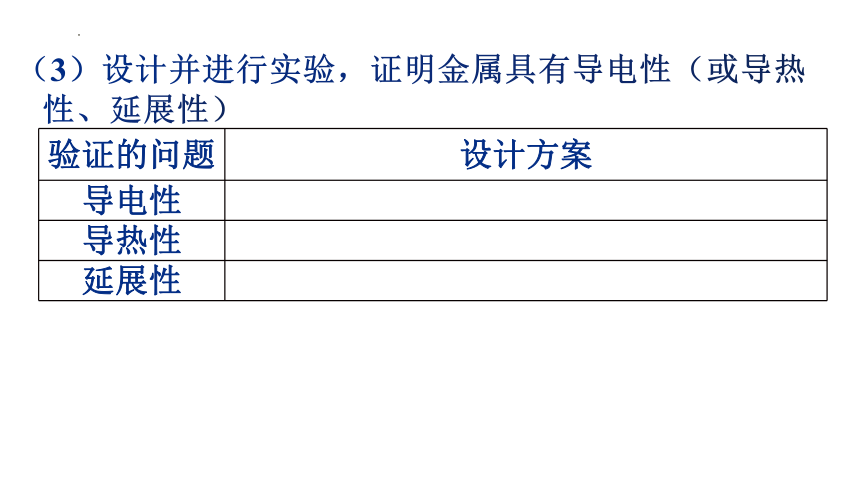
(3)设计并进行实验,证明金属具有导电性(或导热
性、延展性)
验证的问题 设计方案
导电性
导热性
延展性
(3)设计并进行实验,证明金属具有导电性(或导热性、延展性)
验证的问题 设计方案
导电性(或导热性、延展性)
2.金属的化学性质
(1)用坩埚钳夹住铜片,放在酒精灯的火焰上灼烧,现象为 ,反应的化学方程式为 。
略(方案合理即可)
表面变黑
2Cu+O2 2CuO
△
(2)金属与酸的作用(选稀盐酸或稀硫酸)
实验内容 现象 化学方程式
镁条+稀盐酸
铝片+稀盐酸
锌粒+稀盐酸
铁片+稀盐酸
铜片+稀盐酸
快速产生气泡,放热,镁很快溶解
产生气泡,铝逐渐溶解
产生气泡,锌逐渐溶解
不反应
缓慢产生气泡,溶液逐渐变绿浅色
Mg+2HCl====MgCl2+H2↑
2Al+6HCl====2AlCl3+3H2↑
Zn+2HCl====ZnCl2+H2↑
Fe+2HCl====FeCl2+H2↑
(3)比较铁、铜、银的金属活动性强弱(提示:参考
“课前思考题3”设计的方案选一种或两种进行)。
实验内容(选择药品,并实验) 现象
方案I Fe>Cu:药品 _____________
Cu>Ag:药品______________
方案Ⅱ Fe>Cu:药品______________
Cu>Ag:药品______________
实验结论:_________________________
铁、铜与盐酸
铁缓慢产生气泡,
铜不反应
铜和硝酸银溶液
铜表面覆盖银灰色
固体,溶液逐渐变蓝
铁、硫酸铜溶液
铁表面覆盖红色物质,溶液逐渐变浅绿色
铜和硝酸银溶液
铜表面覆盖银灰色固
体,溶液逐渐变蓝
金属活动性顺序为铁>铜>银
【问题与交流】铁是银白色金属。在实验中,观察到铁
粉和铁片是什么颜色的?
铁粉是灰黑色的,铁片是银白色的
测评反馈
1.所有金属都具有的性质是( )
A.导电性 B.银白色
C.熔点高 D.能与盐酸反应
2.下列物质中,不能在氧气中燃烧的是( )
A.铁丝 B.木炭
C.氢气 D.金箔
A
D
3.根据金属的活动性顺序判断,下列物质之间不能发
生化学反应的是( )
A.Fe和CuSO4溶液 B.Cu和稀盐酸
C.Zn和AgNO3溶液 D.Mg和稀硫酸
4.某硝酸铜溶液加入少量锌粉,反应停止后过滤,滤
液仍为蓝色,下列正确的是( )
A.滤渣中一定有铜和锌
B.滤渣中一定有锌
C.滤液中一定有硝酸铜,可能有硝酸锌
D.滤液中一定有硝酸铜、硝酸锌
B
D
5.对Ag、Fe、Cu三种金属活动性顺序的探究,下列
所选试剂不可行的是( )
A.Fe、Ag、CuSO4溶液
B.Cu、Ag、FeSO4溶液
C.Fe、Cu、稀盐酸、AgNO3溶液
D.Cu、FeSO4溶液、AgNO3溶液
B
名师点睛
1.金属活动性探究实验的设计思路
(1)金属与氧气的反应:金属越活泼,越容易与氧气
反应,如镁在空气中剧烈燃烧,铁在氧气中燃烧,而
铜在空气中加热表面变黑,说明金属活动性强弱顺序
为镁、铁、铜。
(2)金属与酸反应,酸要选择盐酸或稀硫酸,一般判
断金属活动性在氢之前或氢之后。
(3)金属与化合物溶液反应:
①依次置换,如铁与硫酸铜溶液反应,铁比铜强,铜
与硝酸银溶液反应,说明铜比银强,从而得出金属活
动性强弱顺序为铁、铜、银;
②“金属夹化合物”,如“Fe、CuSO4溶液、Ag”,
铁与硫酸铜溶液反应,说明铁比铜强,银与硫酸铜溶
液不反应,则说明铜比银强;
③“化合物溶液夹金属”,如“FeSO4溶液、铜、
AgNO3溶液”,铜不与硫酸亚铁溶液反应,铁比铜
强,铜与硝酸银溶液反应,说明铜比银强。
2.易错点(被列为初中化学负面内容,可以不作要求)
(1)金属与多种化合物的混合溶液反应,最弱的金属
最先被置换。如:锌加入到硝酸银、硝酸铜、硝酸亚
铁组成的混合溶液中,锌依次与硝酸银、硝酸铜、硝
酸亚铁反应。
(2)多种金属与某化合物溶液反应,最活泼的金属先
反应。如:铝、锌、铁、铜加入到硝酸银溶液中,最
先反应的金属是铝,待铝反应完毕后,锌开始与硝酸
银溶液反应,依次类推。
实验活动4 金属的物理性质和某些化学性质
三维目标
知识 与技能 巩固和加深对金属物理性质和化学性质的认识;培养实验设计能力
过程 与方法 做好实验预习工作,根据金属的化学性质进行实验设计;通过实验探究促进对金属性质的理解
情感态度与价值观 培养敢于质疑、勤于动手的科学精神,激发求知欲和探究激情;感受科学探究对知识构建的重要意义
重点难点
重点 金属的物理性质;金属的化学性质及活动性强弱探究
难点 金属活动性强弱探究的设计
课前思考
1.将铁丝、铜丝分别伸入盛有同种试剂的两支试管
中,能比较出铁、铜金属活动性强弱的是( )
A.蒸馏水 B.稀硫酸
C.硫酸钠溶液 D.硝酸银溶液
B
2.写出下列化学方程式。
(1)铁和稀硫酸:______________________。
(2)铁和硫酸铜溶液:______________________。
(3)铜和硝酸银溶液:____________________________。
Fe+H2SO4 === FeSO4+H2↑
Fe+CuSO4 === FeSO4+Cu
Cu+2AgNO3 === Cu(NO3)2+2Ag
3.请根据桌面试剂:稀盐酸(或稀硫酸)、铁、铜、
硫酸铜溶液、硝酸银溶液,设计实验探究铁、铜、
银的金属活动性强弱。
铁的金属活动性比铜强 铜的金属活动性比银强
需要的药品
设计的思路 判断氢前氢后 金属之间的置换 金属之间
的置换
铁、铜、稀盐酸(或稀硫酸)
铁和硫酸铜溶液
铜和硝酸银溶液
课堂互动
【课堂活动】完成课本第24页“实验活动4”。
1.金属的物理性质
(1)观察并描述金属的颜色和光泽。
金属 镁 铝 锌 铜
颜色
光泽
银白
银白
银白
紫红
有金属光泽
有金属光泽
有金属光泽
有金属光泽
(2)比较金属片的硬度(采用互相刻画的方法)。
实验 内容 铜片和铝片 互相刻画 铜片和黄铜片(或
白铜片)互相刻画
痕迹
实验 结论
铝片表面深
铜片表面深
合金的硬度大于其组成成分;铜的硬度大于铝
(3)设计并进行实验,证明金属具有导电性(或导热
性、延展性)
验证的问题 设计方案
导电性
导热性
延展性
(3)设计并进行实验,证明金属具有导电性(或导热性、延展性)
验证的问题 设计方案
导电性(或导热性、延展性)
2.金属的化学性质
(1)用坩埚钳夹住铜片,放在酒精灯的火焰上灼烧,现象为 ,反应的化学方程式为 。
略(方案合理即可)
表面变黑
2Cu+O2 2CuO
△
(2)金属与酸的作用(选稀盐酸或稀硫酸)
实验内容 现象 化学方程式
镁条+稀盐酸
铝片+稀盐酸
锌粒+稀盐酸
铁片+稀盐酸
铜片+稀盐酸
快速产生气泡,放热,镁很快溶解
产生气泡,铝逐渐溶解
产生气泡,锌逐渐溶解
不反应
缓慢产生气泡,溶液逐渐变绿浅色
Mg+2HCl====MgCl2+H2↑
2Al+6HCl====2AlCl3+3H2↑
Zn+2HCl====ZnCl2+H2↑
Fe+2HCl====FeCl2+H2↑
(3)比较铁、铜、银的金属活动性强弱(提示:参考
“课前思考题3”设计的方案选一种或两种进行)。
实验内容(选择药品,并实验) 现象
方案I Fe>Cu:药品 _____________
Cu>Ag:药品______________
方案Ⅱ Fe>Cu:药品______________
Cu>Ag:药品______________
实验结论:_________________________
铁、铜与盐酸
铁缓慢产生气泡,
铜不反应
铜和硝酸银溶液
铜表面覆盖银灰色
固体,溶液逐渐变蓝
铁、硫酸铜溶液
铁表面覆盖红色物质,溶液逐渐变浅绿色
铜和硝酸银溶液
铜表面覆盖银灰色固
体,溶液逐渐变蓝
金属活动性顺序为铁>铜>银
【问题与交流】铁是银白色金属。在实验中,观察到铁
粉和铁片是什么颜色的?
铁粉是灰黑色的,铁片是银白色的
测评反馈
1.所有金属都具有的性质是( )
A.导电性 B.银白色
C.熔点高 D.能与盐酸反应
2.下列物质中,不能在氧气中燃烧的是( )
A.铁丝 B.木炭
C.氢气 D.金箔
A
D
3.根据金属的活动性顺序判断,下列物质之间不能发
生化学反应的是( )
A.Fe和CuSO4溶液 B.Cu和稀盐酸
C.Zn和AgNO3溶液 D.Mg和稀硫酸
4.某硝酸铜溶液加入少量锌粉,反应停止后过滤,滤
液仍为蓝色,下列正确的是( )
A.滤渣中一定有铜和锌
B.滤渣中一定有锌
C.滤液中一定有硝酸铜,可能有硝酸锌
D.滤液中一定有硝酸铜、硝酸锌
B
D
5.对Ag、Fe、Cu三种金属活动性顺序的探究,下列
所选试剂不可行的是( )
A.Fe、Ag、CuSO4溶液
B.Cu、Ag、FeSO4溶液
C.Fe、Cu、稀盐酸、AgNO3溶液
D.Cu、FeSO4溶液、AgNO3溶液
B
名师点睛
1.金属活动性探究实验的设计思路
(1)金属与氧气的反应:金属越活泼,越容易与氧气
反应,如镁在空气中剧烈燃烧,铁在氧气中燃烧,而
铜在空气中加热表面变黑,说明金属活动性强弱顺序
为镁、铁、铜。
(2)金属与酸反应,酸要选择盐酸或稀硫酸,一般判
断金属活动性在氢之前或氢之后。
(3)金属与化合物溶液反应:
①依次置换,如铁与硫酸铜溶液反应,铁比铜强,铜
与硝酸银溶液反应,说明铜比银强,从而得出金属活
动性强弱顺序为铁、铜、银;
②“金属夹化合物”,如“Fe、CuSO4溶液、Ag”,
铁与硫酸铜溶液反应,说明铁比铜强,银与硫酸铜溶
液不反应,则说明铜比银强;
③“化合物溶液夹金属”,如“FeSO4溶液、铜、
AgNO3溶液”,铜不与硫酸亚铁溶液反应,铁比铜
强,铜与硝酸银溶液反应,说明铜比银强。
2.易错点(被列为初中化学负面内容,可以不作要求)
(1)金属与多种化合物的混合溶液反应,最弱的金属
最先被置换。如:锌加入到硝酸银、硝酸铜、硝酸亚
铁组成的混合溶液中,锌依次与硝酸银、硝酸铜、硝
酸亚铁反应。
(2)多种金属与某化合物溶液反应,最活泼的金属先
反应。如:铝、锌、铁、铜加入到硝酸银溶液中,最
先反应的金属是铝,待铝反应完毕后,锌开始与硝酸
银溶液反应,依次类推。
同课章节目录
