江苏省溧阳市南渡高级中学高二化学学案 015分子的空间构型
文档属性
| 名称 | 江苏省溧阳市南渡高级中学高二化学学案 015分子的空间构型 |  | |
| 格式 | zip | ||
| 文件大小 | 525.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-12-16 11:00:17 | ||
图片预览

文档简介
分子的空间构型
【学习目标】
1、理解杂化轨道理论的主要内容,掌握三种主要的杂化轨道类型;
2、学会用杂化轨道原理解释常见分子的成键情况与空间构型;
3、掌握价层电子对互斥理论,知道确定分子空间构型的简易方法;
〖你知道吗〗1、C原子与H原子结合形成的分子为什么是CH4,而不是CH2?CH4分子为什么具有正四面体结构?
2、为什么H2O分子是“V”型、键角是104.5°,而不是“直线型”或键角是“90°”?
一、杂化轨道理论(1931年,美国化学家鲍林L.Pauling提出)
基本要点:
①.成键时能级相近的价电子轨道混合杂化,形成新的价电子轨道—杂化轨道。
②.杂化前后轨道数目不变。
③.杂化后轨道伸展方向,形状发生改变。
1、CH4 —— sp3杂化
轨道排布式:
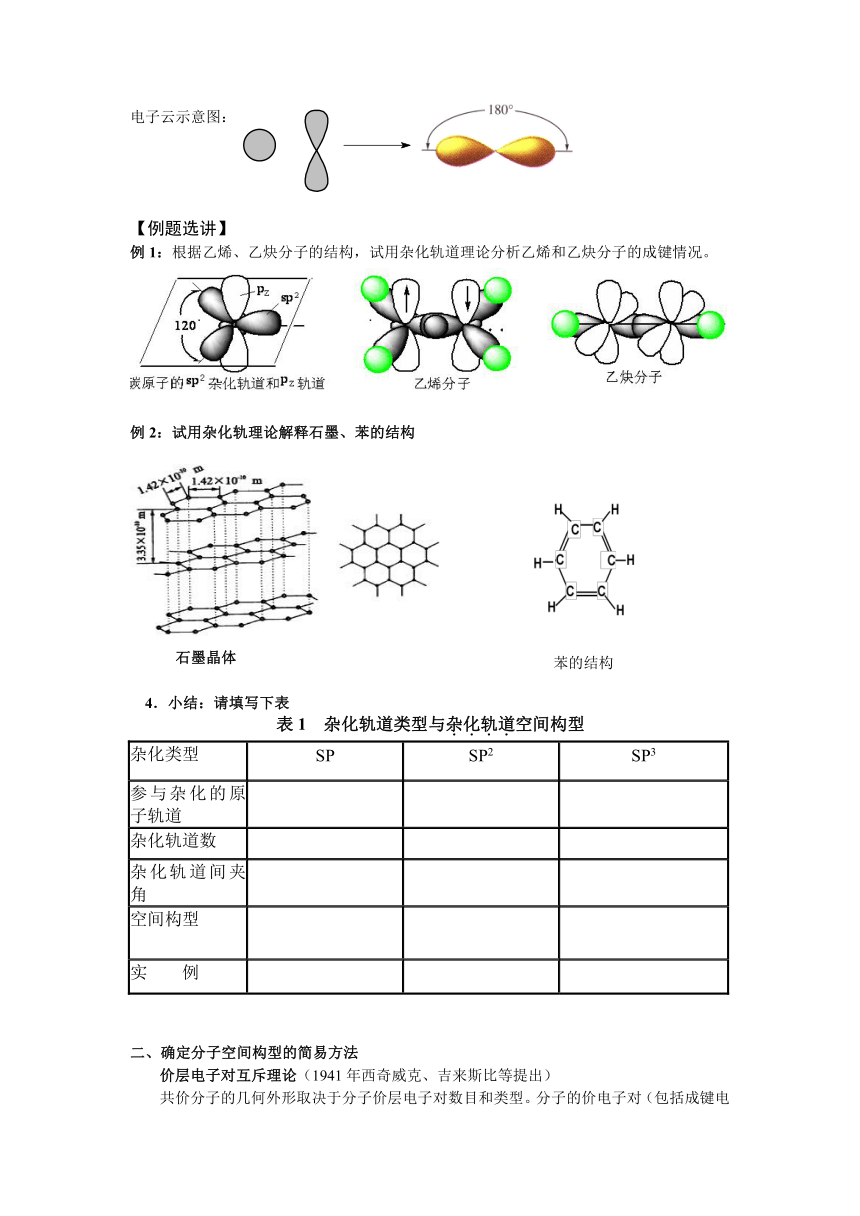
电子云示意图:
(1)能量相近的原子轨道才能参与杂化;
(2)杂化后的轨道一头大,一头小,电子云密度大的一端与成键原子的原子轨道沿键轴方向重叠,形成σ键;由于杂化后原子轨道重叠更大,形成的共价键比原有原子轨道形成的共价键稳定,所以C原子与H原子结合成稳定的CH4,而不是CH2。
2、BF3 —— sp2杂化型
用轨道排布式表示B原子采取sp2杂化轨道成键的形成过程:
电子云示意图:
3、气态BeCl2—— sp杂化型
用轨道排布式表示Be原子采取sp杂化轨道成键的形成过程:
电子云示意图:
【例题选讲】
例1:根据乙烯、乙炔分子的结构,试用杂化轨道理论分析乙烯和乙炔分子的成键情况。
例2:试用杂化轨理论解释石墨、苯的结构
例2:试用杂化轨理论解释石墨、苯的结构
石墨晶体
4.小结:请填写下表
表1 杂化轨道类型与杂化轨道空间构型
杂化类型
SP
SP2
SP3
参与杂化的原子轨道
?
杂化轨道数
杂化轨道间夹角
空间构型
实 例
二、确定分子空间构型的简易方法
价层电子对互斥理论(1941年西奇威克、吉来斯比等提出)
共价分子的几何外形取决于分子价层电子对数目和类型。分子的价电子对(包括成键电子对和孤电子对)由于相互排斥作用,而趋向尽可能远离以减小斥力而采取对称的空间构型。
1、推断分子空间构型的具体步骤:
对于ABm型分子或离子,其中心原子A的杂化轨道数恰好与A的价电子对数相等。
A的价电子对数n
2
3
4
A的杂化轨道数
2
3
4
杂化类型
sp
sp2
sp3
A的价电子空间构型
直线型
平面三角形
正四面体
对于 ABm型分子或离子,其中心原子A的价电子对数可依如下公式算得:
2、确定分子空间构型的简易方法
对于ABm型分子
(1)对于主族元素,中心原子价电子数=最外层电子数,配位原子按提供的价电子数计算,
如:PCl5 中
(2)O、S作为配位原子时按不提供价电子计算,作中心原子时价电子数为6;
(3)离子的价电子对数计算
如: NH4+ : ; SO42- :
例3:计算下列分子或离子中的价电子对数,并根据已学填写下表
物质
价电子对数
中心原子杂化轨道类型
杂化轨道/电子对空间构型
轨道夹角
分子空间构型
键角
气态BeCl2
CO2
BF3
CH4
NH4+
H2O
NH3
PCl3
〖思考、讨论〗
1、NH3、H2O分子中键角分别为107°18′、104.5°,与109°28′相差不大,由此可推测,N、O原子的原子轨道可能采取何种类型杂化?原子轨道间夹角小于109°28′,可能说明了什么问题?
2、下列分子或离子中,空间构型为V型的是 ( )
A、CS2 B、H2Se C、HCN D、ICl
3、下列分子中哪一个分子的空间构型为正四面体 ( )
A、CHCl3 B、CH3Cl C、BBr3 D、SnCl4
4、下列分子和离子中,中心原子的价电子对几何构型为四面体,且分子(离子)空间构型为V形的是 ( )
A、NH4+ B、SO2 C、H3O+ D、OF2
5、下列分子中,结构构成平面三角形的是 ( )
A、HgCl2 B、BF3 C、TeCl4 D、SF6
6、下列分子中,键角最大的是 ( )
A、H2S B、H2O C、CCl4 D、NH3
7、 下列分子中的碳原子不采取sp2杂化的是 ( )
A、C6H6 B、石墨 C、C2H4 D、C3H8
8、 下列分子的键角均是109°28′的是 ( )
A、P4 B、NH3 C、CCl4 D、CH2Cl2
9、 下列判断正确的是 ( )
A、BF3是三角锥形分子 B、铵根离子呈平面形结构
C、甲烷分子中的4个C-H键都是氢原子的1s轨道与碳原子的p轨道形成的s-pσ键
D、甲烷分子中的4个C-H键都是氢原子的1s轨道与碳原子的4个sp3杂化轨道重叠形成的σ键
10、 下列分子结构中,原子的最外层电子不能都满足8电子稳定结构的是 ( ) A、CO2 B、PCl3 C、SiH4 D、NO2
【学习目标】
1、理解杂化轨道理论的主要内容,掌握三种主要的杂化轨道类型;
2、学会用杂化轨道原理解释常见分子的成键情况与空间构型;
3、掌握价层电子对互斥理论,知道确定分子空间构型的简易方法;
〖你知道吗〗1、C原子与H原子结合形成的分子为什么是CH4,而不是CH2?CH4分子为什么具有正四面体结构?
2、为什么H2O分子是“V”型、键角是104.5°,而不是“直线型”或键角是“90°”?
一、杂化轨道理论(1931年,美国化学家鲍林L.Pauling提出)
基本要点:
①.成键时能级相近的价电子轨道混合杂化,形成新的价电子轨道—杂化轨道。
②.杂化前后轨道数目不变。
③.杂化后轨道伸展方向,形状发生改变。
1、CH4 —— sp3杂化
轨道排布式:
电子云示意图:
(1)能量相近的原子轨道才能参与杂化;
(2)杂化后的轨道一头大,一头小,电子云密度大的一端与成键原子的原子轨道沿键轴方向重叠,形成σ键;由于杂化后原子轨道重叠更大,形成的共价键比原有原子轨道形成的共价键稳定,所以C原子与H原子结合成稳定的CH4,而不是CH2。
2、BF3 —— sp2杂化型
用轨道排布式表示B原子采取sp2杂化轨道成键的形成过程:
电子云示意图:
3、气态BeCl2—— sp杂化型
用轨道排布式表示Be原子采取sp杂化轨道成键的形成过程:
电子云示意图:
【例题选讲】
例1:根据乙烯、乙炔分子的结构,试用杂化轨道理论分析乙烯和乙炔分子的成键情况。
例2:试用杂化轨理论解释石墨、苯的结构
例2:试用杂化轨理论解释石墨、苯的结构
石墨晶体
4.小结:请填写下表
表1 杂化轨道类型与杂化轨道空间构型
杂化类型
SP
SP2
SP3
参与杂化的原子轨道
?
杂化轨道数
杂化轨道间夹角
空间构型
实 例
二、确定分子空间构型的简易方法
价层电子对互斥理论(1941年西奇威克、吉来斯比等提出)
共价分子的几何外形取决于分子价层电子对数目和类型。分子的价电子对(包括成键电子对和孤电子对)由于相互排斥作用,而趋向尽可能远离以减小斥力而采取对称的空间构型。
1、推断分子空间构型的具体步骤:
对于ABm型分子或离子,其中心原子A的杂化轨道数恰好与A的价电子对数相等。
A的价电子对数n
2
3
4
A的杂化轨道数
2
3
4
杂化类型
sp
sp2
sp3
A的价电子空间构型
直线型
平面三角形
正四面体
对于 ABm型分子或离子,其中心原子A的价电子对数可依如下公式算得:
2、确定分子空间构型的简易方法
对于ABm型分子
(1)对于主族元素,中心原子价电子数=最外层电子数,配位原子按提供的价电子数计算,
如:PCl5 中
(2)O、S作为配位原子时按不提供价电子计算,作中心原子时价电子数为6;
(3)离子的价电子对数计算
如: NH4+ : ; SO42- :
例3:计算下列分子或离子中的价电子对数,并根据已学填写下表
物质
价电子对数
中心原子杂化轨道类型
杂化轨道/电子对空间构型
轨道夹角
分子空间构型
键角
气态BeCl2
CO2
BF3
CH4
NH4+
H2O
NH3
PCl3
〖思考、讨论〗
1、NH3、H2O分子中键角分别为107°18′、104.5°,与109°28′相差不大,由此可推测,N、O原子的原子轨道可能采取何种类型杂化?原子轨道间夹角小于109°28′,可能说明了什么问题?
2、下列分子或离子中,空间构型为V型的是 ( )
A、CS2 B、H2Se C、HCN D、ICl
3、下列分子中哪一个分子的空间构型为正四面体 ( )
A、CHCl3 B、CH3Cl C、BBr3 D、SnCl4
4、下列分子和离子中,中心原子的价电子对几何构型为四面体,且分子(离子)空间构型为V形的是 ( )
A、NH4+ B、SO2 C、H3O+ D、OF2
5、下列分子中,结构构成平面三角形的是 ( )
A、HgCl2 B、BF3 C、TeCl4 D、SF6
6、下列分子中,键角最大的是 ( )
A、H2S B、H2O C、CCl4 D、NH3
7、 下列分子中的碳原子不采取sp2杂化的是 ( )
A、C6H6 B、石墨 C、C2H4 D、C3H8
8、 下列分子的键角均是109°28′的是 ( )
A、P4 B、NH3 C、CCl4 D、CH2Cl2
9、 下列判断正确的是 ( )
A、BF3是三角锥形分子 B、铵根离子呈平面形结构
C、甲烷分子中的4个C-H键都是氢原子的1s轨道与碳原子的p轨道形成的s-pσ键
D、甲烷分子中的4个C-H键都是氢原子的1s轨道与碳原子的4个sp3杂化轨道重叠形成的σ键
10、 下列分子结构中,原子的最外层电子不能都满足8电子稳定结构的是 ( ) A、CO2 B、PCl3 C、SiH4 D、NO2
