新疆维吾尔自治区喀什第六高级中学2021-2022学年高一下学期2月开学考试化学试题(Word版含答案)
文档属性
| 名称 | 新疆维吾尔自治区喀什第六高级中学2021-2022学年高一下学期2月开学考试化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 241.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-01 17:08:49 | ||
图片预览


文档简介
喀什第六高级中学2021-2022学年高一下学期开学考试
化学
1.本试卷满分共100分。考试用时100分钟。 2.答题前考生务必用黑色字迹的0.5毫米签字笔将学校、姓名、考号写在答题纸的指定区域内。选择题答案按要求用2B铅笔填涂在答题纸上;非选择题的答案用黑色字迹的0.5毫米签字笔,填写在答题纸上对应题目的答案空格内;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用涂改液。答案写在试卷上无效。考试结束后,交回答题纸。
一、单项选择题:本题共20小题,每小题3分,共60分.在每小题给出的四个选项中,只有一个选项是符合题目要求的.
1.下列关于Fe3+的叙述中,错误的是
A.Fe3+不可能大量存在于碱性溶液中
B.Fe3+水溶液中加入氢氧化钠溶液产生红褐色沉淀
C.Fe3+具有氧化性,能与金属锌、铁、铜等反应
D.Fe3+溶液中滴入含硫氰化钾的溶液,有红色沉淀产生
2.下列物质可用来干燥Cl2的是 ①碱石灰 ②浓硫酸 ③无水CaCl2 ④P2O5
A.①② B.①③④ C.②③④ D.①②③④
3.下列操作及现象、结论都正确的是
选项 操作及现象 结论
A 向某无色溶液中滴加盐酸,产生气体,将气体通入澄清石灰水中,石灰水变浑浊 原无色溶液中一定含有
B 将硫酸铜溶液和氢氧化钠溶液混合,产生蓝色沉淀 和反应生成难溶于水的
C 向硫酸氢钾溶液中滴加紫色石蕊溶液,溶液变红色 属于酸
D 向某溶液中滴加氯化钡溶液和稀硝酸,产生白色沉淀 原溶液中一定含有
A.A B.B C.C D.D
4.下列反应的离子方程式书写不正确的是
A.向硫酸铜水溶液中逐渐滴加氨水形成蓝色沉淀,继续添加氨水蓝色沉淀溶解,蓝色沉淀溶解的离子方程式:Cu(OH)2+4NH3 H2O=[Cu(NH3)4]2++2OH-+4H2O
B.向FeBr2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-
C.Ba(OH)2溶液与足量的NaHCO3溶液反应:Ba2++OH-+HCO=BaCO3↓+H2O
D.向NaClO溶液中通入足量的SO2:SO2+H2O+ClO-=2H++SO+Cl-
5.下列物质属于强电解质的是
A.硫酸钡 B.氨水 C.乙醇 D.三氧化硫
6.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.的溶液中:、、、
B.无色透明的溶液中:、、、
C.遇紫色石蕊溶液变蓝的溶液中:、、、
D.含大量的溶液中:、、、
7.下列电离方程式中正确的是
A.Ba(OH)2 = Ba2+ + (OH B.NaHCO3 Na+ + HCO
C.Al2(SO4)3 = 2Al3++3S6++12O2- D.H2SO4 = 2H++
8.化学与生产、生活、社会密切相关。下列说法正确的是
A.可用干冰作镁粉爆炸时的灭火剂
B.焊接废旧钢材前,分别用饱和Na2CO3溶液和NH4Cl溶液处理焊点
C.雾、鸡蛋清溶液、石灰乳、食盐水中,分散质粒子直径最小的是雾
D.某种验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的是葡萄糖
9.下列叙述正确的是
A.钠在空气中久置最终变成碳酸氢钠粉末
B.与、反应时,只作氧化剂
C.能与石灰乳反应,可制备漂白粉
D.向溶液中滴加溶液得到白色沉淀
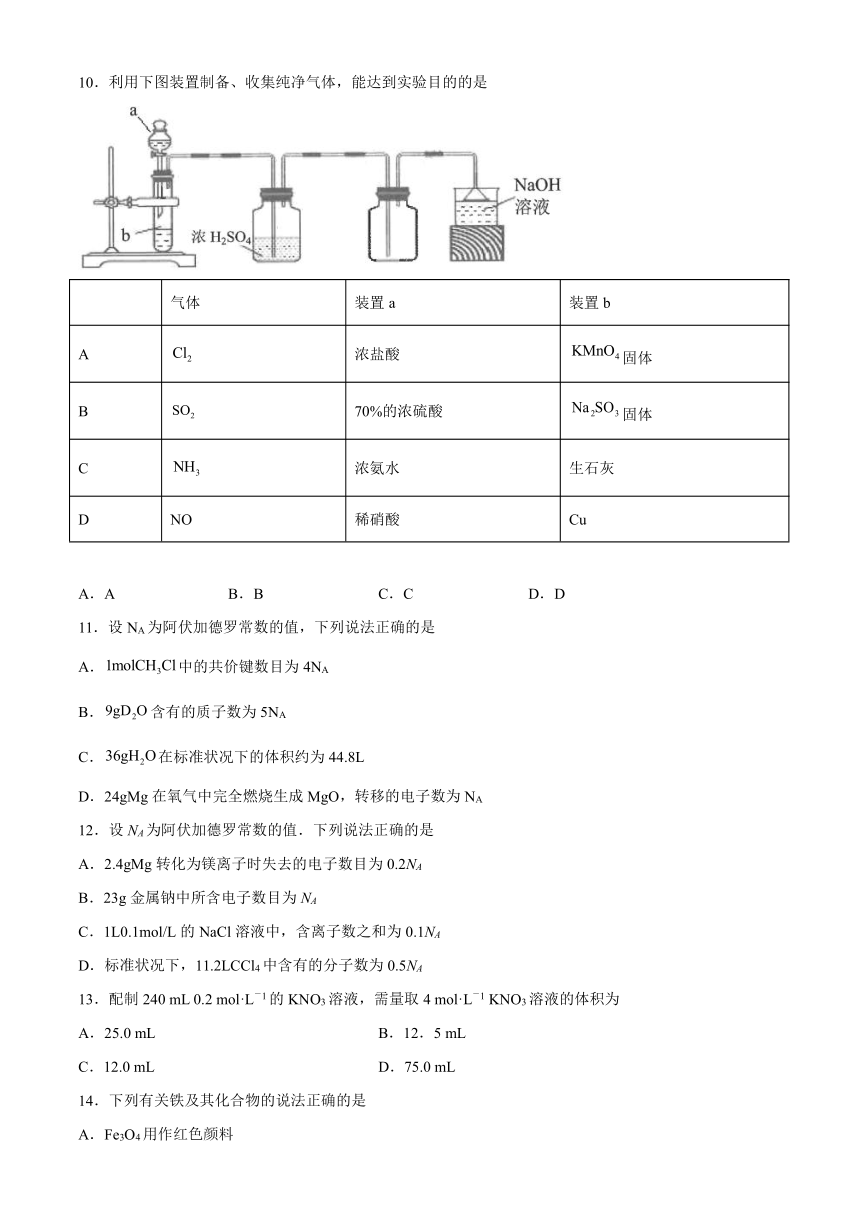
10.利用下图装置制备、收集纯净气体,能达到实验目的的是
气体 装置a 装置b
A 浓盐酸 固体
B 70%的浓硫酸 固体
C 浓氨水 生石灰
D NO 稀硝酸 Cu
A.A B.B C.C D.D
11.设NA为阿伏加德罗常数的值,下列说法正确的是
A.中的共价键数目为4NA
B.含有的质子数为5NA
C.在标准状况下的体积约为44.8L
D.24gMg在氧气中完全燃烧生成MgO,转移的电子数为NA
12.设NA为阿伏加德罗常数的值.下列说法正确的是
A.2.4gMg转化为镁离子时失去的电子数目为0.2NA
B.23g金属钠中所含电子数目为NA
C.1L0.1mol/L的NaCl溶液中,含离子数之和为0.1NA
D.标准状况下,11.2LCCl4中含有的分子数为0.5NA
13.配制240 mL 0.2 mol·L-1的KNO3溶液,需量取4 mol·L-1 KNO3溶液的体积为
A.25.0 mL B.12.5 mL
C.12.0 mL D.75.0 mL
14.下列有关铁及其化合物的说法正确的是
A.Fe3O4用作红色颜料
B.仅用KSCN溶液即可检验Fe2+
C.Fe(OH)2能在空气中稳定存在
D.FeCl3溶液作为覆铜板“腐蚀液”制作印刷电路板
15.将铁投入某溶液中,溶液质量增大,且无气体生成。则该溶液的溶质是
A. B. C. D.
16.设NA表示阿伏加德罗常数的值,下列说法正确的是
A.1.7 g NH3中含有的共用电子对数目为0.4NA
B.标准状况下,11.2L H2O中含有的分子数为0.5NA
C.浓度为1 mol/L的K2SO4溶液中所含K+数目为2NA
D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
17.能证明某溶液中含有氯化钠的是( )
A.焰色反应是黄色
B.溶液有咸味
C.取少量溶液于试管中,滴加稀硝酸酸化的硝酸银溶液,出现白色沉淀
D.焰色反应是黄色,同时又能与硝酸酸化的硝酸银溶液反应生成白色沉淀
18.下列有关实验的操作正确的是
选项 实验 操作
A 配制的溶液 称取胆矾加入水中,搅拌溶解
B 制备胶体 将浓溶液滴加到饱和溶液中
C 用排水法收集催化分解产生的 先从水槽中移出导管,后熄灭酒精灯
D 用乙醇萃取碘水中的 从分液漏斗下口先放出水层,后从上口倒出有机层
A.A B.B C.C D.D
19.X、Y、Z、R、W为原子序数依次增大的短周期元素,Z、W为同族元素,R的原子半径是同周期主族元素中最大的。其中,X、Y、Z、W形成的化合物可表示为。下列说法正确的是
A.简单氢化物的沸点:W>Z
B.原子半径:Z>W>Y
C.Z、R、W三种元素形成的化合物的水溶液呈中性
D.Z与X、Y、R、W均可形成两种或两种以上化合物
20.锂是世界上最轻的金属,它属于碱金属的一种,下列说法不正确的是( )
A.锂位于元素周期表的第二周期第ⅠA族 B.钠离子比锂原子多一个电子层
C.锂离子与钠离子最外层电子数不相同 D.锂是碱金属中原子半径最小的原子
二、综合题、本题共3小题,共40分.
21.某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:
(1)请写出Fe2O3与①反应的离子方程式______________________________。
(2)物质②为_______________。
(3)请写出FeCl3与铁粉反应的化学方程式________________________。
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为____________ ,此过程中发生的氧化还原反应为(用化学方程式表达)_________________________。
(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③为__________________,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_________________________。
22.X、Y、Z、M、N是短周期元素,且原子序数依次递增。已知X的最外层电子数是次外层电子数的3倍,X、M同主族,Y在同周期主族元素中原子半径最大。Z和N可以形成ZN2型化合物。回答下列问题:
(1)元素N在周期表中的位置____________,它的最高价氧化物的化学式为____________________________________。
(2)由元素X、Y形成的一种化合物可以作为呼吸面具的供氧剂,该化合物的电子式为__________________,其所含化学键的类型为____________。
(3)用电子式表示ZN2的形成过程____________________。
(4)Z能在氮气中燃烧,Z在氮气中燃烧的产物与水反应可产生一种使湿润红色石蕊试纸变蓝的气体。写出Z在氮气中的燃烧产物与水反应的化学方程式:________________________________________________________
23.明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S 2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。
(2)将标况下1.12L炉气通入100mL 0.5mol·L-1 NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为___________________________________。
(3)熟料溶解时反应的离子方程式为_________________________。
(4)母液中溶质主要成分的化学式为____________、_____________,溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是 ________________。试卷第1页,共3页
喀什第六高级中学2021-2022学年高一下学期开学考试
化学参考答案
D 2.C 3.B 4.C 5.A 6.C 7.D 8.B 9.C 10.B 11.A 12.A 13.B 14.D 15.D 16.D 17.D 18.C 19.D 20.B
21. Fe2O3+6H+=2Fe3++3H2O NaOH溶液(其它合理答案也可) Fe+2FeCl3=3FeCl3 生成白色沉淀,迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Fe(OH)3胶体 分散质粒子大小不同
22. 第三周期VIIA族 Cl2O7 离子键、共价键 Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
23. Al2(SO4) 3 3.612×1024 c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) Al2O3 +2OH- =2AlO2- + H2O K2SO4 Na2SO4 取最后一次洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净
化学
1.本试卷满分共100分。考试用时100分钟。 2.答题前考生务必用黑色字迹的0.5毫米签字笔将学校、姓名、考号写在答题纸的指定区域内。选择题答案按要求用2B铅笔填涂在答题纸上;非选择题的答案用黑色字迹的0.5毫米签字笔,填写在答题纸上对应题目的答案空格内;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用涂改液。答案写在试卷上无效。考试结束后,交回答题纸。
一、单项选择题:本题共20小题,每小题3分,共60分.在每小题给出的四个选项中,只有一个选项是符合题目要求的.
1.下列关于Fe3+的叙述中,错误的是
A.Fe3+不可能大量存在于碱性溶液中
B.Fe3+水溶液中加入氢氧化钠溶液产生红褐色沉淀
C.Fe3+具有氧化性,能与金属锌、铁、铜等反应
D.Fe3+溶液中滴入含硫氰化钾的溶液,有红色沉淀产生
2.下列物质可用来干燥Cl2的是 ①碱石灰 ②浓硫酸 ③无水CaCl2 ④P2O5
A.①② B.①③④ C.②③④ D.①②③④
3.下列操作及现象、结论都正确的是
选项 操作及现象 结论
A 向某无色溶液中滴加盐酸,产生气体,将气体通入澄清石灰水中,石灰水变浑浊 原无色溶液中一定含有
B 将硫酸铜溶液和氢氧化钠溶液混合,产生蓝色沉淀 和反应生成难溶于水的
C 向硫酸氢钾溶液中滴加紫色石蕊溶液,溶液变红色 属于酸
D 向某溶液中滴加氯化钡溶液和稀硝酸,产生白色沉淀 原溶液中一定含有
A.A B.B C.C D.D
4.下列反应的离子方程式书写不正确的是
A.向硫酸铜水溶液中逐渐滴加氨水形成蓝色沉淀,继续添加氨水蓝色沉淀溶解,蓝色沉淀溶解的离子方程式:Cu(OH)2+4NH3 H2O=[Cu(NH3)4]2++2OH-+4H2O
B.向FeBr2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-
C.Ba(OH)2溶液与足量的NaHCO3溶液反应:Ba2++OH-+HCO=BaCO3↓+H2O
D.向NaClO溶液中通入足量的SO2:SO2+H2O+ClO-=2H++SO+Cl-
5.下列物质属于强电解质的是
A.硫酸钡 B.氨水 C.乙醇 D.三氧化硫
6.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.的溶液中:、、、
B.无色透明的溶液中:、、、
C.遇紫色石蕊溶液变蓝的溶液中:、、、
D.含大量的溶液中:、、、
7.下列电离方程式中正确的是
A.Ba(OH)2 = Ba2+ + (OH B.NaHCO3 Na+ + HCO
C.Al2(SO4)3 = 2Al3++3S6++12O2- D.H2SO4 = 2H++
8.化学与生产、生活、社会密切相关。下列说法正确的是
A.可用干冰作镁粉爆炸时的灭火剂
B.焊接废旧钢材前,分别用饱和Na2CO3溶液和NH4Cl溶液处理焊点
C.雾、鸡蛋清溶液、石灰乳、食盐水中,分散质粒子直径最小的是雾
D.某种验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的是葡萄糖
9.下列叙述正确的是
A.钠在空气中久置最终变成碳酸氢钠粉末
B.与、反应时,只作氧化剂
C.能与石灰乳反应,可制备漂白粉
D.向溶液中滴加溶液得到白色沉淀
10.利用下图装置制备、收集纯净气体,能达到实验目的的是
气体 装置a 装置b
A 浓盐酸 固体
B 70%的浓硫酸 固体
C 浓氨水 生石灰
D NO 稀硝酸 Cu
A.A B.B C.C D.D
11.设NA为阿伏加德罗常数的值,下列说法正确的是
A.中的共价键数目为4NA
B.含有的质子数为5NA
C.在标准状况下的体积约为44.8L
D.24gMg在氧气中完全燃烧生成MgO,转移的电子数为NA
12.设NA为阿伏加德罗常数的值.下列说法正确的是
A.2.4gMg转化为镁离子时失去的电子数目为0.2NA
B.23g金属钠中所含电子数目为NA
C.1L0.1mol/L的NaCl溶液中,含离子数之和为0.1NA
D.标准状况下,11.2LCCl4中含有的分子数为0.5NA
13.配制240 mL 0.2 mol·L-1的KNO3溶液,需量取4 mol·L-1 KNO3溶液的体积为
A.25.0 mL B.12.5 mL
C.12.0 mL D.75.0 mL
14.下列有关铁及其化合物的说法正确的是
A.Fe3O4用作红色颜料
B.仅用KSCN溶液即可检验Fe2+
C.Fe(OH)2能在空气中稳定存在
D.FeCl3溶液作为覆铜板“腐蚀液”制作印刷电路板
15.将铁投入某溶液中,溶液质量增大,且无气体生成。则该溶液的溶质是
A. B. C. D.
16.设NA表示阿伏加德罗常数的值,下列说法正确的是
A.1.7 g NH3中含有的共用电子对数目为0.4NA
B.标准状况下,11.2L H2O中含有的分子数为0.5NA
C.浓度为1 mol/L的K2SO4溶液中所含K+数目为2NA
D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
17.能证明某溶液中含有氯化钠的是( )
A.焰色反应是黄色
B.溶液有咸味
C.取少量溶液于试管中,滴加稀硝酸酸化的硝酸银溶液,出现白色沉淀
D.焰色反应是黄色,同时又能与硝酸酸化的硝酸银溶液反应生成白色沉淀
18.下列有关实验的操作正确的是
选项 实验 操作
A 配制的溶液 称取胆矾加入水中,搅拌溶解
B 制备胶体 将浓溶液滴加到饱和溶液中
C 用排水法收集催化分解产生的 先从水槽中移出导管,后熄灭酒精灯
D 用乙醇萃取碘水中的 从分液漏斗下口先放出水层,后从上口倒出有机层
A.A B.B C.C D.D
19.X、Y、Z、R、W为原子序数依次增大的短周期元素,Z、W为同族元素,R的原子半径是同周期主族元素中最大的。其中,X、Y、Z、W形成的化合物可表示为。下列说法正确的是
A.简单氢化物的沸点:W>Z
B.原子半径:Z>W>Y
C.Z、R、W三种元素形成的化合物的水溶液呈中性
D.Z与X、Y、R、W均可形成两种或两种以上化合物
20.锂是世界上最轻的金属,它属于碱金属的一种,下列说法不正确的是( )
A.锂位于元素周期表的第二周期第ⅠA族 B.钠离子比锂原子多一个电子层
C.锂离子与钠离子最外层电子数不相同 D.锂是碱金属中原子半径最小的原子
二、综合题、本题共3小题,共40分.
21.某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:
(1)请写出Fe2O3与①反应的离子方程式______________________________。
(2)物质②为_______________。
(3)请写出FeCl3与铁粉反应的化学方程式________________________。
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为____________ ,此过程中发生的氧化还原反应为(用化学方程式表达)_________________________。
(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③为__________________,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_________________________。
22.X、Y、Z、M、N是短周期元素,且原子序数依次递增。已知X的最外层电子数是次外层电子数的3倍,X、M同主族,Y在同周期主族元素中原子半径最大。Z和N可以形成ZN2型化合物。回答下列问题:
(1)元素N在周期表中的位置____________,它的最高价氧化物的化学式为____________________________________。
(2)由元素X、Y形成的一种化合物可以作为呼吸面具的供氧剂,该化合物的电子式为__________________,其所含化学键的类型为____________。
(3)用电子式表示ZN2的形成过程____________________。
(4)Z能在氮气中燃烧,Z在氮气中燃烧的产物与水反应可产生一种使湿润红色石蕊试纸变蓝的气体。写出Z在氮气中的燃烧产物与水反应的化学方程式:________________________________________________________
23.明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S 2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。
(2)将标况下1.12L炉气通入100mL 0.5mol·L-1 NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为___________________________________。
(3)熟料溶解时反应的离子方程式为_________________________。
(4)母液中溶质主要成分的化学式为____________、_____________,溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是 ________________。试卷第1页,共3页
喀什第六高级中学2021-2022学年高一下学期开学考试
化学参考答案
D 2.C 3.B 4.C 5.A 6.C 7.D 8.B 9.C 10.B 11.A 12.A 13.B 14.D 15.D 16.D 17.D 18.C 19.D 20.B
21. Fe2O3+6H+=2Fe3++3H2O NaOH溶液(其它合理答案也可) Fe+2FeCl3=3FeCl3 生成白色沉淀,迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Fe(OH)3胶体 分散质粒子大小不同
22. 第三周期VIIA族 Cl2O7 离子键、共价键 Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
23. Al2(SO4) 3 3.612×1024 c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) Al2O3 +2OH- =2AlO2- + H2O K2SO4 Na2SO4 取最后一次洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净
同课章节目录
