2012新课标同步导学高一化学课件:41(苏教版必修2)(共46张PPT)
文档属性
| 名称 | 2012新课标同步导学高一化学课件:41(苏教版必修2)(共46张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-12-16 12:41:27 | ||
图片预览









文档简介
课件46张PPT。第一单元 化学是认识和创造物质的科学1.能用化学发展史说明并体会人类对物质及其变化的认识是逐步发展和深入的。
2.了解化学科学在人类认识物质世界方面的重要作用。
3.了解化学在合成新物质,提高人类生活质量方面的重要作用。
4.了解金属活动性与金属冶炼方法的联系,知道金属冶炼的本质。一、化学是打开物质世界的钥匙
1.人类对金属使用的发展过程
(1)金属使用的发展历程
金属铜约在_____年前已大规模利用,铁约在_____ 年前,而铝的使用仅有____年左右,这与金属的活 动性及人类冶炼金属的技术有关。
(2)金属的活动性与金属冶炼的关系60002500200②冶炼依据:金属的_______不同,冶炼方法不同;
③冶炼方法:___________________________及 _______。活动性电解法、热还原性、热分解法富集法2.化学科学理论的建立与发展
(1)19世纪
①以______________________和____________ 为中心内容的经典原子分子论的建立。
②1869年门捷列夫发现了___________。
③_____________的提出奠定了化学反应的动力 学基础。
④_____的人工合成,彻底动摇了“生命力论”。道尔顿原子论、分子结构原子价键理论元素周期律质量作用定律尿素(2)20世纪
①化学家____提出了____理论和______分子的 螺旋结构模型,为DNA分子双螺旋结构模型的 提出奠定了基础。
②扫描隧道显微镜的发展,实现了对__________ 的操纵。鲍林氢键蛋白质原子或分子3.人类对酸碱认识的发展
(1)阿伦尼乌斯电离学说
①酸:电解质电离产生的阳离子全部是_______的 化合物,如HCl、H2SO4等。
②碱:电解质电离产生的阴离子全部是________ ___的化合物,如NaOH等。氢原子氢氧根离子(2)酸碱质子理论
①酸:能________的物质,如HNO3、CH3COOH 等。
②碱:能_________的物质,如OH-、CH3COO- 等。
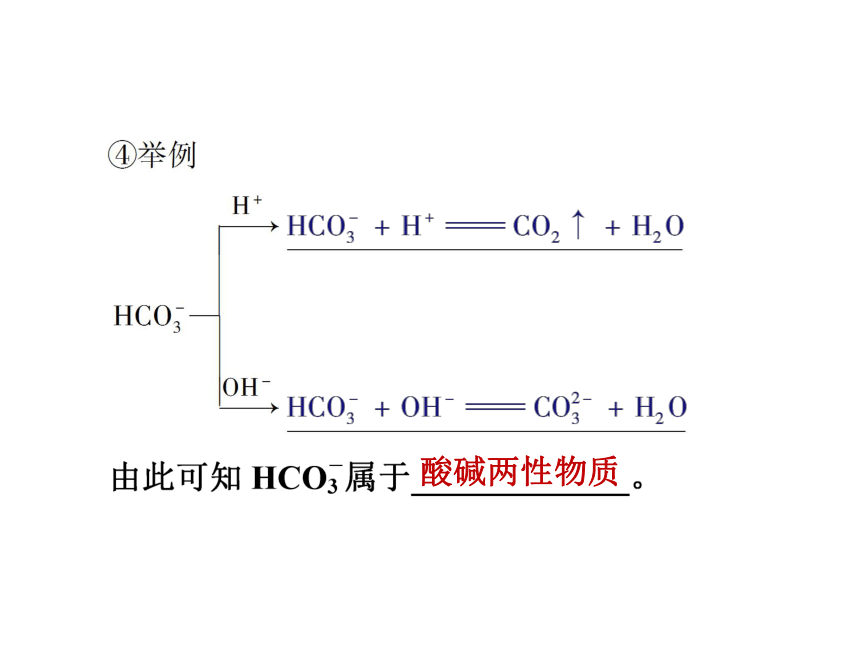
③酸碱两性物质:既能________又能_________ 的物质,如H2O、HCO等。给出质子接受质子给出质子接受质子酸碱两性物质二、化学是人类创造新物质的工具
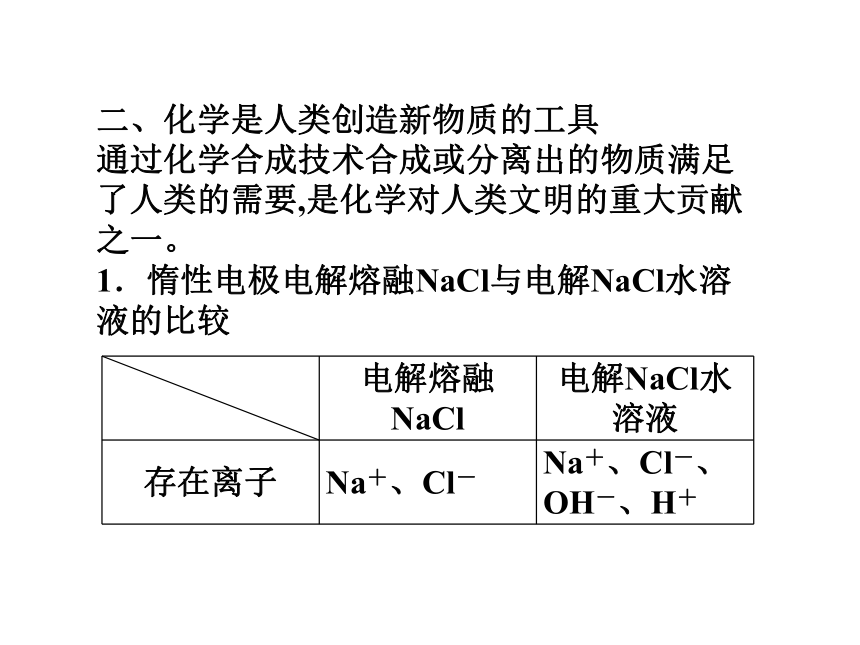
通过化学合成技术合成或分离出的物质满足了人类的需要,是化学对人类文明的重大贡献之一。
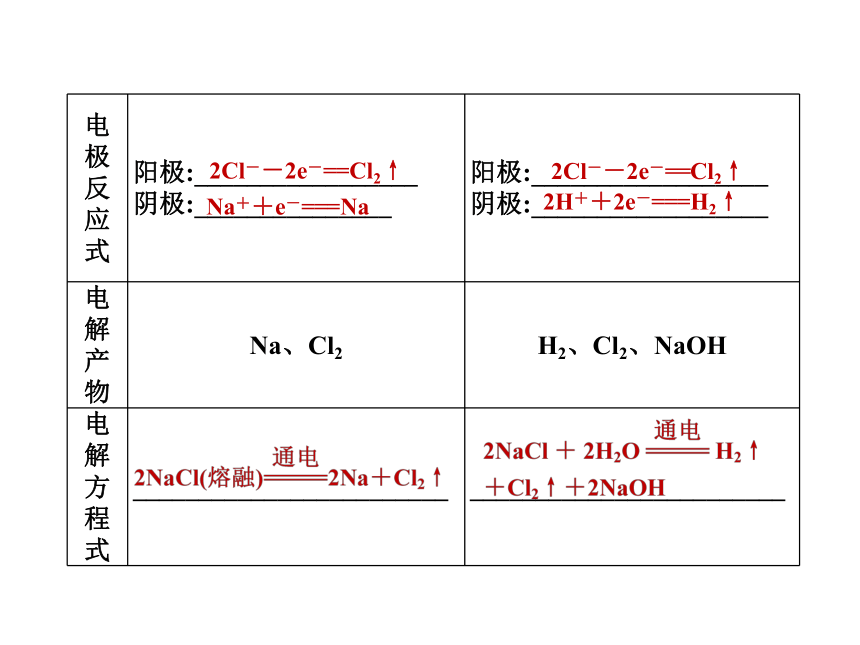
1.惰性电极电解熔融NaCl与电解NaCl水溶液的比较2Cl--2e-==Cl2↑Na++e-===Na2Cl--2e-==Cl2↑2H++2e-===H2↑2.合成氨
(1)反应原理:________________________。
(2)合成氨技术对人类的贡献:____等人于20世纪 初发明的合成氨技术,使世界粮食产量增长近一 倍。
3.合成农药
(1)DDT:残留毒性,对环境危害大。
(2)发展方向:研制__________________________ 解的新型农药。高效、低残毒、能够被生物降哈伯4.合成医药
抗生素和新药物的合成,提高了人类控制和治疗疾病的能力。[学生交流]
【提示】 金属冶炼原理和实质
金属冶炼的实质是使金属化合物中的金属离子得到电子被还原为金属单质的过程:Mn++ne-===M。[学生交流]
【提示】 金属冶炼方法与金属活泼性的关系
金属活动性顺序表中,金属的位置越靠后,越容易被还原;金属的位置越靠前越难被还原。[师生互动]
【提示】 金属冶炼的步骤
第一步:矿物的采集、除杂。提高矿物中有用成分的含量;
第二步:冶炼。利用氧化还原反应的原理,在一定条件下,用还原剂把金属矿物中的金属离子还原成金属单质;
第三步:精炼。采用适当的方法提炼出纯金属。【归纳小结】 金属的常见冶炼方法【解析】 金属冶炼的本质是金属阳离子得到电子被还原成金属原子,因此金属越活泼,对应金属阳离子氧化性越弱,则金属越难冶炼,A、C正确;合金要比各成分金属的熔、沸点低,硬度大,B正确;因AlCl3为共价化合物,其熔融态不导电,因此不能用电解AlCl3的方法来冶炼铝,而通常用Al2O3。
【答案】 D【点评】 选择金属的冶炼方法与金属在自然界中存在的状态、金属活动性等有关,需要在理解的基础上加以记忆。1.常见的冶炼金属的方法有热分解法、还原法、电解法等。下列有关说法不正确的是( )
A.氧化汞一般用热分解法
B.粗铜精炼常用电解法
C.工业上炼铁常用CO还原铁矿石
D.工业上制镁一般是电解氯化镁晶体,而不是电解氧化镁
【解析】 应该电解熔融的无水氯化镁,而不是氯化镁晶体(MgCl2·6H2O)。
【答案】 D[学生交流]
【提示】 酸:③④⑤
碱:②
酸碱两性物质:①⑥⑦【归纳小结】 阿伦尼乌斯酸碱理论和酸碱质子理论的区别【解析】 【答案】 B2.根据酸碱质子理论,下列说法不正确的是( )
A.所有的弱酸根都是碱
B.弱酸酸式根既是酸又是碱
C.一种物质不可能既是酸又是碱
D.氢氧根是碱
【解析】 弱酸的电离是可逆的,其逆反应就是弱酸根或弱酸酸式根与氢离子的结合生成弱酸的反应,因为能够结合氢离子,所以它们都是碱,A选项正确。同时,弱酸酸式根还可以进一步电离出氢离子,所以它又是酸,B选项正确。既能给出质子又能接受质子的物质既是酸又是碱,故C选项错误。OH-+H+===H2O,D项正确。
【答案】 C1.知识小结2.规律点拨
(1)金属冶炼方法的选择取决于金属在自然界中的存在状态、金属活泼性。运用金属活动性顺序判断金属冶炼方法时要灵活掌握,如Cu可用热还原法也可用湿法炼铜,Mg可用电解MgCl2的方法也可用焦炭还原氧化镁的方法。
金属的冶炼原理在近几年高考中常以选择题和填空题形式出现,应注意加强记忆,实验操作叙述注意语言的规范性。
(2)阿伦尼乌斯酸碱理论和酸碱质子理论是从不同的角度建立起来的,在判断物质的类别时,要注意把握理论的实质和适用范围。1.(2010年天津卷)化学已渗透到人类生活的各个方面。下列说法不正确的是( )
A.阿司匹林具有解热镇痛作用
B.可以用Si3N4、Al2O3制作高温结构陶瓷制品
C.在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
D.禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染【解析】 阿斯匹林为解热镇痛药,A正确;高温结构陶瓷的基体的主要成分有Al2O3、MgO·Al2O3、SiO2、Si3N4、SiC等,B正确;钢铁闸门上装一定数量的铜块,形成铁—铜原电池,铁为负极,加速铁的腐蚀,C错;禁止使用含铅汽油,以防止铅对空气的污染,D错。
【答案】 C2.从金属被利用的历史来看,先是青铜器时代,而后是铁器时代,铝的利用是近几百年的事。下列跟这个先后顺序有关的是( )
①地壳中金属元素的含量 ②金属活动性顺序 ③金属的导电性 ④金属冶炼的难易程度 ⑤金属的延展性
A.①③ B.②⑤
C.③⑤ D.②④【解析】 金属活动性顺序表中,金属的位置越靠后,越容易被还原,用一般的还原方法就能使金属离子还原,人们开发、利用的时间就较早;金属的位置越靠前,越难被还原,最活泼的金属只能用最强的还原手段(电解)来使金属离子还原,人们开发利用的时间就较晚。
【答案】 D3.酸碱质子理论认为碱是( )
A.一切有涩味、有滑腻感的溶液
B.一切金属氧化物溶于水生成的物质
C.在水中电离出的阴离子全部是OH-离子的电解质
D.凡是能接受质子的物质
【解析】 A项是17世纪前,人们凭感觉对碱的判断;B项是拉瓦锡在波义耳之后提出的碱的概念;C项是阿伦尼乌斯提出的碱;D项是酸碱质子理论认为的碱。故正确答案为D。
【答案】 D4.下列说法正确的是( )
A.有些活泼金属,如铝可作热还原法的还原剂
B.用电解NaCl溶液的方法来冶炼金属钠
C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝
D回收旧金属可以重新制成金属或它们的化合物【答案】 AD5.下列说法正确的是________。
①19世纪初,道尔顿提出了原子学说;
②1703年,德国化学家贝歇尔和施塔尔提出燃素说;
③1774年,法国科学家拉瓦锡通过实验证明空气是由O2和N2组成的;
④17世纪末,英国化学家波义耳提出了新的酸、碱定义;
⑤1883年,瑞典化学家阿伦尼乌斯创立电离学说;⑥1909年,哈伯等人发明了用锇作催化剂的高压合成氨技术;
⑦1929年,弗莱明发现了青霉素;
⑧20世纪,化学家霍金提出了氢键理论和蛋白质分子的螺旋结构模型;
⑨20世纪80年代以来,先后有多位化学家由于合成C60、发现导电塑料、成功地应用手性催化剂提高药物合成效率,获得了诺贝尔化学奖。
【解析】 霍金是物理学家,提出氢键理论和蛋白质分子的螺旋结构模型的是化学家鲍林。
【答案】 ①②③④⑤⑥⑦⑨6.随着人类对水的研究不断深入,水的应用也越来越广泛。研究人员最近发现,在一定的实验条件下,给水施加一个弱电场,在20 ℃、1个大气压下,水可以结成冰,称为“热冰”。
(1)“热冰”有许多实用价值,如开发新药、用于纳米打印机等,还有可能用来________。
①代替干冰 ②建室温溜冰场 ③在室温下制作冰雕 ④防止冰川融化
A.①② B.②③
C.③④ D.①④(2)电解水可以制氢气,化学反应方程式是______________________。但由于这种方法耗电量大,人们正在研究植物光合作用中光解水的有关机理,以期低成本、高效率地获得氢气,为此需要重点研究的细胞器是________。
(3)氢能将成为绿色可再生能源。首座燃料电池汽车高压加氢站将于年底现身上海,燃料电池是利用原电池的原理将______________________
能转化为________能。【解析】 “热冰”的特点是在较高温度下使水呈固态,因而可以用于在室温下制作冰制品,建立室温溜冰场,但不具有干冰在室温下汽化的性能,所以不能代替干冰。将冰川变为“热冰”不现实。电解水可生成H2和O2。原电池是将化学能转化为电能的装置。练规范、练技能、练速度
2.了解化学科学在人类认识物质世界方面的重要作用。
3.了解化学在合成新物质,提高人类生活质量方面的重要作用。
4.了解金属活动性与金属冶炼方法的联系,知道金属冶炼的本质。一、化学是打开物质世界的钥匙
1.人类对金属使用的发展过程
(1)金属使用的发展历程
金属铜约在_____年前已大规模利用,铁约在_____ 年前,而铝的使用仅有____年左右,这与金属的活 动性及人类冶炼金属的技术有关。
(2)金属的活动性与金属冶炼的关系60002500200②冶炼依据:金属的_______不同,冶炼方法不同;
③冶炼方法:___________________________及 _______。活动性电解法、热还原性、热分解法富集法2.化学科学理论的建立与发展
(1)19世纪
①以______________________和____________ 为中心内容的经典原子分子论的建立。
②1869年门捷列夫发现了___________。
③_____________的提出奠定了化学反应的动力 学基础。
④_____的人工合成,彻底动摇了“生命力论”。道尔顿原子论、分子结构原子价键理论元素周期律质量作用定律尿素(2)20世纪
①化学家____提出了____理论和______分子的 螺旋结构模型,为DNA分子双螺旋结构模型的 提出奠定了基础。
②扫描隧道显微镜的发展,实现了对__________ 的操纵。鲍林氢键蛋白质原子或分子3.人类对酸碱认识的发展
(1)阿伦尼乌斯电离学说
①酸:电解质电离产生的阳离子全部是_______的 化合物,如HCl、H2SO4等。
②碱:电解质电离产生的阴离子全部是________ ___的化合物,如NaOH等。氢原子氢氧根离子(2)酸碱质子理论
①酸:能________的物质,如HNO3、CH3COOH 等。
②碱:能_________的物质,如OH-、CH3COO- 等。
③酸碱两性物质:既能________又能_________ 的物质,如H2O、HCO等。给出质子接受质子给出质子接受质子酸碱两性物质二、化学是人类创造新物质的工具
通过化学合成技术合成或分离出的物质满足了人类的需要,是化学对人类文明的重大贡献之一。
1.惰性电极电解熔融NaCl与电解NaCl水溶液的比较2Cl--2e-==Cl2↑Na++e-===Na2Cl--2e-==Cl2↑2H++2e-===H2↑2.合成氨
(1)反应原理:________________________。
(2)合成氨技术对人类的贡献:____等人于20世纪 初发明的合成氨技术,使世界粮食产量增长近一 倍。
3.合成农药
(1)DDT:残留毒性,对环境危害大。
(2)发展方向:研制__________________________ 解的新型农药。高效、低残毒、能够被生物降哈伯4.合成医药
抗生素和新药物的合成,提高了人类控制和治疗疾病的能力。[学生交流]
【提示】 金属冶炼原理和实质
金属冶炼的实质是使金属化合物中的金属离子得到电子被还原为金属单质的过程:Mn++ne-===M。[学生交流]
【提示】 金属冶炼方法与金属活泼性的关系
金属活动性顺序表中,金属的位置越靠后,越容易被还原;金属的位置越靠前越难被还原。[师生互动]
【提示】 金属冶炼的步骤
第一步:矿物的采集、除杂。提高矿物中有用成分的含量;
第二步:冶炼。利用氧化还原反应的原理,在一定条件下,用还原剂把金属矿物中的金属离子还原成金属单质;
第三步:精炼。采用适当的方法提炼出纯金属。【归纳小结】 金属的常见冶炼方法【解析】 金属冶炼的本质是金属阳离子得到电子被还原成金属原子,因此金属越活泼,对应金属阳离子氧化性越弱,则金属越难冶炼,A、C正确;合金要比各成分金属的熔、沸点低,硬度大,B正确;因AlCl3为共价化合物,其熔融态不导电,因此不能用电解AlCl3的方法来冶炼铝,而通常用Al2O3。
【答案】 D【点评】 选择金属的冶炼方法与金属在自然界中存在的状态、金属活动性等有关,需要在理解的基础上加以记忆。1.常见的冶炼金属的方法有热分解法、还原法、电解法等。下列有关说法不正确的是( )
A.氧化汞一般用热分解法
B.粗铜精炼常用电解法
C.工业上炼铁常用CO还原铁矿石
D.工业上制镁一般是电解氯化镁晶体,而不是电解氧化镁
【解析】 应该电解熔融的无水氯化镁,而不是氯化镁晶体(MgCl2·6H2O)。
【答案】 D[学生交流]
【提示】 酸:③④⑤
碱:②
酸碱两性物质:①⑥⑦【归纳小结】 阿伦尼乌斯酸碱理论和酸碱质子理论的区别【解析】 【答案】 B2.根据酸碱质子理论,下列说法不正确的是( )
A.所有的弱酸根都是碱
B.弱酸酸式根既是酸又是碱
C.一种物质不可能既是酸又是碱
D.氢氧根是碱
【解析】 弱酸的电离是可逆的,其逆反应就是弱酸根或弱酸酸式根与氢离子的结合生成弱酸的反应,因为能够结合氢离子,所以它们都是碱,A选项正确。同时,弱酸酸式根还可以进一步电离出氢离子,所以它又是酸,B选项正确。既能给出质子又能接受质子的物质既是酸又是碱,故C选项错误。OH-+H+===H2O,D项正确。
【答案】 C1.知识小结2.规律点拨
(1)金属冶炼方法的选择取决于金属在自然界中的存在状态、金属活泼性。运用金属活动性顺序判断金属冶炼方法时要灵活掌握,如Cu可用热还原法也可用湿法炼铜,Mg可用电解MgCl2的方法也可用焦炭还原氧化镁的方法。
金属的冶炼原理在近几年高考中常以选择题和填空题形式出现,应注意加强记忆,实验操作叙述注意语言的规范性。
(2)阿伦尼乌斯酸碱理论和酸碱质子理论是从不同的角度建立起来的,在判断物质的类别时,要注意把握理论的实质和适用范围。1.(2010年天津卷)化学已渗透到人类生活的各个方面。下列说法不正确的是( )
A.阿司匹林具有解热镇痛作用
B.可以用Si3N4、Al2O3制作高温结构陶瓷制品
C.在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
D.禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染【解析】 阿斯匹林为解热镇痛药,A正确;高温结构陶瓷的基体的主要成分有Al2O3、MgO·Al2O3、SiO2、Si3N4、SiC等,B正确;钢铁闸门上装一定数量的铜块,形成铁—铜原电池,铁为负极,加速铁的腐蚀,C错;禁止使用含铅汽油,以防止铅对空气的污染,D错。
【答案】 C2.从金属被利用的历史来看,先是青铜器时代,而后是铁器时代,铝的利用是近几百年的事。下列跟这个先后顺序有关的是( )
①地壳中金属元素的含量 ②金属活动性顺序 ③金属的导电性 ④金属冶炼的难易程度 ⑤金属的延展性
A.①③ B.②⑤
C.③⑤ D.②④【解析】 金属活动性顺序表中,金属的位置越靠后,越容易被还原,用一般的还原方法就能使金属离子还原,人们开发、利用的时间就较早;金属的位置越靠前,越难被还原,最活泼的金属只能用最强的还原手段(电解)来使金属离子还原,人们开发利用的时间就较晚。
【答案】 D3.酸碱质子理论认为碱是( )
A.一切有涩味、有滑腻感的溶液
B.一切金属氧化物溶于水生成的物质
C.在水中电离出的阴离子全部是OH-离子的电解质
D.凡是能接受质子的物质
【解析】 A项是17世纪前,人们凭感觉对碱的判断;B项是拉瓦锡在波义耳之后提出的碱的概念;C项是阿伦尼乌斯提出的碱;D项是酸碱质子理论认为的碱。故正确答案为D。
【答案】 D4.下列说法正确的是( )
A.有些活泼金属,如铝可作热还原法的还原剂
B.用电解NaCl溶液的方法来冶炼金属钠
C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝
D回收旧金属可以重新制成金属或它们的化合物【答案】 AD5.下列说法正确的是________。
①19世纪初,道尔顿提出了原子学说;
②1703年,德国化学家贝歇尔和施塔尔提出燃素说;
③1774年,法国科学家拉瓦锡通过实验证明空气是由O2和N2组成的;
④17世纪末,英国化学家波义耳提出了新的酸、碱定义;
⑤1883年,瑞典化学家阿伦尼乌斯创立电离学说;⑥1909年,哈伯等人发明了用锇作催化剂的高压合成氨技术;
⑦1929年,弗莱明发现了青霉素;
⑧20世纪,化学家霍金提出了氢键理论和蛋白质分子的螺旋结构模型;
⑨20世纪80年代以来,先后有多位化学家由于合成C60、发现导电塑料、成功地应用手性催化剂提高药物合成效率,获得了诺贝尔化学奖。
【解析】 霍金是物理学家,提出氢键理论和蛋白质分子的螺旋结构模型的是化学家鲍林。
【答案】 ①②③④⑤⑥⑦⑨6.随着人类对水的研究不断深入,水的应用也越来越广泛。研究人员最近发现,在一定的实验条件下,给水施加一个弱电场,在20 ℃、1个大气压下,水可以结成冰,称为“热冰”。
(1)“热冰”有许多实用价值,如开发新药、用于纳米打印机等,还有可能用来________。
①代替干冰 ②建室温溜冰场 ③在室温下制作冰雕 ④防止冰川融化
A.①② B.②③
C.③④ D.①④(2)电解水可以制氢气,化学反应方程式是______________________。但由于这种方法耗电量大,人们正在研究植物光合作用中光解水的有关机理,以期低成本、高效率地获得氢气,为此需要重点研究的细胞器是________。
(3)氢能将成为绿色可再生能源。首座燃料电池汽车高压加氢站将于年底现身上海,燃料电池是利用原电池的原理将______________________
能转化为________能。【解析】 “热冰”的特点是在较高温度下使水呈固态,因而可以用于在室温下制作冰制品,建立室温溜冰场,但不具有干冰在室温下汽化的性能,所以不能代替干冰。将冰川变为“热冰”不现实。电解水可生成H2和O2。原电池是将化学能转化为电能的装置。练规范、练技能、练速度
