2012新课标同步导学高一化学课件:第2章(第二课时)
文档属性
| 名称 | 2012新课标同步导学高一化学课件:第2章(第二课时) |  | |
| 格式 | zip | ||
| 文件大小 | 778.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-12-16 13:04:33 | ||
图片预览











文档简介
课件41张PPT。第2课时 化学反应的限度1.认识可逆反应有一定的限度。
2.知道可逆反应在一定条件下能够达到平衡状态。
3.掌握平衡状态的特征和判断方法。
4.了解控制反应条件在生产和科学研究中的作用。1.概念:在同一条件下,既可以向__________进行, 又可以向__________进行的反应。
2.表示:用“_______”连接反应物和生成物。
3.特点:在一定条件下,可逆反应有一定的_____, 反应物_____完全转化为生成物。正反应方向逆反应方向限度不能二、化学平衡
1.化学平衡的建立
(1)反应开始时:v(正)最大,v(逆)为__。
(2)反应过程中:反应物浓度逐渐减少→v(正)逐 渐____,生成物浓度逐渐增大→v(逆)从__开始逐 渐增大。
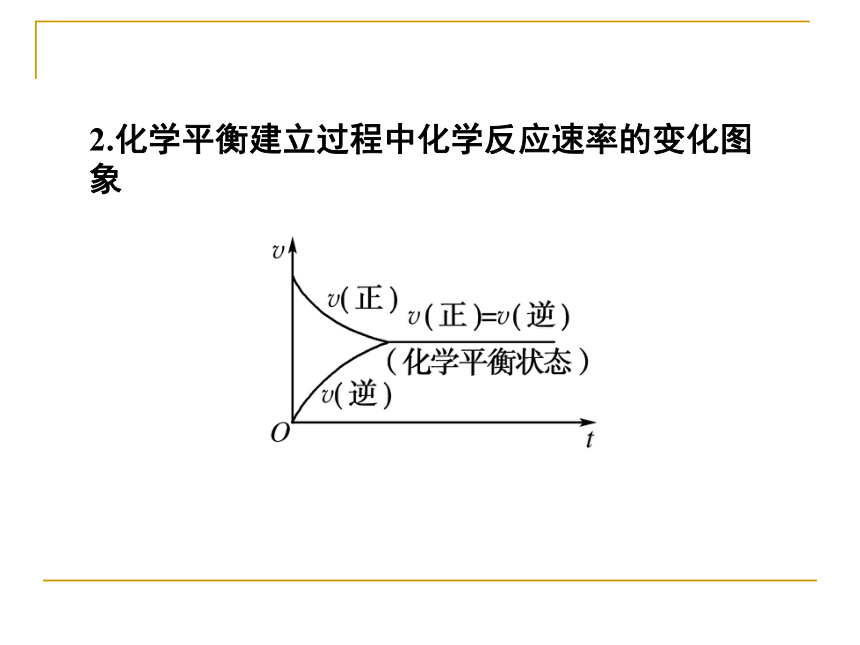
(3)反应达到平衡时:v(正)__v(逆),反应物和生成 物各组分浓度_________。0减小0=不再改变2.化学平衡建立过程中化学反应速率的变化图象
3.概念:在一定条件下的可逆反应进行到一定程 度时,正反应速率和逆反应速率_____,反应物和 生成物的浓度_____________的状态。
4.化学平衡状态的特征
(1)化学平衡是一种_____平衡,即平衡时化学反 应仍在进行,但反应混合物的组成保持_____。
(2)当外界条件改变时,原化学平衡状态______, 一段时间后会达到____________。相等不再发生变化动态不变被破坏新的平衡状态如何判断可逆反应是否达到化学平衡状态?
[师生互动]
【提示】 化学平衡状态的判断技巧:
(1)v(正)=v(逆)。
(2)体系中各组分的物质的量浓度或体积分数、物质的量分数保持不变。
(3)全是气体参加的前后化学计量数改变的可逆反应,压强保持不变。(4)全是气体参加的前后化学计量数改变的可逆反应,平均相对分子质量保持不变。
(5)对于有颜色的气体参加或生成的可逆反应,颜色不随时间发生变化。
(6)对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。⑦温度和体积一定时容器内压强不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
⑩温度和压强一定时,混合气体的密度不再变化【思路点拨】 解答本题要注意以下三点:
(1)要从不同的角度分析正、逆反应速率。
(2)反应过程中压强是否发生变化。
(3)颜色、密度的变化情况。【尝试解答】 注意化学平衡状态的实质是正、逆反应速率相等,要仔细分析各项叙述中的反应速率。①中正、逆反应速率不相等,④、⑤是相同的,都是指的单向反应速率,故均不正确。平衡时,各物质的浓度或百分含量保持不变,并不一定相等,故③不正确。该反应前后气体分子数不变,故压强、相对分子质量、气体密度均不随反应的进行而改变,⑦、⑧、⑩均不正确。各气体中只有I2有颜色,反应进行时,随I2的浓度改变,颜色会发生改变,颜色不再改变时,说明已达平衡,故②⑥⑨正确。
【答案】 ②⑥⑨【解析】 平衡时,正反应速率和逆反应速率相等,即同一种物质的消耗速率和生成速率相等,A选项正确;在任意一个化学反应中,化学反应速率之比等于化学计量数之比,即v(NH3)∶v(O2)∶v(NO)∶v(H2O)=4∶5∶4∶6,所以4v正(O2)=5v正(NO),v正(H2O)的数值最大,B选项错误,C选项正确;若4 mol NH3和5 mol O2恰好完全反应则正好生成4 mol NO,但是该反应为可逆反应,可逆反应不可能完全反应,所以无论如何控制外界条件,都不可能生成4 mol NO,D选项错误。
【答案】 AC[学生交流]
【提示】 化学反应有的快、有的慢,有的进行程度大、有的进行程度小,有的对我们有利、有的对我们不利。控制反应条件,促进有利的化学反应(提高反应物的转化率即原料的利用率,加快反应速率等),抑制有害的化学反应(减缓反应速率,减少甚至消除有害物质的产生,控制副反应的发生等),使化学反应向着对我们有利的方向转化。下列措施,能使煤炭燃烧更充分,提高热能利用率的是( )
A.多加煤以使炉火更旺
B.把煤炭做成大煤球
C.把煤中掺和一些黄泥做成蜂窝煤
D.把煤粉碎,在煤粉燃烧器中燃烧
【解析】 A项中只会增加煤的用量,不会使煤炭燃烧充分,也不能提高热能的利用率;B、C项无论从煤的粉碎程度,还是空气用量上都比不上D项。【答案】 D
【点评】 提高燃料的热能利用率,实质上是从多方面控制燃烧反应条件(包括环境)。它的意义在于节约能源、节省资源、减小污染。【解析】 升高温度,化学反应加快,降低温度,化学反应减慢。
【答案】 D1.知识小结2.规律点拨
(1)一定条件下的可逆反应达到平衡状态即是化学反应进行的最大限度,此时的转化率最大。改变条件,平衡可以发生移动。
(2)化学平衡的实质是同种物质的正、逆反应速率相等。用不同物质的正、逆反应速率判断是否达到化学平衡状态时,要根据化学反应速率之比等于化学计量数之比,转化为同种物质的速率进行比较。C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D.在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题【解析】 对于可逆反应来说,在一定条件下反应物不可能全部转化为产物,反应只能进行到一定程度。在达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,最终正、逆反应速率相等,即达到平衡,此时,反应物和生成物的浓度都不再随时间的变化而变化,但反应并没有停止,正、逆反应都依然进行着。
【答案】 B【解析】 ①正、逆反应速率相等;②浓度不变,说明已达平衡;如果该反应没有达到平衡则反应要和外界有能量的交换,必然导致体系温度改变;③现在体系温度不变,说明已达平衡;由于该反应是一个体积改变的反应,没有达到平衡之前,压强是改变的,分子总数也是改变的,只有平衡了,二者才不再改变,故①②③④⑤均正确。
【答案】 D3.下列措施可以提高燃料燃烧效率的是( )
①提高燃料的着火点 ②降低燃料的着火点 ③将固体燃料粉碎 ④将液体燃料雾化 ⑤将煤气化处理 ⑥通入适量的空气
A.①③④⑤ B.②③⑤⑥
C.③④⑤⑥ D.①②③④【解析】 理论上,提高燃料燃烧效率的方法是:增大燃料与空气的接触面积,并通入充足的空气。可燃物的着火点是无法提高和降低的。①②不能提高燃料的燃烧效率。将固体粉碎、将液体雾化、将煤气化都能增大燃料与空气的接触面积,③④⑤可提高燃料的燃烧效率。⑥通入适量的空气,也是提高燃料燃烧效率的一种方法。
【答案】 C【解析】 增大反应物浓度,平衡向正反应方向移动,故CO2的物质的量一定大于0.6 mol,但1 mol CO完全转化也只能生成1 mol CO2,所以CO2物质的量小于1 mol,故选C。
【答案】 C(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)________,c(I2)________,而c(HI)______,从而化学反应速率v(正)______,而v(逆)________。
(3)当反应进行到v(正)与v(逆)________时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将________。【解析】 主要考查化学平衡建立的过程,开始时,c(H2)和c(I2)为最大值,正反应速率最大,由于此时没有HI,逆反应速率最小为0,随着反应进行c(H2)和c(I2)越来越小,正反应速率越来越小,逆反应速率逐渐变大,直到平衡时,v(正)=v(逆)。【解析】 2 mol SO3分解生成1 mol O2,生成2 mol NO2需1 mol O2,根据“n(O2)=0.1 mol、n(NO2)=3.6 mol”可计算出还剩余SO3 0.2 mol。分析题给反应式可知,SO3、SO2两种物质中知道任意一种就可计算出另一种,NO、NO2两种物质中知道任意一种就可计算出另一种。
【答案】 (1)0.2 mol (2)SO2 NO2 (3)AC练规范、练技能、练速度
2.知道可逆反应在一定条件下能够达到平衡状态。
3.掌握平衡状态的特征和判断方法。
4.了解控制反应条件在生产和科学研究中的作用。1.概念:在同一条件下,既可以向__________进行, 又可以向__________进行的反应。
2.表示:用“_______”连接反应物和生成物。
3.特点:在一定条件下,可逆反应有一定的_____, 反应物_____完全转化为生成物。正反应方向逆反应方向限度不能二、化学平衡
1.化学平衡的建立
(1)反应开始时:v(正)最大,v(逆)为__。
(2)反应过程中:反应物浓度逐渐减少→v(正)逐 渐____,生成物浓度逐渐增大→v(逆)从__开始逐 渐增大。
(3)反应达到平衡时:v(正)__v(逆),反应物和生成 物各组分浓度_________。0减小0=不再改变2.化学平衡建立过程中化学反应速率的变化图象
3.概念:在一定条件下的可逆反应进行到一定程 度时,正反应速率和逆反应速率_____,反应物和 生成物的浓度_____________的状态。
4.化学平衡状态的特征
(1)化学平衡是一种_____平衡,即平衡时化学反 应仍在进行,但反应混合物的组成保持_____。
(2)当外界条件改变时,原化学平衡状态______, 一段时间后会达到____________。相等不再发生变化动态不变被破坏新的平衡状态如何判断可逆反应是否达到化学平衡状态?
[师生互动]
【提示】 化学平衡状态的判断技巧:
(1)v(正)=v(逆)。
(2)体系中各组分的物质的量浓度或体积分数、物质的量分数保持不变。
(3)全是气体参加的前后化学计量数改变的可逆反应,压强保持不变。(4)全是气体参加的前后化学计量数改变的可逆反应,平均相对分子质量保持不变。
(5)对于有颜色的气体参加或生成的可逆反应,颜色不随时间发生变化。
(6)对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。⑦温度和体积一定时容器内压强不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
⑩温度和压强一定时,混合气体的密度不再变化【思路点拨】 解答本题要注意以下三点:
(1)要从不同的角度分析正、逆反应速率。
(2)反应过程中压强是否发生变化。
(3)颜色、密度的变化情况。【尝试解答】 注意化学平衡状态的实质是正、逆反应速率相等,要仔细分析各项叙述中的反应速率。①中正、逆反应速率不相等,④、⑤是相同的,都是指的单向反应速率,故均不正确。平衡时,各物质的浓度或百分含量保持不变,并不一定相等,故③不正确。该反应前后气体分子数不变,故压强、相对分子质量、气体密度均不随反应的进行而改变,⑦、⑧、⑩均不正确。各气体中只有I2有颜色,反应进行时,随I2的浓度改变,颜色会发生改变,颜色不再改变时,说明已达平衡,故②⑥⑨正确。
【答案】 ②⑥⑨【解析】 平衡时,正反应速率和逆反应速率相等,即同一种物质的消耗速率和生成速率相等,A选项正确;在任意一个化学反应中,化学反应速率之比等于化学计量数之比,即v(NH3)∶v(O2)∶v(NO)∶v(H2O)=4∶5∶4∶6,所以4v正(O2)=5v正(NO),v正(H2O)的数值最大,B选项错误,C选项正确;若4 mol NH3和5 mol O2恰好完全反应则正好生成4 mol NO,但是该反应为可逆反应,可逆反应不可能完全反应,所以无论如何控制外界条件,都不可能生成4 mol NO,D选项错误。
【答案】 AC[学生交流]
【提示】 化学反应有的快、有的慢,有的进行程度大、有的进行程度小,有的对我们有利、有的对我们不利。控制反应条件,促进有利的化学反应(提高反应物的转化率即原料的利用率,加快反应速率等),抑制有害的化学反应(减缓反应速率,减少甚至消除有害物质的产生,控制副反应的发生等),使化学反应向着对我们有利的方向转化。下列措施,能使煤炭燃烧更充分,提高热能利用率的是( )
A.多加煤以使炉火更旺
B.把煤炭做成大煤球
C.把煤中掺和一些黄泥做成蜂窝煤
D.把煤粉碎,在煤粉燃烧器中燃烧
【解析】 A项中只会增加煤的用量,不会使煤炭燃烧充分,也不能提高热能的利用率;B、C项无论从煤的粉碎程度,还是空气用量上都比不上D项。【答案】 D
【点评】 提高燃料的热能利用率,实质上是从多方面控制燃烧反应条件(包括环境)。它的意义在于节约能源、节省资源、减小污染。【解析】 升高温度,化学反应加快,降低温度,化学反应减慢。
【答案】 D1.知识小结2.规律点拨
(1)一定条件下的可逆反应达到平衡状态即是化学反应进行的最大限度,此时的转化率最大。改变条件,平衡可以发生移动。
(2)化学平衡的实质是同种物质的正、逆反应速率相等。用不同物质的正、逆反应速率判断是否达到化学平衡状态时,要根据化学反应速率之比等于化学计量数之比,转化为同种物质的速率进行比较。C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D.在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题【解析】 对于可逆反应来说,在一定条件下反应物不可能全部转化为产物,反应只能进行到一定程度。在达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,最终正、逆反应速率相等,即达到平衡,此时,反应物和生成物的浓度都不再随时间的变化而变化,但反应并没有停止,正、逆反应都依然进行着。
【答案】 B【解析】 ①正、逆反应速率相等;②浓度不变,说明已达平衡;如果该反应没有达到平衡则反应要和外界有能量的交换,必然导致体系温度改变;③现在体系温度不变,说明已达平衡;由于该反应是一个体积改变的反应,没有达到平衡之前,压强是改变的,分子总数也是改变的,只有平衡了,二者才不再改变,故①②③④⑤均正确。
【答案】 D3.下列措施可以提高燃料燃烧效率的是( )
①提高燃料的着火点 ②降低燃料的着火点 ③将固体燃料粉碎 ④将液体燃料雾化 ⑤将煤气化处理 ⑥通入适量的空气
A.①③④⑤ B.②③⑤⑥
C.③④⑤⑥ D.①②③④【解析】 理论上,提高燃料燃烧效率的方法是:增大燃料与空气的接触面积,并通入充足的空气。可燃物的着火点是无法提高和降低的。①②不能提高燃料的燃烧效率。将固体粉碎、将液体雾化、将煤气化都能增大燃料与空气的接触面积,③④⑤可提高燃料的燃烧效率。⑥通入适量的空气,也是提高燃料燃烧效率的一种方法。
【答案】 C【解析】 增大反应物浓度,平衡向正反应方向移动,故CO2的物质的量一定大于0.6 mol,但1 mol CO完全转化也只能生成1 mol CO2,所以CO2物质的量小于1 mol,故选C。
【答案】 C(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)________,c(I2)________,而c(HI)______,从而化学反应速率v(正)______,而v(逆)________。
(3)当反应进行到v(正)与v(逆)________时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将________。【解析】 主要考查化学平衡建立的过程,开始时,c(H2)和c(I2)为最大值,正反应速率最大,由于此时没有HI,逆反应速率最小为0,随着反应进行c(H2)和c(I2)越来越小,正反应速率越来越小,逆反应速率逐渐变大,直到平衡时,v(正)=v(逆)。【解析】 2 mol SO3分解生成1 mol O2,生成2 mol NO2需1 mol O2,根据“n(O2)=0.1 mol、n(NO2)=3.6 mol”可计算出还剩余SO3 0.2 mol。分析题给反应式可知,SO3、SO2两种物质中知道任意一种就可计算出另一种,NO、NO2两种物质中知道任意一种就可计算出另一种。
【答案】 (1)0.2 mol (2)SO2 NO2 (3)AC练规范、练技能、练速度
