第三单元 化学能与电能的转化(第2课时)
图片预览








文档简介
课件43张PPT。第2课时 电能转化为化学能1.初步认识电解反应原理及装置。
2.能够正确书写电极反应式。
3.能根据原电池、电解池的构成条件识别原电池、电解池。
4.认识电解原理在电解饱和食盐水、电解氧化铝、电镀和铜的电解精炼中的应用。
5.了解可用电解法制备一些活泼金属单质和非金属单质。一、电能转化为化学能
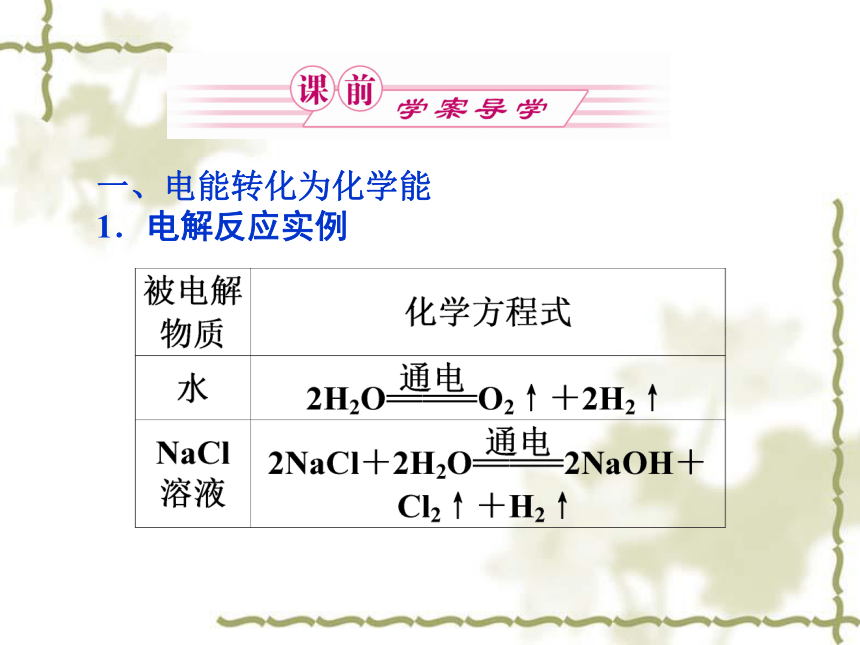
1.电解反应实例2.电解CuCl2溶液有红色固体物质析出产生黄绿色、刺激性气味的气体,湿润的淀粉碘化钾试纸变蓝Cu2++2e-===Cu2Cl--2e-===Cl2↑3.电解
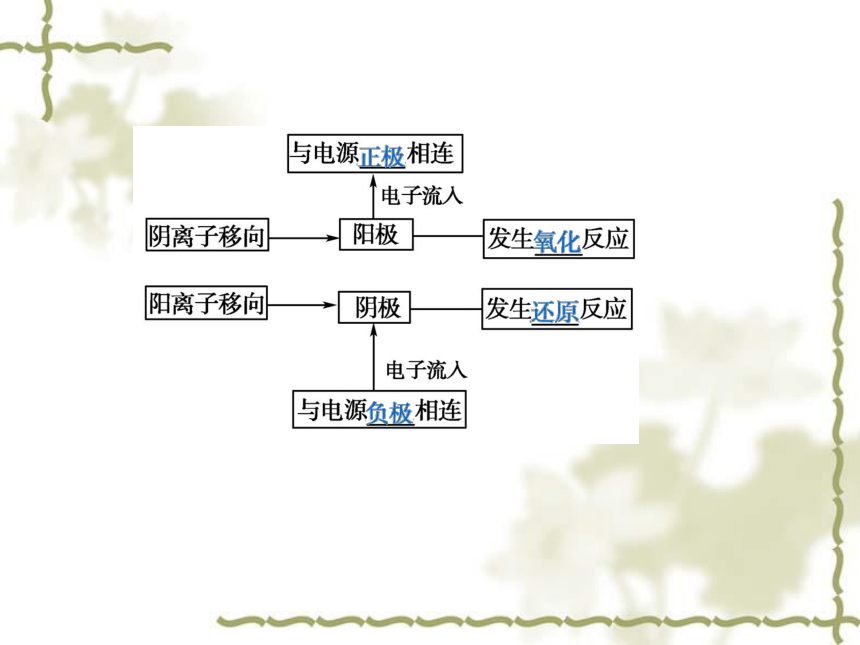
(1)概念:电流通过电解质溶液时引起阴、阳两 极发生__________反应的过程。
(2)电解池:将_____转化为_______的装置。
(3)电极氧化还原电能化学能二、电解的应用
1.制备Na、Mg、Al、F2等活泼金属和非金属
如电解熔融的氧化铝获得铝:
_______________________________。
2.电解精炼铜
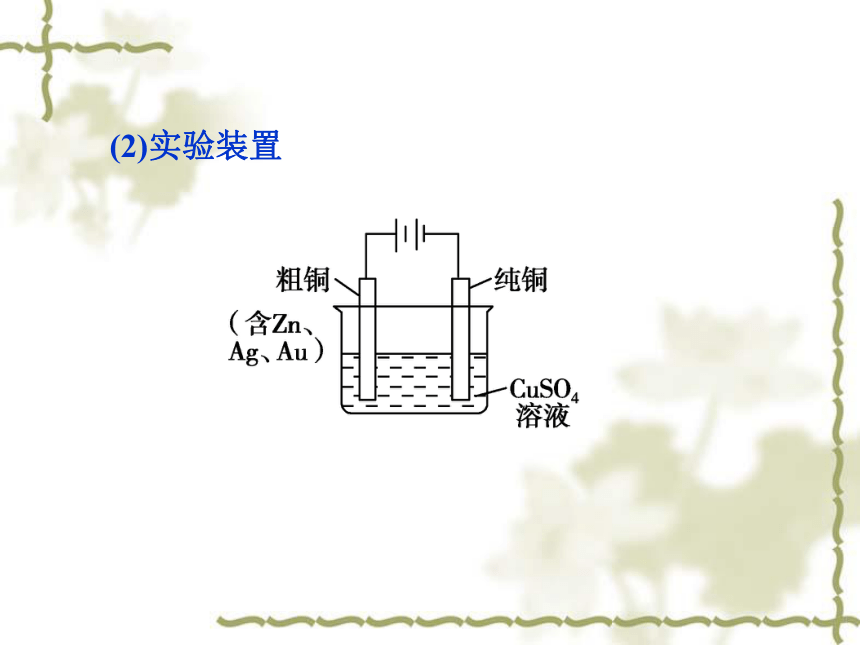
(1)电解池的构成:
①_____作阳极;
②_____作阴极;
③_____________________作电解液。粗铜纯铜硫酸酸化的CuSO4溶液(2)实验装置(3)电极反应:
阳极:__________________________________ 等。
阴极:_________________。
(4)反应特点
①比铜_____的金属:以阳离子形式存在于溶液 中。
②比铜_______的金属:形成阳极泥。
③电解过程中电解质溶液浓度_____,需及时补 充。Zn-2e-===Zn2+、Cu-2e-===Cu2+Cu2++2e-===Cu活泼不活泼降低[学生交流]
【提示】 构成电解池的条件:(1)外接电源;(2)两个电极:阳极连电源的正极,阴极连电源的负极;(3)电解质溶液;(4)形成闭合回路。
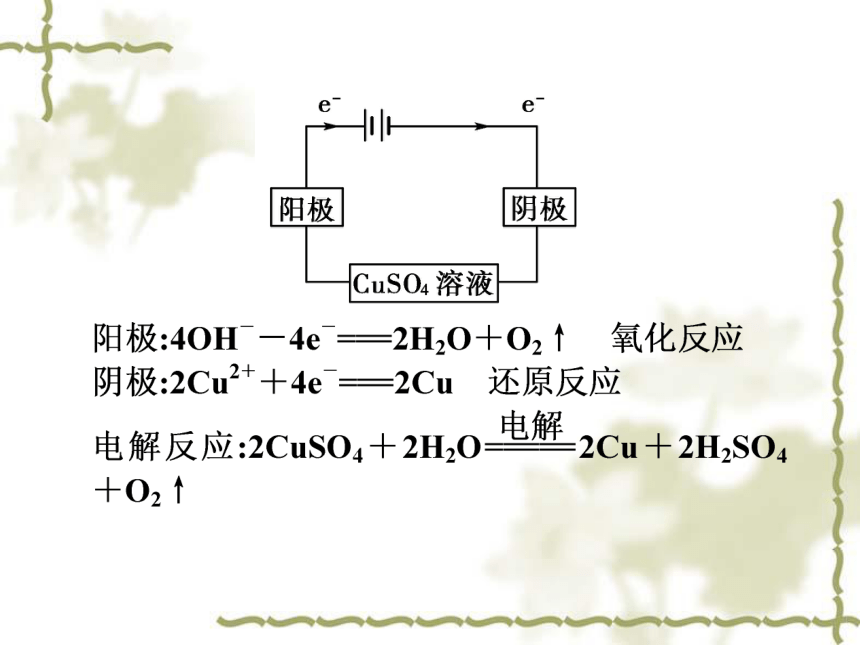
电解原理:以电解CuSO4溶液为例电解时电极产物如何判断?(2)阴极产物的判断
直接根据阳离子放电顺序进行判断,阳离子放电顺序:Hg2+>Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>……【解析】 用惰性电极电解NaCl溶液,其电极反应分别为:阴极:2H++2e-===H2↑ 阳极:2Cl--2e-===Cl2↑,由于a极出现了双色同心圆,内圆为白色,外圈呈浅红色,则a极为电解池的阳极,因为产生的Cl2与水反应生成HCl和HClO,HCl使pH试纸显红色,HClO具有漂白性使pH试纸褪色,b极为阴极,H+得电子产生H2,H+来源于H2O的电离,因此在b极又同时生成了OH-,因此b极附近pH增大。
【答案】 D【点评】 该题主要考查电解池电极反应及电极名称的判断。【答案】 D[师生互动]
【提示】 原电池和电解池的区别和联系A.A池为电解装置
B.C池为原电池装置
C.A池铜棒上的电极反应为2H++2e-===H2↑
D.当A池产生0.05 mol H2时,B池中溶液OH-的浓度为0.05 mol/L
【思路点拨】 解答本题需要明确以下两点:
(1)根据电极金属性的差异判断出原电池。
(2)闭合回路中电极连接顺序是:负极→阴极→阳极→阴极→阳极→正极→负极。【答案】 C【提示】 在C池中,金属银作阳极,电极反应式为:Ag-e-===Ag+,金属铜作阴极,电极反应式为:Ag++e-===Ag,当A池产生0.05 mol H2时,转移电子的物质的量为0.1 mol,生成的Ag也为0.1 mol,所以Cu电极的质量增加0.1 mol×108 g/mol=10.8 g。1.知识小结2.规律点拨
电解原理的考查是高考命题的热点之一,溶液中离子的放电顺序是同学们认识这类问题的难点之一。
(1)在水溶液中因有OH-存在,所以含氧酸根离子一般不放电,OH-的放电反应为4OH--4e-===2H2O+O2↑。
(2)在水溶液中因有H+存在,所以排在氢前的金属离子一般不放电。
(3)Fe3+在水溶液中放电生成Fe2+,而不是生成Fe。1.若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是:Cu+2H+===Cu2++H2↑,则下列关于该装置的有关说法正确的是( )
A.该装置可能是原电池,也可能是电解池
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是电解池,且金属铜为该电解池的阳极
D.该装置只能是原电池,电解质溶液不可能是盐酸【解析】 该反应不能自发反应,只有在外加电源的条件下发生,故该装置为电解池,且铜作阳极。
【答案】 C2.下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
【解析】 电解法制铝时,阳极发生2O2--4e-===O2↑,应用惰性电极作阳极,若用铁作阳极,则阳极发生Fe-2e-===Fe2+,故A不符合生产实际。
【答案】 A【解析】 a极质量增加,必定是金属在a极析出,a极一定是阴极。B选项Z溶液为NaOH,无金属析出,被排除。又因为b极有无色无臭气体生成,只能是O2,而D选项电解CuCl2溶液,阳极要析出Cl2,D选项被排除。在A、C选项中,根据电极名称,X应当作为电源的负极。
【答案】 A4.甲、乙两个电解池均以Pt为电极,且互相串联,甲池盛有AgNO3溶液,乙池盛有一定量的某盐溶液,通电一段时间后,测得甲池中的电极质量增加2.16 g,乙池的电极上析出0.24 g金属。则乙池中电解质可能是( )
A.CuSO4 B.MgSO4
C.Al(NO3)3 D.Na2SO4【解析】 根据电解时离子的放电顺序规律,活泼金属离子放电一定是在H+之后,所以在电解MgSO4、Al(NO3)3、Na2SO4溶液时,均不会析出金属镁、铝或钠,惟有在电解CuSO4溶液时才会析出金属Cu。针对题给数据,依据电子得失守恒,若由甲池的电极上析出2.16 g Ag,则应在乙池的电极上析出0.64 g Cu,而题中只析出0.24 g金属,说明CuSO4溶液中Cu2+的含量较少,这样除有Cu析出外,还有H2产生。
【答案】 A5.采用惰性电极从NO、SO、Cl-、Cu2+、Ba2+、Ag+、H+等离子中选出适当的离子组成电解质,并对其溶液进行电解。
(1)若两极分别放出H2和O2,电解质的化学式为______________。
(2)若阴极析出金属,阳极放出氧气,电解质的化学式为______________。
(3)若两极分别放出气体,且体积比为1∶1,电解质的化学式为______________。【解析】 组成的电解质一般是可溶性的强电解质,根据电解规律逐一判定组合,即可得出答案。
【答案】 (1)H2SO4、HNO3、Ba(NO3)2
(2)AgNO3、Cu(NO3)2、CuSO4
(3)HCl、BaCl2(1)电源A的a端为________极。
(2)滤纸B上发生的总反应方程式为
________________________________。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为________________,电极f上发生的反应为________________,槽中盛放的电镀液可以是________或______(只要求填两种电解质溶液)。【解析】 c点显红色,说明在c点产生了碱,根据电解饱和食盐水的原理可知c点为阴极,则和电源相连的一极为负极,所以a极为正极。B上发生的即是电解饱和食盐水的反应。根据电镀原理,镀层金属放在阳极,被镀物件放在阴极,再确定所发生的反应。练规范、练技能、练速度
2.能够正确书写电极反应式。
3.能根据原电池、电解池的构成条件识别原电池、电解池。
4.认识电解原理在电解饱和食盐水、电解氧化铝、电镀和铜的电解精炼中的应用。
5.了解可用电解法制备一些活泼金属单质和非金属单质。一、电能转化为化学能
1.电解反应实例2.电解CuCl2溶液有红色固体物质析出产生黄绿色、刺激性气味的气体,湿润的淀粉碘化钾试纸变蓝Cu2++2e-===Cu2Cl--2e-===Cl2↑3.电解
(1)概念:电流通过电解质溶液时引起阴、阳两 极发生__________反应的过程。
(2)电解池:将_____转化为_______的装置。
(3)电极氧化还原电能化学能二、电解的应用
1.制备Na、Mg、Al、F2等活泼金属和非金属
如电解熔融的氧化铝获得铝:
_______________________________。
2.电解精炼铜
(1)电解池的构成:
①_____作阳极;
②_____作阴极;
③_____________________作电解液。粗铜纯铜硫酸酸化的CuSO4溶液(2)实验装置(3)电极反应:
阳极:__________________________________ 等。
阴极:_________________。
(4)反应特点
①比铜_____的金属:以阳离子形式存在于溶液 中。
②比铜_______的金属:形成阳极泥。
③电解过程中电解质溶液浓度_____,需及时补 充。Zn-2e-===Zn2+、Cu-2e-===Cu2+Cu2++2e-===Cu活泼不活泼降低[学生交流]
【提示】 构成电解池的条件:(1)外接电源;(2)两个电极:阳极连电源的正极,阴极连电源的负极;(3)电解质溶液;(4)形成闭合回路。
电解原理:以电解CuSO4溶液为例电解时电极产物如何判断?(2)阴极产物的判断
直接根据阳离子放电顺序进行判断,阳离子放电顺序:Hg2+>Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>……【解析】 用惰性电极电解NaCl溶液,其电极反应分别为:阴极:2H++2e-===H2↑ 阳极:2Cl--2e-===Cl2↑,由于a极出现了双色同心圆,内圆为白色,外圈呈浅红色,则a极为电解池的阳极,因为产生的Cl2与水反应生成HCl和HClO,HCl使pH试纸显红色,HClO具有漂白性使pH试纸褪色,b极为阴极,H+得电子产生H2,H+来源于H2O的电离,因此在b极又同时生成了OH-,因此b极附近pH增大。
【答案】 D【点评】 该题主要考查电解池电极反应及电极名称的判断。【答案】 D[师生互动]
【提示】 原电池和电解池的区别和联系A.A池为电解装置
B.C池为原电池装置
C.A池铜棒上的电极反应为2H++2e-===H2↑
D.当A池产生0.05 mol H2时,B池中溶液OH-的浓度为0.05 mol/L
【思路点拨】 解答本题需要明确以下两点:
(1)根据电极金属性的差异判断出原电池。
(2)闭合回路中电极连接顺序是:负极→阴极→阳极→阴极→阳极→正极→负极。【答案】 C【提示】 在C池中,金属银作阳极,电极反应式为:Ag-e-===Ag+,金属铜作阴极,电极反应式为:Ag++e-===Ag,当A池产生0.05 mol H2时,转移电子的物质的量为0.1 mol,生成的Ag也为0.1 mol,所以Cu电极的质量增加0.1 mol×108 g/mol=10.8 g。1.知识小结2.规律点拨
电解原理的考查是高考命题的热点之一,溶液中离子的放电顺序是同学们认识这类问题的难点之一。
(1)在水溶液中因有OH-存在,所以含氧酸根离子一般不放电,OH-的放电反应为4OH--4e-===2H2O+O2↑。
(2)在水溶液中因有H+存在,所以排在氢前的金属离子一般不放电。
(3)Fe3+在水溶液中放电生成Fe2+,而不是生成Fe。1.若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是:Cu+2H+===Cu2++H2↑,则下列关于该装置的有关说法正确的是( )
A.该装置可能是原电池,也可能是电解池
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是电解池,且金属铜为该电解池的阳极
D.该装置只能是原电池,电解质溶液不可能是盐酸【解析】 该反应不能自发反应,只有在外加电源的条件下发生,故该装置为电解池,且铜作阳极。
【答案】 C2.下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
【解析】 电解法制铝时,阳极发生2O2--4e-===O2↑,应用惰性电极作阳极,若用铁作阳极,则阳极发生Fe-2e-===Fe2+,故A不符合生产实际。
【答案】 A【解析】 a极质量增加,必定是金属在a极析出,a极一定是阴极。B选项Z溶液为NaOH,无金属析出,被排除。又因为b极有无色无臭气体生成,只能是O2,而D选项电解CuCl2溶液,阳极要析出Cl2,D选项被排除。在A、C选项中,根据电极名称,X应当作为电源的负极。
【答案】 A4.甲、乙两个电解池均以Pt为电极,且互相串联,甲池盛有AgNO3溶液,乙池盛有一定量的某盐溶液,通电一段时间后,测得甲池中的电极质量增加2.16 g,乙池的电极上析出0.24 g金属。则乙池中电解质可能是( )
A.CuSO4 B.MgSO4
C.Al(NO3)3 D.Na2SO4【解析】 根据电解时离子的放电顺序规律,活泼金属离子放电一定是在H+之后,所以在电解MgSO4、Al(NO3)3、Na2SO4溶液时,均不会析出金属镁、铝或钠,惟有在电解CuSO4溶液时才会析出金属Cu。针对题给数据,依据电子得失守恒,若由甲池的电极上析出2.16 g Ag,则应在乙池的电极上析出0.64 g Cu,而题中只析出0.24 g金属,说明CuSO4溶液中Cu2+的含量较少,这样除有Cu析出外,还有H2产生。
【答案】 A5.采用惰性电极从NO、SO、Cl-、Cu2+、Ba2+、Ag+、H+等离子中选出适当的离子组成电解质,并对其溶液进行电解。
(1)若两极分别放出H2和O2,电解质的化学式为______________。
(2)若阴极析出金属,阳极放出氧气,电解质的化学式为______________。
(3)若两极分别放出气体,且体积比为1∶1,电解质的化学式为______________。【解析】 组成的电解质一般是可溶性的强电解质,根据电解规律逐一判定组合,即可得出答案。
【答案】 (1)H2SO4、HNO3、Ba(NO3)2
(2)AgNO3、Cu(NO3)2、CuSO4
(3)HCl、BaCl2(1)电源A的a端为________极。
(2)滤纸B上发生的总反应方程式为
________________________________。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为________________,电极f上发生的反应为________________,槽中盛放的电镀液可以是________或______(只要求填两种电解质溶液)。【解析】 c点显红色,说明在c点产生了碱,根据电解饱和食盐水的原理可知c点为阴极,则和电源相连的一极为负极,所以a极为正极。B上发生的即是电解饱和食盐水的反应。根据电镀原理,镀层金属放在阳极,被镀物件放在阴极,再确定所发生的反应。练规范、练技能、练速度
