第三单元 化学能与电能的转化
图片预览









文档简介
课件47张PPT。第三单元 化学能与电能的转化第1课时 化学能转化为电能 化学电源1.通过对铜锌原电池的实验探究,认识化学能转化为电能的装置。
2.初步认识原电池反应的原理。
3.能够正确的书写电极反应式。
4.会利用原电池原理,设计一些简单的化学电源。
5.了解常见的化学电源以及它们在生产和生活中的应用。一、原电池原理
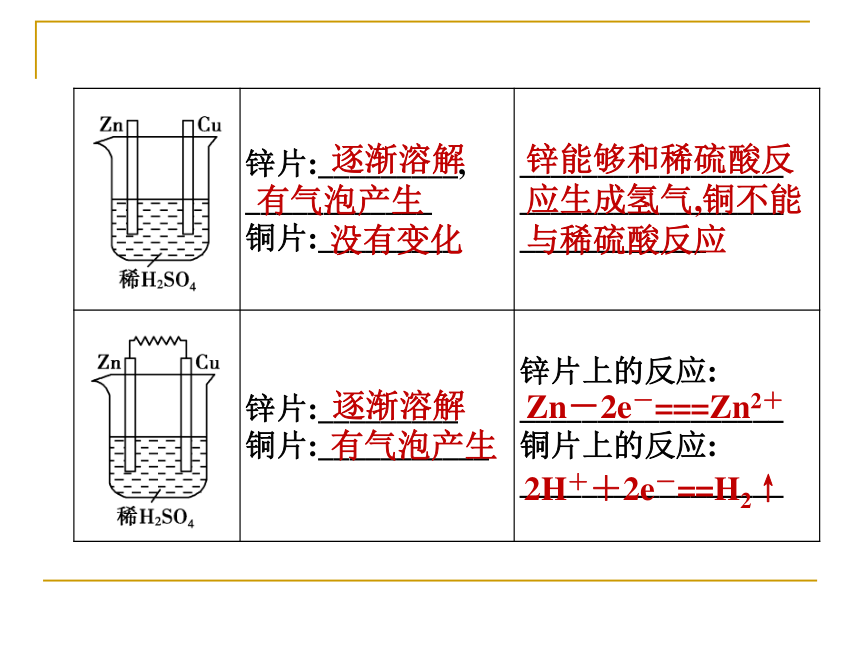
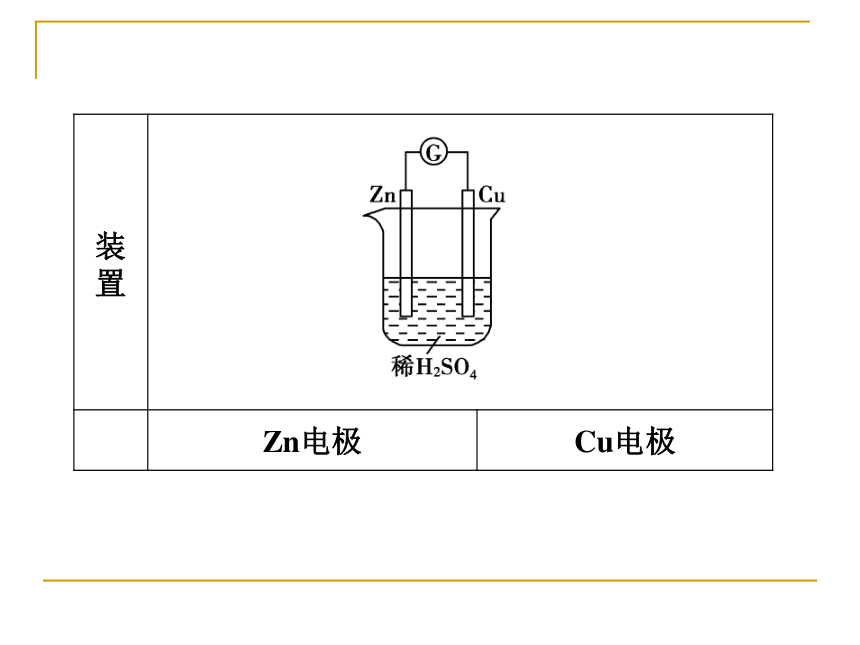
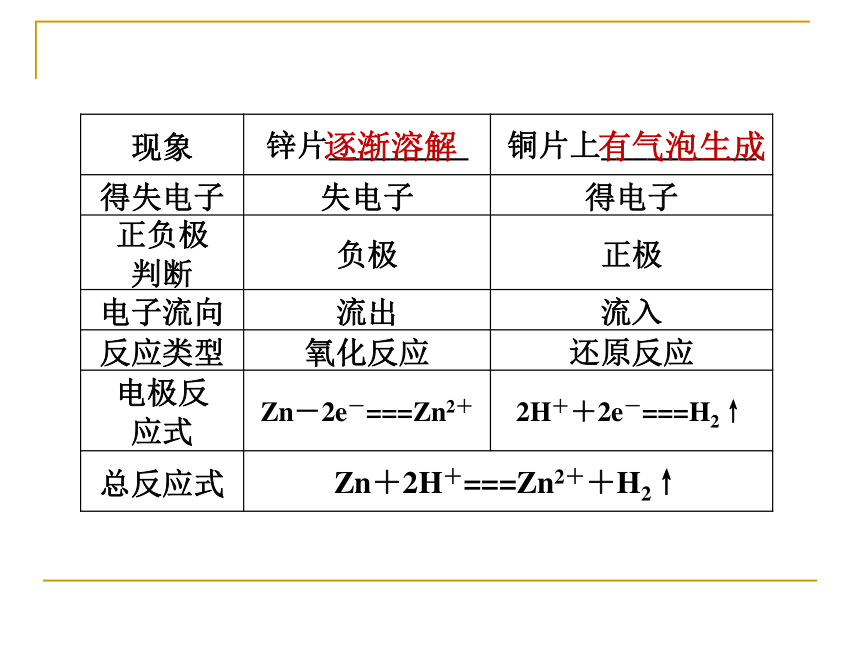
1.实验探究逐渐溶解有气泡产生没有变化锌能够和稀硫酸反应生成氢气铜不能与稀硫酸反应逐渐溶解有气泡产生没有变化锌能够和稀硫酸反应生成氢气,铜不能与稀硫酸反应逐渐溶解有气泡产生Zn-2e-===Zn2+2H++2e-==H2↑逐渐溶解有气泡产生指针发生偏转Zn-2e-===Zn2+2H++2e-==H2↑电流2.原电池
(1)含义:将_______转变为_____的装置。
(2)构成条件
①两个______不同的电极材料,可以是____或是 _____________。
②电极插入___________中。
③构成_________。
④能自发地发生氧化还原反应。
(3)工作原理化学能电能活泼性金属导电的非金属电解质溶液闭合回路逐渐溶解有气泡生成二、钢铁的电化学腐蚀
1.电化学腐蚀
金属跟____________接触,发生原电池反应,比较 活泼的金属失去电子而被氧化的腐蚀。
2.钢铁的腐蚀
(1)条件
①电极:铁和少量___形成两个电极。
②电解质溶液:水中溶有少量__________及____ 等气体。
(2)电极反应(以吸氧腐蚀为例)
①负极反应式(Fe):________________。
②正极反应式(C):________________________。电解质溶液H+和OH-氧气碳Fe-2e-===Fe2+2H2O+O2+4e-===4OH-三、化学电源
1.制造原理:_______原理。
2.优点:能量转化率比_________要大的多。
3.化学电源的分类
(1)____电池:用过之后不能复原,如______电 池。
(2)____电池:充电后能继续使用,如________ 电池、_____电池、_____电池。原电池燃料燃烧锌锰干一次二次银锌纽扣铅蓄镍氢[学生交流]
【提示】 (1)具有活动性不同的两电极。
(2)具有电解质溶液。
(3)形成闭合回路。原电池正负极的判断方法有哪些?请列举之。
[师生互动]
【提示】 正确判断原电池正负极的方法
(1)根据组成原电池的两极材料判断。
一般是活泼的金属为负极;活泼性较弱的金属或能导电的非金属为正极。(2)根据电流方向或电子流动方向判断。
电流是由正极流向负极;电子流动方向是由负极流向正极。
(3)根据原电池中电解质溶液内离子的定向流动方向判断。
一般在原电池的电解质溶液内,阳离子移向的极是正极,阴离子移向的极是负极。
(4)根据原电池两极发生的变化来判断。
原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
(5)根据现象判断。
一般溶解的一极为负极,增重或有气泡放出的一极为正极。书写电极反应式的步骤如何?
[师生互动]
【提示】 正确书写电极反应式的步骤及注意事项
(1)写出总化学反应方程式。
(2)根据总化学反应方程式,按照电子得失情况,分成氧化反应和还原反应。(3)氧化反应在负极发生,还原反应在正极发生,注意介质参与的反应;总的化学反应式是正负电极反应相加的结果,反过来也可以相减,得电极反应,电极反应也遵守质量守恒,电荷守恒及正、负极得失电子相等的规律。
(4)弱电解质、气体或难溶物均以分子式表示,其余均以离子符号表示。下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极【解析】乙中I-失去电子放电,发生氧化反应,A正确;由总反应方程式知,Fe3+被还原成Fe2+,B正确;当电流计读数为零时,说明没有电子发生转移,反应达到平衡状态,C正确。加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,作为负极,D错误。
【答案】D
【点评】本题考查原电池原理,即原电池与氧化还原反应的关系,以及原电池正、负极的判断。【解析】 本题根据总反应式可判断Li被氧化,应为负极材料,其失电子成为Li+,正极放电的为MnO2。若已知电池总反应式,要写电极反应式,一般处理方法是:根据规律先判断负极材料,负极材料若是金属则失电子而变为相应的阳离子(注意:Fe失电子一般为Fe2+),负极材料若是其他被氧化的物质,则失电子变为相应的氧化产物,然后再推断正极反应式,可利用总反应式与已知某一极的电极反应式作差推出。
【答案】 B[师生互动]
【提示】 (1)加快氧化还原反应速率
如实验室用Zn和稀H2SO4(或稀HCl)反应制H2,常用粗锌,它产生H2的速率快。原因是粗锌中的杂质和锌、稀H2SO4的溶液形成原电池,加快了锌的腐蚀,使产生H2的速率加快。(2)比较金属的活动性强弱
原电池中,一般活动性强的金属为负极,活动性弱的金属为正极。例如有两种金属A和B,用导线连接后插入到稀硫酸中,观察到A极溶解,B极上有气泡产生,由原电池原理可知,金属活动性A>B。
(3)设计原电池,防止金属腐蚀。
(4)制作化学电源。【解析】 电池工作时,正极上O2得到电子被还原,电极反应为:O2+2H2O+4e-===4OH-,A正确。电解液为NaOH溶液时,在负极上产生的是NaAlO2而不是Al(OH)3,B错误。电池的总反应为:4Al+3O2+4NaOH===4NaAlO2+2H2O,消耗NaOH,pH减小。电池工作时,电子通过外电路由负极流向正极。
【答案】 A
【点评】 本题考查对原电池原理的应用。在书写电极反应式时要注意体系所在的环境(酸性或碱性)。【解析】 铜片、银片、Cu(NO3)2溶液、AgNO3溶液、盐桥构成一个原电池,Cu作负极,Ag作正极,两极电极反应分别为:负极:Cu-2e-===Cu2+,正极:2Ag++2e-===2Ag,盐桥起到了传导离子、形成闭合回路的作用,电子的流向是由负极流向正极,电流的方向和电子的流向相反,因此C正确。
【答案】 C1.知识小结2.规律点拨
(1)有些原电池中,负极不一定比正极活泼,也就是说失去电子的不一定是较活泼的金属。如:
①当Mg、Al用导线连接后插入NaOH溶液中构成原电池时,活泼金属Mg作正极,此时较不活泼的Al作负极。
②当铜、铁用导线连接后插入浓硝酸中构成原电池时,由于Fe被钝化,此时Cu作原电池的负极。
(2)书写电极反应方程式用总电极反应方程式与正、负极电极反应方程式相加减时,必须保证得失电子守恒,且两边电荷守恒。(3)书写电极反应方程式时要注意电极生成物能否与电解质溶液反应。
(4)在正极上,若是电解质溶液中的某种离子被还原,无论该离子是强电解质提供的,还是弱电解质提供的,一律写离子符号;而在原电池反应中,要遵循离子方程式的书写规则,只有易溶的强电解质用离子符号表示。
(5)利用原电池原理可以设计各种电池,减缓金属的腐蚀。1.下列关于原电池的叙述中正确的是( )
A.正极和负极必须是两种不同的金属
B.原电池是把化学能转化成电能的装置
C.原电池工作时,正极和负极上发生的都是氧化还原反应
D.锌、铜和盐酸构成的原电池工作时,锌片上有6.5 g锌溶解,正极上就有0.1 g氢气生成【解析】 原电池是把化学能转化成电能的装置,它的正、负极可以是活泼性不同的金属,也可以是金属与非金属,工作时负极发生氧化反应。当锌片上有6.5 g锌溶解,根据两极得失电子守恒,正极上析出0.2 g氢气。
【答案】 B2.如图所示装置中,观察到电流计指针偏转(指针顺着电流方向偏转),M棒变粗,N棒变细,由此判断下表中所列M、N、P三种物质,其中可以成立的是( )【解析】 该原电池中M棒变粗,N棒变细。说明原电池反应时N棒溶解作负极,溶液中有金属析出在M棒上,M棒作正极。A、B两项中,电解质溶液分别为稀硫酸和稀盐酸,原电池工作时,不会有金属析出;C项正极反应为Ag++e-===Ag,符合题意;而D项正极反应为Fe3++e-===Fe2+,不会有金属析出。
【答案】 C3.(2010年北京卷)下列有关钢铁腐蚀与防护的说法正确的是( )
A.钢管与电源正极连接,钢管可被保护
B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
C.钢管与铜管露天堆放在一起时,钢管不易被腐蚀
D.钢铁发生析氢腐蚀时,负极反应是Fe-3e-===Fe3+【解析】 钢管与电源正极连接,作电解池的阳极,被氧化而腐蚀,A项错;铁在冷浓硝酸中表面生成一层致密的氧化物保护膜,从而保护内部不被腐蚀,B项正确,钢管与铜管堆放一起时,构成原电池,钢管作负极而易被腐蚀,C项错;钢铁发生析氢腐蚀时,负极反应:Fe-2e-===Fe2+,D项错。
【答案】 BA.a极是负极,该电极上发生氧化反应
B.b极反应是O2+4OH--4e-===2H2O
C.总反应方程式为2H2+O2===2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源【解析】 依据原电池原理,注意电解质溶液参与反应。A项:a极通H2为负极,电极反应为:2H2+4OH--4e-===4H2O发生氧化反应;B项:b极通O2为正极,电极反应为:O2+2H2O+4e-===4OH-,B项不正确;C项:正负极电极反应式相加得总反应为2H2+O2===2H2O;D项:氢氧燃料电池的能量高,且产物为水,对环境无污染,故是具有应用前景的绿色电源。
【答案】 B5.如图所示装置,在盛有水的烧杯中,铁圈和银圈的相接处吊着一根绝缘的细丝,使之平衡。小心地向烧杯中央滴入CuSO4溶液。
(1)片刻后可观察到的现象是(指悬吊的金属圈)( )
A.铁圈和银圈左右摇摆不定
B.保持平衡状态不变
C.铁圈向下倾斜
D.银圈向下倾斜(2)产生上述现象的原因是______________________________________。
(3)写出反应的化学方程式:
________________________________________________________________________。【解析】 首先铁圈可以与CuSO4发生氧化还原反应:Fe+CuSO4===FeSO4+Cu;其次是铁圈和银圈直接相连,电子可以顺利传递,所以可以构成原电池。其电极方程式为负极:Fe-2e-===Fe2+,正极:Cu2++2e-===Cu。铁溶解,铁圈减轻;生成的Cu沉积在银圈上,银圈增重。【答案】 (1)D (2)加入CuSO4溶液后,构成Fe-Ag原电池,铁溶解,质量减轻,Cu2+在银圈上得电子,生成Cu沉积在银圈上,质量增加 (3)Fe+CuSO4===FeSO4+Cu6.在由铜片、锌和200 mL稀H2SO4组成的原电池中,若锌片只发生电化学腐蚀,当在铜片上放出3.36 L(标准状况下)H2时,H2SO4恰好用完,则产生这些气体消耗的Zn为________g,在导线上有________mol电子通过,原稀H2SO4的物质的量浓度是________。【答案】 9.75 0.3 0.75 mol·L-1练规范、练技能、练速度
2.初步认识原电池反应的原理。
3.能够正确的书写电极反应式。
4.会利用原电池原理,设计一些简单的化学电源。
5.了解常见的化学电源以及它们在生产和生活中的应用。一、原电池原理
1.实验探究逐渐溶解有气泡产生没有变化锌能够和稀硫酸反应生成氢气铜不能与稀硫酸反应逐渐溶解有气泡产生没有变化锌能够和稀硫酸反应生成氢气,铜不能与稀硫酸反应逐渐溶解有气泡产生Zn-2e-===Zn2+2H++2e-==H2↑逐渐溶解有气泡产生指针发生偏转Zn-2e-===Zn2+2H++2e-==H2↑电流2.原电池
(1)含义:将_______转变为_____的装置。
(2)构成条件
①两个______不同的电极材料,可以是____或是 _____________。
②电极插入___________中。
③构成_________。
④能自发地发生氧化还原反应。
(3)工作原理化学能电能活泼性金属导电的非金属电解质溶液闭合回路逐渐溶解有气泡生成二、钢铁的电化学腐蚀
1.电化学腐蚀
金属跟____________接触,发生原电池反应,比较 活泼的金属失去电子而被氧化的腐蚀。
2.钢铁的腐蚀
(1)条件
①电极:铁和少量___形成两个电极。
②电解质溶液:水中溶有少量__________及____ 等气体。
(2)电极反应(以吸氧腐蚀为例)
①负极反应式(Fe):________________。
②正极反应式(C):________________________。电解质溶液H+和OH-氧气碳Fe-2e-===Fe2+2H2O+O2+4e-===4OH-三、化学电源
1.制造原理:_______原理。
2.优点:能量转化率比_________要大的多。
3.化学电源的分类
(1)____电池:用过之后不能复原,如______电 池。
(2)____电池:充电后能继续使用,如________ 电池、_____电池、_____电池。原电池燃料燃烧锌锰干一次二次银锌纽扣铅蓄镍氢[学生交流]
【提示】 (1)具有活动性不同的两电极。
(2)具有电解质溶液。
(3)形成闭合回路。原电池正负极的判断方法有哪些?请列举之。
[师生互动]
【提示】 正确判断原电池正负极的方法
(1)根据组成原电池的两极材料判断。
一般是活泼的金属为负极;活泼性较弱的金属或能导电的非金属为正极。(2)根据电流方向或电子流动方向判断。
电流是由正极流向负极;电子流动方向是由负极流向正极。
(3)根据原电池中电解质溶液内离子的定向流动方向判断。
一般在原电池的电解质溶液内,阳离子移向的极是正极,阴离子移向的极是负极。
(4)根据原电池两极发生的变化来判断。
原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
(5)根据现象判断。
一般溶解的一极为负极,增重或有气泡放出的一极为正极。书写电极反应式的步骤如何?
[师生互动]
【提示】 正确书写电极反应式的步骤及注意事项
(1)写出总化学反应方程式。
(2)根据总化学反应方程式,按照电子得失情况,分成氧化反应和还原反应。(3)氧化反应在负极发生,还原反应在正极发生,注意介质参与的反应;总的化学反应式是正负电极反应相加的结果,反过来也可以相减,得电极反应,电极反应也遵守质量守恒,电荷守恒及正、负极得失电子相等的规律。
(4)弱电解质、气体或难溶物均以分子式表示,其余均以离子符号表示。下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极【解析】乙中I-失去电子放电,发生氧化反应,A正确;由总反应方程式知,Fe3+被还原成Fe2+,B正确;当电流计读数为零时,说明没有电子发生转移,反应达到平衡状态,C正确。加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,作为负极,D错误。
【答案】D
【点评】本题考查原电池原理,即原电池与氧化还原反应的关系,以及原电池正、负极的判断。【解析】 本题根据总反应式可判断Li被氧化,应为负极材料,其失电子成为Li+,正极放电的为MnO2。若已知电池总反应式,要写电极反应式,一般处理方法是:根据规律先判断负极材料,负极材料若是金属则失电子而变为相应的阳离子(注意:Fe失电子一般为Fe2+),负极材料若是其他被氧化的物质,则失电子变为相应的氧化产物,然后再推断正极反应式,可利用总反应式与已知某一极的电极反应式作差推出。
【答案】 B[师生互动]
【提示】 (1)加快氧化还原反应速率
如实验室用Zn和稀H2SO4(或稀HCl)反应制H2,常用粗锌,它产生H2的速率快。原因是粗锌中的杂质和锌、稀H2SO4的溶液形成原电池,加快了锌的腐蚀,使产生H2的速率加快。(2)比较金属的活动性强弱
原电池中,一般活动性强的金属为负极,活动性弱的金属为正极。例如有两种金属A和B,用导线连接后插入到稀硫酸中,观察到A极溶解,B极上有气泡产生,由原电池原理可知,金属活动性A>B。
(3)设计原电池,防止金属腐蚀。
(4)制作化学电源。【解析】 电池工作时,正极上O2得到电子被还原,电极反应为:O2+2H2O+4e-===4OH-,A正确。电解液为NaOH溶液时,在负极上产生的是NaAlO2而不是Al(OH)3,B错误。电池的总反应为:4Al+3O2+4NaOH===4NaAlO2+2H2O,消耗NaOH,pH减小。电池工作时,电子通过外电路由负极流向正极。
【答案】 A
【点评】 本题考查对原电池原理的应用。在书写电极反应式时要注意体系所在的环境(酸性或碱性)。【解析】 铜片、银片、Cu(NO3)2溶液、AgNO3溶液、盐桥构成一个原电池,Cu作负极,Ag作正极,两极电极反应分别为:负极:Cu-2e-===Cu2+,正极:2Ag++2e-===2Ag,盐桥起到了传导离子、形成闭合回路的作用,电子的流向是由负极流向正极,电流的方向和电子的流向相反,因此C正确。
【答案】 C1.知识小结2.规律点拨
(1)有些原电池中,负极不一定比正极活泼,也就是说失去电子的不一定是较活泼的金属。如:
①当Mg、Al用导线连接后插入NaOH溶液中构成原电池时,活泼金属Mg作正极,此时较不活泼的Al作负极。
②当铜、铁用导线连接后插入浓硝酸中构成原电池时,由于Fe被钝化,此时Cu作原电池的负极。
(2)书写电极反应方程式用总电极反应方程式与正、负极电极反应方程式相加减时,必须保证得失电子守恒,且两边电荷守恒。(3)书写电极反应方程式时要注意电极生成物能否与电解质溶液反应。
(4)在正极上,若是电解质溶液中的某种离子被还原,无论该离子是强电解质提供的,还是弱电解质提供的,一律写离子符号;而在原电池反应中,要遵循离子方程式的书写规则,只有易溶的强电解质用离子符号表示。
(5)利用原电池原理可以设计各种电池,减缓金属的腐蚀。1.下列关于原电池的叙述中正确的是( )
A.正极和负极必须是两种不同的金属
B.原电池是把化学能转化成电能的装置
C.原电池工作时,正极和负极上发生的都是氧化还原反应
D.锌、铜和盐酸构成的原电池工作时,锌片上有6.5 g锌溶解,正极上就有0.1 g氢气生成【解析】 原电池是把化学能转化成电能的装置,它的正、负极可以是活泼性不同的金属,也可以是金属与非金属,工作时负极发生氧化反应。当锌片上有6.5 g锌溶解,根据两极得失电子守恒,正极上析出0.2 g氢气。
【答案】 B2.如图所示装置中,观察到电流计指针偏转(指针顺着电流方向偏转),M棒变粗,N棒变细,由此判断下表中所列M、N、P三种物质,其中可以成立的是( )【解析】 该原电池中M棒变粗,N棒变细。说明原电池反应时N棒溶解作负极,溶液中有金属析出在M棒上,M棒作正极。A、B两项中,电解质溶液分别为稀硫酸和稀盐酸,原电池工作时,不会有金属析出;C项正极反应为Ag++e-===Ag,符合题意;而D项正极反应为Fe3++e-===Fe2+,不会有金属析出。
【答案】 C3.(2010年北京卷)下列有关钢铁腐蚀与防护的说法正确的是( )
A.钢管与电源正极连接,钢管可被保护
B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
C.钢管与铜管露天堆放在一起时,钢管不易被腐蚀
D.钢铁发生析氢腐蚀时,负极反应是Fe-3e-===Fe3+【解析】 钢管与电源正极连接,作电解池的阳极,被氧化而腐蚀,A项错;铁在冷浓硝酸中表面生成一层致密的氧化物保护膜,从而保护内部不被腐蚀,B项正确,钢管与铜管堆放一起时,构成原电池,钢管作负极而易被腐蚀,C项错;钢铁发生析氢腐蚀时,负极反应:Fe-2e-===Fe2+,D项错。
【答案】 BA.a极是负极,该电极上发生氧化反应
B.b极反应是O2+4OH--4e-===2H2O
C.总反应方程式为2H2+O2===2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源【解析】 依据原电池原理,注意电解质溶液参与反应。A项:a极通H2为负极,电极反应为:2H2+4OH--4e-===4H2O发生氧化反应;B项:b极通O2为正极,电极反应为:O2+2H2O+4e-===4OH-,B项不正确;C项:正负极电极反应式相加得总反应为2H2+O2===2H2O;D项:氢氧燃料电池的能量高,且产物为水,对环境无污染,故是具有应用前景的绿色电源。
【答案】 B5.如图所示装置,在盛有水的烧杯中,铁圈和银圈的相接处吊着一根绝缘的细丝,使之平衡。小心地向烧杯中央滴入CuSO4溶液。
(1)片刻后可观察到的现象是(指悬吊的金属圈)( )
A.铁圈和银圈左右摇摆不定
B.保持平衡状态不变
C.铁圈向下倾斜
D.银圈向下倾斜(2)产生上述现象的原因是______________________________________。
(3)写出反应的化学方程式:
________________________________________________________________________。【解析】 首先铁圈可以与CuSO4发生氧化还原反应:Fe+CuSO4===FeSO4+Cu;其次是铁圈和银圈直接相连,电子可以顺利传递,所以可以构成原电池。其电极方程式为负极:Fe-2e-===Fe2+,正极:Cu2++2e-===Cu。铁溶解,铁圈减轻;生成的Cu沉积在银圈上,银圈增重。【答案】 (1)D (2)加入CuSO4溶液后,构成Fe-Ag原电池,铁溶解,质量减轻,Cu2+在银圈上得电子,生成Cu沉积在银圈上,质量增加 (3)Fe+CuSO4===FeSO4+Cu6.在由铜片、锌和200 mL稀H2SO4组成的原电池中,若锌片只发生电化学腐蚀,当在铜片上放出3.36 L(标准状况下)H2时,H2SO4恰好用完,则产生这些气体消耗的Zn为________g,在导线上有________mol电子通过,原稀H2SO4的物质的量浓度是________。【答案】 9.75 0.3 0.75 mol·L-1练规范、练技能、练速度
