2012新课标同步导学高一化学课件:第1章(苏教版必修2)(2)
文档属性
| 名称 | 2012新课标同步导学高一化学课件:第1章(苏教版必修2)(2) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-12-16 00:00:00 | ||
图片预览










文档简介
课件56张PPT。第一单元 原子核外电子排布与元素周期律
第1课时 核外电子排布与元素周期律1.在有关原子结构知识的基础上,了解元素的原子核外电子排布。
2.能用原子(离子)结构示意图表示1~18号元素原子(离子)的核外电子排布。
3.通过有关数据和实验事实,了解原子结构与元素性质之间的关系,理解元素周期律的含义及其实质。一、核外电子排布
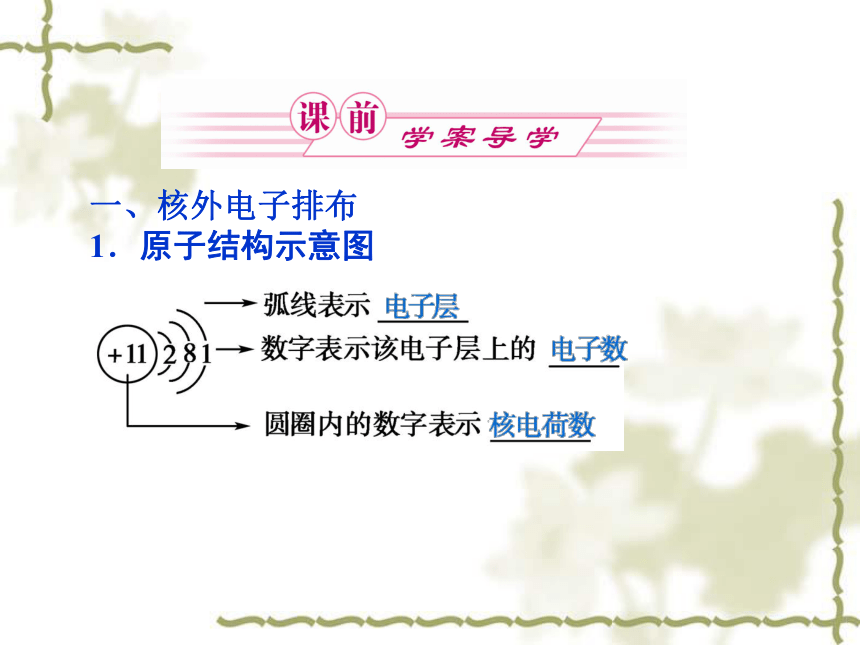
1.原子结构示意图2.电子层
(1)概念:原子核外电子运动的不同区域。
(2)表示符号、能量高低和离核远近低高近远3.原子核外电子的排布规律
(1)电子尽量先排布在能量_____的电子层里。
(2)各电子层最多能容纳____个电子(n为电子层数)。
(3)最外层电子数不超过__个(当K层为最外层时不 超过__个)。
(4)次外层电子数不超过___个。
二、元素周期律
1.原子序数
(1)概念:按照__________由小到大的顺序给元素编 的序号。
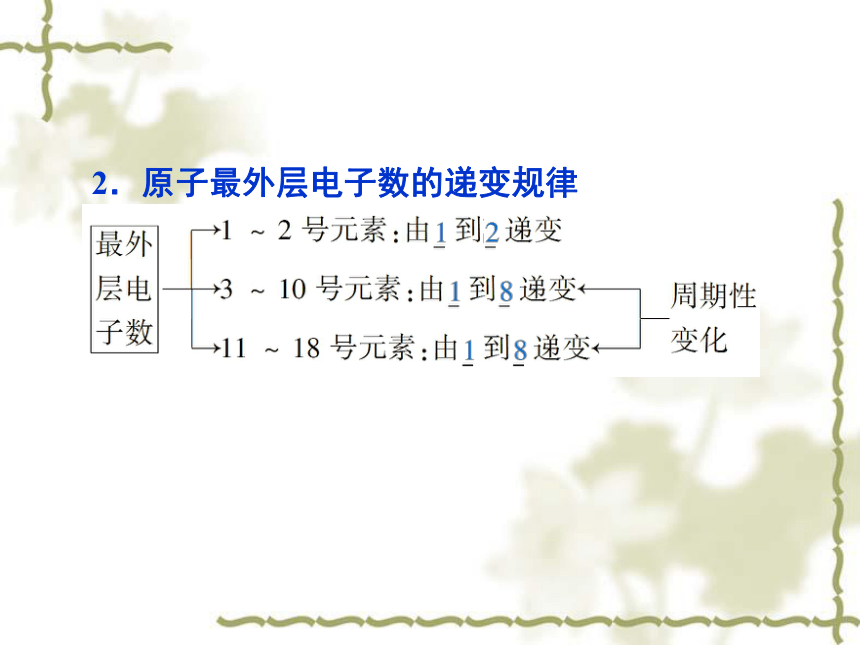
(2)数值:等于该元素原子的_________。最低2n28218核电荷数核电荷数2.原子最外层电子数的递变规律3.原子半径的递变规律
3~9号元素或11~17号元素,随着原子序数的递 增,原子半径呈现_________的周期性变化。
4.元素化合价的递变规律
(1)随着原子序数的递增,最高正化合价重复着 从___价到___价,负价从___价到____价的周期 性变化。
(2)非金属元素的最高正化合价和最低负化合 价的绝对值之和等于__。由大到小+1+7-4-185.元素的金属性和非金属性的递变规律
(1)钠、镁、铝的金属性强弱
①与酸或水反应置换出氢由易到难的顺序为: __________。
②最高价氧化物对应水化物的碱性由强到弱的顺 序为:________________________。
③金属性由强到弱的顺序为:__________。Na>Mg>AlNaOH>Mg(OH)2>Al(OH)3Na>Mg>Al(2)14~17号元素的非金属性强弱
①单质与氢气化合由易到难的顺序为: __________。
②气态氢化物的稳定性由强到弱的顺序为: ___________________。
③最高价氧化物对应水化物的酸性由强到弱的 顺序为:___________________________。
④非金属性由强到弱的顺序为:__________。Cl>S>P>SiHCl>H2S>PH3>SiH4HClO4>H2SO4>H3PO4>H4SiO4Cl>S>P>Si(3)11~17号元素的金属性和非金属性的递变规 律
随着原子序数的递增,元素的金属性逐渐____,非 金属性逐渐增强。
6.元素周期律
(1)概念:元素的性质随着元素________的递增而 呈周期性变化的规律。
(2)实质:元素周期律是____________________随 着元素核电荷数的递增发生周期性变化的必然 结果。减弱核电荷数元素原子核外电子排布一、原子或简单离子的核外电子排布在空白处填写符合下列结构特点的1~18号元素符号。
①最外层电子数为1的原子有________。
②最外层电子数为2的原子有________。
③最外层电子数跟次外层电子数相等的原子有________。
④最外层电子数是次外层电子数2倍的原子是________。⑤最外层电子数是次外层电子数3倍的原子是________。
⑥最外层电子数是次外层电子数4倍的原子是________。
⑦次外层电子数是最外层电子数2倍的原子有________。
⑧内层电子总数是最外层电子数2倍的原子有________。⑨电子层数跟最外层电子数相等的原子有________。
⑩电子层数是最外层电子数2倍的原子是________。
?最外层电子数是电子层数2倍的原子有________。
?最外层电子数是电子层数3倍的原子有________。[学生交流]
【提示】 ①H、Li、Na ②He、Be、Mg ③Be、Ar ④C ⑤O ⑥Ne ⑦Li、Si ⑧Li、P ⑨H、Be、Al ⑩Li ?He、C、S ?O具有相同电子层排布的微粒有哪些(仅限于1~20号元素)[师生互动]
【提示】 (1)具有相同电子层排布的微粒的含义:电子层数相同,各层电子数也相同的单个原子或离子。
(2)与He原子具有相同电子层排布的微粒(2电子微粒):(3)与Ne原子具有相同电子层排布的微粒(10电子微粒):(4)与Ar原子具有相同电子层排布的微粒(18电子微粒):有A、B、C、D四种元素,A元素地壳中含量最多的金属元素;B元素的原子其M层电子数比L层少1个电子;C元素的原子得到2个电子、D元素的原子失去1个电子所得到的微粒都具有与氖原子相同的电子层结构。回答下列问题:
(1)上述四种元素中C的名称是________;
(2)画出B元素原子的结构示意图________;(3)写出下列化学方程式
单质D在单质C中燃烧的化学方程式________________________________________________________________________;
A的氢氧化物和D的氢氧化物反应的离子方程式________________________________________________________________________。【点评】 本题主要考查微粒的电子层结构,熟练掌握核外电子排布规律是解决此类问题的关键。1.A、B、C三种元素的原子序数依次为a、b、c,它们的离子An+、Bn-、Cm-具有相同的电子层结构,且n>m,则下列关系正确的是( )
A.a>b>c B.a>c>b
C.a=b+m+n D.a=c-n-m【解析】 An+和Bn-具有相同的电子层结构,则a-n=b+n,a=b+2n,a>b。An+和Cm-具有相同的电子层结构,则a-n=c+m,a=c+m+n,a>c。Bn-和Cm-具有相同电子层结构,且n>m,b+n=c+m,b-c=m-n<0,故c>b,所以a>c>b,选B。
【答案】 B[学生交流]
【提示】 元素周期律的本质是元素原子核外电子排布呈周期性变化。元素的性质主要由元素原子的电子层结构特别是最外层电子数决定。随着元素原子序数的递增,元素原子的电子层结构呈周期性的变化,必然引起元素性质也呈周期性的变化。因此,元素性质的周期性变化是元素原子内部结构周期性变化的反映,是元素原子的核外电子排布的周期性变化的必然结果。元素的金属性和非金属性与元素原子核外电子排布有何关系?
[师生互动]
【提示】 元素原子的核外电子排布决定着元素的主要性质。
(1)一般来说,当最外层电子数少于4个时,易失去电子,表现出金属性;当最外层电子数多于4个时,易得到电子,表现出非金属性。
(2)当最外层为8个电子(氦为2个电子)时,原子处于稳定结构,化学性质稳定。如何判断元素的金属性和非金属性强弱?
[师生互动]
【提示】 (1)元素金属性强弱的判断
比较元素金属性强弱,其实质是看元素原子失去 电子的难易程度,越容易失去电子,金属性越强。
①从元素的原子结构判断
a.当最外层电子数相同时,核电荷数越大,金属性
越强。
b.当电子层数相同时,核电荷数越大,金属性越弱。②从元素单质及其化合物的相关性质判断
a.金属单质和水或非氧化性酸反应置换出氢越容易,金属性越强。
b.最高价氧化物对应的水化物的碱性越强,金属性越强。
c.金属单质之间发生置换反应,被置换出的金属元素金属性较弱。(2)元素非金属性强弱的判断
比较元素非金属性强弱,其实质是看元素原子得到电子的难易程度,越容易得到电子,非金属性越强。
①从元素的原子结构判断
a.当最外层电子数相同时,核电荷数越大,非金属性越弱。
b.当电子层数相同时,核电荷数越大,非金属性越强。②从元素单质及其化合物的相关性质判断
a.单质越易跟H2化合,生成的氢化物也就越稳定,氢化物的还原性也就越弱,说明其非金属性也就越强。
b.最高价氧化物对应水化物的酸性越强,说明其非金属性越强。
c.非金属单质间发生置换反应,被置换出的非金属元素非金属性较强。下列说法中正确的是( )
A.元素性质的周期性变化是指原子半径、元素的主要化合价及原子核外电子排布的周期性变化
B.元素性质的周期性变化决定于元素原子结构的周期性变化
C.从Li―→F,Na―→Cl,元素的最高化合价均呈现从+1价―→+7价的变化
D.电子层数相同的原子核外电子排布,其最外层电子数均从1个到8个呈现周期性变化【思路点拨】 解答本题需要注意以下三点:
(1)元素周期律的本质。
(2)元素周期律的内容。
(3)个别元素的特殊性,如F无正价。【尝试解答】 【答案】 B2.下列叙述中,能肯定A金属比B金属活泼性强的是( )
A.A原子的最外层电子数比B原子的最外层电子数少
B.A原子的电子层数比B原子电子层数多
C.1 mol A从酸中置换出的H2比1 mol B从酸中置换出的H2多
D.常温时,A能从水中置换出H2,而B不能【解析】 选项A中只指出A、B两种元素原子的最外层电子数的多少,而不能确定A、B的金属性强弱,选项B中指出了A、B原子的电子层的多少,但电子层数少的比电子层数多的原子的金属性不一定弱。选项C中说明了等物质的量的A、B金属与酸反应生成H2的多少,未说明与酸反应的快慢。与酸反应生成H2多的金属活泼性不一定强,如1 mol Al比1 mol Na与足量稀HCl反应时,生成的H2多,但Al不如Na活泼,选项D正确,只有很活泼的金属在常温下才与水反应,而较活泼的金属在常温时不与水发生反应。
【答案】 D1.知识小结2.规律点拨
(1)核外电子排布的规律是相互联系的,不能孤立地理解,如当M层不是最外层时,最多可以排布18个电子,而当它是最外层时,最多可以排布8个电子。
电子不一定排满M层才排N层,如K和Ca的核外电子排布情况分别为:1.下列说法中,不正确的是( )
A.元素的性质随着相对原子质量的逐渐增大而呈周期性的变化
B.元素的原子序数越大,其相对原子质量就越大
C.除稀有气体外,电子层数相同的原子,核内质子数越多,原子半径越小
D.电子层数相同的非金属原子,核电荷数越大,负化合价的绝对值越小【解析】 解答本题需要准确理解元素周期律的意义:元素的性质随着原子序数的递增而呈周期性的变化。虽然一般来说,原子序数增加,相对原子质量增大,但也有例外,如18号Ar的相对原子质量为39.95,而19号K的相对原子质量为39.10,则可判断选项A和B不正确。
【答案】 AB2.根据下列三种微粒结构示意图的共同特征,可以把它们归为一类。下列微粒中可以归入此类的微粒是( )【解析】 题中所述的三个微粒分别是Cl-、O2-、Ca2+,它们都是阴、阳离子,最外层是8电子稳定结构,因此可以与它们归为一类的是C项K+,其余均为原子,不符合要求。
【答案】 C3.下列关于核电荷数为1~18的元素的叙述中,正确的是( )
A.最外层只有1个电子的元素一定是金属元素
B.最外层只有2个电子的元素一定是金属元素
C.最外层有5个电子的元素一定是金属元素
D.核电荷数为17的元素的原子容易获得1个电子【解析】 A项中氢原子最外层只有1个电子,但氢是非金属元素;B项中稀有气体氦的最外层只有2个电子;C项中氮原子的最外层有5个电子,但氮是非金属元素;D项正确。
【答案】 D【解析】 Cu为变价金属,X2可将其氧化为+2价,Y只能将其氧化为-1价,故可判断氧化性:X2>Y。由第三个方程式可得氧化性:Z2>X2,联合可得结论:非金属性:Z>X>Y,且X、Z最低负价为-1,Y最低负价为-2,故可得酸性:HZO4>HXO4>H2YO4,选B。
【答案】 B5.用“>”或“<”回答下列问题:
(1)酸性:H2CO3________H2SiO3,H2SiO3________ H3PO4;
(2)碱性:Ca(OH)2______Mg(OH)2,Mg(OH)2______ Al(OH)3;
(3)气态氢化物稳定性:H2O______H2S,H2S_______ HCl;
(4)还原性:H2O________H2S,H2S________HCl;
(5)酸性:H2SO4______H2SO3,HClO4______HClO。从以上答案中可以归纳出:
①元素的非金属性越强,其最高价氧化物对应水化物的酸性越________;
②元素的金属性越强,其最高价氧化物对应水化物的碱性越________;
③元素的________性越强,其对应气态氢化物的稳定性越________;
④非金属性越强的元素形成的气态氢化物,其还原性越________;
⑤同种非金属元素形成的含氧酸,其成酸元素价态越高,其酸性也越________。【答案】 (1)> < (2)> > (3)> < (4)< > (5)> > ①强 ②强 ③非金属 强 ④弱 ⑤强6.已知A元素原子的核电荷数大于B元素原子的核电荷数,但两种元素的原子具有相同数目的电子层,A元素最外层电子数为B元素的2倍,A元素原子M层电子数为K层电子数的3倍,C元素原子的核电荷数是电子层数的4倍,其质子数为最外层电子数的6倍。请完成下列空白。
(1)A的原子结构示意图为:________;A元素的名称为:________。
(2)B的原子结构示意图为:________;B元素的名称为:________。
(3)C的离子结构示意图为:________;C元素的名称为:________。【解析】 因为K层最多容纳2个电子,又已知A元素原子M层电子数是K层电子数的3倍,所以M层电子数为6,则A为硫。B元素最外层的电子数为6÷2=3,则B为铝。已知C元素原子的核电荷数是电子层数的4倍,其质子数为最外层电子数的6倍,4与6的最小公倍数为12,可见该元素原子的核内质子数为12的倍数。当核内质子数和核外电子总数均为12时,原子核内的质子数恰好为其电子层数的4倍,并为其最外层电子数的6倍,则C为镁,最外层电子数少于4的原子,易失电子形成离子。练规范、练技能、练速度
第1课时 核外电子排布与元素周期律1.在有关原子结构知识的基础上,了解元素的原子核外电子排布。
2.能用原子(离子)结构示意图表示1~18号元素原子(离子)的核外电子排布。
3.通过有关数据和实验事实,了解原子结构与元素性质之间的关系,理解元素周期律的含义及其实质。一、核外电子排布
1.原子结构示意图2.电子层
(1)概念:原子核外电子运动的不同区域。
(2)表示符号、能量高低和离核远近低高近远3.原子核外电子的排布规律
(1)电子尽量先排布在能量_____的电子层里。
(2)各电子层最多能容纳____个电子(n为电子层数)。
(3)最外层电子数不超过__个(当K层为最外层时不 超过__个)。
(4)次外层电子数不超过___个。
二、元素周期律
1.原子序数
(1)概念:按照__________由小到大的顺序给元素编 的序号。
(2)数值:等于该元素原子的_________。最低2n28218核电荷数核电荷数2.原子最外层电子数的递变规律3.原子半径的递变规律
3~9号元素或11~17号元素,随着原子序数的递 增,原子半径呈现_________的周期性变化。
4.元素化合价的递变规律
(1)随着原子序数的递增,最高正化合价重复着 从___价到___价,负价从___价到____价的周期 性变化。
(2)非金属元素的最高正化合价和最低负化合 价的绝对值之和等于__。由大到小+1+7-4-185.元素的金属性和非金属性的递变规律
(1)钠、镁、铝的金属性强弱
①与酸或水反应置换出氢由易到难的顺序为: __________。
②最高价氧化物对应水化物的碱性由强到弱的顺 序为:________________________。
③金属性由强到弱的顺序为:__________。Na>Mg>AlNaOH>Mg(OH)2>Al(OH)3Na>Mg>Al(2)14~17号元素的非金属性强弱
①单质与氢气化合由易到难的顺序为: __________。
②气态氢化物的稳定性由强到弱的顺序为: ___________________。
③最高价氧化物对应水化物的酸性由强到弱的 顺序为:___________________________。
④非金属性由强到弱的顺序为:__________。Cl>S>P>SiHCl>H2S>PH3>SiH4HClO4>H2SO4>H3PO4>H4SiO4Cl>S>P>Si(3)11~17号元素的金属性和非金属性的递变规 律
随着原子序数的递增,元素的金属性逐渐____,非 金属性逐渐增强。
6.元素周期律
(1)概念:元素的性质随着元素________的递增而 呈周期性变化的规律。
(2)实质:元素周期律是____________________随 着元素核电荷数的递增发生周期性变化的必然 结果。减弱核电荷数元素原子核外电子排布一、原子或简单离子的核外电子排布在空白处填写符合下列结构特点的1~18号元素符号。
①最外层电子数为1的原子有________。
②最外层电子数为2的原子有________。
③最外层电子数跟次外层电子数相等的原子有________。
④最外层电子数是次外层电子数2倍的原子是________。⑤最外层电子数是次外层电子数3倍的原子是________。
⑥最外层电子数是次外层电子数4倍的原子是________。
⑦次外层电子数是最外层电子数2倍的原子有________。
⑧内层电子总数是最外层电子数2倍的原子有________。⑨电子层数跟最外层电子数相等的原子有________。
⑩电子层数是最外层电子数2倍的原子是________。
?最外层电子数是电子层数2倍的原子有________。
?最外层电子数是电子层数3倍的原子有________。[学生交流]
【提示】 ①H、Li、Na ②He、Be、Mg ③Be、Ar ④C ⑤O ⑥Ne ⑦Li、Si ⑧Li、P ⑨H、Be、Al ⑩Li ?He、C、S ?O具有相同电子层排布的微粒有哪些(仅限于1~20号元素)[师生互动]
【提示】 (1)具有相同电子层排布的微粒的含义:电子层数相同,各层电子数也相同的单个原子或离子。
(2)与He原子具有相同电子层排布的微粒(2电子微粒):(3)与Ne原子具有相同电子层排布的微粒(10电子微粒):(4)与Ar原子具有相同电子层排布的微粒(18电子微粒):有A、B、C、D四种元素,A元素地壳中含量最多的金属元素;B元素的原子其M层电子数比L层少1个电子;C元素的原子得到2个电子、D元素的原子失去1个电子所得到的微粒都具有与氖原子相同的电子层结构。回答下列问题:
(1)上述四种元素中C的名称是________;
(2)画出B元素原子的结构示意图________;(3)写出下列化学方程式
单质D在单质C中燃烧的化学方程式________________________________________________________________________;
A的氢氧化物和D的氢氧化物反应的离子方程式________________________________________________________________________。【点评】 本题主要考查微粒的电子层结构,熟练掌握核外电子排布规律是解决此类问题的关键。1.A、B、C三种元素的原子序数依次为a、b、c,它们的离子An+、Bn-、Cm-具有相同的电子层结构,且n>m,则下列关系正确的是( )
A.a>b>c B.a>c>b
C.a=b+m+n D.a=c-n-m【解析】 An+和Bn-具有相同的电子层结构,则a-n=b+n,a=b+2n,a>b。An+和Cm-具有相同的电子层结构,则a-n=c+m,a=c+m+n,a>c。Bn-和Cm-具有相同电子层结构,且n>m,b+n=c+m,b-c=m-n<0,故c>b,所以a>c>b,选B。
【答案】 B[学生交流]
【提示】 元素周期律的本质是元素原子核外电子排布呈周期性变化。元素的性质主要由元素原子的电子层结构特别是最外层电子数决定。随着元素原子序数的递增,元素原子的电子层结构呈周期性的变化,必然引起元素性质也呈周期性的变化。因此,元素性质的周期性变化是元素原子内部结构周期性变化的反映,是元素原子的核外电子排布的周期性变化的必然结果。元素的金属性和非金属性与元素原子核外电子排布有何关系?
[师生互动]
【提示】 元素原子的核外电子排布决定着元素的主要性质。
(1)一般来说,当最外层电子数少于4个时,易失去电子,表现出金属性;当最外层电子数多于4个时,易得到电子,表现出非金属性。
(2)当最外层为8个电子(氦为2个电子)时,原子处于稳定结构,化学性质稳定。如何判断元素的金属性和非金属性强弱?
[师生互动]
【提示】 (1)元素金属性强弱的判断
比较元素金属性强弱,其实质是看元素原子失去 电子的难易程度,越容易失去电子,金属性越强。
①从元素的原子结构判断
a.当最外层电子数相同时,核电荷数越大,金属性
越强。
b.当电子层数相同时,核电荷数越大,金属性越弱。②从元素单质及其化合物的相关性质判断
a.金属单质和水或非氧化性酸反应置换出氢越容易,金属性越强。
b.最高价氧化物对应的水化物的碱性越强,金属性越强。
c.金属单质之间发生置换反应,被置换出的金属元素金属性较弱。(2)元素非金属性强弱的判断
比较元素非金属性强弱,其实质是看元素原子得到电子的难易程度,越容易得到电子,非金属性越强。
①从元素的原子结构判断
a.当最外层电子数相同时,核电荷数越大,非金属性越弱。
b.当电子层数相同时,核电荷数越大,非金属性越强。②从元素单质及其化合物的相关性质判断
a.单质越易跟H2化合,生成的氢化物也就越稳定,氢化物的还原性也就越弱,说明其非金属性也就越强。
b.最高价氧化物对应水化物的酸性越强,说明其非金属性越强。
c.非金属单质间发生置换反应,被置换出的非金属元素非金属性较强。下列说法中正确的是( )
A.元素性质的周期性变化是指原子半径、元素的主要化合价及原子核外电子排布的周期性变化
B.元素性质的周期性变化决定于元素原子结构的周期性变化
C.从Li―→F,Na―→Cl,元素的最高化合价均呈现从+1价―→+7价的变化
D.电子层数相同的原子核外电子排布,其最外层电子数均从1个到8个呈现周期性变化【思路点拨】 解答本题需要注意以下三点:
(1)元素周期律的本质。
(2)元素周期律的内容。
(3)个别元素的特殊性,如F无正价。【尝试解答】 【答案】 B2.下列叙述中,能肯定A金属比B金属活泼性强的是( )
A.A原子的最外层电子数比B原子的最外层电子数少
B.A原子的电子层数比B原子电子层数多
C.1 mol A从酸中置换出的H2比1 mol B从酸中置换出的H2多
D.常温时,A能从水中置换出H2,而B不能【解析】 选项A中只指出A、B两种元素原子的最外层电子数的多少,而不能确定A、B的金属性强弱,选项B中指出了A、B原子的电子层的多少,但电子层数少的比电子层数多的原子的金属性不一定弱。选项C中说明了等物质的量的A、B金属与酸反应生成H2的多少,未说明与酸反应的快慢。与酸反应生成H2多的金属活泼性不一定强,如1 mol Al比1 mol Na与足量稀HCl反应时,生成的H2多,但Al不如Na活泼,选项D正确,只有很活泼的金属在常温下才与水反应,而较活泼的金属在常温时不与水发生反应。
【答案】 D1.知识小结2.规律点拨
(1)核外电子排布的规律是相互联系的,不能孤立地理解,如当M层不是最外层时,最多可以排布18个电子,而当它是最外层时,最多可以排布8个电子。
电子不一定排满M层才排N层,如K和Ca的核外电子排布情况分别为:1.下列说法中,不正确的是( )
A.元素的性质随着相对原子质量的逐渐增大而呈周期性的变化
B.元素的原子序数越大,其相对原子质量就越大
C.除稀有气体外,电子层数相同的原子,核内质子数越多,原子半径越小
D.电子层数相同的非金属原子,核电荷数越大,负化合价的绝对值越小【解析】 解答本题需要准确理解元素周期律的意义:元素的性质随着原子序数的递增而呈周期性的变化。虽然一般来说,原子序数增加,相对原子质量增大,但也有例外,如18号Ar的相对原子质量为39.95,而19号K的相对原子质量为39.10,则可判断选项A和B不正确。
【答案】 AB2.根据下列三种微粒结构示意图的共同特征,可以把它们归为一类。下列微粒中可以归入此类的微粒是( )【解析】 题中所述的三个微粒分别是Cl-、O2-、Ca2+,它们都是阴、阳离子,最外层是8电子稳定结构,因此可以与它们归为一类的是C项K+,其余均为原子,不符合要求。
【答案】 C3.下列关于核电荷数为1~18的元素的叙述中,正确的是( )
A.最外层只有1个电子的元素一定是金属元素
B.最外层只有2个电子的元素一定是金属元素
C.最外层有5个电子的元素一定是金属元素
D.核电荷数为17的元素的原子容易获得1个电子【解析】 A项中氢原子最外层只有1个电子,但氢是非金属元素;B项中稀有气体氦的最外层只有2个电子;C项中氮原子的最外层有5个电子,但氮是非金属元素;D项正确。
【答案】 D【解析】 Cu为变价金属,X2可将其氧化为+2价,Y只能将其氧化为-1价,故可判断氧化性:X2>Y。由第三个方程式可得氧化性:Z2>X2,联合可得结论:非金属性:Z>X>Y,且X、Z最低负价为-1,Y最低负价为-2,故可得酸性:HZO4>HXO4>H2YO4,选B。
【答案】 B5.用“>”或“<”回答下列问题:
(1)酸性:H2CO3________H2SiO3,H2SiO3________ H3PO4;
(2)碱性:Ca(OH)2______Mg(OH)2,Mg(OH)2______ Al(OH)3;
(3)气态氢化物稳定性:H2O______H2S,H2S_______ HCl;
(4)还原性:H2O________H2S,H2S________HCl;
(5)酸性:H2SO4______H2SO3,HClO4______HClO。从以上答案中可以归纳出:
①元素的非金属性越强,其最高价氧化物对应水化物的酸性越________;
②元素的金属性越强,其最高价氧化物对应水化物的碱性越________;
③元素的________性越强,其对应气态氢化物的稳定性越________;
④非金属性越强的元素形成的气态氢化物,其还原性越________;
⑤同种非金属元素形成的含氧酸,其成酸元素价态越高,其酸性也越________。【答案】 (1)> < (2)> > (3)> < (4)< > (5)> > ①强 ②强 ③非金属 强 ④弱 ⑤强6.已知A元素原子的核电荷数大于B元素原子的核电荷数,但两种元素的原子具有相同数目的电子层,A元素最外层电子数为B元素的2倍,A元素原子M层电子数为K层电子数的3倍,C元素原子的核电荷数是电子层数的4倍,其质子数为最外层电子数的6倍。请完成下列空白。
(1)A的原子结构示意图为:________;A元素的名称为:________。
(2)B的原子结构示意图为:________;B元素的名称为:________。
(3)C的离子结构示意图为:________;C元素的名称为:________。【解析】 因为K层最多容纳2个电子,又已知A元素原子M层电子数是K层电子数的3倍,所以M层电子数为6,则A为硫。B元素最外层的电子数为6÷2=3,则B为铝。已知C元素原子的核电荷数是电子层数的4倍,其质子数为最外层电子数的6倍,4与6的最小公倍数为12,可见该元素原子的核内质子数为12的倍数。当核内质子数和核外电子总数均为12时,原子核内的质子数恰好为其电子层数的4倍,并为其最外层电子数的6倍,则C为镁,最外层电子数少于4的原子,易失电子形成离子。练规范、练技能、练速度
