2012新课标同步导学高一化学课件:第1章(苏教版必修2)(3)
文档属性
| 名称 | 2012新课标同步导学高一化学课件:第1章(苏教版必修2)(3) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-12-16 13:27:12 | ||
图片预览











文档简介
课件66张PPT。第2课时 元素周期表及其应用1.能描述元素周期表的结构。
2.知道同主族、同周期元素原子核外电子排布,元素化学性质的递变规律。
3.了解元素周期表中金属元素、非金属元素的分布。
4.了解主族元素在元素周期表中的位置、原子结构、元素性质三者之间的关系。
5.了解元素周期表的意义与应用。一、元素周期表的结构
1.编排依据:___________。
2.排列原则
(1)横行:________相同,每个横行称为一个_____。
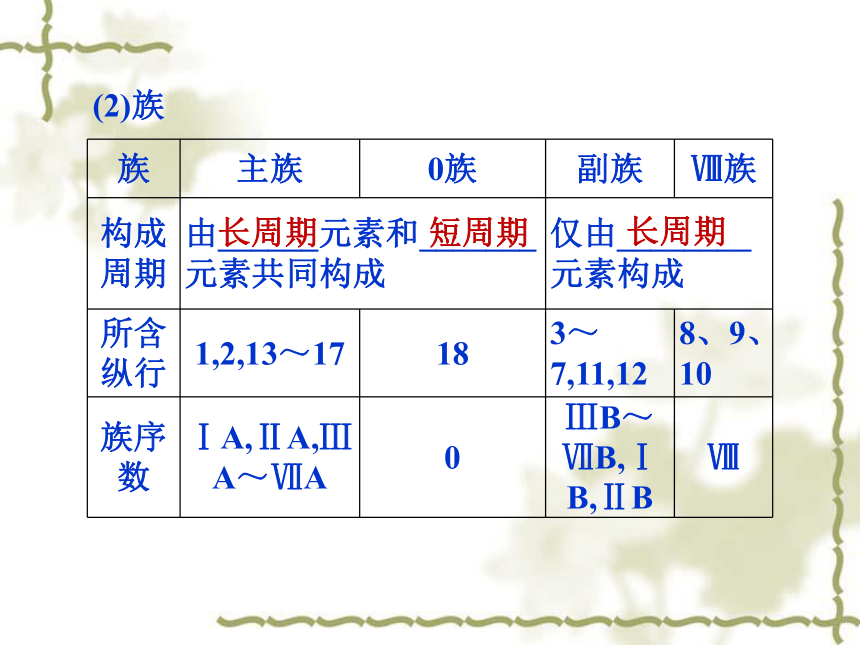
(2)纵行:_____________相同,18纵行分为16个族。元素周期律周期电子层数最外层电子数3.组成结构
(1)周期28818183226长周期不完全周期(2)族长周期短周期长周期二、同主族和同周期元素性质的递变
1.同周期元素性质的递变
同周期元素(除稀有气体元素外)中,随着核电荷 数增多,原子半径逐渐_____,原子核对最外层电 子的吸引能力逐渐_____,原子失电子能力逐渐 ____,得电子能力逐渐_____,所以元素的金属性 逐渐______,非金属性逐渐_____。减小增强减弱增强减弱增强2.同主族元素性质的递变
同主族元素中随着核电荷数增多,原子半径逐 渐_____,原子核对最外层电子的吸引能力逐渐 _____,原子失电子能力逐渐______,得电子能力 逐渐_____,所以元素的金属性逐渐____,非金属 性逐渐_____。增大减弱增强减弱增强减弱3.金属元素和非金属元素的分区
(1)分界线
(2)性质的递变
①金属性最强的元素处于周期表的_______,它是 ______元素。
②非金属性最强的元素处于周期表的_______,它 是_____元素。
③临近虚线两侧的元素既表现出一定的_____性, 又表现一定的_______性。左下角铯(Cs)右上角氟(F)金属非金属三、元素周期表的应用
1.位、构、性之间的关系
(1)元素的________决定了元素在周期表中的位置。
(2)元素在周期表中的位置反映了元素的________ 和元素的_____特点。
2.应用
(1)根据元素在周期表中的位置,推测元素的原子结 构,预测其主要_____。
(2)研究合成新物质
①在金属和非金属的分界线附近寻找_______材料 (如___________等);
②在_____元素中寻找各种优良的催化剂及耐高温、 耐腐蚀的合金材料。原子结构原子结构性质性质半导体Si、Ge、Se过渡[学生交流]
【提示】18列;不是,第8、9、10列代表一族;主族元素分别处于第1、2、13、14、15、16、17列。[学生交流]
【提示】 (1)周期序数=电子层数;主族族序数=最外层电子数。
(2)最外层电子数为2的元素不一定是第ⅡA族,如He等。[学生交流]
【提示】 (1)ⅢB族元素种类最多,共有32种;第6周期元素种类最多,共有32种。
(2)ⅡA族全部是金属元素, ⅦA族全部是非金属元素。[学生交流]
【提示】 目前112种元素中金属元素共90种,非金属元素共22种,元素周期表中从ⅢB到ⅡB共10个纵行,包括了第Ⅷ族和全部副族元素,共66种元素,全部为金属元素,统称为过渡元素。族序数为Ⅱ、Ⅲ的地方是主族和副族的分界线,第一次分界时主族在副族的前面,第二次分界时副族在主族的前面。“第一次”指ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ依次排列。“第二次”指ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0依次排列。【归纳小结】 元素周期表的结构
(1)周期(2)族【思路点拨】 解答本题要注意以下三点:
(1)元素周期表中周期和族的编排依据。
(2)周期和族的分类。
(3)周期表单元格中的各信息及意义。【尝试解答】 (1)根据元素周期表的结构知:第一周期有2种元素,第二、三周期有8种元素,分列于第1、2、13~18列,第四、五、六、七周期为长周期,包括1~18列。由此可画出周期表的边界。
(2)画出周期表的边界,对照周期表,很容易找出各元素在周期表中的位置。
(3)第三周期、第ⅥA族元素为硫,原子序数为16,相对原子质量为32。(4)元素原子结构与元素在元素周期表中的位置关系为:①元素所在周期序数等于其原子的电子层数,元素所在的主族序数等于原子的最外层电子数,由元素原子的电子层数和最外层电子数可确定元素在元素周期表中的位置。②同一周期元素原子的电子层数相同,同一主族元素原子的最外层电子数相同。【答案】 (1)【解析】 第ⅢB族中包含锕系与镧系元素,共有32种元素,A项正确;元素周期表中共有18个纵行,16个族,B项错误;第ⅠA族中H为非金属元素,C项错误;短周期包括第1、2、3周期,D项错误。
【答案】 A[师生互动]
【提示】 元素周期表中位置、结构、性质之间的关系
[师生互动]
【提示】 元素周期表中元素性质的递变规律[师生互动]
【提示】 (1)由原子序数定核电荷数画出原子结构示意图,根据周期序数等于原子电子层数、主族序数等于原子最外层电子数确定元素在周期表中的位置。(2)建立在0族元素原子序数基础上进行逐步确定。
①比大小定周期
比较该元素的原子序数与0族元素的序数大小,找出与其相邻近的0族元素,那么该元素就和序数大的0族元素处于同一周期。
②求差值定族数
a.若某元素原子序数比相应的0族元素多1或2,则该元素应处在0族元素所在周期的下一个周期的ⅠA族或ⅡA族。
b.若比相应的0族元素少1~5时,则应处在同周期的ⅦA~ⅢA族。
c.若差其他数,则由相应差数找出相应的族。例如:53号元素
由于36<53<54,则53号元素位于第五周期,54-53=1,所以53号元素位于54号元素左侧第一格,即第ⅦA族,所以53号元素位于第五周期第ⅦA族。
再如:88号元素
由于86<88<118,则88号元素位于第七周期,88-86=2,所以88号元素位于第七周期的第二格,即第ⅡA族,所以88号元素位于第七周期第ⅡA族。
(3)确定该元素在周期表中的位置,形式为“第几周期第几族”,要注意分清主族、副族、0族、Ⅷ族。【尝试解答】 表中a为Na元素,b为Mg元素,c为C元素,d为O元素,e为S元素,f为Cl元素。则A中稳定性:H2S>H2O显然是错误的,因为同主族元素从上到下氢化物稳定性逐渐减弱。B中原子半径应该是Na>Mg>S,因为同周期元素从左到右原子半径逐渐变小。上述6种元素中,a、b为活泼金属,d、e、f为活泼非金属,c的活泼性是最差的,故C错误。
【答案】 D【解析】 6号元素原子比Ne(10)少4个电子,有2个电子层,最外层电子数为4,则其位于第二周期第ⅣA族;13号元素原子比11号元素钠的原子多2个电子,有3个电子层,最外层电子数为3,位于第三周期第ⅢA族;34号元素原子比Kr(36)少2个电子,共有4个电子层,最外层电子数为6,位于第四周期第ⅥA族;53号元素原子比Xe(54)少1个电子,共有5个电子层,最外层电子数为7,位于第五周期第ⅦA族;88号元素原子比87号元素钫多1个电子,共有7个电子层,最外层电子数为2,位于第七周期第ⅡA族。【答案】[师生互动]
【提示】 原子半径的大小主要由核外电子层数和原子核对核外电子的作用两方面因素来决定:
(1)同电子层:一般来说,当电子层相同时,随着核电荷数的增加,其原子半径(或离子半径)逐渐减小(除惰性气体外),有“序小径大”的规律。
(2)同主族:一般来说,当最外层电子数相同时,电子层数越多,原子(或离子)半径越大。[师生互动]
【提示】 (1)对同一种元素来说,原子半径>阳离子的半径,如r(Na)>r(Na+);原子半径<阴离子的半径,如r(Cl)(2)对于同种元素的各种微粒,核外电子数越多,半径越大;核外电子数越少,半径越小。例如:r(Cl-)>r(Cl);r(Fe)>r(Fe2+)>r(Fe3+);r(H-)>r(H)>r(H+)。(3)对于电子层结构相同的离子,核电荷数大的半径小,核电荷数小的半径大。如S2->Cl->K+>Ca2+、O2->F->Na+>Mg2+>Al3+。但注意,稀有气体元素的原子半径一般比相同电子层数的非金属元素原子半径大。【思路点拨】 比较原子半径大小时,对同周期或同主族元素的原子,按其递变规律进行比较;对具有相同电子层结构的离子要按其核电荷数的多少进行判断,即原子序数小的离子半径大。【尝试解答】 A项中四种离子核外电子数相同,随着核电荷数增多,离子半径依次减小,即
Al3+Cl->Na+>Al3+,故B项正确。
【答案】 B【解析】 根据X、Y在同一周期,X+与Z2-具有相同的核外电子层结构,可推断Z在X、Y的上一周期,又因为X、Y、Z原子序数之和为36,综合判断知X为Na、Z为O-,Y为Cl。B项中的离子半径应为Z2->X+。
【答案】 B1.知识小结2.规律点拨
应用结构、性质、位置的关系,可以解决由结构推断性质,由性质逆推结构。由结构推出其在元素周期表中的位置,真正理解结构决定性质的规律。很多规律方法只适用于主族元素,不适用于副族元素,解题时注意不要随意将其适用范围扩大化。1.(2009年山东理综)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族元素的原子,最外层电子数相同,化学性质完全相同【解析】 处于金属和非金属分界线上的元素既可表现金属性,又可表现非金属性,如Si、Al等;C中H+、H-均不能达到8电子稳定结构,D中化学性质相似。
【答案】 B2.已知短周期元素的离子aA2+、bB+、cC2-、dD-具有相同的电子层结构。则下列叙述正确的是( )
A.原子半径:A>B>C>D
B.离子半径:C2->D->B+>A2+
C.原子序数:d>c>b>a
D.原子的失电子能力:A>B>D>C【解析】 采用分类归纳法。首先将四种离子分成阳离子与阴离子两类,分析其原子序数及离子半径。阳离子为aA2+、bB+,因具有相同的电子层结构,故原子序数a>b,离子半径A2+D-。再将其综合分析,因四种离子具有相同的电子层结构,故A、B位于C、D的下一周期,其原子序数为a>b>d>c,离子半径C2->D->B+>A2+。
【答案】 B3.A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的最高价氧化物的水化物均呈酸性,且酸性C>D,E是这五种元素中半径最小的元素,它们的原子序数由小到大的顺序是( )
A.A、B、C、D、E B.C、D、A、B、E
C.B、A、D、C、E D.E、C、D、B、A【解析】 碱性B>A,原子序数A>B;酸性C>D,原子序数C>D;E为同周期半径最小,非金属性最强,序数最大,所以顺序应为B、A、D、C、E。
【答案】 C【解析】 由题意知,图中应是周期表第2、3周期的一部分,若设B的原子序数为x,则A、C原子序数分别为x-9、x-7,有x-9+x-7+x=2x,得x=16,所以A、B、C分别为N、S、F。显然,原子半径的大小顺序是S>N>F,即B>A>C,所以A项错误,将B、C、D项中涉及到的物质具体化,易知它们是否正确。
【答案】 A5.下表为元素周期表的一部分,请回答有关问题:
(1)⑤和⑧的元素符号是________和________。
(2)表中最活泼的金属是________,非金属性最强的元素是________。(填写元素符号)
(3)表中能形成两性氢氧化物的元素是________,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物对应水化物反应的化学方程式:
_____________________________________,
________________________________;
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:
______________________________________________________________________________。【解析】 将①~⑩号元素的元素符号填入表中相应的位置,然后再根据条件得出相应的答案【答案】 (1)Si Ar (2)K F
(3)铝(或Al) 2Al(OH)3+3H2SO4===Al2(SO4)3+6H2O Al(OH)3+KOH===KAlO2+2H2O
(4)在NaBr溶液中通入氯气(或加入氯水),溶液变红棕色(或橙色),可得氧化性Cl2>Br2(其他合理答案也可)6.现有部分短周期元素的性质或原子结构如下表:(3)元素Z与元素T相比,非金属性较强的是______________________(用元素符号表示),下列表述中能证明这一事实的是______________。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是________,理由是__________________________
_____________________________________。【解析】 (1)由题意知T为硫,X为碳,Y为氮,Z为氯。碳元素的一种核素14C可用于测定文物年代。
(2)常利用铵盐与碱共热产生碱性气体NH3的方法检验NH的存在。
(3)元素Cl与S相比,非金属性较强的应为Cl,可用氢化物的稳定性、非金属元素最高价氧化物对应水化物的酸性强弱及非金属间的相互置换反应等来判断。
(4)T、X、Y、Z四种元素最高价氧化物的水化物分别为:H2SO4、H2CO3、HNO3、HClO4,其中只有H2CO3是弱酸,其余均为强酸。练规范、练技能、练速度
2.知道同主族、同周期元素原子核外电子排布,元素化学性质的递变规律。
3.了解元素周期表中金属元素、非金属元素的分布。
4.了解主族元素在元素周期表中的位置、原子结构、元素性质三者之间的关系。
5.了解元素周期表的意义与应用。一、元素周期表的结构
1.编排依据:___________。
2.排列原则
(1)横行:________相同,每个横行称为一个_____。
(2)纵行:_____________相同,18纵行分为16个族。元素周期律周期电子层数最外层电子数3.组成结构
(1)周期28818183226长周期不完全周期(2)族长周期短周期长周期二、同主族和同周期元素性质的递变
1.同周期元素性质的递变
同周期元素(除稀有气体元素外)中,随着核电荷 数增多,原子半径逐渐_____,原子核对最外层电 子的吸引能力逐渐_____,原子失电子能力逐渐 ____,得电子能力逐渐_____,所以元素的金属性 逐渐______,非金属性逐渐_____。减小增强减弱增强减弱增强2.同主族元素性质的递变
同主族元素中随着核电荷数增多,原子半径逐 渐_____,原子核对最外层电子的吸引能力逐渐 _____,原子失电子能力逐渐______,得电子能力 逐渐_____,所以元素的金属性逐渐____,非金属 性逐渐_____。增大减弱增强减弱增强减弱3.金属元素和非金属元素的分区
(1)分界线
(2)性质的递变
①金属性最强的元素处于周期表的_______,它是 ______元素。
②非金属性最强的元素处于周期表的_______,它 是_____元素。
③临近虚线两侧的元素既表现出一定的_____性, 又表现一定的_______性。左下角铯(Cs)右上角氟(F)金属非金属三、元素周期表的应用
1.位、构、性之间的关系
(1)元素的________决定了元素在周期表中的位置。
(2)元素在周期表中的位置反映了元素的________ 和元素的_____特点。
2.应用
(1)根据元素在周期表中的位置,推测元素的原子结 构,预测其主要_____。
(2)研究合成新物质
①在金属和非金属的分界线附近寻找_______材料 (如___________等);
②在_____元素中寻找各种优良的催化剂及耐高温、 耐腐蚀的合金材料。原子结构原子结构性质性质半导体Si、Ge、Se过渡[学生交流]
【提示】18列;不是,第8、9、10列代表一族;主族元素分别处于第1、2、13、14、15、16、17列。[学生交流]
【提示】 (1)周期序数=电子层数;主族族序数=最外层电子数。
(2)最外层电子数为2的元素不一定是第ⅡA族,如He等。[学生交流]
【提示】 (1)ⅢB族元素种类最多,共有32种;第6周期元素种类最多,共有32种。
(2)ⅡA族全部是金属元素, ⅦA族全部是非金属元素。[学生交流]
【提示】 目前112种元素中金属元素共90种,非金属元素共22种,元素周期表中从ⅢB到ⅡB共10个纵行,包括了第Ⅷ族和全部副族元素,共66种元素,全部为金属元素,统称为过渡元素。族序数为Ⅱ、Ⅲ的地方是主族和副族的分界线,第一次分界时主族在副族的前面,第二次分界时副族在主族的前面。“第一次”指ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ依次排列。“第二次”指ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0依次排列。【归纳小结】 元素周期表的结构
(1)周期(2)族【思路点拨】 解答本题要注意以下三点:
(1)元素周期表中周期和族的编排依据。
(2)周期和族的分类。
(3)周期表单元格中的各信息及意义。【尝试解答】 (1)根据元素周期表的结构知:第一周期有2种元素,第二、三周期有8种元素,分列于第1、2、13~18列,第四、五、六、七周期为长周期,包括1~18列。由此可画出周期表的边界。
(2)画出周期表的边界,对照周期表,很容易找出各元素在周期表中的位置。
(3)第三周期、第ⅥA族元素为硫,原子序数为16,相对原子质量为32。(4)元素原子结构与元素在元素周期表中的位置关系为:①元素所在周期序数等于其原子的电子层数,元素所在的主族序数等于原子的最外层电子数,由元素原子的电子层数和最外层电子数可确定元素在元素周期表中的位置。②同一周期元素原子的电子层数相同,同一主族元素原子的最外层电子数相同。【答案】 (1)【解析】 第ⅢB族中包含锕系与镧系元素,共有32种元素,A项正确;元素周期表中共有18个纵行,16个族,B项错误;第ⅠA族中H为非金属元素,C项错误;短周期包括第1、2、3周期,D项错误。
【答案】 A[师生互动]
【提示】 元素周期表中位置、结构、性质之间的关系
[师生互动]
【提示】 元素周期表中元素性质的递变规律[师生互动]
【提示】 (1)由原子序数定核电荷数画出原子结构示意图,根据周期序数等于原子电子层数、主族序数等于原子最外层电子数确定元素在周期表中的位置。(2)建立在0族元素原子序数基础上进行逐步确定。
①比大小定周期
比较该元素的原子序数与0族元素的序数大小,找出与其相邻近的0族元素,那么该元素就和序数大的0族元素处于同一周期。
②求差值定族数
a.若某元素原子序数比相应的0族元素多1或2,则该元素应处在0族元素所在周期的下一个周期的ⅠA族或ⅡA族。
b.若比相应的0族元素少1~5时,则应处在同周期的ⅦA~ⅢA族。
c.若差其他数,则由相应差数找出相应的族。例如:53号元素
由于36<53<54,则53号元素位于第五周期,54-53=1,所以53号元素位于54号元素左侧第一格,即第ⅦA族,所以53号元素位于第五周期第ⅦA族。
再如:88号元素
由于86<88<118,则88号元素位于第七周期,88-86=2,所以88号元素位于第七周期的第二格,即第ⅡA族,所以88号元素位于第七周期第ⅡA族。
(3)确定该元素在周期表中的位置,形式为“第几周期第几族”,要注意分清主族、副族、0族、Ⅷ族。【尝试解答】 表中a为Na元素,b为Mg元素,c为C元素,d为O元素,e为S元素,f为Cl元素。则A中稳定性:H2S>H2O显然是错误的,因为同主族元素从上到下氢化物稳定性逐渐减弱。B中原子半径应该是Na>Mg>S,因为同周期元素从左到右原子半径逐渐变小。上述6种元素中,a、b为活泼金属,d、e、f为活泼非金属,c的活泼性是最差的,故C错误。
【答案】 D【解析】 6号元素原子比Ne(10)少4个电子,有2个电子层,最外层电子数为4,则其位于第二周期第ⅣA族;13号元素原子比11号元素钠的原子多2个电子,有3个电子层,最外层电子数为3,位于第三周期第ⅢA族;34号元素原子比Kr(36)少2个电子,共有4个电子层,最外层电子数为6,位于第四周期第ⅥA族;53号元素原子比Xe(54)少1个电子,共有5个电子层,最外层电子数为7,位于第五周期第ⅦA族;88号元素原子比87号元素钫多1个电子,共有7个电子层,最外层电子数为2,位于第七周期第ⅡA族。【答案】[师生互动]
【提示】 原子半径的大小主要由核外电子层数和原子核对核外电子的作用两方面因素来决定:
(1)同电子层:一般来说,当电子层相同时,随着核电荷数的增加,其原子半径(或离子半径)逐渐减小(除惰性气体外),有“序小径大”的规律。
(2)同主族:一般来说,当最外层电子数相同时,电子层数越多,原子(或离子)半径越大。[师生互动]
【提示】 (1)对同一种元素来说,原子半径>阳离子的半径,如r(Na)>r(Na+);原子半径<阴离子的半径,如r(Cl)
Al3+
【答案】 B【解析】 根据X、Y在同一周期,X+与Z2-具有相同的核外电子层结构,可推断Z在X、Y的上一周期,又因为X、Y、Z原子序数之和为36,综合判断知X为Na、Z为O-,Y为Cl。B项中的离子半径应为Z2->X+。
【答案】 B1.知识小结2.规律点拨
应用结构、性质、位置的关系,可以解决由结构推断性质,由性质逆推结构。由结构推出其在元素周期表中的位置,真正理解结构决定性质的规律。很多规律方法只适用于主族元素,不适用于副族元素,解题时注意不要随意将其适用范围扩大化。1.(2009年山东理综)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族元素的原子,最外层电子数相同,化学性质完全相同【解析】 处于金属和非金属分界线上的元素既可表现金属性,又可表现非金属性,如Si、Al等;C中H+、H-均不能达到8电子稳定结构,D中化学性质相似。
【答案】 B2.已知短周期元素的离子aA2+、bB+、cC2-、dD-具有相同的电子层结构。则下列叙述正确的是( )
A.原子半径:A>B>C>D
B.离子半径:C2->D->B+>A2+
C.原子序数:d>c>b>a
D.原子的失电子能力:A>B>D>C【解析】 采用分类归纳法。首先将四种离子分成阳离子与阴离子两类,分析其原子序数及离子半径。阳离子为aA2+、bB+,因具有相同的电子层结构,故原子序数a>b,离子半径A2+
【答案】 B3.A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的最高价氧化物的水化物均呈酸性,且酸性C>D,E是这五种元素中半径最小的元素,它们的原子序数由小到大的顺序是( )
A.A、B、C、D、E B.C、D、A、B、E
C.B、A、D、C、E D.E、C、D、B、A【解析】 碱性B>A,原子序数A>B;酸性C>D,原子序数C>D;E为同周期半径最小,非金属性最强,序数最大,所以顺序应为B、A、D、C、E。
【答案】 C【解析】 由题意知,图中应是周期表第2、3周期的一部分,若设B的原子序数为x,则A、C原子序数分别为x-9、x-7,有x-9+x-7+x=2x,得x=16,所以A、B、C分别为N、S、F。显然,原子半径的大小顺序是S>N>F,即B>A>C,所以A项错误,将B、C、D项中涉及到的物质具体化,易知它们是否正确。
【答案】 A5.下表为元素周期表的一部分,请回答有关问题:
(1)⑤和⑧的元素符号是________和________。
(2)表中最活泼的金属是________,非金属性最强的元素是________。(填写元素符号)
(3)表中能形成两性氢氧化物的元素是________,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物对应水化物反应的化学方程式:
_____________________________________,
________________________________;
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:
______________________________________________________________________________。【解析】 将①~⑩号元素的元素符号填入表中相应的位置,然后再根据条件得出相应的答案【答案】 (1)Si Ar (2)K F
(3)铝(或Al) 2Al(OH)3+3H2SO4===Al2(SO4)3+6H2O Al(OH)3+KOH===KAlO2+2H2O
(4)在NaBr溶液中通入氯气(或加入氯水),溶液变红棕色(或橙色),可得氧化性Cl2>Br2(其他合理答案也可)6.现有部分短周期元素的性质或原子结构如下表:(3)元素Z与元素T相比,非金属性较强的是______________________(用元素符号表示),下列表述中能证明这一事实的是______________。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是________,理由是__________________________
_____________________________________。【解析】 (1)由题意知T为硫,X为碳,Y为氮,Z为氯。碳元素的一种核素14C可用于测定文物年代。
(2)常利用铵盐与碱共热产生碱性气体NH3的方法检验NH的存在。
(3)元素Cl与S相比,非金属性较强的应为Cl,可用氢化物的稳定性、非金属元素最高价氧化物对应水化物的酸性强弱及非金属间的相互置换反应等来判断。
(4)T、X、Y、Z四种元素最高价氧化物的水化物分别为:H2SO4、H2CO3、HNO3、HClO4,其中只有H2CO3是弱酸,其余均为强酸。练规范、练技能、练速度
