2012新课标同步导学高一化学课件:第1章(苏教版必修2)(4)
文档属性
| 名称 | 2012新课标同步导学高一化学课件:第1章(苏教版必修2)(4) |  | |
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-12-16 13:32:01 | ||
图片预览








文档简介
课件53张PPT。第二单元 微粒之间的相互作用力1.掌握离子键和共价键的形成微粒、表示方法,以及离子化合物、共价化合物的区别。
2.从碳的成键特点认识有机化合物的多样性。
3.了解可用球棍模型和比例模型表示分子的结构。
4.了解分子间作用力对由分子构成的物质某些物理性质的影响。一、化学键
1.概念:通常指物质中_____________________之 间存在的_______________。
2.常见类别:_____键和_____键。
二、离子键
1.离子化合物:由___________通过________形成 的化合物。
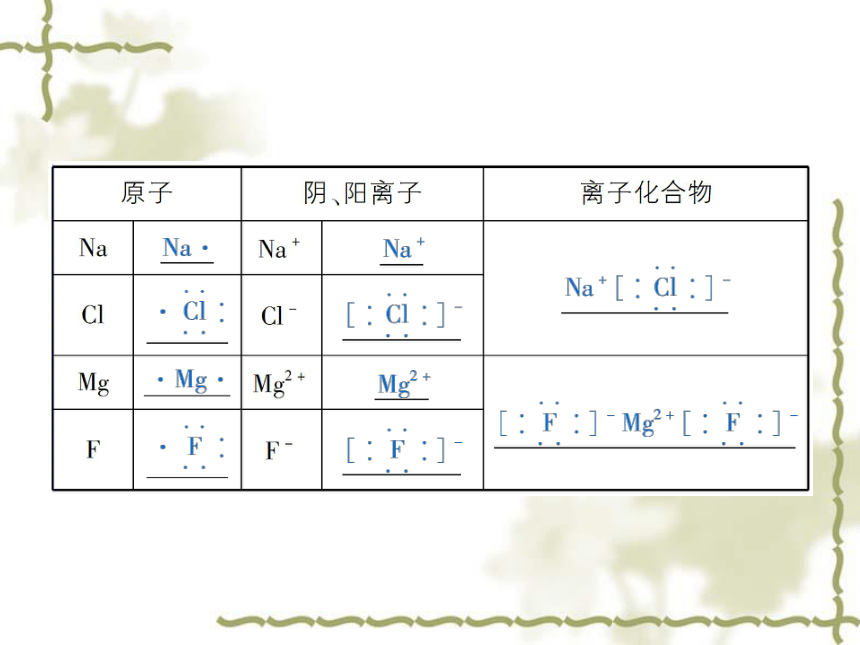
2.离子键:使带相反电荷的阴、阳离子结合的 _________。直接相邻的原子或离子强烈的相互作用离子共价阴、阳离子静电作用相互作用3.电子式
(1)概念:在元素符号周围用“·”或“×”来表示原子、离子的最外电子层电子排布的式子。
(2)典型实例三、共价键
1.共价键
(1)概念:原子间通过___________所形成的强烈 的相互作用。
(2)形成过程:两种_______元素相互化合时,原子 间共用_________的电子,形成___________,以达 到_____的电子层结构,___________同时受到两 个原子核的吸引。
2.共价化合物
分子中直接相邻的原子间均以_______相结合的 化合物。共用电子对非金属最外层上共用电子对稳定共用电子对共价键3.常见共价分子的表示方法4.有机化合物中碳原子的成键方式四、分子间作用力
1.分子间作用力
(1)概念:将分子___________的作用力。
(2)特点:比化学键___得多。
(3)对物质性质的影响
分子间作用力影响由分子构成的物质的_______ __和_______。
2.氢键
存在于某些氢化物分子(如H2O)之间的较强的 作用。聚集在一起弱熔、沸点溶解性一、化学键
化学键存在于什么类型的物质中?[师生互动]
【提示】 (1)构成稀有气体的单质分子,由于原子已形成稳定结构,在这些单原子分子中不存在化学键。
(2)在离子化合物中一定含有离子键,可能含有共价键。如K2O2、NaOH、NH4Cl等离子化合物中既有离子键又有共价键。(3)在共价化合物中一定不存在离子键。
(4)离子化合物不一定都由金属元素和非金属元素组成。例如NH4Cl、NH4NO3等离子化合物中不含金属元素,只含非金属元素。
(5)共价化合物可能含有金属元素,如AlCl3等。[师生互动]
【提示】 离子键、共价键的比较[师生互动]
【提示】 离子化合物与共价化合物(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是____________;
D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为________,电子式为________,化学键类型为______________(填“离子键”、“非极性共价键”或“极性共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成________,其化学键类型为________;加热时生成________,其化学键类型为________________,电子式为________。【点评】 先分析化合物类型,然后分析化学键的类型。【答案】 B[师生互动]
【提示】 化学键、分子间作用力及氢键的区别
[师生互动]
【提示】 (1)化学反应过程
①化学反应过程中反应物一定有化学键被破坏,同时也有新化学键生成。
如H2+F2===2HF,H—H键、F—F键均被破坏,H—F键生成。
②化学反应时,并不是反应物中所有的化学键都被破坏,如(NH4)2SO4+BaCl2===BaSO4↓+2NH4Cl,只破坏反应物中的离子键,而共价键未被破坏。(2)离子化合物的溶解或熔化过程
对于离子化合物,溶于水或熔化后均电离成为自由的阴、阳离子,离子键被破坏。
(3)共价化合物的溶解或熔化过程
①溶解过程
a.有些共价化合物溶于水后,能与水反应,其分子内共价键被破坏。例如:CO2、SO3等。
b.有些共价化合物溶于水后,发生电离,形成阴、阳离子,其分子内的共价键被破坏。例如:HCl、H2SO4等强酸。
c.某些共价化合物溶于水后,其分子内的化学键不被破坏。例如:蔗糖(C12H22O11)、酒精(C2H5OH)等。②熔化过程
a.由分子构成的共价化合物,熔化时只破坏分子间作用力,而不破坏化学键。
b.由原子构成的共价化合物,如SiO2,熔化时破坏共价键。
(4)单质的熔化或溶解过程
①由分子构成的固体单质,如I2的升华、P4的熔化只破坏分子间作用力,而不破坏化学键。
②由原子构成的单质,如金刚石、晶体硅、熔化时破坏共价键。
③对于某些活泼的非金属单质,溶于水后,能与水反应,其分子内共价键被破坏,如Cl2、F2等。试根据上表回答下列问题:
(1)常温下,a为______色液体;b的分子式为:________。
(2)写出②系列中物质主要化学性质的递变规律______________________________________________________(任写一种)。
(3)除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是________________________________。
(4)上表中,________和________两种物质的沸点较同系列其他物质反常,反常的主要原因是
________________________。【思路点拨】 解答本题要明确如下三点:
(1)各组物质组成和结构的特点。
(2)各组物质沸点的总体变化趋势及其原因。
(3)沸点变化反常的物质及其原因。【尝试解答】 表中所给的是四种同族元素的单质和气态氢化物的沸点,同主族非金属元素的性质随着原子序数的递增,单质的氧化性越来越弱,氢化物的稳定性越来越弱,最高价氧化物对应的水化物的酸性越来越弱。同族非金属元素的单质和气态氢化物的组成和结构相似,随着原子序数的递增,相对分子质量逐渐增大,分子间作用力逐渐增大,熔沸点逐渐升高。但是HF、H2O分子间存在氢键,使沸点反常的高。【答案】 (1)深红棕 H2Se
(2)单质的氧化性越来越弱或氢化物的稳定性越来越弱(或其他合理答案)
(3)相对分子质量越大,熔沸点越高
(4)HF H2O 分子间存在氢键,所以熔沸点较高⑤NaOH和HCl反应时形成________和________。
⑥反应2H2+O2===2H2O中,被破坏的是____________,形成的是________。
⑦CaCl2和Na2CO3反应时,被破坏的化学键有________,形成的化学键有________。
⑧Na2O熔化时被破坏的是________。(2)下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是________。
A.NH4Cl===NH3↑+HCl↑
B.NH3+CO2+H2O===NH4HCO3
C.2NaOH+Cl2===NaCl+NaClO+H2O
D.2Na2O2+2CO2===2Na2CO3+O2【解析】 (1)NaCl、HCl、SO2中分别含有离子键、极性键、极性键,溶于水时被破坏相应的化学键;酒精溶于水时只破坏分子间作用力;可解决①、②、③、④;而⑤、⑥、⑦是考查化学变化中化学键的变化情况,根据各物质中的化学键类型判断即可;⑧中Na2O是离子化合物,熔化时破坏离子键。
(2)解决此小题时注意题干要求;在同一个反应中,既要有三种化学键的断裂,还要有三种化学键的形成,只有D项符合题意。【答案】 (1)①离子键 ②极性键 ③极性键 ④分子间作用力 ⑤离子键 极性键 ⑥非极性键 极性键 ⑦离子键 离子键 ⑧离子键 (2)D1.知识小结2.规律点拨
(1)存在离子键的化合物一定是离子化合物。共价化合物中只含共价键,不含离子键,只含共价键的物质不一定是共价化合物,可能是非金属单质。
(2)化学键被破坏的变化,不一定是化学变化,如NaCl、金刚石的受热熔化、NaCl溶于水等。只有旧化学键的断裂而没有新键的生成,故不是化学变化。【答案】 A2.(2010年海南化学卷)短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。下列化合物中同时存在极性和非极性共价键的是( )
A.Z2Y B.X2Y2
C.Z2Y2 D.ZYX【解析】 Y2-与Z+核外电子层结构相同,且Y、Z为短周期元素,二者原子序数之和小于20,可推知Y为O元素,Z为Na元素,从而推出X为H元素,A项Na2O只含离子键,B项H2O2既含极性共价键又含非极性共价键,C项Na2O2含离子键和非极性共价键,D项NaOH含离子键和极性共价键。
【答案】 B【解析】 氢键是某些氢化物(NH3、H2O、HF)分子间存在的比分子间作用力稍强的作用力,它的存在使氢化物的熔点、沸点相对较高,因此HF的沸点高是由氢键所致,A项正确;水在结冰时体积膨胀是由于水分子大范围的以氢键互相联结,形成相对疏松的晶体,从而在结构上有许多空隙,造成体积膨胀,B项正确;NH3的稳定性取决于N—H键,而不是氢键,C项不正确;氨分子和水分子之间主要是以氢键结合的,故D项正确。
【答案】 C4.下列各组物质中,化学键类型相同,熔化时所克服的作用力也完全相同的是( )
A.CO2和SiO2
B.NaCl和HCl
C.(NH4)2CO3和CO(NH2)2
D.NaH和KCl
【解析】只有D中两种物质具有相同的晶型,都是由离子键构成的离子化合物,所以熔化时所克服作用力相同。其中C选项中CO(NH2)2为尿素,是共价分子,而(NH4)2CO3则为离子化合物。
【答案】 D5.(2009年郑州高一统考)在下列物质中:①CO2 ②KCl ③CaBr2
④O2 ⑤NH4Cl ⑥Ca(OH)2 ⑦N2 ⑧HBr ⑨NH3 ⑩Na2O2
试用以上编号填空:
(1)只有非极性键的是________;
(2)只有极性键的是________;
(3)只有离子键的是________;
(4)有离子键,也有非极性键的是________;
(5)既有离子键,又有极性键的是________;
(6)属于离子化合物的是________;
(7)属于共价化合物的是________。【解析】 本题考查离子键、共价键的形成条件以及极性键、非极性键的形成条件。应特别注意在某些离子化合物中也存在共价键。
【答案】 (1)④⑦ (2)①⑧⑨ (3)②③ (4)⑩ (5)⑤⑥ (6)②③⑤⑥⑩ (7)①⑧⑨6.已知五种元素的原子序数大小顺序为C>A>B>D>E,A、C同周期,B、C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子的分子。
试回答下列问题:
(1)写出五种元素的名称:A________,B________,C________,D________,E________。(2)用电子式表示离子化合物A2B的形成过程:
________________________________________________________________________。
(3)写出下列物质的电子式:
D元素形成的单质________;
E与B形成的化合物________;
A、B、E形成的含有三个原子的化合物________________________________________________________________________;
D与E形成的共价化合物________。【解析】 (1)因为A、B离子的电子数相同,在电子总数为30的A2B型离子化合物中,每个离子的电子数为10个,故可推知A是Na,B是O。分子只有4个原子核共10个电子,则一定是NH3。原子序数D>E,故D为N,E为H。C与A(Na)同周期,与B(O)同主族,所以C位于第三周期第ⅥA族,为S。练规范、练技能、练速度
2.从碳的成键特点认识有机化合物的多样性。
3.了解可用球棍模型和比例模型表示分子的结构。
4.了解分子间作用力对由分子构成的物质某些物理性质的影响。一、化学键
1.概念:通常指物质中_____________________之 间存在的_______________。
2.常见类别:_____键和_____键。
二、离子键
1.离子化合物:由___________通过________形成 的化合物。
2.离子键:使带相反电荷的阴、阳离子结合的 _________。直接相邻的原子或离子强烈的相互作用离子共价阴、阳离子静电作用相互作用3.电子式
(1)概念:在元素符号周围用“·”或“×”来表示原子、离子的最外电子层电子排布的式子。
(2)典型实例三、共价键
1.共价键
(1)概念:原子间通过___________所形成的强烈 的相互作用。
(2)形成过程:两种_______元素相互化合时,原子 间共用_________的电子,形成___________,以达 到_____的电子层结构,___________同时受到两 个原子核的吸引。
2.共价化合物
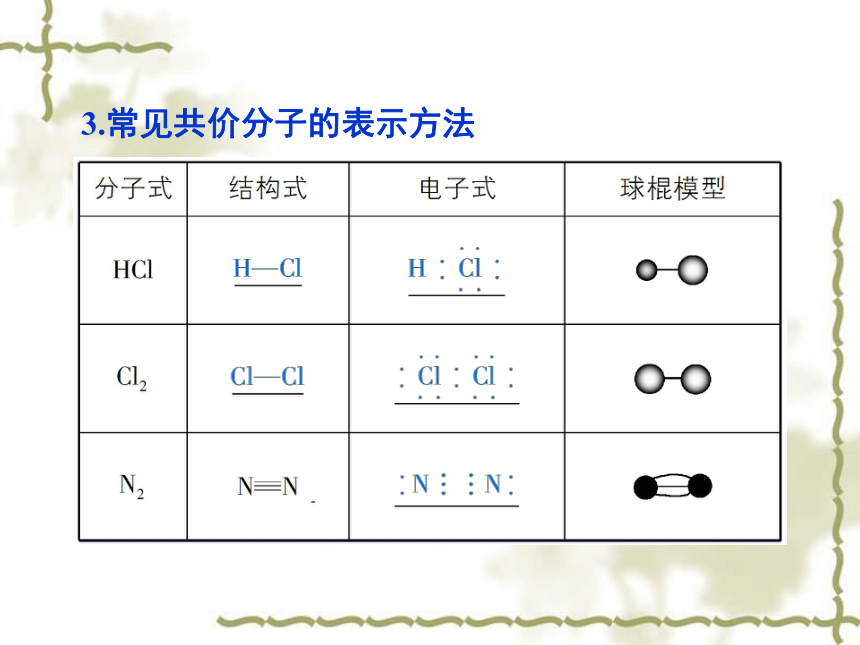
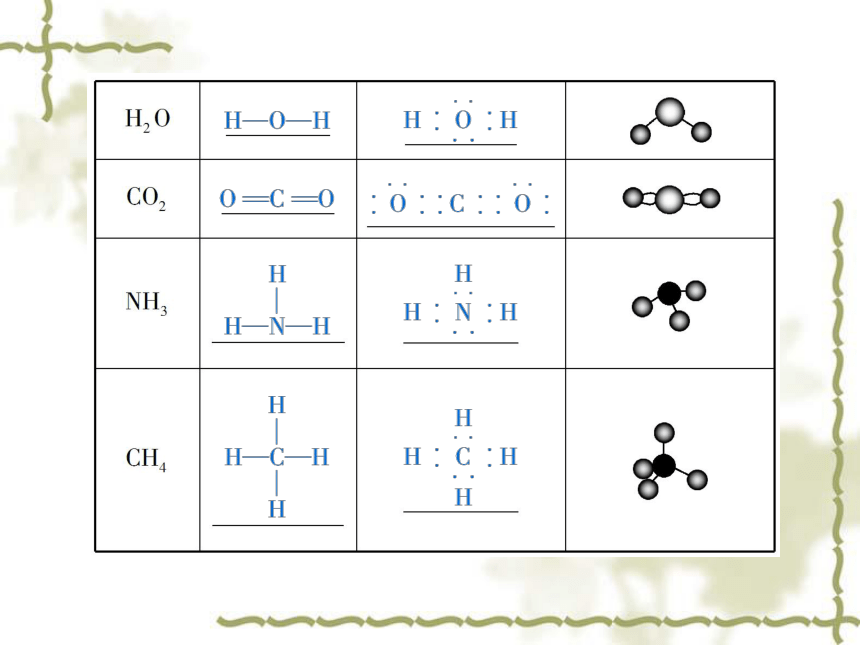
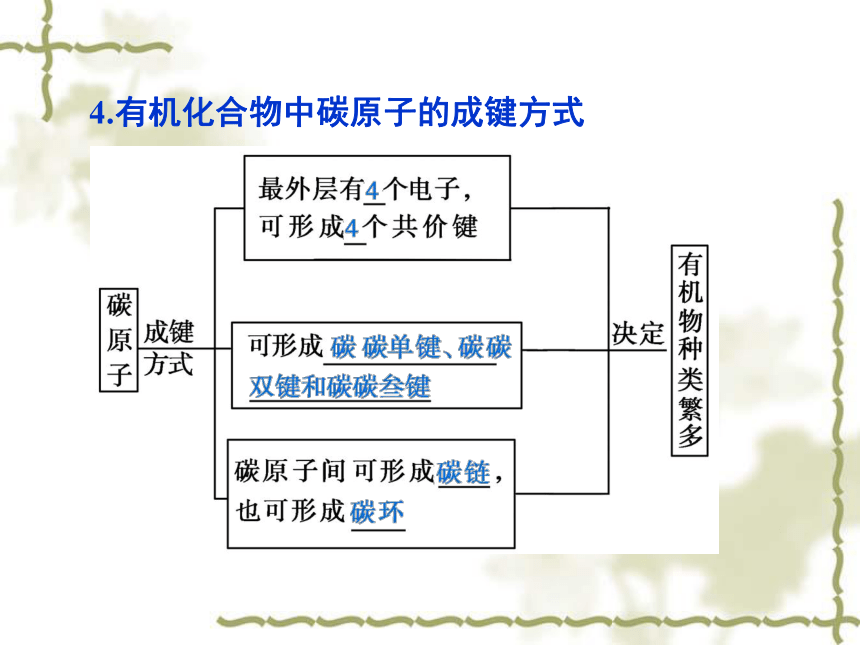
分子中直接相邻的原子间均以_______相结合的 化合物。共用电子对非金属最外层上共用电子对稳定共用电子对共价键3.常见共价分子的表示方法4.有机化合物中碳原子的成键方式四、分子间作用力
1.分子间作用力
(1)概念:将分子___________的作用力。
(2)特点:比化学键___得多。
(3)对物质性质的影响
分子间作用力影响由分子构成的物质的_______ __和_______。
2.氢键
存在于某些氢化物分子(如H2O)之间的较强的 作用。聚集在一起弱熔、沸点溶解性一、化学键
化学键存在于什么类型的物质中?[师生互动]
【提示】 (1)构成稀有气体的单质分子,由于原子已形成稳定结构,在这些单原子分子中不存在化学键。
(2)在离子化合物中一定含有离子键,可能含有共价键。如K2O2、NaOH、NH4Cl等离子化合物中既有离子键又有共价键。(3)在共价化合物中一定不存在离子键。
(4)离子化合物不一定都由金属元素和非金属元素组成。例如NH4Cl、NH4NO3等离子化合物中不含金属元素,只含非金属元素。
(5)共价化合物可能含有金属元素,如AlCl3等。[师生互动]
【提示】 离子键、共价键的比较[师生互动]
【提示】 离子化合物与共价化合物(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是____________;
D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为________,电子式为________,化学键类型为______________(填“离子键”、“非极性共价键”或“极性共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成________,其化学键类型为________;加热时生成________,其化学键类型为________________,电子式为________。【点评】 先分析化合物类型,然后分析化学键的类型。【答案】 B[师生互动]
【提示】 化学键、分子间作用力及氢键的区别
[师生互动]
【提示】 (1)化学反应过程
①化学反应过程中反应物一定有化学键被破坏,同时也有新化学键生成。
如H2+F2===2HF,H—H键、F—F键均被破坏,H—F键生成。
②化学反应时,并不是反应物中所有的化学键都被破坏,如(NH4)2SO4+BaCl2===BaSO4↓+2NH4Cl,只破坏反应物中的离子键,而共价键未被破坏。(2)离子化合物的溶解或熔化过程
对于离子化合物,溶于水或熔化后均电离成为自由的阴、阳离子,离子键被破坏。
(3)共价化合物的溶解或熔化过程
①溶解过程
a.有些共价化合物溶于水后,能与水反应,其分子内共价键被破坏。例如:CO2、SO3等。
b.有些共价化合物溶于水后,发生电离,形成阴、阳离子,其分子内的共价键被破坏。例如:HCl、H2SO4等强酸。
c.某些共价化合物溶于水后,其分子内的化学键不被破坏。例如:蔗糖(C12H22O11)、酒精(C2H5OH)等。②熔化过程
a.由分子构成的共价化合物,熔化时只破坏分子间作用力,而不破坏化学键。
b.由原子构成的共价化合物,如SiO2,熔化时破坏共价键。
(4)单质的熔化或溶解过程
①由分子构成的固体单质,如I2的升华、P4的熔化只破坏分子间作用力,而不破坏化学键。
②由原子构成的单质,如金刚石、晶体硅、熔化时破坏共价键。
③对于某些活泼的非金属单质,溶于水后,能与水反应,其分子内共价键被破坏,如Cl2、F2等。试根据上表回答下列问题:
(1)常温下,a为______色液体;b的分子式为:________。
(2)写出②系列中物质主要化学性质的递变规律______________________________________________________(任写一种)。
(3)除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是________________________________。
(4)上表中,________和________两种物质的沸点较同系列其他物质反常,反常的主要原因是
________________________。【思路点拨】 解答本题要明确如下三点:
(1)各组物质组成和结构的特点。
(2)各组物质沸点的总体变化趋势及其原因。
(3)沸点变化反常的物质及其原因。【尝试解答】 表中所给的是四种同族元素的单质和气态氢化物的沸点,同主族非金属元素的性质随着原子序数的递增,单质的氧化性越来越弱,氢化物的稳定性越来越弱,最高价氧化物对应的水化物的酸性越来越弱。同族非金属元素的单质和气态氢化物的组成和结构相似,随着原子序数的递增,相对分子质量逐渐增大,分子间作用力逐渐增大,熔沸点逐渐升高。但是HF、H2O分子间存在氢键,使沸点反常的高。【答案】 (1)深红棕 H2Se
(2)单质的氧化性越来越弱或氢化物的稳定性越来越弱(或其他合理答案)
(3)相对分子质量越大,熔沸点越高
(4)HF H2O 分子间存在氢键,所以熔沸点较高⑤NaOH和HCl反应时形成________和________。
⑥反应2H2+O2===2H2O中,被破坏的是____________,形成的是________。
⑦CaCl2和Na2CO3反应时,被破坏的化学键有________,形成的化学键有________。
⑧Na2O熔化时被破坏的是________。(2)下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是________。
A.NH4Cl===NH3↑+HCl↑
B.NH3+CO2+H2O===NH4HCO3
C.2NaOH+Cl2===NaCl+NaClO+H2O
D.2Na2O2+2CO2===2Na2CO3+O2【解析】 (1)NaCl、HCl、SO2中分别含有离子键、极性键、极性键,溶于水时被破坏相应的化学键;酒精溶于水时只破坏分子间作用力;可解决①、②、③、④;而⑤、⑥、⑦是考查化学变化中化学键的变化情况,根据各物质中的化学键类型判断即可;⑧中Na2O是离子化合物,熔化时破坏离子键。
(2)解决此小题时注意题干要求;在同一个反应中,既要有三种化学键的断裂,还要有三种化学键的形成,只有D项符合题意。【答案】 (1)①离子键 ②极性键 ③极性键 ④分子间作用力 ⑤离子键 极性键 ⑥非极性键 极性键 ⑦离子键 离子键 ⑧离子键 (2)D1.知识小结2.规律点拨
(1)存在离子键的化合物一定是离子化合物。共价化合物中只含共价键,不含离子键,只含共价键的物质不一定是共价化合物,可能是非金属单质。
(2)化学键被破坏的变化,不一定是化学变化,如NaCl、金刚石的受热熔化、NaCl溶于水等。只有旧化学键的断裂而没有新键的生成,故不是化学变化。【答案】 A2.(2010年海南化学卷)短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。下列化合物中同时存在极性和非极性共价键的是( )
A.Z2Y B.X2Y2
C.Z2Y2 D.ZYX【解析】 Y2-与Z+核外电子层结构相同,且Y、Z为短周期元素,二者原子序数之和小于20,可推知Y为O元素,Z为Na元素,从而推出X为H元素,A项Na2O只含离子键,B项H2O2既含极性共价键又含非极性共价键,C项Na2O2含离子键和非极性共价键,D项NaOH含离子键和极性共价键。
【答案】 B【解析】 氢键是某些氢化物(NH3、H2O、HF)分子间存在的比分子间作用力稍强的作用力,它的存在使氢化物的熔点、沸点相对较高,因此HF的沸点高是由氢键所致,A项正确;水在结冰时体积膨胀是由于水分子大范围的以氢键互相联结,形成相对疏松的晶体,从而在结构上有许多空隙,造成体积膨胀,B项正确;NH3的稳定性取决于N—H键,而不是氢键,C项不正确;氨分子和水分子之间主要是以氢键结合的,故D项正确。
【答案】 C4.下列各组物质中,化学键类型相同,熔化时所克服的作用力也完全相同的是( )
A.CO2和SiO2
B.NaCl和HCl
C.(NH4)2CO3和CO(NH2)2
D.NaH和KCl
【解析】只有D中两种物质具有相同的晶型,都是由离子键构成的离子化合物,所以熔化时所克服作用力相同。其中C选项中CO(NH2)2为尿素,是共价分子,而(NH4)2CO3则为离子化合物。
【答案】 D5.(2009年郑州高一统考)在下列物质中:①CO2 ②KCl ③CaBr2
④O2 ⑤NH4Cl ⑥Ca(OH)2 ⑦N2 ⑧HBr ⑨NH3 ⑩Na2O2
试用以上编号填空:
(1)只有非极性键的是________;
(2)只有极性键的是________;
(3)只有离子键的是________;
(4)有离子键,也有非极性键的是________;
(5)既有离子键,又有极性键的是________;
(6)属于离子化合物的是________;
(7)属于共价化合物的是________。【解析】 本题考查离子键、共价键的形成条件以及极性键、非极性键的形成条件。应特别注意在某些离子化合物中也存在共价键。
【答案】 (1)④⑦ (2)①⑧⑨ (3)②③ (4)⑩ (5)⑤⑥ (6)②③⑤⑥⑩ (7)①⑧⑨6.已知五种元素的原子序数大小顺序为C>A>B>D>E,A、C同周期,B、C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子的分子。
试回答下列问题:
(1)写出五种元素的名称:A________,B________,C________,D________,E________。(2)用电子式表示离子化合物A2B的形成过程:
________________________________________________________________________。
(3)写出下列物质的电子式:
D元素形成的单质________;
E与B形成的化合物________;
A、B、E形成的含有三个原子的化合物________________________________________________________________________;
D与E形成的共价化合物________。【解析】 (1)因为A、B离子的电子数相同,在电子总数为30的A2B型离子化合物中,每个离子的电子数为10个,故可推知A是Na,B是O。分子只有4个原子核共10个电子,则一定是NH3。原子序数D>E,故D为N,E为H。C与A(Na)同周期,与B(O)同主族,所以C位于第三周期第ⅥA族,为S。练规范、练技能、练速度
