专题7初识酸、碱和盐检测题-2021-2022学年九年级化学仁爱版下册(word版有答案)
文档属性
| 名称 | 专题7初识酸、碱和盐检测题-2021-2022学年九年级化学仁爱版下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 305.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-01 23:33:50 | ||
图片预览


文档简介
专题7《初识酸、碱和盐》检测题
一、单选题
1.下列事实中,利用物质化学性质的是
A.稀有气体制成霓虹灯 B.盐酸除锈
C.铜作导线 D.铁铸成锅
2.推理是学习化学的重要思维方法,下列推理中合理的是
A.碱溶液pH>7,所以pH>7的溶液均为碱溶液
B.溶液是均一、稳定的混合物,但均一、稳定的物质不一定是溶液
C.洗涤剂去油污是利用了乳化作用,汽油去油污也是利用了乳化作用
D.碳酸盐与盐酸反应都有气体生成,与盐酸反应有气体生成的物质一定是碳酸盐
3.下列过程中发生化学为变化的是
A.海水晒盐 B.自制汽水
C.将金属制成不同形状 D.氢氧化钠固体潮解
4.安全无小事。无论做任何事,我们都应树立安全意识。下列做法符合安全要求的是
A.使用酒精炉吃火锅时,直接向燃着的酒精炉内添加酒精
B.发现家中天然气泄露时,立即打电话报警
C.不慎将浓硫酸沾到皮肤上,立即用大量的水冲洗,然后涂上3%~5%的碳酸氢钠溶液
D.厨房炒菜时,油锅着火,立即向锅内加水灭火
5.水与甲、乙、丙物质转化关系如右下图,甲为单质,乙为化合物。下列说法错误的是
A.若反应①为电解水,负极产生的气体是甲,则甲是H2
B.若甲为O2,则反应①可以通过植物的光合作用实现
C.若乙能使紫色石蕊试液变红,则乙可能是H2CO3
D.若丙能在甲中燃烧,则丙不可能是单质
6.通过实验以及对实验现象的观察、记录和分析,可以发现和验证化学原理。下面是小兰同学在完成酸、碱的性质实验时记录的部分实验现象,其中正确的是( )
A.打开盛有浓盐酸的试剂瓶瓶盖,瓶口有白烟产生
B.向氧化铁中加入足量稀硫酸,红棕色固体溶解,溶液由无色变成浅绿色
C.向氯化铜溶液中加入几滴氢氧化钠溶液,产生蓝色沉淀
D.将尿素与熟石灰混合研磨,有刺激性气味的氨气生成
7.下图是工业上制硝酸发生的主要反应之一,相关说法正确的是
A.参加反应的a和b的分子个数比为2:3
B.该反应中b物质由原子构成
C.物质a可使紫色石蕊溶液变蓝
D.催化剂在化学反应前后质量和性质均不变
8.今年秋粮又获丰收,再显中国饭碗自信,其中化肥和农药功不可没。下列说法错误的是
A.Ca3(PO4)2可以促进作物生长,增强作物的抗寒、抗旱能力
B.硝酸钾属于钾肥
C.含氮量为40%的尿素【CO(NH2)2】化肥样品为混合物
D.大量施用化肥和农药会造成环境污染
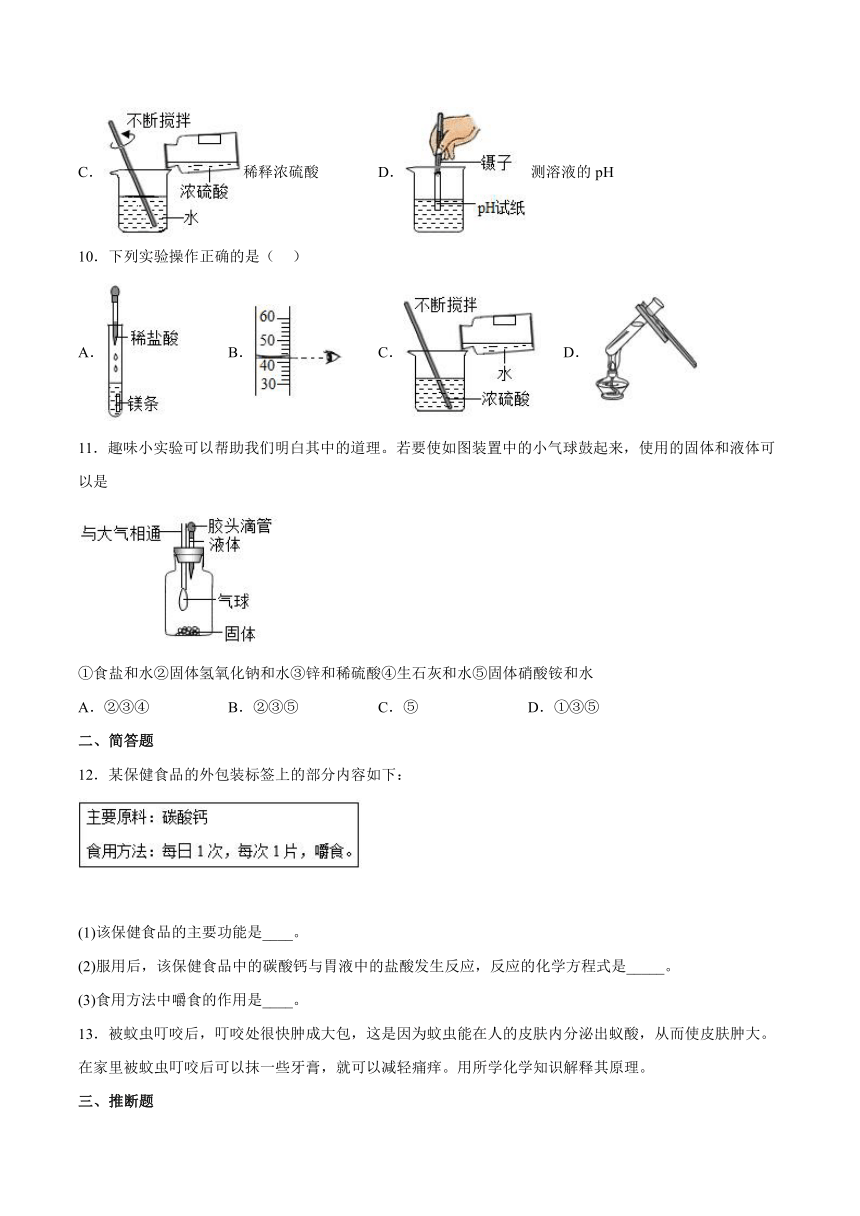
9.下列实验操作正确的是
A.移走蒸发皿 B.点燃酒精灯
C.稀释浓硫酸 D.测溶液的pH
10.下列实验操作正确的是( )
A. B. C. D.
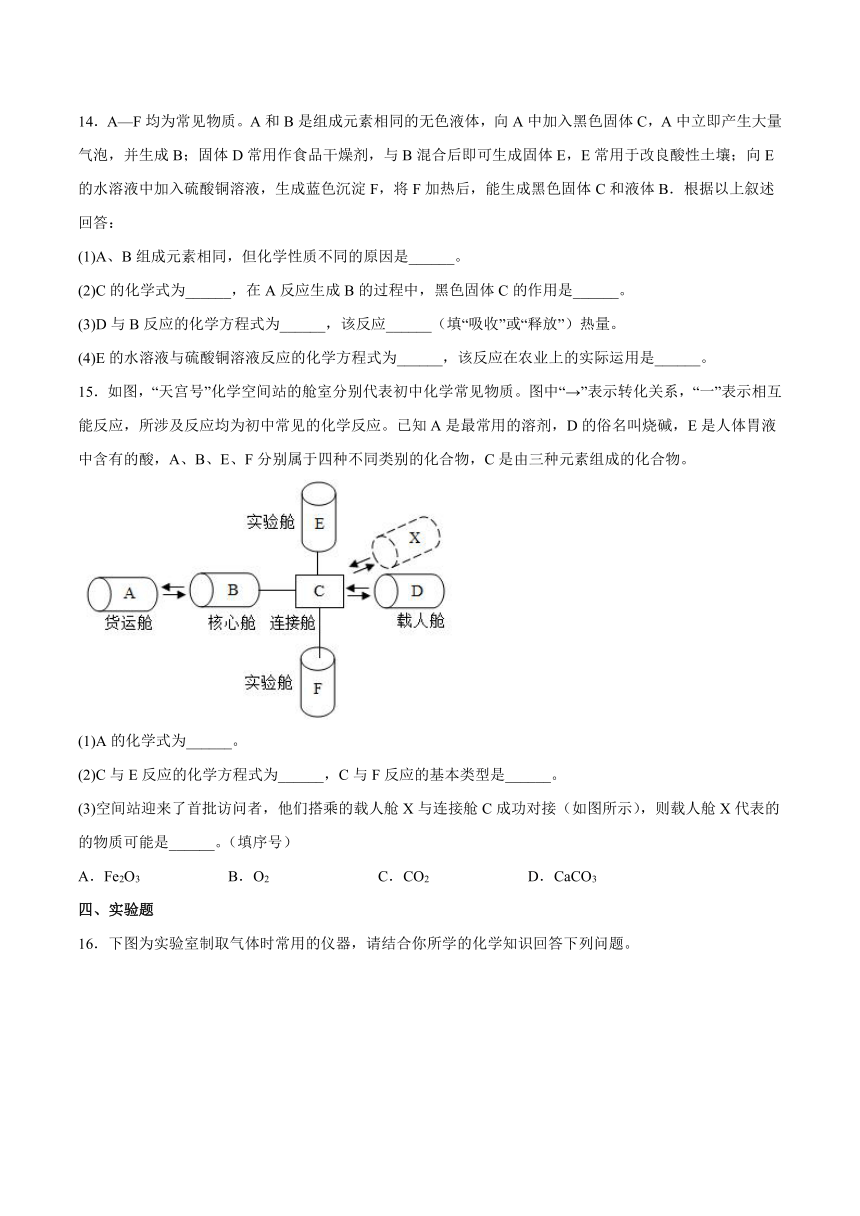
11.趣味小实验可以帮助我们明白其中的道理。若要使如图装置中的小气球鼓起来,使用的固体和液体可以是
①食盐和水②固体氢氧化钠和水③锌和稀硫酸④生石灰和水⑤固体硝酸铵和水
A.②③④ B.②③⑤ C.⑤ D.①③⑤
二、简答题
12.某保健食品的外包装标签上的部分内容如下:
(1)该保健食品的主要功能是____。
(2)服用后,该保健食品中的碳酸钙与胃液中的盐酸发生反应,反应的化学方程式是_____。
(3)食用方法中嚼食的作用是____。
13.被蚊虫叮咬后,叮咬处很快肿成大包,这是因为蚊虫能在人的皮肤内分泌出蚁酸,从而使皮肤肿大。在家里被蚊虫叮咬后可以抹一些牙膏,就可以减轻痛痒。用所学化学知识解释其原理。
三、推断题
14.A—F均为常见物质。A和B是组成元素相同的无色液体,向A中加入黑色固体C,A中立即产生大量气泡,并生成B;固体D常用作食品干燥剂,与B混合后即可生成固体E,E常用于改良酸性土壤;向E的水溶液中加入硫酸铜溶液,生成蓝色沉淀F,将F加热后,能生成黑色固体C和液体B.根据以上叙述回答:
(1)A、B组成元素相同,但化学性质不同的原因是______。
(2)C的化学式为______,在A反应生成B的过程中,黑色固体C的作用是______。
(3)D与B反应的化学方程式为______,该反应______(填“吸收”或“释放”)热量。
(4)E的水溶液与硫酸铜溶液反应的化学方程式为______,该反应在农业上的实际运用是______。
15.如图,“天宫号”化学空间站的舱室分别代表初中化学常见物质。图中“→”表示转化关系,“一”表示相互能反应,所涉及反应均为初中常见的化学反应。已知A是最常用的溶剂,D的俗名叫烧碱,E是人体胃液中含有的酸,A、B、E、F分别属于四种不同类别的化合物,C是由三种元素组成的化合物。
(1)A的化学式为______。
(2)C与E反应的化学方程式为______,C与F反应的基本类型是______。
(3)空间站迎来了首批访问者,他们搭乘的载人舱X与连接舱C成功对接(如图所示),则载人舱X代表的的物质可能是______。(填序号)
A.Fe2O3 B.O2 C.CO2 D.CaCO3
四、实验题
16.下图为实验室制取气体时常用的仪器,请结合你所学的化学知识回答下列问题。
(1)仪器①的名称___________。
(2)写出用与的混合固体制取的化学方程式:___________;若用A装置作为发生装置,还缺少___________(填仪器名称)。
(3)实验室制取的化学方程式是___________。选择___________和D组合作为制取和收集装置,其突出优点是可以随时控制反应的发生和停止。
(4)将和的混合气体通过F装置进行净化,最终得到的气体是___________(选填字母)。
A.、 B. C. D.、
(5)实验室常用块状固体电石(主要成分是)与水反应制取乙炔(),该反应很剧烈,应选择的发生装置是___________(选填字母)。通常情况下乙炔是一种无色、无味的气体,密度比空气略小,难溶于水,若要收集较纯净的乙炔气体,则应将气体从___________(选填“a” “b” “c”或“d”)通入。
17.下图是实验室制取、净化、干燥气体的常用装置。回答下列问题:
(1)图中标号①的仪器名称是______。
(2)实验室用高锰酸钾制取氧气,选取的发生装置为______(填字母代号);若用D装置收集O2,验满的方法是______。
(3)为除去制得的CO2中混入的HCl气体和水蒸气,得到纯净、干燥的二氧化碳,小聪同学设计了除杂实验。请你完成装置连接:A→______→______→D(选填标号)。(已知:)
18.今有A、B、C、D、E五种装置如下图所示。按下列要求回答问题(所选装置用其代号字母表示)
(1)实验室用高锰酸钾加热分解来制取氧气时,发生装置选用_______,该装置制取氧气的化学方程式为_________。
(2)实验室用大理石和稀盐酸来制取二氧化碳时,发生装置选用_____,收集装置常选用 ________;检验二氧化碳气体是否收集满把燃着的木条伸到_______。
(3)硫化氢(H2S)是一种无色且有臭鸡蛋气味的气体,密度比空气大,能溶于水,可形成一种酸溶液(氢硫酸)。实验室用硫化亚铁跟稀硫酸反应制取硫化氢气体。试回答:
①硫化氢气体具有臭鸡蛋味,这是硫化氢的_____(填“物理”或“化学”)性质。
②硫化氢的水溶液能使紫色石蕊试液变______色。
③实验室制取硫化氢气体时,发生装置应选用_____,收集装置应选用_____。
五、计算题
19.某课外活动小组对失去标签的稀硫酸浓度进行测定:取稀硫酸50.00g于烧杯中,逐滴滴加3.42%的氢氧化钡溶液,烧杯内溶质质量与滴加氢氧化钡溶液质量关系如图所示。(结果保留两位小数)。
(1)当滴加Ba(OH)2溶液50g时烧杯内溶液的pH__________7(填“>”“<”或“=”)。
(2)求该硫酸溶液的溶质质量分数_____。(结果保留0.01%)。
20.为了测定碳酸钠样品中碳酸钠的质量分数(杂质不溶于水,也不参与反应),进行了如下实验,回答下列问题:
(1)反应生成二氧化碳的质量为___________g。
(2)求原样品中碳酸钠的质量分数。
21.为测定氯化钠和氯化镁固体混合物中氯化镁的质量分数。某同学取固体混合物38.0g,向其中加入105.6g水,使其完全溶解配制成混合溶液。将100g一定溶质质量分数的氢氧化钠溶液滴入到上述混合溶液中,生成沉淀的质量与滴入氢氧化钠溶液的质量关系如图所示。
请计算:
(1)图中a的值为 。
(2)恰好完全反应时,所得不饱和溶液中溶质的质量分数(写出计算过程,结果精确到0.1%)。
参考答案:
1.B 2.B 3.B 4.C 5.D 6.C 7.C 8.B 9.C 10.B 11.C
12.(1)可以向人体内补充钙元素
(2)CaCO3+2HCl═CaCl2+CO2↑+H2O
(3)增大反应物的接触面积,促进钙的吸收
13.蚊虫分泌液显酸性,牙膏显弱碱性,二者接触发生中和反应,所以可减轻痛痒
14.(1)它们的分子构成不同(或它们由不同的分子构成)
(2) CuO 催化作用(或加快反应速度)
(3) CaO+H2O=Ca(OH)2 释放
(4) Ca(OH)2+CuSO4=Cu(OH)2↓+CaSO4 配制波尔多液
15.(1)H2O
(2)
复分解反应
(3)C
16.(1)分液漏斗
(2)
酒精灯
(3) CaCO3+2HCl=CaCl2+H2O+CO2↑ C
(4)C
(5) B d
17.(1)酒精灯
(2) B 用带火星的木条放置在集气瓶口,木条复燃,说明氧气已收满
(3) G E
18.(1) A 2KMnO4K2MnO4+MnO2+O2↑
(2) B C 集气瓶口处
(3) 物理 红 B C
19.(1)<
(2)3.92%
解:由图可知,加入100g氢氧化钡溶液两者恰好完全反应,设50g稀硫酸中含H2SO4的质量为x,
硫酸溶液的溶质质量分数为×100%=3.92%;
答:硫酸溶液的溶质质量分数3.92%。
20.(1)4.4;
(2)解:设参加反应的碳酸钠的质量为x。
x=10.6g
原样品中碳酸钠的质量分数为:
答:原样品中碳酸钠的质量分数为53%。
21.(1)8.7
(2)解:设氯化镁的质量为x,生成的氯化钠的质量为y,则有
溶液中氯化钠质量为38.0g-19.0g+23.4g=42.4g,溶液质量为38.0g+105.6g+80.0g-11.6g=212g,
恰好完全反应时,所得不饱和溶液中溶质的质量分数为×100%=20.0%;
答:恰好完全反应时,所得不饱和溶液中溶质的质量分数为20.0%。
一、单选题
1.下列事实中,利用物质化学性质的是
A.稀有气体制成霓虹灯 B.盐酸除锈
C.铜作导线 D.铁铸成锅
2.推理是学习化学的重要思维方法,下列推理中合理的是
A.碱溶液pH>7,所以pH>7的溶液均为碱溶液
B.溶液是均一、稳定的混合物,但均一、稳定的物质不一定是溶液
C.洗涤剂去油污是利用了乳化作用,汽油去油污也是利用了乳化作用
D.碳酸盐与盐酸反应都有气体生成,与盐酸反应有气体生成的物质一定是碳酸盐
3.下列过程中发生化学为变化的是
A.海水晒盐 B.自制汽水
C.将金属制成不同形状 D.氢氧化钠固体潮解
4.安全无小事。无论做任何事,我们都应树立安全意识。下列做法符合安全要求的是
A.使用酒精炉吃火锅时,直接向燃着的酒精炉内添加酒精
B.发现家中天然气泄露时,立即打电话报警
C.不慎将浓硫酸沾到皮肤上,立即用大量的水冲洗,然后涂上3%~5%的碳酸氢钠溶液
D.厨房炒菜时,油锅着火,立即向锅内加水灭火
5.水与甲、乙、丙物质转化关系如右下图,甲为单质,乙为化合物。下列说法错误的是
A.若反应①为电解水,负极产生的气体是甲,则甲是H2
B.若甲为O2,则反应①可以通过植物的光合作用实现
C.若乙能使紫色石蕊试液变红,则乙可能是H2CO3
D.若丙能在甲中燃烧,则丙不可能是单质
6.通过实验以及对实验现象的观察、记录和分析,可以发现和验证化学原理。下面是小兰同学在完成酸、碱的性质实验时记录的部分实验现象,其中正确的是( )
A.打开盛有浓盐酸的试剂瓶瓶盖,瓶口有白烟产生
B.向氧化铁中加入足量稀硫酸,红棕色固体溶解,溶液由无色变成浅绿色
C.向氯化铜溶液中加入几滴氢氧化钠溶液,产生蓝色沉淀
D.将尿素与熟石灰混合研磨,有刺激性气味的氨气生成
7.下图是工业上制硝酸发生的主要反应之一,相关说法正确的是
A.参加反应的a和b的分子个数比为2:3
B.该反应中b物质由原子构成
C.物质a可使紫色石蕊溶液变蓝
D.催化剂在化学反应前后质量和性质均不变
8.今年秋粮又获丰收,再显中国饭碗自信,其中化肥和农药功不可没。下列说法错误的是
A.Ca3(PO4)2可以促进作物生长,增强作物的抗寒、抗旱能力
B.硝酸钾属于钾肥
C.含氮量为40%的尿素【CO(NH2)2】化肥样品为混合物
D.大量施用化肥和农药会造成环境污染
9.下列实验操作正确的是
A.移走蒸发皿 B.点燃酒精灯
C.稀释浓硫酸 D.测溶液的pH
10.下列实验操作正确的是( )
A. B. C. D.
11.趣味小实验可以帮助我们明白其中的道理。若要使如图装置中的小气球鼓起来,使用的固体和液体可以是
①食盐和水②固体氢氧化钠和水③锌和稀硫酸④生石灰和水⑤固体硝酸铵和水
A.②③④ B.②③⑤ C.⑤ D.①③⑤
二、简答题
12.某保健食品的外包装标签上的部分内容如下:
(1)该保健食品的主要功能是____。
(2)服用后,该保健食品中的碳酸钙与胃液中的盐酸发生反应,反应的化学方程式是_____。
(3)食用方法中嚼食的作用是____。
13.被蚊虫叮咬后,叮咬处很快肿成大包,这是因为蚊虫能在人的皮肤内分泌出蚁酸,从而使皮肤肿大。在家里被蚊虫叮咬后可以抹一些牙膏,就可以减轻痛痒。用所学化学知识解释其原理。
三、推断题
14.A—F均为常见物质。A和B是组成元素相同的无色液体,向A中加入黑色固体C,A中立即产生大量气泡,并生成B;固体D常用作食品干燥剂,与B混合后即可生成固体E,E常用于改良酸性土壤;向E的水溶液中加入硫酸铜溶液,生成蓝色沉淀F,将F加热后,能生成黑色固体C和液体B.根据以上叙述回答:
(1)A、B组成元素相同,但化学性质不同的原因是______。
(2)C的化学式为______,在A反应生成B的过程中,黑色固体C的作用是______。
(3)D与B反应的化学方程式为______,该反应______(填“吸收”或“释放”)热量。
(4)E的水溶液与硫酸铜溶液反应的化学方程式为______,该反应在农业上的实际运用是______。
15.如图,“天宫号”化学空间站的舱室分别代表初中化学常见物质。图中“→”表示转化关系,“一”表示相互能反应,所涉及反应均为初中常见的化学反应。已知A是最常用的溶剂,D的俗名叫烧碱,E是人体胃液中含有的酸,A、B、E、F分别属于四种不同类别的化合物,C是由三种元素组成的化合物。
(1)A的化学式为______。
(2)C与E反应的化学方程式为______,C与F反应的基本类型是______。
(3)空间站迎来了首批访问者,他们搭乘的载人舱X与连接舱C成功对接(如图所示),则载人舱X代表的的物质可能是______。(填序号)
A.Fe2O3 B.O2 C.CO2 D.CaCO3
四、实验题
16.下图为实验室制取气体时常用的仪器,请结合你所学的化学知识回答下列问题。
(1)仪器①的名称___________。
(2)写出用与的混合固体制取的化学方程式:___________;若用A装置作为发生装置,还缺少___________(填仪器名称)。
(3)实验室制取的化学方程式是___________。选择___________和D组合作为制取和收集装置,其突出优点是可以随时控制反应的发生和停止。
(4)将和的混合气体通过F装置进行净化,最终得到的气体是___________(选填字母)。
A.、 B. C. D.、
(5)实验室常用块状固体电石(主要成分是)与水反应制取乙炔(),该反应很剧烈,应选择的发生装置是___________(选填字母)。通常情况下乙炔是一种无色、无味的气体,密度比空气略小,难溶于水,若要收集较纯净的乙炔气体,则应将气体从___________(选填“a” “b” “c”或“d”)通入。
17.下图是实验室制取、净化、干燥气体的常用装置。回答下列问题:
(1)图中标号①的仪器名称是______。
(2)实验室用高锰酸钾制取氧气,选取的发生装置为______(填字母代号);若用D装置收集O2,验满的方法是______。
(3)为除去制得的CO2中混入的HCl气体和水蒸气,得到纯净、干燥的二氧化碳,小聪同学设计了除杂实验。请你完成装置连接:A→______→______→D(选填标号)。(已知:)
18.今有A、B、C、D、E五种装置如下图所示。按下列要求回答问题(所选装置用其代号字母表示)
(1)实验室用高锰酸钾加热分解来制取氧气时,发生装置选用_______,该装置制取氧气的化学方程式为_________。
(2)实验室用大理石和稀盐酸来制取二氧化碳时,发生装置选用_____,收集装置常选用 ________;检验二氧化碳气体是否收集满把燃着的木条伸到_______。
(3)硫化氢(H2S)是一种无色且有臭鸡蛋气味的气体,密度比空气大,能溶于水,可形成一种酸溶液(氢硫酸)。实验室用硫化亚铁跟稀硫酸反应制取硫化氢气体。试回答:
①硫化氢气体具有臭鸡蛋味,这是硫化氢的_____(填“物理”或“化学”)性质。
②硫化氢的水溶液能使紫色石蕊试液变______色。
③实验室制取硫化氢气体时,发生装置应选用_____,收集装置应选用_____。
五、计算题
19.某课外活动小组对失去标签的稀硫酸浓度进行测定:取稀硫酸50.00g于烧杯中,逐滴滴加3.42%的氢氧化钡溶液,烧杯内溶质质量与滴加氢氧化钡溶液质量关系如图所示。(结果保留两位小数)。
(1)当滴加Ba(OH)2溶液50g时烧杯内溶液的pH__________7(填“>”“<”或“=”)。
(2)求该硫酸溶液的溶质质量分数_____。(结果保留0.01%)。
20.为了测定碳酸钠样品中碳酸钠的质量分数(杂质不溶于水,也不参与反应),进行了如下实验,回答下列问题:
(1)反应生成二氧化碳的质量为___________g。
(2)求原样品中碳酸钠的质量分数。
21.为测定氯化钠和氯化镁固体混合物中氯化镁的质量分数。某同学取固体混合物38.0g,向其中加入105.6g水,使其完全溶解配制成混合溶液。将100g一定溶质质量分数的氢氧化钠溶液滴入到上述混合溶液中,生成沉淀的质量与滴入氢氧化钠溶液的质量关系如图所示。
请计算:
(1)图中a的值为 。
(2)恰好完全反应时,所得不饱和溶液中溶质的质量分数(写出计算过程,结果精确到0.1%)。
参考答案:
1.B 2.B 3.B 4.C 5.D 6.C 7.C 8.B 9.C 10.B 11.C
12.(1)可以向人体内补充钙元素
(2)CaCO3+2HCl═CaCl2+CO2↑+H2O
(3)增大反应物的接触面积,促进钙的吸收
13.蚊虫分泌液显酸性,牙膏显弱碱性,二者接触发生中和反应,所以可减轻痛痒
14.(1)它们的分子构成不同(或它们由不同的分子构成)
(2) CuO 催化作用(或加快反应速度)
(3) CaO+H2O=Ca(OH)2 释放
(4) Ca(OH)2+CuSO4=Cu(OH)2↓+CaSO4 配制波尔多液
15.(1)H2O
(2)
复分解反应
(3)C
16.(1)分液漏斗
(2)
酒精灯
(3) CaCO3+2HCl=CaCl2+H2O+CO2↑ C
(4)C
(5) B d
17.(1)酒精灯
(2) B 用带火星的木条放置在集气瓶口,木条复燃,说明氧气已收满
(3) G E
18.(1) A 2KMnO4K2MnO4+MnO2+O2↑
(2) B C 集气瓶口处
(3) 物理 红 B C
19.(1)<
(2)3.92%
解:由图可知,加入100g氢氧化钡溶液两者恰好完全反应,设50g稀硫酸中含H2SO4的质量为x,
硫酸溶液的溶质质量分数为×100%=3.92%;
答:硫酸溶液的溶质质量分数3.92%。
20.(1)4.4;
(2)解:设参加反应的碳酸钠的质量为x。
x=10.6g
原样品中碳酸钠的质量分数为:
答:原样品中碳酸钠的质量分数为53%。
21.(1)8.7
(2)解:设氯化镁的质量为x,生成的氯化钠的质量为y,则有
溶液中氯化钠质量为38.0g-19.0g+23.4g=42.4g,溶液质量为38.0g+105.6g+80.0g-11.6g=212g,
恰好完全反应时,所得不饱和溶液中溶质的质量分数为×100%=20.0%;
答:恰好完全反应时,所得不饱和溶液中溶质的质量分数为20.0%。
