2021-2022学年高二化学鲁科版(2019)选择性必修3-1.2有机化合物的结构与性质同步练习(word版含解析)
文档属性
| 名称 | 2021-2022学年高二化学鲁科版(2019)选择性必修3-1.2有机化合物的结构与性质同步练习(word版含解析) |

|
|
| 格式 | zip | ||
| 文件大小 | 409.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-02 22:09:54 | ||
图片预览



文档简介
1.2有机化合物的结构与性质
一、选择题(共16题)
1.下列化合物结构中有两种官能团的是( )
A. B.
C. D.
2.下列各组物质中,互为同系物的是( )
A.CH3—CH3和CH3—CH=CH2
B.CH2=CH—CH3和CH3—CH=CH2
C.CH3—CH=CH2和CH3—CH2—CH=CH2
D.CH3—CH2—CH2—CH3和CH3—CH(CH3)—CH3
3.下列表示的是有机化合物结构式中的一部分,其中不是官能团的是
A.-OH B.-C≡C- C. D.
4.下列说法不正确的是
A.核素H的中子数是1
B.12C和14C互为同位素
C.金刚石和石墨互为同素异形体
D.CH3CH2OH和CH3OCH3互为同分异构体
5.下列说法正确的是
A.和互为同位素
B.正己烷和互为同系物
C.和是具有相同质子数的不同核素
D.和是同分异构体
6.正丁醛经催化加氢可制备正丁醇。为提纯含少量正丁醛杂质的正丁醇,现设计如图路线:
粗品
已知:①正丁醛与饱和溶液反应可生成沉淀;②乙醚的沸点是34.5 ℃,微溶于水,与正丁醇互溶;③正丁醇的沸点是118 ℃。则操作1~4分别是
A.萃取、过滤、蒸馏、蒸馏 B.过滤、分液、蒸馏、萃取
C.过滤、蒸馏、过滤、蒸馏 D.过滤、分液、过滤、蒸馏
7.下列各对物质含有不同官能团的是
A.CH3CH2CH2CH3和CH3CH(CH3)2
B.CH3CH2CH2COOH和HOOCCH2CH2CH2CH3
C.CH3CH2OH和CH3OCH3
D.CH2=C(CH3)2和CH3CH=CHCH3
8.已知丙烷的二氯代物有四种同分异构体,则其六氯代物的异构体数目为
A.三种 B.四种 C.五种 D.六种
9.下列说法正确的是
A.235U和237U是同一种核素 B.甲酸乙酯与丙酸互为同分异构体
C.苯酚与苯甲醇互为同系物 D.N元素位于周期表的第3周期ⅣA族
10.对下列化学用语的理解正确的是
A.比例模型既可以表示甲烷分子,也可以表示四氯化碳分子
B.电子式既可以表示羟基,也可以表示氢氧根离子
C.分子式为C7H16的烷烃,含有3个甲基的同分异构体有3种
D.丙烷的最简式可表示为CH2
11.拟除虫菊酯是一类高效,低毒,对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图。下列对该化合物叙述不正确的是
A.属于芳香化合物 B.分子中碳原子个数是25
C.具有酯类化合物的性质 D.在一定条件下可以发生加成反应
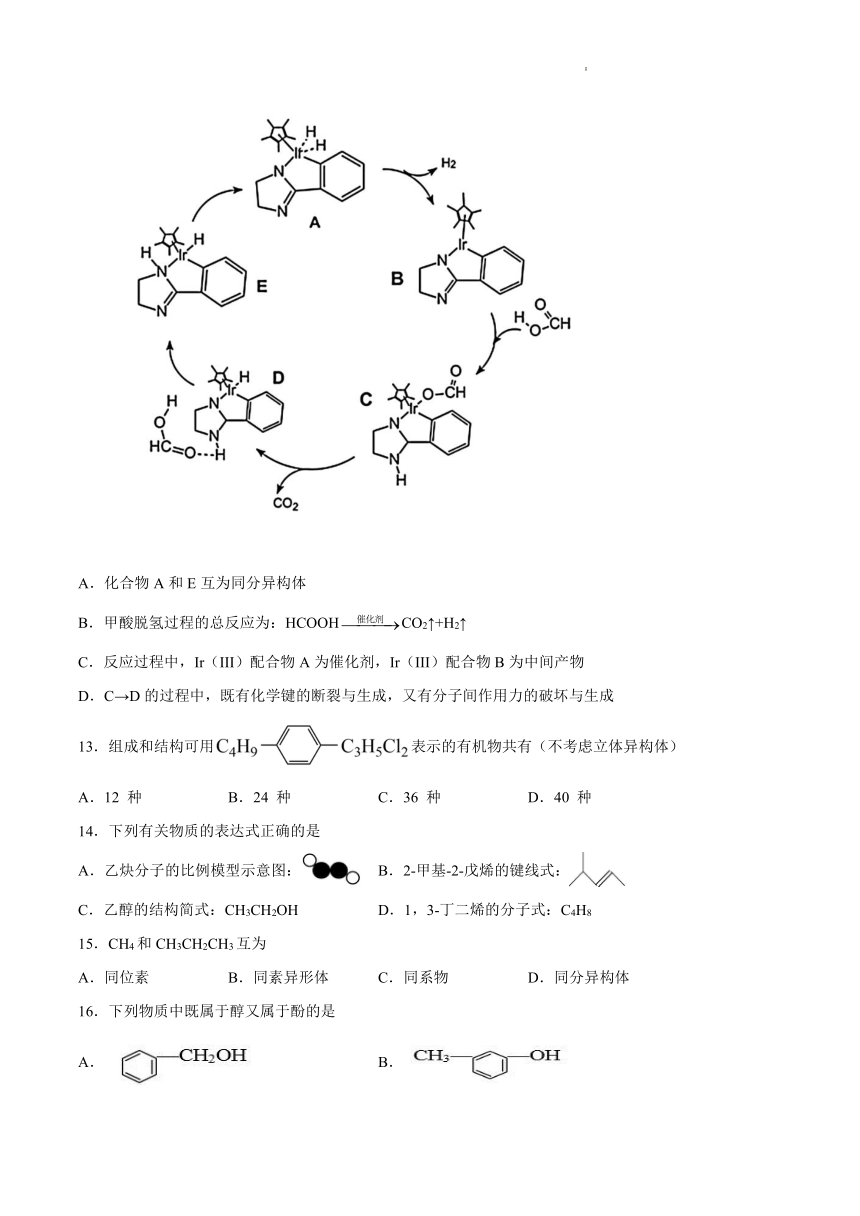
12.使用NC环金属化Ir(III)配合物催化甲酸脱氢的反应机理如图所示。下列说法不正确的是
A.化合物A和E互为同分异构体
B.甲酸脱氢过程的总反应为:HCOOHCO2↑+H2↑
C.反应过程中,Ir(III)配合物A为催化剂,Ir(III)配合物B为中间产物
D.C→D的过程中,既有化学键的断裂与生成,又有分子间作用力的破坏与生成
13.组成和结构可用表示的有机物共有(不考虑立体异构体)
A.12 种 B.24 种 C.36 种 D.40 种
14.下列有关物质的表达式正确的是
A.乙炔分子的比例模型示意图: B.2-甲基-2-戊烯的键线式:
C.乙醇的结构简式:CH3CH2OH D.1,3-丁二烯的分子式:C4H8
15.CH4和CH3CH2CH3互为
A.同位素 B.同素异形体 C.同系物 D.同分异构体
16.下列物质中既属于醇又属于酚的是
A. B.
C. D.
二、综合题(共6题)
17.(1)将下列符合要求的组别字母填入相应位置
A.O2和O3 B.和 C.CH3CH2CH2CH3和
D. E.CH3CH2CH2CH3和
①___________组两种微粒互为同位素;
②__________组两种物质互为同素异形体;
③___________组两种物质属于同系物;
④___________组两物质互为同分异构体;
⑤___________组两物质是同一物质。
(2)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为__________________,X为________,若反应经2min达到平衡,平衡时C的浓度________ 0.8mol/L(填“大于,小于或等于”)。
18.按要求回答问题
(1)给有机物命名, 名称________________________。
(2) 写出符合分子式C3H8O的有机物的结构简式(如乙酸结构简式为CH3COOH):CH3CH2CH2OH,__________________________________________________。
(3)配平下列反应离子方程式:
As2S3 + H2O + NO3- AsO + SO + NO↑ + (未配平)
___________________________________________________________
(4)某地污水中的有机污染物主要成分是三氯乙烯(C2HCl3),向污水中加入KMnO4(其还原产物为MnO2)可将三氯乙烯除去,其生成物不污染环境,写出该反应的化学方程式:_____。
(5)根据氧化还原反应:2 Fe3+ + Cu = 2Fe2+ +Cu2+ ,设计一个盐桥原电池。画出原电池结构图(需注明电极、电解质溶液、盐桥)。___
19.有机化学基础填空题:
⑴具有复合官能团的复杂有机物中官能团具有各自的独立性,在不同条件下所发生的化学反应可分别从各官能团讨论。根据上图回答:该物质具有的官能团是_______________、_____________(填化学式),所以该物质即可以归为_____________类又可以归为____________类(填有机物的类别)。
⑵写出下列化合物的名称或结构简式:
①结构简式为
此烃的名称为__________________
②结构简式为此烃的名称为_______________
③2,4-二甲基已烷的结构简式为_________________
20.(1)利用某些有机物之间的相互转换可以贮存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)的反应为
△H=+88.62 kJ/mol
以下叙述错误的是_____(填序号)
a NBD的能量比Q的能量高b NBD和Q互为同分异构体
c NBD的分子式为C7H8d NBD能使溴水褪色e NBD及Q的一氯代物均为三种
(2)如图是在一定温度下,某固定容积的密闭容器中充入一定量的NO2气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是_____。
a t1时,反应未达到平衡,NO2浓度在减小
b t2时,反应达到平衡,反应不再进行
c t2~t3,各物质浓度不再变化
d t2~t3,各物质的浓度相等
e 0~t2,N2O4浓度增大
f.反应过程中气体的颜色不变
(3)某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,如表是其实验设计的有关数据:
实验 序号 锌的质量/g 锌的 状态 c(H2SO4)/mol L﹣1 V(H2SO4) /mL 反应前溶液的温度/℃ 添加剂
1 0.65 粒状 0.5 50 20 无
2 0.65 粉末 0.5 50 20 无
3 0.65 粒状 0.5 50 20 2滴CuSO4溶液
4 0.65 粉末 0.8 50 20 无
5 0.65 粉末 0.8 50 35 2滴CuSO4溶液
①在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过定量测定锌完全消失所需的时间进行判断,其速率最快的实验是_____(填实验序号)。
②对锌和稀硫酸反应,实验1和2表明,_____对反应速率有影响,实验1和3表明,_____对反应速率有影响
③进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图像如图所示。在OA、AB、BC三段中反应速率最快的是_____,2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)=_____。
21.乙苯(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:
C8H10(g) C8H8(g)+H2(g) ΔH=+125 kJ·mol-1
Ⅰ.某温度下,将0.40 mol乙苯充入1 L真空密闭容器中发生上述反应,测定不同时间该容器内物质的物质的量,得到数据见下表:
时间/min 0 10 20 30 40
n(C8H10)/mol 0.40 0.30 0.26 n2 n3
n(C8H8)/mol 0.00 0.10 n1 0.16 0.16
(1)当反应进行到20 min时,该段时间内H2的平均生成速率是__________。
(2)该温度下,反应从开始到平衡的过程中共从环境吸收__________kJ热量。
(3)若保持反应条件不变,用0.40 mol H2(g)和0.40 mol C8H8(g)合成C8H10(g),当有25 kJ热量放出时,该反应中H2的转化率是______,此时该反应的方向是________(填“正向” 或“ 逆向”)。
Ⅱ.氢化热是指在一定条件下,1 mol不饱和化合物加氢时放出的热量,表中是环己烯(g)、1,3- 环己二烯(g)和苯的氢化热数据:
物质 +H2 +2H2 +3H2
氢化热(kJ/mol) 119.7 232.7 208.4
(4)1,3 -环己二烯的稳定性________(填“大于”“小于”或“等于”)苯。
(5)某有机物是苯的同分异构体,其分子中的碳碳键角只有60度和90度两种。请写出这种有机物的键线式结构________,它在核磁共振氢谱上会产生________个吸收峰 。
(6)与环己烯互为同分异构体的炔烃共有________种(不考虑立体异构)。
22.工业上烟气脱氮的原理 NO(g)+NO2(g)+2NH3(g)2N2(g)+3H2O(g)+Q(Q>0)
(1)该反应化学平衡常数K的表达式为_____________。如果平衡常数K值增大,对_______(填“正反应”或“逆反应”)的速率影响更大。
(2)若反应在恒容条件下进行,能说明反应已经达到平衡状态的是______(填序号)
a.容器内混合物的质量不变
b.容器内气体的压强不变
c.反应消耗0.5 molNO的同时生成 1molN2
d.NO2 的浓度不变
(3)向 2 L密闭容器中加入反应物,10 min后达到平衡,测得平衡时气体的物质的量增加了 0.2 mol,则用H2O(g)表示的平均反应速率为__________________。
(4)如图是 P1 压强下NO的转化率随反应时间(t)的变化图,请在图中画出其他条件不变情况下,压强为P2(P2>P1)下NO的转化率随反应时间变化的示意图___________。
(5)写出反应物中的氨气的电子式______;其空间构型为______;它常用来生产化肥 NH4Cl。NH4Cl溶液显_____________性;常温下将等体积等浓度的氨水和NH4Cl溶液混合,pH>7,溶液中 NH3·H2O、H+、OH-、NH4+、Cl-浓度由大到小的关系是____________________。
试卷第1页,共3页
(北京)股份有限公司
(北京)股份有限公司
参考答案:
1.A
【详解】
A.分子中含有碳碳双键和氯原子两种官能团,A项正确;
B.分子中只含有羟基()一种官能团,B项错误;
C.分子中只含有羧基()一种官能团,C项错误;
D.分子中只含有羧基()一种官能团,D项错误。
故选:A。
2.C
【详解】
同系物是指结构相似在分子组成上相差一个或若干个CH2原子团的有机物,据此解题:
A.CH3—CH3和CH3—CH=CH2二者结构不相似,组成上也不相差一个CH2原子团,A不合题意;
B.CH2=CH—CH3和CH3—CH=CH2二者分子式相同,不互为同系物,属于同一种物质,B不合题意;
C.CH3—CH=CH2和CH3—CH2—CH=CH2二者结构相似(都含有一个碳碳双键),组成上相差一个CH2原子团,故互为同系物,C符合题意;
D.CH3—CH2—CH2—CH3和CH3—CH(CH3)—CH3二者分子式相同,故不互为同系物,属于同分异构体,D不合题意;
故答案为:C。
3.D
【详解】
A.—OH是羟基,是醇或酚的官能团,故A不符合题意;
B.-C≡C-是碳碳三键,是炔烃的官能团,故B不符合题意;
C.是碳碳双键,是烯烃的官能团,故C不符合题意;
D.,属于烃基,不是官能团,故D符合题意;
答案为D。
4.A
【详解】
A. 核素H的中子数是1-1=0,故A错误;
B. 12C和14C质子数均为6,中子数分别是6和8,碳的两种核素,互为同位素,故B正确;
C. 金刚石和石墨是由碳组成的两种不同的单质,互为同素异形体,故C正确;
D. CH3CH2OH和CH3OCH3分子相同,结构不同,互为同分异构体,故D正确;
故选A。
5.B
【详解】
A.同位素的研究对象为原子(或核素),而和为单质,故A错误;
B.正己烷和的结构相似,在分子组成上相差1个“”原子团,二者互为同系物,故B正确;
C.和为碳元素形成的不同单质,不是核素,互为同素异形体,故C错误;
D.的分子式为,而的分子式为,二者分子式不同,不互为同分异构体,故D错误;
故答案为B。
6.D
【详解】
正丁醛与饱和溶液反应生成沉淀,且经操作1可得到滤液,故操作1为过滤;操作2是萃取后的步骤,故为分液;加固体干燥剂后,要把干燥剂分离出来,故操作3为过滤;根据乙醚与正丁醇的沸点相差较大,可知操作4为蒸馏,故D正确。
故选D。
7.C
【详解】
A.CH3CH2CH2CH3和CH3CH(CH3)2属于烷烃,没有官能团,A不符题意;
B.CH3CH2CH2COOH和HOOCCH2CH2CH2CH3含有的官能团都为羧基,二者相同,B不符题意;
C.CH3CH2OH含有的官能团为羟基,CH3OCH3含有的官能团为醚键,二者不同,C符合题意;
D.CH2=C(CH3)2和CH3CH=CHCH3所含官能团都为碳碳双键,二都相同,D不符题意。
答案选C。
8.B
【详解】
丙烷有8个H原子,其中2个H原子被氯原子取代形成丙烷的二氯代物。六氯代物可以看作C3Cl8中的8个氯原子,其中2个氯原子被2个氢原子代替形成,两者是等效的;二氯代物有四种同分异构体,可得到六氯代物也有四种同分异构体;
答案选B。
9.B
【详解】
A.235U和237U质子数相同,质量数不同,属于同一元素的不同核素,故A错误;
B.甲酸乙酯和丙酸的分子式均为C3H6O2,但二者结构不同,互为同分异构体,故B正确;
C.苯酚的官能团为酚羟基,苯甲醇的官能团为醇羟基,二者结构不相似,不是同系物,故C错误;
D.N元素位于第二周期ⅤA族,故D错误;
综上所述答案为B。
10.C
【详解】
A.由于碳原子半径大于氢原子半径,该比例模型可以表示甲烷分子,不可以表示四氯化碳分子,因为氯原子半径大于碳原子,故A错误;
B.为羟基电子式,氢氧根离子表示为[]-,故B错误;
C.分子式为C7H16的烷烃,该烃结构式中含有3个甲基,则该烷烃只有1个支链,若支链为-CH3,主链含有6个碳原子,符合条件的有:CH3CH(CH3)CH2CH2CH2CH3,CH3CH2CH(CH3) CH2CH2CH3;若支链为-CH2CH3,主链含5个碳原子,符合条件的有: CH3CH2CH(CH2CH3) CH2CH3;支链不可能大于3个碳原子,所以符合条件的烷烃有3种;故C正确;
D.丙烷的分子式C3H8,最简式为C3H8,故D错误;
故选C。
11.B
【详解】
A.结构中含有苯环,属于芳香化合物,故A正确;
B.根据结构简式,该分子中还原18个碳原子,故B错误;
C.结构中含有酯基,具有酯类化合物的性质,故C正确;
D.结构中含有碳碳双键和苯环,在一定条件下可发生加成反应,故D正确;
故选B。
12.C
【详解】
A.化合物A和E分子式相同,只是原子连接方式不同,互为同分异构体,故A正确;
B.由反应历程可知,甲酸脱氢过程的总反应为:HCOOHCO2↑+H2↑,故B正确;
C.催化剂参与反应,且反应前后的质量和性质不变,根据题意和反应历程可知, Ir(III)配合物A为中间产物,Ir(III)配合物B为催化剂,故C错误;
D. C→D的过程中,既有旧C=O等化学键的断裂,又有二氧化碳中新C=O的生成,同时有分子间作用力的破坏与生成,故D正确;
故答案为:C
13.C
【详解】
丁烷为CH3CH2CH2CH3时,分子中有2种不同的H原子,故有2种丁基;丁烷为CH(CH3)3时,分子中有2种不同的H原子,故有2种丁基,因此丁基(-C4H9)共有4种;-C3H5Cl2的碳链为或,当为,2个氯在一号位或者二号位或者三号位有3种.1个氯在一号位,剩下的一个氯在二号或者三号,2种;1个氯在二号位剩下的一个氯在三号位,1种,总共6种;当为,2个氯在同一个碳上有1种。在两个左边的碳和中间的碳上,1种。左边的碳上和右边的碳上,1种,总计3种,故-C3H5Cl2共有9种;该有机物共有36种,答案选C。
14.C
【详解】
A.乙炔分子中4个原子在同一条直线上,是直线型分子,因此图示不能表示乙炔分子,A错误;
B.应该从离双键较近的右端给主链上C原子编号,以确定碳碳双键及甲基在主链上的位置,该物质名称为4-甲基-2-戊烯,B错误;
C.该物质能够准确表示乙醇的结构,是乙醇的结构简式,C正确;
D.1,3-丁二烯分子中含有2个不饱和的碳碳双键,结构简式是CH2=CH-CH=CH2,则其分子式:C4H6,D错误;
故合理选项是C。
15.C
【详解】
CH4和CH3CH2CH3结构相似,分子组成相差2个CH2,所以CH4和CH3CH2CH3互为同系物,故选C。
16.D
【详解】
A.含有含有醇羟基,书友醇,不属于酚类,故A错误;
B.含有酚羟基,属于酚类,不属于醇,故B错误;
C.含有酚羟基,属于酚类,故C错误;
D.含有一个酚羟基和一个醇羟基,属于酚类也属于醇类,故D正确.
故选D.
17. B A C E D 0.2mol/(L.min) 2 小于
【详解】
①根据以上分析可知:核电荷数相同,中子数不同的核素,和 互为同位素;综上所述,本题选B。
②根据以上分析可知:由氧元素组成的不同性质的单质,O2和O3互为同分异构体; 综上所述,本题选A。
③根据以上分析可知:组成相同,相差nCH2原子团,CH3CH2CH2CH3和互为同系物;综上所述,本题选C。
④根据以上分析可知:分子式一样,结构不同,CH3CH2CH2CH3和互为同分异构体;综上所述,本题选E。
⑤根据以上分析可知:均为四面体结构,为同一种物质;综上所述,本题选D。
(2)利用三段式法计算 3A(g)+ B(g)═xC(g)
起始(mol/L): 1.5 0.5 0
转化(mol/L): 0.6 0.2 0.2x
1min后(mol/L): 0.9 0.3 0.2x
根据以上分析可知,1min内,B的平均反应速率为V= =0.2/1=0.2mol/(L.min);0.2x=0.4,x=2;由题知,反应进行1min时,C的浓度为0.4mol/L,若反应继续进行至达到平衡再需1分钟,因为随着反应的进行正反应速率不断减慢,同样是历时1min生成的C的量要比前1min的少,因此,平衡时C的浓度小于0.8mol/L;综上所述,本题答案是:0.2mol/(L.min); 2; 小于。
18. 2-甲基-2丁烯 CH3CH (OH)CH3,CH3-O-CH2CH3 3As2S3+4H2O+28NO3-=6AsO43-+ 9SO42-+28NO↑ +8H+ C2HCl3+2KMnO4 =2CO2↑+2MnO2+HCl+KCl (或其他合理答案)
【详解】
(1) 名称2-甲基-2丁烯;
(2) CH3CH2CH2OH可能的结构简式有CH3CH (OH)CH3,CH3-O-CH2CH3;
(3)反应中 ,As元素化合价由+3价升高为+5价,S元素化合价由 2价升高为+6价,化合价共升高2×(5 3)+3×[6 ( 2)]=28, ,N元素化合价由+5价降低为+2价,化合价共降低3价,故化合价升降最小公倍数为84,故 系数为3, 系数为4,根据原子守恒可知, 系数为6, 系数为9,NO系数为28,根据电荷守恒可知,缺项为H+,故H+系数为8,由原子守恒可知,故H2O的系数为4,配平后离子方程式为:3As2S3+4H2O+28NO3-=6AsO43-+ 9SO42-+28NO↑ +8H+;
(4)由题意可知:KMnO4溶液与三氯乙烯反应,产物有 , ,依据原子个数守恒可知其余产物为:KCl,HCl,该反应为氧化还原反应, ,Mn元素由+7价→+4价,一个KMnO4得3个电子;C2HCl3→CO2,C元素由+1价→+4价,一个C2HCl3失去6个电子,依据得失电子守恒可知反应的方程式为:C2HCl3+2KMnO4 =2CO2↑+2MnO2+HCl+KCl;
(5)根据氧化还原反应:2 Fe3+ + Cu = 2Fe2+ +Cu2+ ,依据原电池原理负极失去电子发生氧化反应,正极得到电子发生还原反应,画出结构图如下:
。
19. —COOH —CHO 羧酸 醛 3-甲基-2-乙基-1-戊烯 1, 2—二甲基—4—乙基苯
【详解】
(1)有机物含有的官能团有羧基、酚羟基和醛基,所以这个化合物可看作羧酸类和醛类;
(2)①的最长碳链含有5个碳原子,为戊烯,在3号碳原子上有一个甲基,在2号碳原子上有一个乙基,命名为:3-甲基-2-乙基-1-戊烯;
②有苯环的,命名时可以依次编号命名,命名为:对甲基乙苯或4-甲基乙基苯;
③根据2,4-二甲基已烷的名称可知,在主链上有6个碳原子,在2号和4号碳上各有一个甲基,结构简式为。
点睛:判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
1)烷烃命名原则:
①长:选最长碳链为主链;
②多:遇等长碳链时,支链最多为主链;
③近:离支链最近一端编号;
④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;
2)有机物的名称书写要规范;
3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;
4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小。
20. a ace 5 固体反应物的表面积 形成原电池 AB 0.06mol L﹣1 min﹣1
【详解】
(1)a.反应为吸热反应,说明反应物的总能量小于生成物的总能量,a错误;
b.二者分子式相同,但结构不同,属于同分异构体,b正确;
c.由结构简式可知分子中能够含有7个C、8个H,则分子式为C7H8,c正确;
d.含有C=C,可发生加成反应,能使溴水褪色,d正确;
e.NBD及Q中含有3种氢原子,一氯取代物有3种,e正确;
答案选a。
(2)a.t1时,正反应速率大于逆反应速率,反应未达到平衡,NO2浓度在减小,a正确;
b.t2时,正逆反应速率相等反应达到平衡,反应仍在进行,b错误;
c.t2~t3,正逆反应速率相等反应达到平衡,各物质浓度不再变化,c正确;
d.t2~t3,正逆反应速率相等反应达到平衡,各物质的浓度不一定相等,d错误;
e.0~t2,逆反应速率加快,N2O4浓度增大,e正确;
f.NO2气体显红棕色,反应过程中NO2气体浓度减小,颜色变浅,f错误;
答案选:ace。
(3)①第5组实验时温度最高,浓度最大,也滴加了硫酸铜溶液,利用了Zn﹣Cu原电池,因此反应速率最快,锌完全消失所需的时间最短。
答案为:5。
②1和2除固体表面积不同外,其它因素相同,是考查固体反应物的表面积对速率的影响,实验3比1多了形成Zn﹣Cu原电池,因此考查影响速率的因素是否形成原电池。
答案为:固体反应物的表面积;形成原电池。
③从图中看出2﹣4分钟内产生氢气最多,故这段时间内反应速率最大,因为为反应放热,使温度升高,反应速率加快;2﹣4分钟内,产生氢气179.2﹣44.8=134.4mL,物质的量为=6×10﹣3mol,根据反应方程式:Zn+H2SO4=ZnSO4+H2↑可知,参加反应硫酸的物质的量与生成的氢气相等也为6×10﹣3mol,所以2~4min内v(H2SO4)==0.06mol L﹣1 min﹣1。
答案为:AB;0.06mol L﹣1 min﹣1。
21. 0.007 mol·L-1·min-1 20 50% 正向 小于 1 7
【详解】
(1)当反应进行到20 min时消耗乙苯0.40mol-0.26mol=0.14mol,根据方程式可知生成氢气是0.14mol,浓度是0.14mol/L,所以该段时间内H2的平均生成速率是0.14mol/L÷20min=0.007 mol·L-1·min-1。
(2)根据表中数据可知平衡时生成苯乙烯是0.16mol,所以该温度下,反应从开始到平衡的过程中共从环境吸收0.16mol×125 kJ·mol-1=20kJ热量。
(3)当有25 kJ热量放出时,消耗氢气是25 kJ÷125 kJ·mol-1=0.2mol,所以氢气的转化率是0.2/0.4×100%=50%,此时该反应的方向是正向;
(4)根据题干信息可知①C6H8+2H2→C6H12 △H=-232.7kJ/mol,②C6H6+3H2→C6H12 △H=-208.4kJ/mol,依据盖斯定律②-①得到:C6H6+H2→C6H8 △H=+24.3kJ/mol,即苯转化为1,3 环己二烯吸热,因此苯的能量低于1,3 环己二烯,所以苯的稳定性强;
(5)某有机物是苯的同分异构体,其分子中的碳碳键角只有60度和90度两种,所以这种有机物的键线式结构为,它在核磁共振氢谱上会产生1个吸收峰。
(6)与环己烯互为同分异构体的炔烃共有CH≡CCH2CH2CH2CH3、CH3C≡CCH2CH2CH3、CH3CH2C≡CCH2CH3、CH≡CCH2CH(CH3)2、CH≡CCH(CH3)CH2CH3、CH≡CC(CH3)3、CH3C≡CCH(CH3)2,共计7种。
22. K= 逆反应 bd 0.03 mol/(L·min) 三角锥形 酸性 c()>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+)
【详解】
(1)根据方程式可知该反应化学平衡常数K的表达式为K=。如果平衡常数K值增大,说明平衡向正反应方向进行,因此对逆反应的速率影响更大。
(2)a.反应混合物都是气体,气体的质量始终不变,因此不能根据质量不变判断反应是否处于平衡状态,a错误;
b.正反应是气体体积减小的反应,若容器内气体的压强不变说明反应达到平衡状态,b正确;
c.根据方程式可知反应消耗0.5 mol NO的同时一定生成1 mol N2,表示的都是反应正向进行,因此不能说明反应达到平衡状态,c错误;
d.NO2 的浓度不变说明达到平衡状态,d正确;
故合理选项是bd;
(3)根据方程式可知每生成3 mol水蒸气,混合气体的物质的量就增加1 mol,因此平衡时气体的物质的量增加了0.2 mol,说明生成0.6 mol水蒸气,则用H2O(g)表示的平均反应速率为v(H2O)==0.03mol/(L·min)。
(4)正反应是气体体积增大的反应,增大压强平衡向气体体积减小的逆反应方向进行,NO转化率降低,所以NO的转化率随反应时间变化的示意图为。
(5)N原子最外层有5个电子,其中的3个成单电子与3个H原子形成3对共用电子对,使分子中各原子都达到稳定结构,故其电子式为:;
N原子价层电子对数是4,由于N原子上有1对共用电子对,所以NH3分子的空间构型为三角锥形。
NH4Cl是强酸弱碱盐,铵根水解使溶液显酸性;常温下将等体积等浓度的氨水和NH4Cl溶液混合,pH>7,说明NH3·H2O的电离程度大于的水解程度,则溶液中 NH3·H2O、H+、OH-、、Cl-浓度由大到小的关系是c()>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+)。
答案第1页,共2页
一、选择题(共16题)
1.下列化合物结构中有两种官能团的是( )
A. B.
C. D.
2.下列各组物质中,互为同系物的是( )
A.CH3—CH3和CH3—CH=CH2
B.CH2=CH—CH3和CH3—CH=CH2
C.CH3—CH=CH2和CH3—CH2—CH=CH2
D.CH3—CH2—CH2—CH3和CH3—CH(CH3)—CH3
3.下列表示的是有机化合物结构式中的一部分,其中不是官能团的是
A.-OH B.-C≡C- C. D.
4.下列说法不正确的是
A.核素H的中子数是1
B.12C和14C互为同位素
C.金刚石和石墨互为同素异形体
D.CH3CH2OH和CH3OCH3互为同分异构体
5.下列说法正确的是
A.和互为同位素
B.正己烷和互为同系物
C.和是具有相同质子数的不同核素
D.和是同分异构体
6.正丁醛经催化加氢可制备正丁醇。为提纯含少量正丁醛杂质的正丁醇,现设计如图路线:
粗品
已知:①正丁醛与饱和溶液反应可生成沉淀;②乙醚的沸点是34.5 ℃,微溶于水,与正丁醇互溶;③正丁醇的沸点是118 ℃。则操作1~4分别是
A.萃取、过滤、蒸馏、蒸馏 B.过滤、分液、蒸馏、萃取
C.过滤、蒸馏、过滤、蒸馏 D.过滤、分液、过滤、蒸馏
7.下列各对物质含有不同官能团的是
A.CH3CH2CH2CH3和CH3CH(CH3)2
B.CH3CH2CH2COOH和HOOCCH2CH2CH2CH3
C.CH3CH2OH和CH3OCH3
D.CH2=C(CH3)2和CH3CH=CHCH3
8.已知丙烷的二氯代物有四种同分异构体,则其六氯代物的异构体数目为
A.三种 B.四种 C.五种 D.六种
9.下列说法正确的是
A.235U和237U是同一种核素 B.甲酸乙酯与丙酸互为同分异构体
C.苯酚与苯甲醇互为同系物 D.N元素位于周期表的第3周期ⅣA族
10.对下列化学用语的理解正确的是
A.比例模型既可以表示甲烷分子,也可以表示四氯化碳分子
B.电子式既可以表示羟基,也可以表示氢氧根离子
C.分子式为C7H16的烷烃,含有3个甲基的同分异构体有3种
D.丙烷的最简式可表示为CH2
11.拟除虫菊酯是一类高效,低毒,对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图。下列对该化合物叙述不正确的是
A.属于芳香化合物 B.分子中碳原子个数是25
C.具有酯类化合物的性质 D.在一定条件下可以发生加成反应
12.使用NC环金属化Ir(III)配合物催化甲酸脱氢的反应机理如图所示。下列说法不正确的是
A.化合物A和E互为同分异构体
B.甲酸脱氢过程的总反应为:HCOOHCO2↑+H2↑
C.反应过程中,Ir(III)配合物A为催化剂,Ir(III)配合物B为中间产物
D.C→D的过程中,既有化学键的断裂与生成,又有分子间作用力的破坏与生成
13.组成和结构可用表示的有机物共有(不考虑立体异构体)
A.12 种 B.24 种 C.36 种 D.40 种
14.下列有关物质的表达式正确的是
A.乙炔分子的比例模型示意图: B.2-甲基-2-戊烯的键线式:
C.乙醇的结构简式:CH3CH2OH D.1,3-丁二烯的分子式:C4H8
15.CH4和CH3CH2CH3互为
A.同位素 B.同素异形体 C.同系物 D.同分异构体
16.下列物质中既属于醇又属于酚的是
A. B.
C. D.
二、综合题(共6题)
17.(1)将下列符合要求的组别字母填入相应位置
A.O2和O3 B.和 C.CH3CH2CH2CH3和
D. E.CH3CH2CH2CH3和
①___________组两种微粒互为同位素;
②__________组两种物质互为同素异形体;
③___________组两种物质属于同系物;
④___________组两物质互为同分异构体;
⑤___________组两物质是同一物质。
(2)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为__________________,X为________,若反应经2min达到平衡,平衡时C的浓度________ 0.8mol/L(填“大于,小于或等于”)。
18.按要求回答问题
(1)给有机物命名, 名称________________________。
(2) 写出符合分子式C3H8O的有机物的结构简式(如乙酸结构简式为CH3COOH):CH3CH2CH2OH,__________________________________________________。
(3)配平下列反应离子方程式:
As2S3 + H2O + NO3- AsO + SO + NO↑ + (未配平)
___________________________________________________________
(4)某地污水中的有机污染物主要成分是三氯乙烯(C2HCl3),向污水中加入KMnO4(其还原产物为MnO2)可将三氯乙烯除去,其生成物不污染环境,写出该反应的化学方程式:_____。
(5)根据氧化还原反应:2 Fe3+ + Cu = 2Fe2+ +Cu2+ ,设计一个盐桥原电池。画出原电池结构图(需注明电极、电解质溶液、盐桥)。___
19.有机化学基础填空题:
⑴具有复合官能团的复杂有机物中官能团具有各自的独立性,在不同条件下所发生的化学反应可分别从各官能团讨论。根据上图回答:该物质具有的官能团是_______________、_____________(填化学式),所以该物质即可以归为_____________类又可以归为____________类(填有机物的类别)。
⑵写出下列化合物的名称或结构简式:
①结构简式为
此烃的名称为__________________
②结构简式为此烃的名称为_______________
③2,4-二甲基已烷的结构简式为_________________
20.(1)利用某些有机物之间的相互转换可以贮存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)的反应为
△H=+88.62 kJ/mol
以下叙述错误的是_____(填序号)
a NBD的能量比Q的能量高b NBD和Q互为同分异构体
c NBD的分子式为C7H8d NBD能使溴水褪色e NBD及Q的一氯代物均为三种
(2)如图是在一定温度下,某固定容积的密闭容器中充入一定量的NO2气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是_____。
a t1时,反应未达到平衡,NO2浓度在减小
b t2时,反应达到平衡,反应不再进行
c t2~t3,各物质浓度不再变化
d t2~t3,各物质的浓度相等
e 0~t2,N2O4浓度增大
f.反应过程中气体的颜色不变
(3)某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,如表是其实验设计的有关数据:
实验 序号 锌的质量/g 锌的 状态 c(H2SO4)/mol L﹣1 V(H2SO4) /mL 反应前溶液的温度/℃ 添加剂
1 0.65 粒状 0.5 50 20 无
2 0.65 粉末 0.5 50 20 无
3 0.65 粒状 0.5 50 20 2滴CuSO4溶液
4 0.65 粉末 0.8 50 20 无
5 0.65 粉末 0.8 50 35 2滴CuSO4溶液
①在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过定量测定锌完全消失所需的时间进行判断,其速率最快的实验是_____(填实验序号)。
②对锌和稀硫酸反应,实验1和2表明,_____对反应速率有影响,实验1和3表明,_____对反应速率有影响
③进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图像如图所示。在OA、AB、BC三段中反应速率最快的是_____,2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)=_____。
21.乙苯(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:
C8H10(g) C8H8(g)+H2(g) ΔH=+125 kJ·mol-1
Ⅰ.某温度下,将0.40 mol乙苯充入1 L真空密闭容器中发生上述反应,测定不同时间该容器内物质的物质的量,得到数据见下表:
时间/min 0 10 20 30 40
n(C8H10)/mol 0.40 0.30 0.26 n2 n3
n(C8H8)/mol 0.00 0.10 n1 0.16 0.16
(1)当反应进行到20 min时,该段时间内H2的平均生成速率是__________。
(2)该温度下,反应从开始到平衡的过程中共从环境吸收__________kJ热量。
(3)若保持反应条件不变,用0.40 mol H2(g)和0.40 mol C8H8(g)合成C8H10(g),当有25 kJ热量放出时,该反应中H2的转化率是______,此时该反应的方向是________(填“正向” 或“ 逆向”)。
Ⅱ.氢化热是指在一定条件下,1 mol不饱和化合物加氢时放出的热量,表中是环己烯(g)、1,3- 环己二烯(g)和苯的氢化热数据:
物质 +H2 +2H2 +3H2
氢化热(kJ/mol) 119.7 232.7 208.4
(4)1,3 -环己二烯的稳定性________(填“大于”“小于”或“等于”)苯。
(5)某有机物是苯的同分异构体,其分子中的碳碳键角只有60度和90度两种。请写出这种有机物的键线式结构________,它在核磁共振氢谱上会产生________个吸收峰 。
(6)与环己烯互为同分异构体的炔烃共有________种(不考虑立体异构)。
22.工业上烟气脱氮的原理 NO(g)+NO2(g)+2NH3(g)2N2(g)+3H2O(g)+Q(Q>0)
(1)该反应化学平衡常数K的表达式为_____________。如果平衡常数K值增大,对_______(填“正反应”或“逆反应”)的速率影响更大。
(2)若反应在恒容条件下进行,能说明反应已经达到平衡状态的是______(填序号)
a.容器内混合物的质量不变
b.容器内气体的压强不变
c.反应消耗0.5 molNO的同时生成 1molN2
d.NO2 的浓度不变
(3)向 2 L密闭容器中加入反应物,10 min后达到平衡,测得平衡时气体的物质的量增加了 0.2 mol,则用H2O(g)表示的平均反应速率为__________________。
(4)如图是 P1 压强下NO的转化率随反应时间(t)的变化图,请在图中画出其他条件不变情况下,压强为P2(P2>P1)下NO的转化率随反应时间变化的示意图___________。
(5)写出反应物中的氨气的电子式______;其空间构型为______;它常用来生产化肥 NH4Cl。NH4Cl溶液显_____________性;常温下将等体积等浓度的氨水和NH4Cl溶液混合,pH>7,溶液中 NH3·H2O、H+、OH-、NH4+、Cl-浓度由大到小的关系是____________________。
试卷第1页,共3页
(北京)股份有限公司
(北京)股份有限公司
参考答案:
1.A
【详解】
A.分子中含有碳碳双键和氯原子两种官能团,A项正确;
B.分子中只含有羟基()一种官能团,B项错误;
C.分子中只含有羧基()一种官能团,C项错误;
D.分子中只含有羧基()一种官能团,D项错误。
故选:A。
2.C
【详解】
同系物是指结构相似在分子组成上相差一个或若干个CH2原子团的有机物,据此解题:
A.CH3—CH3和CH3—CH=CH2二者结构不相似,组成上也不相差一个CH2原子团,A不合题意;
B.CH2=CH—CH3和CH3—CH=CH2二者分子式相同,不互为同系物,属于同一种物质,B不合题意;
C.CH3—CH=CH2和CH3—CH2—CH=CH2二者结构相似(都含有一个碳碳双键),组成上相差一个CH2原子团,故互为同系物,C符合题意;
D.CH3—CH2—CH2—CH3和CH3—CH(CH3)—CH3二者分子式相同,故不互为同系物,属于同分异构体,D不合题意;
故答案为:C。
3.D
【详解】
A.—OH是羟基,是醇或酚的官能团,故A不符合题意;
B.-C≡C-是碳碳三键,是炔烃的官能团,故B不符合题意;
C.是碳碳双键,是烯烃的官能团,故C不符合题意;
D.,属于烃基,不是官能团,故D符合题意;
答案为D。
4.A
【详解】
A. 核素H的中子数是1-1=0,故A错误;
B. 12C和14C质子数均为6,中子数分别是6和8,碳的两种核素,互为同位素,故B正确;
C. 金刚石和石墨是由碳组成的两种不同的单质,互为同素异形体,故C正确;
D. CH3CH2OH和CH3OCH3分子相同,结构不同,互为同分异构体,故D正确;
故选A。
5.B
【详解】
A.同位素的研究对象为原子(或核素),而和为单质,故A错误;
B.正己烷和的结构相似,在分子组成上相差1个“”原子团,二者互为同系物,故B正确;
C.和为碳元素形成的不同单质,不是核素,互为同素异形体,故C错误;
D.的分子式为,而的分子式为,二者分子式不同,不互为同分异构体,故D错误;
故答案为B。
6.D
【详解】
正丁醛与饱和溶液反应生成沉淀,且经操作1可得到滤液,故操作1为过滤;操作2是萃取后的步骤,故为分液;加固体干燥剂后,要把干燥剂分离出来,故操作3为过滤;根据乙醚与正丁醇的沸点相差较大,可知操作4为蒸馏,故D正确。
故选D。
7.C
【详解】
A.CH3CH2CH2CH3和CH3CH(CH3)2属于烷烃,没有官能团,A不符题意;
B.CH3CH2CH2COOH和HOOCCH2CH2CH2CH3含有的官能团都为羧基,二者相同,B不符题意;
C.CH3CH2OH含有的官能团为羟基,CH3OCH3含有的官能团为醚键,二者不同,C符合题意;
D.CH2=C(CH3)2和CH3CH=CHCH3所含官能团都为碳碳双键,二都相同,D不符题意。
答案选C。
8.B
【详解】
丙烷有8个H原子,其中2个H原子被氯原子取代形成丙烷的二氯代物。六氯代物可以看作C3Cl8中的8个氯原子,其中2个氯原子被2个氢原子代替形成,两者是等效的;二氯代物有四种同分异构体,可得到六氯代物也有四种同分异构体;
答案选B。
9.B
【详解】
A.235U和237U质子数相同,质量数不同,属于同一元素的不同核素,故A错误;
B.甲酸乙酯和丙酸的分子式均为C3H6O2,但二者结构不同,互为同分异构体,故B正确;
C.苯酚的官能团为酚羟基,苯甲醇的官能团为醇羟基,二者结构不相似,不是同系物,故C错误;
D.N元素位于第二周期ⅤA族,故D错误;
综上所述答案为B。
10.C
【详解】
A.由于碳原子半径大于氢原子半径,该比例模型可以表示甲烷分子,不可以表示四氯化碳分子,因为氯原子半径大于碳原子,故A错误;
B.为羟基电子式,氢氧根离子表示为[]-,故B错误;
C.分子式为C7H16的烷烃,该烃结构式中含有3个甲基,则该烷烃只有1个支链,若支链为-CH3,主链含有6个碳原子,符合条件的有:CH3CH(CH3)CH2CH2CH2CH3,CH3CH2CH(CH3) CH2CH2CH3;若支链为-CH2CH3,主链含5个碳原子,符合条件的有: CH3CH2CH(CH2CH3) CH2CH3;支链不可能大于3个碳原子,所以符合条件的烷烃有3种;故C正确;
D.丙烷的分子式C3H8,最简式为C3H8,故D错误;
故选C。
11.B
【详解】
A.结构中含有苯环,属于芳香化合物,故A正确;
B.根据结构简式,该分子中还原18个碳原子,故B错误;
C.结构中含有酯基,具有酯类化合物的性质,故C正确;
D.结构中含有碳碳双键和苯环,在一定条件下可发生加成反应,故D正确;
故选B。
12.C
【详解】
A.化合物A和E分子式相同,只是原子连接方式不同,互为同分异构体,故A正确;
B.由反应历程可知,甲酸脱氢过程的总反应为:HCOOHCO2↑+H2↑,故B正确;
C.催化剂参与反应,且反应前后的质量和性质不变,根据题意和反应历程可知, Ir(III)配合物A为中间产物,Ir(III)配合物B为催化剂,故C错误;
D. C→D的过程中,既有旧C=O等化学键的断裂,又有二氧化碳中新C=O的生成,同时有分子间作用力的破坏与生成,故D正确;
故答案为:C
13.C
【详解】
丁烷为CH3CH2CH2CH3时,分子中有2种不同的H原子,故有2种丁基;丁烷为CH(CH3)3时,分子中有2种不同的H原子,故有2种丁基,因此丁基(-C4H9)共有4种;-C3H5Cl2的碳链为或,当为,2个氯在一号位或者二号位或者三号位有3种.1个氯在一号位,剩下的一个氯在二号或者三号,2种;1个氯在二号位剩下的一个氯在三号位,1种,总共6种;当为,2个氯在同一个碳上有1种。在两个左边的碳和中间的碳上,1种。左边的碳上和右边的碳上,1种,总计3种,故-C3H5Cl2共有9种;该有机物共有36种,答案选C。
14.C
【详解】
A.乙炔分子中4个原子在同一条直线上,是直线型分子,因此图示不能表示乙炔分子,A错误;
B.应该从离双键较近的右端给主链上C原子编号,以确定碳碳双键及甲基在主链上的位置,该物质名称为4-甲基-2-戊烯,B错误;
C.该物质能够准确表示乙醇的结构,是乙醇的结构简式,C正确;
D.1,3-丁二烯分子中含有2个不饱和的碳碳双键,结构简式是CH2=CH-CH=CH2,则其分子式:C4H6,D错误;
故合理选项是C。
15.C
【详解】
CH4和CH3CH2CH3结构相似,分子组成相差2个CH2,所以CH4和CH3CH2CH3互为同系物,故选C。
16.D
【详解】
A.含有含有醇羟基,书友醇,不属于酚类,故A错误;
B.含有酚羟基,属于酚类,不属于醇,故B错误;
C.含有酚羟基,属于酚类,故C错误;
D.含有一个酚羟基和一个醇羟基,属于酚类也属于醇类,故D正确.
故选D.
17. B A C E D 0.2mol/(L.min) 2 小于
【详解】
①根据以上分析可知:核电荷数相同,中子数不同的核素,和 互为同位素;综上所述,本题选B。
②根据以上分析可知:由氧元素组成的不同性质的单质,O2和O3互为同分异构体; 综上所述,本题选A。
③根据以上分析可知:组成相同,相差nCH2原子团,CH3CH2CH2CH3和互为同系物;综上所述,本题选C。
④根据以上分析可知:分子式一样,结构不同,CH3CH2CH2CH3和互为同分异构体;综上所述,本题选E。
⑤根据以上分析可知:均为四面体结构,为同一种物质;综上所述,本题选D。
(2)利用三段式法计算 3A(g)+ B(g)═xC(g)
起始(mol/L): 1.5 0.5 0
转化(mol/L): 0.6 0.2 0.2x
1min后(mol/L): 0.9 0.3 0.2x
根据以上分析可知,1min内,B的平均反应速率为V= =0.2/1=0.2mol/(L.min);0.2x=0.4,x=2;由题知,反应进行1min时,C的浓度为0.4mol/L,若反应继续进行至达到平衡再需1分钟,因为随着反应的进行正反应速率不断减慢,同样是历时1min生成的C的量要比前1min的少,因此,平衡时C的浓度小于0.8mol/L;综上所述,本题答案是:0.2mol/(L.min); 2; 小于。
18. 2-甲基-2丁烯 CH3CH (OH)CH3,CH3-O-CH2CH3 3As2S3+4H2O+28NO3-=6AsO43-+ 9SO42-+28NO↑ +8H+ C2HCl3+2KMnO4 =2CO2↑+2MnO2+HCl+KCl (或其他合理答案)
【详解】
(1) 名称2-甲基-2丁烯;
(2) CH3CH2CH2OH可能的结构简式有CH3CH (OH)CH3,CH3-O-CH2CH3;
(3)反应中 ,As元素化合价由+3价升高为+5价,S元素化合价由 2价升高为+6价,化合价共升高2×(5 3)+3×[6 ( 2)]=28, ,N元素化合价由+5价降低为+2价,化合价共降低3价,故化合价升降最小公倍数为84,故 系数为3, 系数为4,根据原子守恒可知, 系数为6, 系数为9,NO系数为28,根据电荷守恒可知,缺项为H+,故H+系数为8,由原子守恒可知,故H2O的系数为4,配平后离子方程式为:3As2S3+4H2O+28NO3-=6AsO43-+ 9SO42-+28NO↑ +8H+;
(4)由题意可知:KMnO4溶液与三氯乙烯反应,产物有 , ,依据原子个数守恒可知其余产物为:KCl,HCl,该反应为氧化还原反应, ,Mn元素由+7价→+4价,一个KMnO4得3个电子;C2HCl3→CO2,C元素由+1价→+4价,一个C2HCl3失去6个电子,依据得失电子守恒可知反应的方程式为:C2HCl3+2KMnO4 =2CO2↑+2MnO2+HCl+KCl;
(5)根据氧化还原反应:2 Fe3+ + Cu = 2Fe2+ +Cu2+ ,依据原电池原理负极失去电子发生氧化反应,正极得到电子发生还原反应,画出结构图如下:
。
19. —COOH —CHO 羧酸 醛 3-甲基-2-乙基-1-戊烯 1, 2—二甲基—4—乙基苯
【详解】
(1)有机物含有的官能团有羧基、酚羟基和醛基,所以这个化合物可看作羧酸类和醛类;
(2)①的最长碳链含有5个碳原子,为戊烯,在3号碳原子上有一个甲基,在2号碳原子上有一个乙基,命名为:3-甲基-2-乙基-1-戊烯;
②有苯环的,命名时可以依次编号命名,命名为:对甲基乙苯或4-甲基乙基苯;
③根据2,4-二甲基已烷的名称可知,在主链上有6个碳原子,在2号和4号碳上各有一个甲基,结构简式为。
点睛:判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
1)烷烃命名原则:
①长:选最长碳链为主链;
②多:遇等长碳链时,支链最多为主链;
③近:离支链最近一端编号;
④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;
2)有机物的名称书写要规范;
3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;
4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小。
20. a ace 5 固体反应物的表面积 形成原电池 AB 0.06mol L﹣1 min﹣1
【详解】
(1)a.反应为吸热反应,说明反应物的总能量小于生成物的总能量,a错误;
b.二者分子式相同,但结构不同,属于同分异构体,b正确;
c.由结构简式可知分子中能够含有7个C、8个H,则分子式为C7H8,c正确;
d.含有C=C,可发生加成反应,能使溴水褪色,d正确;
e.NBD及Q中含有3种氢原子,一氯取代物有3种,e正确;
答案选a。
(2)a.t1时,正反应速率大于逆反应速率,反应未达到平衡,NO2浓度在减小,a正确;
b.t2时,正逆反应速率相等反应达到平衡,反应仍在进行,b错误;
c.t2~t3,正逆反应速率相等反应达到平衡,各物质浓度不再变化,c正确;
d.t2~t3,正逆反应速率相等反应达到平衡,各物质的浓度不一定相等,d错误;
e.0~t2,逆反应速率加快,N2O4浓度增大,e正确;
f.NO2气体显红棕色,反应过程中NO2气体浓度减小,颜色变浅,f错误;
答案选:ace。
(3)①第5组实验时温度最高,浓度最大,也滴加了硫酸铜溶液,利用了Zn﹣Cu原电池,因此反应速率最快,锌完全消失所需的时间最短。
答案为:5。
②1和2除固体表面积不同外,其它因素相同,是考查固体反应物的表面积对速率的影响,实验3比1多了形成Zn﹣Cu原电池,因此考查影响速率的因素是否形成原电池。
答案为:固体反应物的表面积;形成原电池。
③从图中看出2﹣4分钟内产生氢气最多,故这段时间内反应速率最大,因为为反应放热,使温度升高,反应速率加快;2﹣4分钟内,产生氢气179.2﹣44.8=134.4mL,物质的量为=6×10﹣3mol,根据反应方程式:Zn+H2SO4=ZnSO4+H2↑可知,参加反应硫酸的物质的量与生成的氢气相等也为6×10﹣3mol,所以2~4min内v(H2SO4)==0.06mol L﹣1 min﹣1。
答案为:AB;0.06mol L﹣1 min﹣1。
21. 0.007 mol·L-1·min-1 20 50% 正向 小于 1 7
【详解】
(1)当反应进行到20 min时消耗乙苯0.40mol-0.26mol=0.14mol,根据方程式可知生成氢气是0.14mol,浓度是0.14mol/L,所以该段时间内H2的平均生成速率是0.14mol/L÷20min=0.007 mol·L-1·min-1。
(2)根据表中数据可知平衡时生成苯乙烯是0.16mol,所以该温度下,反应从开始到平衡的过程中共从环境吸收0.16mol×125 kJ·mol-1=20kJ热量。
(3)当有25 kJ热量放出时,消耗氢气是25 kJ÷125 kJ·mol-1=0.2mol,所以氢气的转化率是0.2/0.4×100%=50%,此时该反应的方向是正向;
(4)根据题干信息可知①C6H8+2H2→C6H12 △H=-232.7kJ/mol,②C6H6+3H2→C6H12 △H=-208.4kJ/mol,依据盖斯定律②-①得到:C6H6+H2→C6H8 △H=+24.3kJ/mol,即苯转化为1,3 环己二烯吸热,因此苯的能量低于1,3 环己二烯,所以苯的稳定性强;
(5)某有机物是苯的同分异构体,其分子中的碳碳键角只有60度和90度两种,所以这种有机物的键线式结构为,它在核磁共振氢谱上会产生1个吸收峰。
(6)与环己烯互为同分异构体的炔烃共有CH≡CCH2CH2CH2CH3、CH3C≡CCH2CH2CH3、CH3CH2C≡CCH2CH3、CH≡CCH2CH(CH3)2、CH≡CCH(CH3)CH2CH3、CH≡CC(CH3)3、CH3C≡CCH(CH3)2,共计7种。
22. K= 逆反应 bd 0.03 mol/(L·min) 三角锥形 酸性 c()>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+)
【详解】
(1)根据方程式可知该反应化学平衡常数K的表达式为K=。如果平衡常数K值增大,说明平衡向正反应方向进行,因此对逆反应的速率影响更大。
(2)a.反应混合物都是气体,气体的质量始终不变,因此不能根据质量不变判断反应是否处于平衡状态,a错误;
b.正反应是气体体积减小的反应,若容器内气体的压强不变说明反应达到平衡状态,b正确;
c.根据方程式可知反应消耗0.5 mol NO的同时一定生成1 mol N2,表示的都是反应正向进行,因此不能说明反应达到平衡状态,c错误;
d.NO2 的浓度不变说明达到平衡状态,d正确;
故合理选项是bd;
(3)根据方程式可知每生成3 mol水蒸气,混合气体的物质的量就增加1 mol,因此平衡时气体的物质的量增加了0.2 mol,说明生成0.6 mol水蒸气,则用H2O(g)表示的平均反应速率为v(H2O)==0.03mol/(L·min)。
(4)正反应是气体体积增大的反应,增大压强平衡向气体体积减小的逆反应方向进行,NO转化率降低,所以NO的转化率随反应时间变化的示意图为。
(5)N原子最外层有5个电子,其中的3个成单电子与3个H原子形成3对共用电子对,使分子中各原子都达到稳定结构,故其电子式为:;
N原子价层电子对数是4,由于N原子上有1对共用电子对,所以NH3分子的空间构型为三角锥形。
NH4Cl是强酸弱碱盐,铵根水解使溶液显酸性;常温下将等体积等浓度的氨水和NH4Cl溶液混合,pH>7,说明NH3·H2O的电离程度大于的水解程度,则溶液中 NH3·H2O、H+、OH-、、Cl-浓度由大到小的关系是c()>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+)。
答案第1页,共2页
