2021-2022学年高一下学期化学鲁科版(2019)必修第二册第1章《原子结构元素周期律》随堂练习(word版含解析)
文档属性
| 名称 | 2021-2022学年高一下学期化学鲁科版(2019)必修第二册第1章《原子结构元素周期律》随堂练习(word版含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 234.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-02 22:15:16 | ||
图片预览




文档简介
第1章《原子结构 元素周期律》随堂练习
一、单选题(共11道题)
1.元素X、Y、Z、Q的原子序数依次增加,金属元素X可用于制备高能电池,Y的一种单质是自然界中硬度最大的物质,Z的最高价氧化物的水化物M与其简单氢化物接触时产生大量白烟,工业上常用Q的单质所制的容器储运M的浓溶液。下列说法一定正确的是
A.X的单质在空气中加热形成的化合物仅含离子键
B.Z的氢化物沸点高于Y的氢化物
C.X、Y、Z的原子半径依次增大
D.Q在空气中能形成致密的氧化膜,是一种抗腐蚀的金属
2.已知R、X、Y、Z、W为原子序数依次增大的短周期主族元素,Y是短周期主族元素中原子半径最大的元素,X与Z同主族,Z的最高正价与最低负价之和为4,R、Y、W的最外层电子数之和为9,且R为非金属元素,下列说法中正确的是
A.Y的最高价氧化物对应的水化物是强酸
B.X与R形成的化合物都具有强氧化性
C.由X和Z形成的化合物ZX2,具有漂白性
D.简单离子半径:Y>W
3.实现中国梦,离不开化学与科技的发展。下列说法不正确的是
A.极地考查船“雪龙2号”船身上镀的锌层可减缓铁制船体遭受的腐蚀
B.中国天眼FAST用到的高性能碳化硅是一种新型的有机高分子材料
C.国产飞机——C919使用的航空煤油可从石油中分馏得到
D.科学家合成世界首个由碳原子构成的具有半导体特性的碳环C18,与C60互为同素异形体
4.下列有关氧化物的性质与用途具有对应关系的是
A.熔点高,可用于制造耐火材料
B.具有氧化性,可用于漂白草编织物
C.硬度大,可用于制作光导纤维
D.具有两性,可用于电解治炼金属铝
5.下列有关物质的性质与用途具有对应关系的是
A.二氧化硅熔点高,可用于制光导纤维
B.稀硫酸具有酸性,可用于除去铁锈
C.受热易分解,可用于制胃酸中和剂
D.具有氧化性,可用作食品抗氧化剂
6.中国首次火星探测任务工程总设计师张荣桥入选《自然》杂志发布的2021年度十大人物。火星大气及岩石中富含W、X、Y、Z四种元素。已知W、X、Y、Z为原子序数递增的短周期主族元素,W和Z为同一主族元素,X是地壳中含量最多的元素,W元素原子最外层电子数是最内层的2倍,火星岩石中含有YZX3。下列说法不正确的是
A.原子半径:Y>Z>W>X B.简单氢化物的沸点:X>W
C.工业上电解熔融YX制备Y单质 D.Z的单质可以和NaOH溶液反应
7.X、Y、Z、W是四种原子序数依次增大的前20号主族元素,Y原子的最外层电子数为其内层电子数的2倍;Z原子的最外层电子数等于Y原子的核外电子数;W原子的半径是前20号元素中最大的,四种元素原子序数之和为34。下列说法错误的是
A.X与W为同主族元素
B.Y、Z的单质均有同素异形体
C.X与W形成化合物为离子化合物
D.最简单氢化物的沸点高低:Y>Z
8.2021年11月9日,烟台海阳市全域从燃煤取暖进入核能供热。核能利用有利于早日实现“碳达峰、碳中和”。核裂变的原理为:,下列说法错误的是
A.与互为同素异形体
B.的中子数为143
C.核外电子数为56
D.Kr在周期表中的位置为第四周期0族
9.锂电池的研究与开发已日臻成熟,某锂电池材料的组成与结构如图。M、W、X、Y、Z是原子序数依次增大的同周期主族元素,Y元素原子的价电子数是W的两倍。下列说法错误的是
A.该材料中元素原子均达到8电子稳定结构 B.该材料中X的化合价为
C.元素X与Y原子轨道中含有的未成对电子数相同 D.简单离子半径为
10.下列说法错误的是
A.“百炼成钢”蕴含了我国古代劳动人民提升铁合金品质的方法
B.福鼎白茶中茶多酚含量很高,因其较强的氧化性,茶多酚常用作抗氧化剂
C.光洁莹润的“德化白瓷”(主要成分)属于无机非金属材料
D.选择公共交通工具代替私家车出行,更有利于低碳环保
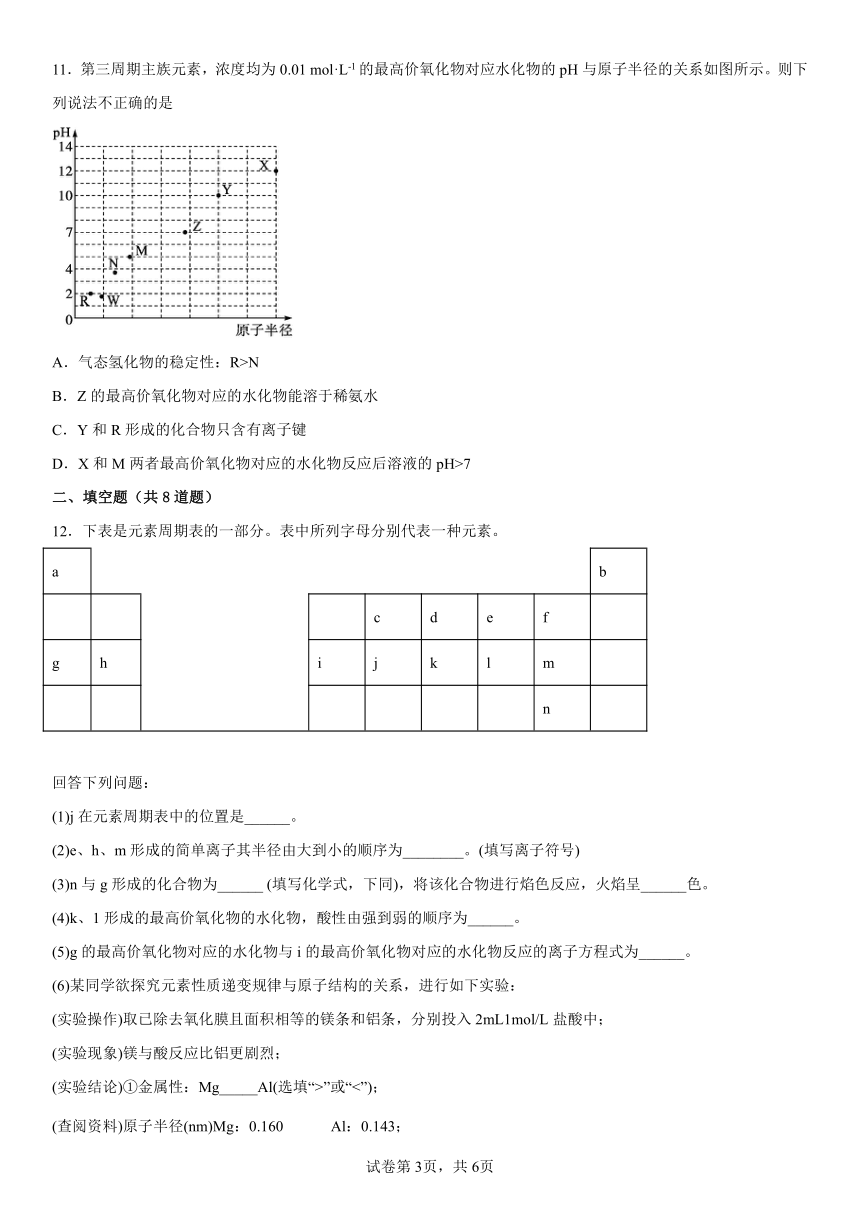
11.第三周期主族元素,浓度均为0.01 mol·L-1的最高价氧化物对应水化物的pH与原子半径的关系如图所示。则下列说法不正确的是
A.气态氢化物的稳定性:R>N
B.Z的最高价氧化物对应的水化物能溶于稀氨水
C.Y和R形成的化合物只含有离子键
D.X和M两者最高价氧化物对应的水化物反应后溶液的pH>7
二、填空题(共8道题)
12.下表是元素周期表的一部分。表中所列字母分别代表一种元素。
a b
c d e f
g h i j k l m
n
回答下列问题:
(1)j在元素周期表中的位置是______。
(2)e、h、m形成的简单离子其半径由大到小的顺序为________。(填写离子符号)
(3)n与g形成的化合物为______ (填写化学式,下同),将该化合物进行焰色反应,火焰呈______色。
(4)k、1形成的最高价氧化物的水化物,酸性由强到弱的顺序为______。
(5)g的最高价氧化物对应的水化物与i的最高价氧化物对应的水化物反应的离子方程式为______。
(6)某同学欲探究元素性质递变规律与原子结构的关系,进行如下实验:
(实验操作)取已除去氧化膜且面积相等的镁条和铝条,分别投入2mL1mol/L盐酸中;
(实验现象)镁与酸反应比铝更剧烈;
(实验结论)①金属性:Mg_____Al(选填“>”或“<”);
(查阅资料)原子半径(nm)Mg:0.160 Al:0.143;
(思考)②利用元素周期律对上述实验结论进行解释______。
13.回答下列问题
(1)分离豆浆和豆渣常用的实验方法为___________。
(2)已知R是一种金属,75.5gR(NO3)3中含有个硝酸根离子,则该硝酸盐的摩尔质量为___________g/mol。
(3)在80g密度为dg/cm3的硫酸铁溶液中,含有2.8gFe3+,则此溶液中SO的物质的量浓度为___________mol/L。
(4)在水溶液中的电离方程式为___________。
(5)二氧化硅(SiO2)是酸性氧化物,写出其与NaOH溶液反应的化学方程式:___________。
14.下表是元素周期表的一部分。
族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
二 ① ② ③ ④
三 ⑤ ⑥ ⑦ ⑧
(1)表中元素③的氢化物的电子式为___________;此氢化物的稳定性比元素④的氢化物的稳定性___________(选填“强”或“弱”);此氢化物与元素⑧的氢化物反应生成的化合物其水溶液呈酸性,用离子方程式表示其原因是___________。
(2)③④⑤⑥元素中,原子半径最大的元素是___________(填元素符号);这四种元素形成的简单离子中离子半径最小的是___________(填离子符号)。
(3)⑤、⑥两元素相比较,金属性较强是___________(填元素符号),可以证明该结论的实验是___________。
a.比较这两种元素最高价氧化物对应的水化物的碱性
b.比较这两种元素的气态氢化物的稳定性
c.将这两种元素的单质分别放入冷水中
d.比较这两种元素的单质与酸反应时失电子的数目
(4)请用一个化学方程式证明元素⑦和⑧的非金属性强弱关系___________。
15.回答下列问题:
(1)现有①三氧化硫②澄清石灰水③液氯④纯碱⑤酒精⑥醋酸⑦稀硫酸⑧熔融的氢氧化钠等物质中,属于能导电的是_______,属于强电解质的是_______。
(2)有甲、乙、丙三种元素,甲元素M层的电子数是其K层的电子数的1/2,乙元素原子核内无中子,丙元素原子核内有8个质子。
①写出丙元素的元素符号_______。
②写出甲、乙、丙三种元素组成的化合物在水中的电离方程式_______。
③画出甲元素的离子结构示意图_______。
16.联合国将2019年定为“国际化学元素周期表年”,新版周期表包含118种元素,下表代表元素周期表前四周期,回答下列问题:
(1)将磷的元素符号填写在上述周期表相应的空格中___________。
(2)Cl元素的最高价氧化物对应水化物的化学式为___________。
(3)下列有关性质的比较正确,且能用元素周期律解释的是___________。
a.酸性:HCl>H2SO3 b.非金属性:O>S
c.碱性:NaOH>Mg(OH)2 d.热稳定性:HF<HCl
(4)从原子结构角度解释元素的非金属性S弱于Cl的原因___________。
(5)硒(Se)是人体必需的微量元素,其原子结构示意图为。
①Se在元素周期表中的位置是___________。
②Se的气态氢化物的化学式为____________。
③和互称为___________。
17.I.Cl2是一种重要的化工原料,实验室通常用MnO2和浓盐酸制取Cl2。
(1)写出该反应离子方程式:_______,若将8.7gMnO2投入足量浓盐酸充分反应,被氧化的HCl的物质的量为_______mol,转移的电子数目为_______。
(2)将H2点燃后,将导管缓慢伸入充满Cl2的集气瓶中,现象为_______。将Cl2通入新制的FeCl2溶液中离子反应方程式为_______。
II.氮、磷、砷(As)、锑(Sb)、铋(Bi)为元素周期表中原子序数依次增大的同主族元素。回答下列问题:
(3)铋在元素周期表中的位置为_______,锑的原子序数为_______
(4)Bi的中子数与质子数的差值为_______
(5)次磷酸(H3PO2)是一种精细化工产品,具有较强的还原性。它可将溶液中的银离子还原为银单质,氧化产物为H3PO4。利用H3PO2进行化学镀银时,氧化剂与还原剂的物质的量之比为_______。
18.某化学兴趣小组设计如下实验探究KMnO4固体与草酸(H2C2O4)反应的产物,以其产物为原料制备氯气:室温下,取KMnO4固体于锥形瓶中,加入适量的草酸(H2C2O4)溶液,振荡,充分反应,可以观察到有黑色沉淀产生,溶液变为无色,同时生成无色无味的气体M,将燃着的木条靠近锥形瓶瓶口时木条熄灭。分析实验并回答相应问题。
(1)M的化学式是_____,组成草酸的三种元素中,非金属性最强的是_____(填元素符号)。
(2)将充分反应后的混合物过滤,检验滤液中金属阳离子的方法及现象为_____,向滤液中加入盐酸时又产生无色无味气体,该反应的离子方程式为______。
(3)将过滤得到的滤渣洗涤干净,确认滤渣已洗涤干净的操作是_____。
(4)将滤渣加入浓盐酸中加热,产生黄绿色气体,该反应的离子方程式为_____。
(5)写出高锰酸钾与草酸溶液发生反应的化学方程式,并用单线桥法表示反应中电子的转移情况:______。
19.废旧太阳能电池具有较高的回收利用价值,其主要组成CIGS的化学式可写为CuIn0.5Ga05Se2;回答下列问题:
(1)Cu在元素周期表中属于_______分区。同周期元素基态原子中与其未成对电子数相同的原子还有_______(写元素名称)。
(2)Ga、In与Al同主族,写出Ga基态原子电子排布式_______。
(3)Ga、Se与As同周期,推测这三种元素第一电离能由大到小的顺序_______(用元素符号表示),推测的理由是_______。
(4)CIGS含有的四种元素中电负性最强的是_______(用元素符号表示),Cu的化合价为_______。
试卷第1页,共3页
试卷第1页,共3页
(北京)股份有限公司
(北京)股份有限公司
参考答案:
1.A
【解析】金属元素X可用于制备高能电池,X是Li元素;Y的一种单质是自然界中硬度最大的物质,Y是C元素;Z的最高价氧化物的水化物M与其简单氢化物接触时产生大量白烟,Z是N元素、M是硝酸;工业上常用Q的单质所制的容器储运浓硝酸,Q是Al或Fe元素。
A.X是Li,Li在空气中加热形成生成Li2O,仅含离子键,故A正确;
B.Y是C,Z是N,C元素能形成多种氢化物,有些氢化物呈固态,所以Z(N)的氢化物沸点不一定高于Y(C)的氢化物,故B错误;
C.X、Y、Z依次为Li、C、N,Li、C、N的原子半径依次减小,故C错误;
D.若Q是Fe,Fe的氧化膜疏松,易被腐蚀,故D错误;
选A。
2.C
【解析】已知R、X、Y、Z、W为原子序数依次增大的短周期主族元素,Y是短周期主族元素中原子半径最大的元素,则Y为Na元素;X与Z同主族,Z的最高正价与最低负价之和为4,则Z为S元素、X为O元素;R、Y、W的最外层电子数之和为9,且R为非金属元素,原子序数W>Z,且为短周期的主族元素,则W为Cl,R+1+7=9,解得R=1,又因R为非金属元素,则R为H元素,综上R、X、Y、Z、W分别为H、O、Na、S、Cl元素,据此分析可得;
A.Y为11号Na元素,则其最高价氧化物对应的水化物为NaOH,是强碱,故A错;
B.R、X分别为H、O,则其形成的化和物有,其中只有具有强氧化性,故B错;
C.X、Z分别为O、S,则其形成化合物SO2,为能具有漂白性的化合物,故C正确;
D.Y、W分别为Na、Cl元素,则其简单离子分别为10电子结构的和18电子结构的,则离子半径,故D错;
答案选C。
3.B
【解析】A.在船体上镶嵌锌块,形成锌铁原电池,锌比铁活泼,锌作阳极不断被腐蚀,铁做阴极则不会被腐蚀,选项A正确;
B.中国天眼FAST用到的高性能碳化硅又名金刚砂,是用石英砂、石油焦(或煤焦)、木屑等原料通过电阻炉高温冶炼而成,是一种新型的无机非金属材料,选项B不正确;
C.客机所用的燃料油是航空煤油,是石油分馏得到的,选项C正确;
D.由碳原子构成的具有半导体特性的碳环C18,与C60均由碳元素形成的不同单质,互为同素异形体,选项D正确;
答案选B。
4.A
【解析】A.氧化镁是熔点高的离子化合物,常用于制造耐火材料,故A正确;
B.二氧化硫具有漂白性,可用于漂白草编织物,故B错误;
C.二氧化硅对光具有良好的全反射作用,常用于制作光导纤维,故C错误;
D.氧化铝是离子化合物,熔融状态下能导电,可用于电解治炼金属铝,故D错误;
故选A。
5.B
【解析】A.二氧化硅晶体能对光产生全反射,能传递光信号,所以二氧化硅晶体可用于制光导纤维,与熔点无关,A错误;
B.稀硫酸具有酸性,可与氧化铁反应生成硫酸铁,可用于除去铁锈,B正确;
C.能与胃酸中的盐酸反应,可用于中和胃酸,但与受热易分解无关,C错误;
D.具有还原性,可消耗氧气,可用作食品抗氧化剂,D错误;
故选B。
6.C
【解析】已知W、X、Y、Z为原子序数递增的短周期主族元素, X是地壳中含量最多的元素,则X是O元素,W和Z为同一主族元素,W元素原子最外层电子数是最内层的2倍,则W核外电子排布是2、4,所以W是C元素,Z是Si元素,火星岩石中含有YZX3,则Y是最外层有2个电子,原子序数小于Si大于O元素的Mg元素,然后根据元素周期律及物质的性质分析解答。
根据上述分析可知:W是C,X是O,Y是Mg,Z是Si元素。
A.原子核外电子层数越多,原子半径越大;当原子核外电子层数相同时,原子序数越大,原子半径就越小,所以原子半径:Y(Mg)>Z(Si)>W(C)>X(O),A正确;
B.W是C,X是O,二者形成的简单氢化物分别是CH4、H2O,二者都是由分子构成的物质,由于H2O的分子之间还存在氢键,增加了分子之间的吸引作用,导致物质的熔沸点升高,所以简单氢化物的沸点:X(H2O)>W(CH4),B正确;
C.X是O,Y是Mg,二者形成的化合物MgO是离子化合物,在工业上一般是用电解熔沸点比MgO低的熔融MgCl2的方法冶炼Mg,而不是电解熔融MgO来冶炼Mg,C错误;
D.Z是Si,Si单质能够与NaOH溶液反应产生Na2SiO3、H2,D正确;
故合理选项是C。
7.D
【解析】X、Y、Z、W是四种原子序数依次增大的前20号主族元素,Y原子的最外层电子数为其内层电子数的2倍,则为C元素;Z原子的最外层电子数等于Y原子的核外电子数,则为O元素;W原子的半径是前20号元素中最大的,则为K元素;四种元素原子序数之和为34,则X的原子序数为34-6-8-19=1,故X为H元素。
分析可知X、Y、Z、W分别为H、C、O、K。
A.H与K为同主族元素,选项A正确;
B.金刚石、石墨、C60等为碳元素的同素异形体,O2与O3为氧元素的同素异形体,选项B正确;
C.H与K形成的化合物为离子化合物KH,选项C正确;
D.最简单氢化物的沸点高.低:CH4答案选D。
8.A
【解析】A.与质子数都是92,中子数不同,中子数分别是146、143,因此二者互为同位素,A错误;
B.原子符号左下角为质子数,左上角为质量数,质量数等于质子数与中子数的和。的中子数为235-92=143,B正确;
C.原子核外电子数等于原子核内质子数,则核外电子数为56,C正确;
D.Kr原子核外电子排布是2、8、18、8,根据原子结构与元素在周期表的位置关系可知:Kr在周期表中的位置为第四周期0族,D正确;
故合理选项是A。
9.A
【解析】某锂电池材料的组成与结构如图,因此M是Li。M、W、X、Y、Z是原子序数依次增大的同周期主族元素,Y元素原子的价电子数是W的两倍,根据结构可判断Y位于第ⅥA族,X位于ⅣA族,所以W是B,X是C,Y是O,Z是F,据此解答。
A.该材料中元素原子除Li以外均达到8电子稳定结构,A错误;
B.该材料中X形成碳碳单键、碳氟键和碳氧双键,因此C的化合价为+3价,B正确;
C.元素X与Y原子轨道中含有的未成对电子数相同,均是2个,C正确;
D.核外电子层数越多离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则简单离子半径为,D正确;
答案选A。
10.B
【解析】A.钢是铁和碳的合金,有良好的韧性和机械强度,所以"百炼成钢”蕴含了我国古代劳动人民提升铁合金品质的方法,A正确;
B.茶多酚具有较强的还原性,所以茶多酚常用作抗氧化剂,B错误;
C.从成分可以看出,属于无机非金属材料,C正确;
D.公共交通工具代替私家车出行,低碳环保,D正确;
故选B。
11.B
【解析】X原子半径最大,浓度为0.01 mol·L-1的最高价氧化物对应水化物的pH=12,说明该水化物是强碱,X为Na,Y是Mg,R原子半径最小,R是Cl,W浓度为0.01 mol·L-1的最高价氧化物对应水化物是二元强酸,pH最小,W是硫,N是磷,磷酸是弱酸,M是硅,硅酸微溶,Z是铝,氢氧化铝难溶。
A. 非金属性:Cl>P,气态氢化物的稳定性:R>N,故A正确;
B. Al的最高价氧化物对应的水化物具有两性,但不能溶于稀氨水,故B错误;
C. Y和R形成的化合物MgCl2只含有镁离子和氯离子间的离子键,故C正确;
D. X和M两者最高价氧化物对应的水化物是氢氧化钠和硅酸反应后生成硅酸钠,硅酸钠是强碱弱酸盐水解后呈碱性,溶液的pH>7,故D正确;
故选B。
12.(1)第三周期第IVA族
(2)r(Cl-)>r(O2-)>r(Mg2+)或Cl->O2->Mg2+
(3) NaBr 黄
(4)H2SO4>H3PO4
(5)Al(OH)3+OH-=+2H2O
(6) > 同周期元素从左到右,随着原子序数的递增,原子半径逐渐减小,原子失去电子能力减弱,金属性减弱
【解析】根据元素在周期表中的相对位置可知a~n分别是H、He、C、N、O、F、Na、Mg、Al、Si、P、S、Cl、Br,据此解答。
(1)
j是Si,在元素周期表中的位置是第三周期第IVA族。
(2)
离子核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则e、h、m形成的简单离子其半径由大到小的顺序为r(Cl-)>r(O2-)>r(Mg2+)。
(3)
n与g形成的化合物为NaBr,因此将该化合物进行焰色反应,火焰呈黄色。
(4)
非金属性越强,最高价含氧酸的酸性越强,非金属性S>P,则k、1形成的最高价氧化物的水化物,酸性由强到弱的顺序为H2SO4>H3PO4。
(5)
g的最高价氧化物对应的水化物氢氧化钠与i的最高价氧化物对应的水化物氢氧化铝反应的离子方程式为Al(OH)3+OH-=+2H2O。
(6)
①镁比铝与酸反应更剧烈,说明Mg比Al活泼,所以金属性:Mg>Al,故答案为:>;
②Mg、Al位于同周期,都是金属,同周期元素从左到右,随着原子序数的递增,原子半径逐渐减小,原子失去电子能力减弱,所以金属性:Mg>Al,故答案为:同周期元素从左到右,随着原子序数的递增,原子半径逐渐减小,原子失去电子能力减弱,金属性减弱。
13.(1)过滤
(2)151
(3)
(4)NH4HCO3=NH +HCO
(5)SiO2 + 2NaOH = Na2SiO3 + H2O
【解析】
(1)
豆浆为胶体,可透过滤纸,豆渣粒子直径较大,不能透过滤纸,可用过滤的方法分离,
(2)
个硝酸根离子的物质的量,则R(NO3)3的物质的量为0.5mol,该硝酸盐的摩尔质量为;
(3)
2.8gFe3+的物质的量,硫酸铁的物质的量为0.025mol,则SO的物质的量为0.025mol×3=0.075mol,溶液的体积为,SO的物质的量浓度为 mol/L;
(4)
为可溶性盐,在水溶液中完全电离,电离方程式为NH4HCO3=NH +HCO;
(5)
SiO2是酸性氧化物,与NaOH溶液反应生成正盐硅酸钠和水,反应的化学方程式:SiO2 + 2NaOH = Na2SiO3 + H2O。
14.(1) 弱 NH+H2ONH3·H2O+H+
(2) Na Al3+
(3) Na ac
(4)Cl2+H2S=2HCl+S
【解析】由元素在周期表中的位置可知,①为Be、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为S、⑧为Cl,据此解答。
(1)
元素③的氢化物是共价化合物氨气,电子式为;非金属性O大于N,非金属性越强,简单氢化物越稳定,则此氢化物的稳定性比元素氧的氢化物的稳定性弱;此氢化物与元素⑧的氢化物反应生成的化合物是氯化铵,铵根水解,因此其水溶液呈酸性,离子方程式为NH+H2ONH3·H2O+H+;
(2)
同周期自左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,因此③④⑤⑥元素中,原子半径最大的元素是Na;核外电子层数越多离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,这四种元素形成的简单离子中离子半径最小的是Al3+。
(3)
Na、Al同周期,原子序数增大,金属性减弱,故Na的金属性较强;金属性强弱可以根据与水反应的难易或剧烈程度比较,可以根据最高价氧化物对应水化物的碱性强弱比较,金属性强弱与失去电子难易有关,与失去电子数目多少无关,氢化物稳定性可以比较元素非金属性强弱,不能比较金属性强弱,故ac正确、bd错误,故答案为:Na;ac;
(4)
氯气能和硫化氢反应生成单质硫和氯化氢,可以证明氯元素的非金属性强于硫元素,反应的化学方程式为Cl2+H2S=2HCl+S。
15.(1) ②⑦⑧ ④⑧
(2) O NaOH=Na++OH-
【解析】
(1)
①SO3不电离,不导电,是非电解质;
②澄清石灰水是混合物,导电,不是电解质也不是非电解质;
③液氯是单质,不导电,不是电解质也不是非电解质;
④纯碱不导电,熔融状态下全部电离,是强电解质;
⑤酒精(CH3CH2OH)不电离,不导电,是非电解质;
⑥醋酸不电离,不导电,溶于水部分电离,是弱电解质;
⑦稀硫酸为混合物,导电,不是电解质也不是非电解质;
⑧熔融的氢氧化钠完全电离出阴阳离子,可导电,是强电解质;
以上物质中能导电的是②⑦⑧;属于强电解质的是④⑧。
(2)
根据甲元素M层的电子数是其K层的电子数的1/2,可知甲为钠;乙元素原子核内无中子,可知乙为氢元素;丙元素原子核内有8个质子,可知丙为氧元素。
①丙为氧元素,元素符号O,故答案为O;
②甲、乙、丙三种元素组成的化合物为氢氧化钠,氢氧化钠为强电解质,电离方程式为:NaOH=Na++OH-,故答案为NaOH=Na++OH-;
③甲元素为钠,钠原子的结构示意图:,故答案为。
16.(1)
(2)HClO4
(3)bc
(4)S、Cl位于同一周期,从左到右随核电荷数递增,原子半径逐渐减小,原子核吸引电子的能力逐渐增强,得电子能力逐渐增强,因此,非金属性S弱于Cl
(5) 第四周期第ⅥA族 H2Se 同位素
【解析】
(1)
磷元素的原子序数为15,位于元素周期表第三周期第VA族,根据元素在周期表中所处位置填写磷元素符号见表,故答案为:。
(2)
Cl元素的最高正价为+7价,最高价氧化物对应水化物的化学式为HClO4,故答案为:HClO4。
(3)
a.非金属性强弱与氢化物酸性没有关系,则酸性:HCl>H2SO3不能用元素周期律解释,故a错误;
b.同主族从上到下非金属性逐渐减弱,则非金属性:O>S能用元素周期律解释,故b正确;
c.金属性越强,最高价氧化物的对应水化物的碱性越强,则碱性:NaOH>Mg(OH)2能用元素周期律解释,故c正确;
d.热稳定性:HF<HCl不能用元素周期律解释,故d错误;
答案选:bc。
(4)
S、Cl位于同一周期,从左到右随核电荷数递增,原子半径逐渐减小,原子核吸引电子的能力逐渐增强,得电子能力逐渐增强,非金属性逐渐增强,因此,非金属性S弱于Cl。
(5)
①电子层数=周期序数,主族元素原子的最外层电子数=主族序数。由原子结构可知,Se为34号元素,Se原子有4个电子层,最外层电子数为6,因此在元素周期表中位于第四周期第ⅥA族。
②Se的最低负价为-2价,则Se的气态氢化物的化学式为H2Se。
③和的质子数相同,中子数不同,二者互称为同位素。
17.(1) MnO2+4H++2Cl-Mn2++Cl2+2H2O 0.2 1.2041023
(2) 安静地燃烧,产生苍白色火焰,瓶口有白雾产生 2Fe2++Cl2=2Fe3++2Cl-
(3) 第六周期第VA族 51
(4)43
(5)4:1
【解析】
(1)
二氧化锰氧化浓盐酸生成氯化锰、氯气和水,该反应离子方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O,若将8.7gMnO2(物质的量是0.1mol)投入足量浓盐酸充分反应,根据方程式可知被氧化的HCl的物质的量为0.2molmol,锰元素化合价从+4价降低到+2价,则转移的电子数目为0.2mol×6.02×1023=1.2041023。
(2)
将H2点燃后,将导管缓慢伸入充满Cl2的集气瓶中,二者化合生成氯化氢,现象为安静地燃烧,产生苍白色火焰,瓶口有白雾产生。将Cl2通入新制的FeCl2溶液中,亚铁离子被氧化为铁离子,离子反应方程式为2Fe2++Cl2=2Fe3++2Cl-。
(3)
氮、磷、砷(As)、锑(Sb)、铋(Bi)为元素周期表中原子序数依次增大的同主族元素,因此铋在元素周期表中的位置为第六周期第VA族,As的原子序数是33,则锑的原子序数为33+18=51;
(4)
质子数+中子数=质量数,则Bi的中子数与质子数的差值为209-83-83=43;
(5)
反应中P元素化合价从+1价升高到+5价,失去4个电子,次磷酸作还原剂,Ag元素化合价从+1价降低到0价,银离子作氧化剂,依据电子得失守恒可知氧化剂与还原剂的物质的量之比为4:1。
18.(1) CO2 O
(2) 焰色试验,透过蓝色钴玻璃观察到火焰为浅紫色 或
(3)取少量最后一次洗涤液,向其中加入澄清石灰水,观察是否有沉淀产生,如果没有白色沉淀产生,说明滤渣已洗涤干净
(4)
(5)或
【解析】取KMnO4固体于锥形瓶中,加入适量的草酸(H2C2O4)溶液,振荡,充分反应,可以观察到有黑色沉淀为二氧化锰,溶液变为无色,溶液为碳酸钾或碳酸氢钾,同时生成无色无味的气体M,将燃着的木条靠近锥形瓶瓶口时木条熄灭可推断M为二氧化碳,以此来解析;
(1)
气体M能将燃着的条靠熄灭则M的化学式为CO2,H2C2O4非金属性O>C>H,非金属性最强的是O;
(2)
焰色试验透过蓝色钴玻瑞观察到紫色Na+、K+常通过焰色试验检验,滤液可能为K2CO3或KHCO3为离方程成为:CO+2H+=CO2↑+H2O或HCO+H+=CO2↑+H2O;
(3)
二氧化锰固体含有碳酸钾溶液,碳酸根离子检验,确认滤渣已洗涤干净的操作为:取少量最后一次洗涤液,向其中加入澄清石灰水,观察是否有沉淀产生,如果没有白色沉淀产生,说明滤渣已洗涤干净;
(4)
滤渣为二氧化锰,二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,反应的化学方程式为:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;
(5)
高锰酸钾与草酸溶液发生反应生成了二氧化碳,碳酸钾或碳酸氢钾,二氧化锰,根据元素守恒和化合价升降守恒,可得化学方程式为:2KMnO4+3H2C2O4=K2CO3+5CO2↑+2MnO2↓+3H2O,或2KMnO4+3H2C2O4=2KHCO3+4CO2↑+2MnO2↓+2H2O,反应中KMnO4中Mn的 化合价由+7价降为+4价,两个锰原子的化合价变化,转移电子数目为2×3e-,H2C2O4中C的化合价由+3价升高到+4价,所以H2C2O4为还原剂,单线桥法表示反应中电子的转移为:或;
19.(1) ds 钾钪镓溴
(2)1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1
(3) As>Se>Ga Ga、Se、As处于同一周期,As价电子为4s24p3处于半满结构,比较稳定,第一电离能最大;与Ga比Se原子半径小,核电荷数大,所以第一电离能Ga比Se小
(4) Se +1价
【解析】
(1)
Cu的外围电子排布式为3d104s1,Cu属于第IB族元素,在周期表中位于ds区;
Cu是第四周期的元素,原子的最外层有1个为成对的电子,与铜同周期的所有元素的基态原子中,未成对电子数与铜原子相同的元素还有钾钪镓溴;
(2)
镓是31号元素,核外有31个电子,基态镓(Ga)原子的电子排布式为1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1,故答案为:1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1;
(3)
Ga、Se、As处于同一周期,As价电子为4s24p3处于半满结构,比较稳定,第一电离能最大;与Ga比Se原子半径小,核电荷数大,所以第一电离能Ga比Se小,故Ga、Se与As三种元素第一电离能由大到小的顺序为As>Se>Ga;
(4)
元素非金属性越强其电负性越强,则CIGS含有的四种元素中电负性最强的是Se;根据化合物中各元素化合价代数和为0,CuIn0.5Ga05Se2中In、Ga的化合价均为+3价,Se的化合价为-2价,则Cu的化合价为+1价。
答案第1页,共2页
答案第1页,共2页
一、单选题(共11道题)
1.元素X、Y、Z、Q的原子序数依次增加,金属元素X可用于制备高能电池,Y的一种单质是自然界中硬度最大的物质,Z的最高价氧化物的水化物M与其简单氢化物接触时产生大量白烟,工业上常用Q的单质所制的容器储运M的浓溶液。下列说法一定正确的是
A.X的单质在空气中加热形成的化合物仅含离子键
B.Z的氢化物沸点高于Y的氢化物
C.X、Y、Z的原子半径依次增大
D.Q在空气中能形成致密的氧化膜,是一种抗腐蚀的金属
2.已知R、X、Y、Z、W为原子序数依次增大的短周期主族元素,Y是短周期主族元素中原子半径最大的元素,X与Z同主族,Z的最高正价与最低负价之和为4,R、Y、W的最外层电子数之和为9,且R为非金属元素,下列说法中正确的是
A.Y的最高价氧化物对应的水化物是强酸
B.X与R形成的化合物都具有强氧化性
C.由X和Z形成的化合物ZX2,具有漂白性
D.简单离子半径:Y>W
3.实现中国梦,离不开化学与科技的发展。下列说法不正确的是
A.极地考查船“雪龙2号”船身上镀的锌层可减缓铁制船体遭受的腐蚀
B.中国天眼FAST用到的高性能碳化硅是一种新型的有机高分子材料
C.国产飞机——C919使用的航空煤油可从石油中分馏得到
D.科学家合成世界首个由碳原子构成的具有半导体特性的碳环C18,与C60互为同素异形体
4.下列有关氧化物的性质与用途具有对应关系的是
A.熔点高,可用于制造耐火材料
B.具有氧化性,可用于漂白草编织物
C.硬度大,可用于制作光导纤维
D.具有两性,可用于电解治炼金属铝
5.下列有关物质的性质与用途具有对应关系的是
A.二氧化硅熔点高,可用于制光导纤维
B.稀硫酸具有酸性,可用于除去铁锈
C.受热易分解,可用于制胃酸中和剂
D.具有氧化性,可用作食品抗氧化剂
6.中国首次火星探测任务工程总设计师张荣桥入选《自然》杂志发布的2021年度十大人物。火星大气及岩石中富含W、X、Y、Z四种元素。已知W、X、Y、Z为原子序数递增的短周期主族元素,W和Z为同一主族元素,X是地壳中含量最多的元素,W元素原子最外层电子数是最内层的2倍,火星岩石中含有YZX3。下列说法不正确的是
A.原子半径:Y>Z>W>X B.简单氢化物的沸点:X>W
C.工业上电解熔融YX制备Y单质 D.Z的单质可以和NaOH溶液反应
7.X、Y、Z、W是四种原子序数依次增大的前20号主族元素,Y原子的最外层电子数为其内层电子数的2倍;Z原子的最外层电子数等于Y原子的核外电子数;W原子的半径是前20号元素中最大的,四种元素原子序数之和为34。下列说法错误的是
A.X与W为同主族元素
B.Y、Z的单质均有同素异形体
C.X与W形成化合物为离子化合物
D.最简单氢化物的沸点高低:Y>Z
8.2021年11月9日,烟台海阳市全域从燃煤取暖进入核能供热。核能利用有利于早日实现“碳达峰、碳中和”。核裂变的原理为:,下列说法错误的是
A.与互为同素异形体
B.的中子数为143
C.核外电子数为56
D.Kr在周期表中的位置为第四周期0族
9.锂电池的研究与开发已日臻成熟,某锂电池材料的组成与结构如图。M、W、X、Y、Z是原子序数依次增大的同周期主族元素,Y元素原子的价电子数是W的两倍。下列说法错误的是
A.该材料中元素原子均达到8电子稳定结构 B.该材料中X的化合价为
C.元素X与Y原子轨道中含有的未成对电子数相同 D.简单离子半径为
10.下列说法错误的是
A.“百炼成钢”蕴含了我国古代劳动人民提升铁合金品质的方法
B.福鼎白茶中茶多酚含量很高,因其较强的氧化性,茶多酚常用作抗氧化剂
C.光洁莹润的“德化白瓷”(主要成分)属于无机非金属材料
D.选择公共交通工具代替私家车出行,更有利于低碳环保
11.第三周期主族元素,浓度均为0.01 mol·L-1的最高价氧化物对应水化物的pH与原子半径的关系如图所示。则下列说法不正确的是
A.气态氢化物的稳定性:R>N
B.Z的最高价氧化物对应的水化物能溶于稀氨水
C.Y和R形成的化合物只含有离子键
D.X和M两者最高价氧化物对应的水化物反应后溶液的pH>7
二、填空题(共8道题)
12.下表是元素周期表的一部分。表中所列字母分别代表一种元素。
a b
c d e f
g h i j k l m
n
回答下列问题:
(1)j在元素周期表中的位置是______。
(2)e、h、m形成的简单离子其半径由大到小的顺序为________。(填写离子符号)
(3)n与g形成的化合物为______ (填写化学式,下同),将该化合物进行焰色反应,火焰呈______色。
(4)k、1形成的最高价氧化物的水化物,酸性由强到弱的顺序为______。
(5)g的最高价氧化物对应的水化物与i的最高价氧化物对应的水化物反应的离子方程式为______。
(6)某同学欲探究元素性质递变规律与原子结构的关系,进行如下实验:
(实验操作)取已除去氧化膜且面积相等的镁条和铝条,分别投入2mL1mol/L盐酸中;
(实验现象)镁与酸反应比铝更剧烈;
(实验结论)①金属性:Mg_____Al(选填“>”或“<”);
(查阅资料)原子半径(nm)Mg:0.160 Al:0.143;
(思考)②利用元素周期律对上述实验结论进行解释______。
13.回答下列问题
(1)分离豆浆和豆渣常用的实验方法为___________。
(2)已知R是一种金属,75.5gR(NO3)3中含有个硝酸根离子,则该硝酸盐的摩尔质量为___________g/mol。
(3)在80g密度为dg/cm3的硫酸铁溶液中,含有2.8gFe3+,则此溶液中SO的物质的量浓度为___________mol/L。
(4)在水溶液中的电离方程式为___________。
(5)二氧化硅(SiO2)是酸性氧化物,写出其与NaOH溶液反应的化学方程式:___________。
14.下表是元素周期表的一部分。
族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
二 ① ② ③ ④
三 ⑤ ⑥ ⑦ ⑧
(1)表中元素③的氢化物的电子式为___________;此氢化物的稳定性比元素④的氢化物的稳定性___________(选填“强”或“弱”);此氢化物与元素⑧的氢化物反应生成的化合物其水溶液呈酸性,用离子方程式表示其原因是___________。
(2)③④⑤⑥元素中,原子半径最大的元素是___________(填元素符号);这四种元素形成的简单离子中离子半径最小的是___________(填离子符号)。
(3)⑤、⑥两元素相比较,金属性较强是___________(填元素符号),可以证明该结论的实验是___________。
a.比较这两种元素最高价氧化物对应的水化物的碱性
b.比较这两种元素的气态氢化物的稳定性
c.将这两种元素的单质分别放入冷水中
d.比较这两种元素的单质与酸反应时失电子的数目
(4)请用一个化学方程式证明元素⑦和⑧的非金属性强弱关系___________。
15.回答下列问题:
(1)现有①三氧化硫②澄清石灰水③液氯④纯碱⑤酒精⑥醋酸⑦稀硫酸⑧熔融的氢氧化钠等物质中,属于能导电的是_______,属于强电解质的是_______。
(2)有甲、乙、丙三种元素,甲元素M层的电子数是其K层的电子数的1/2,乙元素原子核内无中子,丙元素原子核内有8个质子。
①写出丙元素的元素符号_______。
②写出甲、乙、丙三种元素组成的化合物在水中的电离方程式_______。
③画出甲元素的离子结构示意图_______。
16.联合国将2019年定为“国际化学元素周期表年”,新版周期表包含118种元素,下表代表元素周期表前四周期,回答下列问题:
(1)将磷的元素符号填写在上述周期表相应的空格中___________。
(2)Cl元素的最高价氧化物对应水化物的化学式为___________。
(3)下列有关性质的比较正确,且能用元素周期律解释的是___________。
a.酸性:HCl>H2SO3 b.非金属性:O>S
c.碱性:NaOH>Mg(OH)2 d.热稳定性:HF<HCl
(4)从原子结构角度解释元素的非金属性S弱于Cl的原因___________。
(5)硒(Se)是人体必需的微量元素,其原子结构示意图为。
①Se在元素周期表中的位置是___________。
②Se的气态氢化物的化学式为____________。
③和互称为___________。
17.I.Cl2是一种重要的化工原料,实验室通常用MnO2和浓盐酸制取Cl2。
(1)写出该反应离子方程式:_______,若将8.7gMnO2投入足量浓盐酸充分反应,被氧化的HCl的物质的量为_______mol,转移的电子数目为_______。
(2)将H2点燃后,将导管缓慢伸入充满Cl2的集气瓶中,现象为_______。将Cl2通入新制的FeCl2溶液中离子反应方程式为_______。
II.氮、磷、砷(As)、锑(Sb)、铋(Bi)为元素周期表中原子序数依次增大的同主族元素。回答下列问题:
(3)铋在元素周期表中的位置为_______,锑的原子序数为_______
(4)Bi的中子数与质子数的差值为_______
(5)次磷酸(H3PO2)是一种精细化工产品,具有较强的还原性。它可将溶液中的银离子还原为银单质,氧化产物为H3PO4。利用H3PO2进行化学镀银时,氧化剂与还原剂的物质的量之比为_______。
18.某化学兴趣小组设计如下实验探究KMnO4固体与草酸(H2C2O4)反应的产物,以其产物为原料制备氯气:室温下,取KMnO4固体于锥形瓶中,加入适量的草酸(H2C2O4)溶液,振荡,充分反应,可以观察到有黑色沉淀产生,溶液变为无色,同时生成无色无味的气体M,将燃着的木条靠近锥形瓶瓶口时木条熄灭。分析实验并回答相应问题。
(1)M的化学式是_____,组成草酸的三种元素中,非金属性最强的是_____(填元素符号)。
(2)将充分反应后的混合物过滤,检验滤液中金属阳离子的方法及现象为_____,向滤液中加入盐酸时又产生无色无味气体,该反应的离子方程式为______。
(3)将过滤得到的滤渣洗涤干净,确认滤渣已洗涤干净的操作是_____。
(4)将滤渣加入浓盐酸中加热,产生黄绿色气体,该反应的离子方程式为_____。
(5)写出高锰酸钾与草酸溶液发生反应的化学方程式,并用单线桥法表示反应中电子的转移情况:______。
19.废旧太阳能电池具有较高的回收利用价值,其主要组成CIGS的化学式可写为CuIn0.5Ga05Se2;回答下列问题:
(1)Cu在元素周期表中属于_______分区。同周期元素基态原子中与其未成对电子数相同的原子还有_______(写元素名称)。
(2)Ga、In与Al同主族,写出Ga基态原子电子排布式_______。
(3)Ga、Se与As同周期,推测这三种元素第一电离能由大到小的顺序_______(用元素符号表示),推测的理由是_______。
(4)CIGS含有的四种元素中电负性最强的是_______(用元素符号表示),Cu的化合价为_______。
试卷第1页,共3页
试卷第1页,共3页
(北京)股份有限公司
(北京)股份有限公司
参考答案:
1.A
【解析】金属元素X可用于制备高能电池,X是Li元素;Y的一种单质是自然界中硬度最大的物质,Y是C元素;Z的最高价氧化物的水化物M与其简单氢化物接触时产生大量白烟,Z是N元素、M是硝酸;工业上常用Q的单质所制的容器储运浓硝酸,Q是Al或Fe元素。
A.X是Li,Li在空气中加热形成生成Li2O,仅含离子键,故A正确;
B.Y是C,Z是N,C元素能形成多种氢化物,有些氢化物呈固态,所以Z(N)的氢化物沸点不一定高于Y(C)的氢化物,故B错误;
C.X、Y、Z依次为Li、C、N,Li、C、N的原子半径依次减小,故C错误;
D.若Q是Fe,Fe的氧化膜疏松,易被腐蚀,故D错误;
选A。
2.C
【解析】已知R、X、Y、Z、W为原子序数依次增大的短周期主族元素,Y是短周期主族元素中原子半径最大的元素,则Y为Na元素;X与Z同主族,Z的最高正价与最低负价之和为4,则Z为S元素、X为O元素;R、Y、W的最外层电子数之和为9,且R为非金属元素,原子序数W>Z,且为短周期的主族元素,则W为Cl,R+1+7=9,解得R=1,又因R为非金属元素,则R为H元素,综上R、X、Y、Z、W分别为H、O、Na、S、Cl元素,据此分析可得;
A.Y为11号Na元素,则其最高价氧化物对应的水化物为NaOH,是强碱,故A错;
B.R、X分别为H、O,则其形成的化和物有,其中只有具有强氧化性,故B错;
C.X、Z分别为O、S,则其形成化合物SO2,为能具有漂白性的化合物,故C正确;
D.Y、W分别为Na、Cl元素,则其简单离子分别为10电子结构的和18电子结构的,则离子半径,故D错;
答案选C。
3.B
【解析】A.在船体上镶嵌锌块,形成锌铁原电池,锌比铁活泼,锌作阳极不断被腐蚀,铁做阴极则不会被腐蚀,选项A正确;
B.中国天眼FAST用到的高性能碳化硅又名金刚砂,是用石英砂、石油焦(或煤焦)、木屑等原料通过电阻炉高温冶炼而成,是一种新型的无机非金属材料,选项B不正确;
C.客机所用的燃料油是航空煤油,是石油分馏得到的,选项C正确;
D.由碳原子构成的具有半导体特性的碳环C18,与C60均由碳元素形成的不同单质,互为同素异形体,选项D正确;
答案选B。
4.A
【解析】A.氧化镁是熔点高的离子化合物,常用于制造耐火材料,故A正确;
B.二氧化硫具有漂白性,可用于漂白草编织物,故B错误;
C.二氧化硅对光具有良好的全反射作用,常用于制作光导纤维,故C错误;
D.氧化铝是离子化合物,熔融状态下能导电,可用于电解治炼金属铝,故D错误;
故选A。
5.B
【解析】A.二氧化硅晶体能对光产生全反射,能传递光信号,所以二氧化硅晶体可用于制光导纤维,与熔点无关,A错误;
B.稀硫酸具有酸性,可与氧化铁反应生成硫酸铁,可用于除去铁锈,B正确;
C.能与胃酸中的盐酸反应,可用于中和胃酸,但与受热易分解无关,C错误;
D.具有还原性,可消耗氧气,可用作食品抗氧化剂,D错误;
故选B。
6.C
【解析】已知W、X、Y、Z为原子序数递增的短周期主族元素, X是地壳中含量最多的元素,则X是O元素,W和Z为同一主族元素,W元素原子最外层电子数是最内层的2倍,则W核外电子排布是2、4,所以W是C元素,Z是Si元素,火星岩石中含有YZX3,则Y是最外层有2个电子,原子序数小于Si大于O元素的Mg元素,然后根据元素周期律及物质的性质分析解答。
根据上述分析可知:W是C,X是O,Y是Mg,Z是Si元素。
A.原子核外电子层数越多,原子半径越大;当原子核外电子层数相同时,原子序数越大,原子半径就越小,所以原子半径:Y(Mg)>Z(Si)>W(C)>X(O),A正确;
B.W是C,X是O,二者形成的简单氢化物分别是CH4、H2O,二者都是由分子构成的物质,由于H2O的分子之间还存在氢键,增加了分子之间的吸引作用,导致物质的熔沸点升高,所以简单氢化物的沸点:X(H2O)>W(CH4),B正确;
C.X是O,Y是Mg,二者形成的化合物MgO是离子化合物,在工业上一般是用电解熔沸点比MgO低的熔融MgCl2的方法冶炼Mg,而不是电解熔融MgO来冶炼Mg,C错误;
D.Z是Si,Si单质能够与NaOH溶液反应产生Na2SiO3、H2,D正确;
故合理选项是C。
7.D
【解析】X、Y、Z、W是四种原子序数依次增大的前20号主族元素,Y原子的最外层电子数为其内层电子数的2倍,则为C元素;Z原子的最外层电子数等于Y原子的核外电子数,则为O元素;W原子的半径是前20号元素中最大的,则为K元素;四种元素原子序数之和为34,则X的原子序数为34-6-8-19=1,故X为H元素。
分析可知X、Y、Z、W分别为H、C、O、K。
A.H与K为同主族元素,选项A正确;
B.金刚石、石墨、C60等为碳元素的同素异形体,O2与O3为氧元素的同素异形体,选项B正确;
C.H与K形成的化合物为离子化合物KH,选项C正确;
D.最简单氢化物的沸点高.低:CH4
8.A
【解析】A.与质子数都是92,中子数不同,中子数分别是146、143,因此二者互为同位素,A错误;
B.原子符号左下角为质子数,左上角为质量数,质量数等于质子数与中子数的和。的中子数为235-92=143,B正确;
C.原子核外电子数等于原子核内质子数,则核外电子数为56,C正确;
D.Kr原子核外电子排布是2、8、18、8,根据原子结构与元素在周期表的位置关系可知:Kr在周期表中的位置为第四周期0族,D正确;
故合理选项是A。
9.A
【解析】某锂电池材料的组成与结构如图,因此M是Li。M、W、X、Y、Z是原子序数依次增大的同周期主族元素,Y元素原子的价电子数是W的两倍,根据结构可判断Y位于第ⅥA族,X位于ⅣA族,所以W是B,X是C,Y是O,Z是F,据此解答。
A.该材料中元素原子除Li以外均达到8电子稳定结构,A错误;
B.该材料中X形成碳碳单键、碳氟键和碳氧双键,因此C的化合价为+3价,B正确;
C.元素X与Y原子轨道中含有的未成对电子数相同,均是2个,C正确;
D.核外电子层数越多离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则简单离子半径为,D正确;
答案选A。
10.B
【解析】A.钢是铁和碳的合金,有良好的韧性和机械强度,所以"百炼成钢”蕴含了我国古代劳动人民提升铁合金品质的方法,A正确;
B.茶多酚具有较强的还原性,所以茶多酚常用作抗氧化剂,B错误;
C.从成分可以看出,属于无机非金属材料,C正确;
D.公共交通工具代替私家车出行,低碳环保,D正确;
故选B。
11.B
【解析】X原子半径最大,浓度为0.01 mol·L-1的最高价氧化物对应水化物的pH=12,说明该水化物是强碱,X为Na,Y是Mg,R原子半径最小,R是Cl,W浓度为0.01 mol·L-1的最高价氧化物对应水化物是二元强酸,pH最小,W是硫,N是磷,磷酸是弱酸,M是硅,硅酸微溶,Z是铝,氢氧化铝难溶。
A. 非金属性:Cl>P,气态氢化物的稳定性:R>N,故A正确;
B. Al的最高价氧化物对应的水化物具有两性,但不能溶于稀氨水,故B错误;
C. Y和R形成的化合物MgCl2只含有镁离子和氯离子间的离子键,故C正确;
D. X和M两者最高价氧化物对应的水化物是氢氧化钠和硅酸反应后生成硅酸钠,硅酸钠是强碱弱酸盐水解后呈碱性,溶液的pH>7,故D正确;
故选B。
12.(1)第三周期第IVA族
(2)r(Cl-)>r(O2-)>r(Mg2+)或Cl->O2->Mg2+
(3) NaBr 黄
(4)H2SO4>H3PO4
(5)Al(OH)3+OH-=+2H2O
(6) > 同周期元素从左到右,随着原子序数的递增,原子半径逐渐减小,原子失去电子能力减弱,金属性减弱
【解析】根据元素在周期表中的相对位置可知a~n分别是H、He、C、N、O、F、Na、Mg、Al、Si、P、S、Cl、Br,据此解答。
(1)
j是Si,在元素周期表中的位置是第三周期第IVA族。
(2)
离子核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则e、h、m形成的简单离子其半径由大到小的顺序为r(Cl-)>r(O2-)>r(Mg2+)。
(3)
n与g形成的化合物为NaBr,因此将该化合物进行焰色反应,火焰呈黄色。
(4)
非金属性越强,最高价含氧酸的酸性越强,非金属性S>P,则k、1形成的最高价氧化物的水化物,酸性由强到弱的顺序为H2SO4>H3PO4。
(5)
g的最高价氧化物对应的水化物氢氧化钠与i的最高价氧化物对应的水化物氢氧化铝反应的离子方程式为Al(OH)3+OH-=+2H2O。
(6)
①镁比铝与酸反应更剧烈,说明Mg比Al活泼,所以金属性:Mg>Al,故答案为:>;
②Mg、Al位于同周期,都是金属,同周期元素从左到右,随着原子序数的递增,原子半径逐渐减小,原子失去电子能力减弱,所以金属性:Mg>Al,故答案为:同周期元素从左到右,随着原子序数的递增,原子半径逐渐减小,原子失去电子能力减弱,金属性减弱。
13.(1)过滤
(2)151
(3)
(4)NH4HCO3=NH +HCO
(5)SiO2 + 2NaOH = Na2SiO3 + H2O
【解析】
(1)
豆浆为胶体,可透过滤纸,豆渣粒子直径较大,不能透过滤纸,可用过滤的方法分离,
(2)
个硝酸根离子的物质的量,则R(NO3)3的物质的量为0.5mol,该硝酸盐的摩尔质量为;
(3)
2.8gFe3+的物质的量,硫酸铁的物质的量为0.025mol,则SO的物质的量为0.025mol×3=0.075mol,溶液的体积为,SO的物质的量浓度为 mol/L;
(4)
为可溶性盐,在水溶液中完全电离,电离方程式为NH4HCO3=NH +HCO;
(5)
SiO2是酸性氧化物,与NaOH溶液反应生成正盐硅酸钠和水,反应的化学方程式:SiO2 + 2NaOH = Na2SiO3 + H2O。
14.(1) 弱 NH+H2ONH3·H2O+H+
(2) Na Al3+
(3) Na ac
(4)Cl2+H2S=2HCl+S
【解析】由元素在周期表中的位置可知,①为Be、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为S、⑧为Cl,据此解答。
(1)
元素③的氢化物是共价化合物氨气,电子式为;非金属性O大于N,非金属性越强,简单氢化物越稳定,则此氢化物的稳定性比元素氧的氢化物的稳定性弱;此氢化物与元素⑧的氢化物反应生成的化合物是氯化铵,铵根水解,因此其水溶液呈酸性,离子方程式为NH+H2ONH3·H2O+H+;
(2)
同周期自左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,因此③④⑤⑥元素中,原子半径最大的元素是Na;核外电子层数越多离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,这四种元素形成的简单离子中离子半径最小的是Al3+。
(3)
Na、Al同周期,原子序数增大,金属性减弱,故Na的金属性较强;金属性强弱可以根据与水反应的难易或剧烈程度比较,可以根据最高价氧化物对应水化物的碱性强弱比较,金属性强弱与失去电子难易有关,与失去电子数目多少无关,氢化物稳定性可以比较元素非金属性强弱,不能比较金属性强弱,故ac正确、bd错误,故答案为:Na;ac;
(4)
氯气能和硫化氢反应生成单质硫和氯化氢,可以证明氯元素的非金属性强于硫元素,反应的化学方程式为Cl2+H2S=2HCl+S。
15.(1) ②⑦⑧ ④⑧
(2) O NaOH=Na++OH-
【解析】
(1)
①SO3不电离,不导电,是非电解质;
②澄清石灰水是混合物,导电,不是电解质也不是非电解质;
③液氯是单质,不导电,不是电解质也不是非电解质;
④纯碱不导电,熔融状态下全部电离,是强电解质;
⑤酒精(CH3CH2OH)不电离,不导电,是非电解质;
⑥醋酸不电离,不导电,溶于水部分电离,是弱电解质;
⑦稀硫酸为混合物,导电,不是电解质也不是非电解质;
⑧熔融的氢氧化钠完全电离出阴阳离子,可导电,是强电解质;
以上物质中能导电的是②⑦⑧;属于强电解质的是④⑧。
(2)
根据甲元素M层的电子数是其K层的电子数的1/2,可知甲为钠;乙元素原子核内无中子,可知乙为氢元素;丙元素原子核内有8个质子,可知丙为氧元素。
①丙为氧元素,元素符号O,故答案为O;
②甲、乙、丙三种元素组成的化合物为氢氧化钠,氢氧化钠为强电解质,电离方程式为:NaOH=Na++OH-,故答案为NaOH=Na++OH-;
③甲元素为钠,钠原子的结构示意图:,故答案为。
16.(1)
(2)HClO4
(3)bc
(4)S、Cl位于同一周期,从左到右随核电荷数递增,原子半径逐渐减小,原子核吸引电子的能力逐渐增强,得电子能力逐渐增强,因此,非金属性S弱于Cl
(5) 第四周期第ⅥA族 H2Se 同位素
【解析】
(1)
磷元素的原子序数为15,位于元素周期表第三周期第VA族,根据元素在周期表中所处位置填写磷元素符号见表,故答案为:。
(2)
Cl元素的最高正价为+7价,最高价氧化物对应水化物的化学式为HClO4,故答案为:HClO4。
(3)
a.非金属性强弱与氢化物酸性没有关系,则酸性:HCl>H2SO3不能用元素周期律解释,故a错误;
b.同主族从上到下非金属性逐渐减弱,则非金属性:O>S能用元素周期律解释,故b正确;
c.金属性越强,最高价氧化物的对应水化物的碱性越强,则碱性:NaOH>Mg(OH)2能用元素周期律解释,故c正确;
d.热稳定性:HF<HCl不能用元素周期律解释,故d错误;
答案选:bc。
(4)
S、Cl位于同一周期,从左到右随核电荷数递增,原子半径逐渐减小,原子核吸引电子的能力逐渐增强,得电子能力逐渐增强,非金属性逐渐增强,因此,非金属性S弱于Cl。
(5)
①电子层数=周期序数,主族元素原子的最外层电子数=主族序数。由原子结构可知,Se为34号元素,Se原子有4个电子层,最外层电子数为6,因此在元素周期表中位于第四周期第ⅥA族。
②Se的最低负价为-2价,则Se的气态氢化物的化学式为H2Se。
③和的质子数相同,中子数不同,二者互称为同位素。
17.(1) MnO2+4H++2Cl-Mn2++Cl2+2H2O 0.2 1.2041023
(2) 安静地燃烧,产生苍白色火焰,瓶口有白雾产生 2Fe2++Cl2=2Fe3++2Cl-
(3) 第六周期第VA族 51
(4)43
(5)4:1
【解析】
(1)
二氧化锰氧化浓盐酸生成氯化锰、氯气和水,该反应离子方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O,若将8.7gMnO2(物质的量是0.1mol)投入足量浓盐酸充分反应,根据方程式可知被氧化的HCl的物质的量为0.2molmol,锰元素化合价从+4价降低到+2价,则转移的电子数目为0.2mol×6.02×1023=1.2041023。
(2)
将H2点燃后,将导管缓慢伸入充满Cl2的集气瓶中,二者化合生成氯化氢,现象为安静地燃烧,产生苍白色火焰,瓶口有白雾产生。将Cl2通入新制的FeCl2溶液中,亚铁离子被氧化为铁离子,离子反应方程式为2Fe2++Cl2=2Fe3++2Cl-。
(3)
氮、磷、砷(As)、锑(Sb)、铋(Bi)为元素周期表中原子序数依次增大的同主族元素,因此铋在元素周期表中的位置为第六周期第VA族,As的原子序数是33,则锑的原子序数为33+18=51;
(4)
质子数+中子数=质量数,则Bi的中子数与质子数的差值为209-83-83=43;
(5)
反应中P元素化合价从+1价升高到+5价,失去4个电子,次磷酸作还原剂,Ag元素化合价从+1价降低到0价,银离子作氧化剂,依据电子得失守恒可知氧化剂与还原剂的物质的量之比为4:1。
18.(1) CO2 O
(2) 焰色试验,透过蓝色钴玻璃观察到火焰为浅紫色 或
(3)取少量最后一次洗涤液,向其中加入澄清石灰水,观察是否有沉淀产生,如果没有白色沉淀产生,说明滤渣已洗涤干净
(4)
(5)或
【解析】取KMnO4固体于锥形瓶中,加入适量的草酸(H2C2O4)溶液,振荡,充分反应,可以观察到有黑色沉淀为二氧化锰,溶液变为无色,溶液为碳酸钾或碳酸氢钾,同时生成无色无味的气体M,将燃着的木条靠近锥形瓶瓶口时木条熄灭可推断M为二氧化碳,以此来解析;
(1)
气体M能将燃着的条靠熄灭则M的化学式为CO2,H2C2O4非金属性O>C>H,非金属性最强的是O;
(2)
焰色试验透过蓝色钴玻瑞观察到紫色Na+、K+常通过焰色试验检验,滤液可能为K2CO3或KHCO3为离方程成为:CO+2H+=CO2↑+H2O或HCO+H+=CO2↑+H2O;
(3)
二氧化锰固体含有碳酸钾溶液,碳酸根离子检验,确认滤渣已洗涤干净的操作为:取少量最后一次洗涤液,向其中加入澄清石灰水,观察是否有沉淀产生,如果没有白色沉淀产生,说明滤渣已洗涤干净;
(4)
滤渣为二氧化锰,二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,反应的化学方程式为:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;
(5)
高锰酸钾与草酸溶液发生反应生成了二氧化碳,碳酸钾或碳酸氢钾,二氧化锰,根据元素守恒和化合价升降守恒,可得化学方程式为:2KMnO4+3H2C2O4=K2CO3+5CO2↑+2MnO2↓+3H2O,或2KMnO4+3H2C2O4=2KHCO3+4CO2↑+2MnO2↓+2H2O,反应中KMnO4中Mn的 化合价由+7价降为+4价,两个锰原子的化合价变化,转移电子数目为2×3e-,H2C2O4中C的化合价由+3价升高到+4价,所以H2C2O4为还原剂,单线桥法表示反应中电子的转移为:或;
19.(1) ds 钾钪镓溴
(2)1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1
(3) As>Se>Ga Ga、Se、As处于同一周期,As价电子为4s24p3处于半满结构,比较稳定,第一电离能最大;与Ga比Se原子半径小,核电荷数大,所以第一电离能Ga比Se小
(4) Se +1价
【解析】
(1)
Cu的外围电子排布式为3d104s1,Cu属于第IB族元素,在周期表中位于ds区;
Cu是第四周期的元素,原子的最外层有1个为成对的电子,与铜同周期的所有元素的基态原子中,未成对电子数与铜原子相同的元素还有钾钪镓溴;
(2)
镓是31号元素,核外有31个电子,基态镓(Ga)原子的电子排布式为1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1,故答案为:1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1;
(3)
Ga、Se、As处于同一周期,As价电子为4s24p3处于半满结构,比较稳定,第一电离能最大;与Ga比Se原子半径小,核电荷数大,所以第一电离能Ga比Se小,故Ga、Se与As三种元素第一电离能由大到小的顺序为As>Se>Ga;
(4)
元素非金属性越强其电负性越强,则CIGS含有的四种元素中电负性最强的是Se;根据化合物中各元素化合价代数和为0,CuIn0.5Ga05Se2中In、Ga的化合价均为+3价,Se的化合价为-2价,则Cu的化合价为+1价。
答案第1页,共2页
答案第1页,共2页
