硝酸的性质
图片预览




文档简介
课件19张PPT。第三课时 硝酸
硝酸的物理性质
硝酸的化学性质
硝酸的用途硝酸的性质 挥发刺激性无(2)能与水任意比互溶. 常用浓硝酸质量分数为69%。质量分数为95%以上的硝酸为“发烟硝酸”。(3)纯HNO3的沸点是83℃,密度为1.5g/cm3。 1.酸的通性(HNO3=H++NO3-)(1).使指示剂变色;
(2).与碱反应;
(3).与碱性氧化物反应;
(4).与某些盐起反应
HNO3+NaOH=NaNO3+H2O2HNO3+CaO=Ca(NO3)2+H2O
2HNO3 +CaCO3=Ca(NO3)2+CO2 ↑ +H2O
?硝酸与绝大多数金属反应,且不产生氢气二、硝酸的化学性质2、强氧化性要点一、HNO3 不管浓稀都具有强氧化
性,且氧化性浓HNO3 > 稀HNO3要点二、 HNO3的强氧化性的具体体现:1、与金属反应2、与非金属反应3、与还原性的化合物反应Cu与浓HNO3反应:
现象:
结论:反应剧烈铜丝溶解,溶液变绿,有红棕色气体生成。铜可与浓硝酸反应,并生成
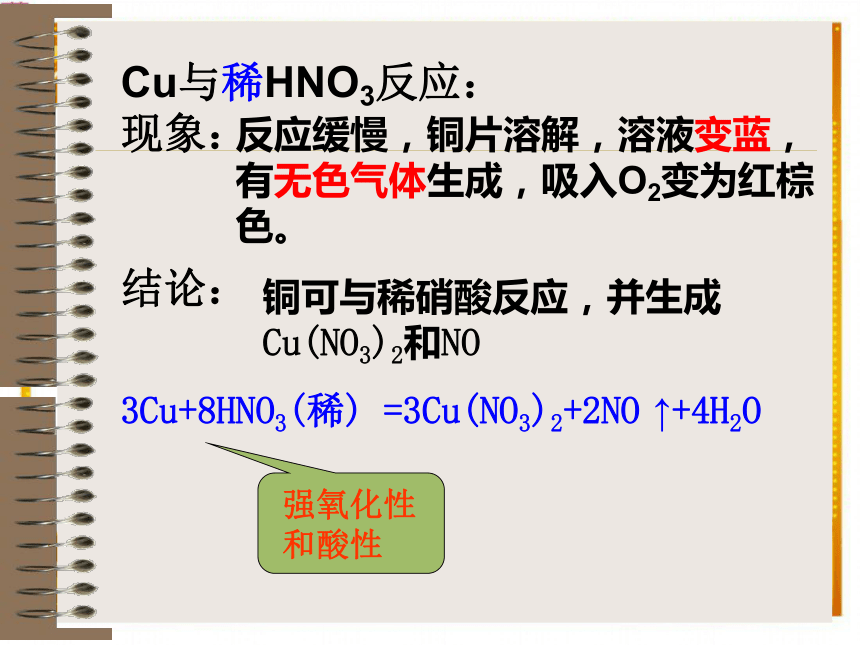
Cu(NO3)2和NO2Cu+4HNO3(浓) = Cu(NO3)2+2NO2 ↑+2H2OCu与稀HNO3反应:
现象:
结论:反应缓慢,铜片溶解,溶液变蓝,有无色气体生成,吸入O2变为红棕色。铜可与稀硝酸反应,并生成
Cu(NO3)2和NO3Cu+8HNO3(稀) =3Cu(NO3)2+2NO ↑+4H2O2、强氧化性A、金属与HNO3反应时,金属被氧化成硝酸盐:
R+HNO3→R(NO3)x+NOx+H2O
一般情况下:浓HNO3被还原为NO2 ,
稀HNO3被还原为NO 。
1)与金属反应:HNO3可与绝大多数金属反应
(除Pt、Au外)B、硝酸浓度越高氧化性越强.浓HNO3>稀HNO3C、常温下,浓硝酸使铁、铝等金属钝化.其原 因是 在铁、铝表面氧化生成一层致密的氧化膜,阻止反应进一步发生。如果加热,则发生反应
与任何金属反应均不生成H2 ,说明呈现氧化性的不是H+而是HNO3,但由于H+的量决定HNO3的量,所以硝酸发生化学反应时要特别关注H+的浓度与金属反应单独的NO3-没有氧化性.必须同时有H+氧化性酸===酸的氧化性?B
P
C
S
I2+4 HNO3(浓) H3BO3
H3PO4
CO2
H2SO4
HIO3+ 4NO2+2H2O2)与非金属反应如含S2- 、SO32- 、Fe2+ 、I-等的化合物反应。 3FeO+10HNO3(稀)=3Fe(NO3)3+NO↑+5H2O3H2S+2HNO3(稀)=3S↓+2NO↑+4H2O3)与还原性化合物反应 玻尔是丹麦著名的物理学家,曾获
得诺贝尔奖。第二次世界大战期间,由于
德军即将占领丹麦,玻尔被迫要离开自己
的祖国。他坚信以后一定能再返祖国,决
定把心爱的诺贝尔奖章留下。为了不使
奖章落入德军手中,他将诺贝尔金质奖章溶解在一种溶液里,装于玻璃瓶中,然后将它放在柜面上。后来,纳粹分子窜进玻尔的住宅,那瓶溶有奖章的溶液就在眼皮底下,他们却一无所知。这是一个多么聪明的办法啊!
玻尔巧藏诺贝尔金质奖章那么波尔到底是用什么来溶解金的呢?王 水V[HNO3(aq)]:V[HCl(aq)]=1:3原来他用的溶液叫王水。王水是浓硝酸和浓盐酸按1:3的体积比配制成的的混和溶液。 注意:①稀硝酸遇石蕊变红(体现酸性),
②浓硝酸遇石蕊先变红(体现酸性),
加热后褪色(体现强氧化性)。己知紫色石蕊试液滴入硝酸现象如下:
分别体现了浓硝酸和稀硝酸的什么性质?久置的硝酸为何会变黄?3、不稳定性:棕色瓶、低温、避光保存。(HNO3浓度越高,越易分解)溶液变黄:因为浓硝酸不稳定分解产生
NO2又溶于硝酸所致。见光易分解的物质:如浓HNO3 、氯水、AgBr、AgI 等。信息一:浓硝酸需放在棕色瓶中信息二:NO2呈红棕色思考题1工业上拟用Cu与适量的硝酸来制备Cu(NO3)2 ,下面是三位同学提出的三个方案:甲: 铜浓硝酸乙: 铜稀硝酸丙: 铜空气△硝酸请问:那一种方案最好?为什么?Cu(NO3)2Cu(NO3)2Cu(NO3)2CuO结论:丙节省硝酸且无污染气体生产思考21.92gCu与浓硝酸反应,铜溶解,生产气体1.12L,求反应的硝酸的物质的量? 硝 酸物理性质化学性质1.不稳定性
2. 强酸性
3.强氧化性
(1)与金属Cu
(2)与非金属C
(3)与低价化合物二、有关硝酸的计算⑴ 得失电子守恒⑶ 溶液中电荷守恒⑵ 原子守恒三
个
守
恒总 结一、硝酸的强氧化性
硝酸的物理性质
硝酸的化学性质
硝酸的用途硝酸的性质 挥发刺激性无(2)能与水任意比互溶. 常用浓硝酸质量分数为69%。质量分数为95%以上的硝酸为“发烟硝酸”。(3)纯HNO3的沸点是83℃,密度为1.5g/cm3。 1.酸的通性(HNO3=H++NO3-)(1).使指示剂变色;
(2).与碱反应;
(3).与碱性氧化物反应;
(4).与某些盐起反应
HNO3+NaOH=NaNO3+H2O2HNO3+CaO=Ca(NO3)2+H2O
2HNO3 +CaCO3=Ca(NO3)2+CO2 ↑ +H2O
?硝酸与绝大多数金属反应,且不产生氢气二、硝酸的化学性质2、强氧化性要点一、HNO3 不管浓稀都具有强氧化
性,且氧化性浓HNO3 > 稀HNO3要点二、 HNO3的强氧化性的具体体现:1、与金属反应2、与非金属反应3、与还原性的化合物反应Cu与浓HNO3反应:
现象:
结论:反应剧烈铜丝溶解,溶液变绿,有红棕色气体生成。铜可与浓硝酸反应,并生成
Cu(NO3)2和NO2Cu+4HNO3(浓) = Cu(NO3)2+2NO2 ↑+2H2OCu与稀HNO3反应:
现象:
结论:反应缓慢,铜片溶解,溶液变蓝,有无色气体生成,吸入O2变为红棕色。铜可与稀硝酸反应,并生成
Cu(NO3)2和NO3Cu+8HNO3(稀) =3Cu(NO3)2+2NO ↑+4H2O2、强氧化性A、金属与HNO3反应时,金属被氧化成硝酸盐:
R+HNO3→R(NO3)x+NOx+H2O
一般情况下:浓HNO3被还原为NO2 ,
稀HNO3被还原为NO 。
1)与金属反应:HNO3可与绝大多数金属反应
(除Pt、Au外)B、硝酸浓度越高氧化性越强.浓HNO3>稀HNO3C、常温下,浓硝酸使铁、铝等金属钝化.其原 因是 在铁、铝表面氧化生成一层致密的氧化膜,阻止反应进一步发生。如果加热,则发生反应
与任何金属反应均不生成H2 ,说明呈现氧化性的不是H+而是HNO3,但由于H+的量决定HNO3的量,所以硝酸发生化学反应时要特别关注H+的浓度与金属反应单独的NO3-没有氧化性.必须同时有H+氧化性酸===酸的氧化性?B
P
C
S
I2+4 HNO3(浓) H3BO3
H3PO4
CO2
H2SO4
HIO3+ 4NO2+2H2O2)与非金属反应如含S2- 、SO32- 、Fe2+ 、I-等的化合物反应。 3FeO+10HNO3(稀)=3Fe(NO3)3+NO↑+5H2O3H2S+2HNO3(稀)=3S↓+2NO↑+4H2O3)与还原性化合物反应 玻尔是丹麦著名的物理学家,曾获
得诺贝尔奖。第二次世界大战期间,由于
德军即将占领丹麦,玻尔被迫要离开自己
的祖国。他坚信以后一定能再返祖国,决
定把心爱的诺贝尔奖章留下。为了不使
奖章落入德军手中,他将诺贝尔金质奖章溶解在一种溶液里,装于玻璃瓶中,然后将它放在柜面上。后来,纳粹分子窜进玻尔的住宅,那瓶溶有奖章的溶液就在眼皮底下,他们却一无所知。这是一个多么聪明的办法啊!
玻尔巧藏诺贝尔金质奖章那么波尔到底是用什么来溶解金的呢?王 水V[HNO3(aq)]:V[HCl(aq)]=1:3原来他用的溶液叫王水。王水是浓硝酸和浓盐酸按1:3的体积比配制成的的混和溶液。 注意:①稀硝酸遇石蕊变红(体现酸性),
②浓硝酸遇石蕊先变红(体现酸性),
加热后褪色(体现强氧化性)。己知紫色石蕊试液滴入硝酸现象如下:
分别体现了浓硝酸和稀硝酸的什么性质?久置的硝酸为何会变黄?3、不稳定性:棕色瓶、低温、避光保存。(HNO3浓度越高,越易分解)溶液变黄:因为浓硝酸不稳定分解产生
NO2又溶于硝酸所致。见光易分解的物质:如浓HNO3 、氯水、AgBr、AgI 等。信息一:浓硝酸需放在棕色瓶中信息二:NO2呈红棕色思考题1工业上拟用Cu与适量的硝酸来制备Cu(NO3)2 ,下面是三位同学提出的三个方案:甲: 铜浓硝酸乙: 铜稀硝酸丙: 铜空气△硝酸请问:那一种方案最好?为什么?Cu(NO3)2Cu(NO3)2Cu(NO3)2CuO结论:丙节省硝酸且无污染气体生产思考21.92gCu与浓硝酸反应,铜溶解,生产气体1.12L,求反应的硝酸的物质的量? 硝 酸物理性质化学性质1.不稳定性
2. 强酸性
3.强氧化性
(1)与金属Cu
(2)与非金属C
(3)与低价化合物二、有关硝酸的计算⑴ 得失电子守恒⑶ 溶液中电荷守恒⑵ 原子守恒三
个
守
恒总 结一、硝酸的强氧化性
