江苏省顶级名校2021-2022学年高三上学期寒假自检试卷 化学
文档属性
| 名称 | 江苏省顶级名校2021-2022学年高三上学期寒假自检试卷 化学 |  | |
| 格式 | zip | ||
| 文件大小 | 727.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-03 19:30:58 | ||
图片预览



文档简介
寒假高三化学自测卷
一、单项选择题:共14题,每题3分,共42分
1.书法是中华文化之瑰宝,书法之美尽在“笔墨纸砚”之间。下列说法正确的是
A.制作笔尖的“狼毫”的主要成分是纤维素 B.墨汁是一种分散系
C.宣纸的主要成分属于无机物 D.石材雕刻制砚的过程是化学变化
2.下列说法正确的是
A.H2O与H2O2互为同素异形体 B.氡()质量数为86
C.CH3CH2OH与CH3OCH3互为同分异构体 D.HCl含非极性共价键
3.实验室处理含FeBr3废催化剂的溶液,可得到溴的苯溶液和无水FeCl3(已知FeCl3在HCl的气流中加热才可以得到FeCl3固体)下列做法能达到相应实验目的的是
A.用装置甲制取Cl2
B.用装置乙使Br-转化为Br2
C.用装置丙分液,先放出水层,再倒出溴的苯溶液
D.用装置丁将分液后的水层蒸干获得无水FeCl3
4.下列有关物质性质与用途具有对应关系的是
A.浓硫酸具有吸水性,可用于干燥NH3
B.SO2具有氧化性,可用于漂白纸浆
C.Fe2O3能与酸反应,可用于制作红色涂料
D.Al(OH)3能与盐酸反应,可用于治疗胃酸过多
5.短周期元素X、Y、Z、W的原子序数依次增大,X是空气中含量最多的元素,基态时Y原子2p原子轨道上有5个电子,Z的周期序数是族序数的3倍,W与Y属于同一主族。下列说法正确的是
A.原子半径:r(X)B.X的第一电离能比同周期相邻元素的大
C.Y的简单气态氢化物的热稳定性比W的弱
D.Z的最高价氧化物对应水化物的酸性比W的强
6.碳及其化合物在工农业生产中有着广泛的应用。工业上用CH4与H2O、CO2重整生产H2,CH4(g)+H2O(g)CO(g)+3H2(g) ΔH=+161.1kJ·mol-1。CO是常见的还原剂,可用CH3COO[Cu(NH3)2]溶液吸收CO。CO2可以用于生产CH4、CH3OCH3等有机物,CO2还是侯氏制碱的原料。下列有关说法正确的是
A.CH4能形成分子间氢键
B.CO2中的键角比CH4的大
C.CO的空间构型为三角锥形
D.CH3COO[Cu(NH3)2]中有6个配位键
7.碳及其化合物在工农业生产中有着广泛的应用。工业上用CH4与H2O、CO2重整生产H2,CH4(g)+H2O(g)CO(g)+3H2(g) ΔH=+161.1kJ·mol-1。CO是常见的还原剂,可用CH3COO[Cu(NH3)2]溶液吸收CO。CO2可以用于生产CH4、CH3OCH3等有机物,CO2还是侯氏制碱的原料。在指定条件下,下列选项所示的物质间转化能实现的是
A.CO2(g)NaHCO3(aq) B.CO2(g)Na2CO3(s)
C.CO(g)Mg(s) D.CO(g)N2(g)
8.下列说法正确的是
A.恒容密闭容器中进行的反应:A(s)+3B(g)2C(g)+D(g),如果气体密度保持不变,说明反应已经达到平衡
B.C ( s) + H2O (g) CO ( g) + H2 (g),其他条件不变,缩小容器体积,正速率减小,逆速率增大
C.N2(g) + 3H2(g)2NH3(g) △H=—93kJ·mol—1,往恒容密闭容器中充入0.4 molN2(g)和2 mol H2(g)达到平衡时,可以放出37.2 kJ的热量
D.A(g)+ 3B (g) 2C (g) + D (g),在两种不同情况下的反应速率分别为:①,②,则前者比后者快
9.实验室以含锌废液(主要成分为,还含有少量的、)为原料制备的实验流程如下:
下列说法正确的是
A.过二硫酸钠中硫元素的化合价为价
B.氧化除锰后的溶液中存在:、、、
C.调节时试剂可以选用、、等物质
D.沉锌时的离子方程式为
10.化合物Z是合成某种抗结核候选药物的重要中间体,可由下列反应制得。
下列有关化合物X、Y和Z的说法错误的是
A.X、Z分子中含有相同数目的手性碳原子
B.Y分子中的碳原子处于同一平面
C.X、Z在浓硫酸催化下加热均可发生消去反应
D.X、Z的混合溶液在过量NaOH溶液中加热,能生成两种有机产物
11.室温下,通过下列实验探究NaHSO3、Na2SO3溶液的性质。
实验1:用pH试纸测量0.1mol·L-1NaHSO3溶液的pH,测得pH约为5
实验2:0.1mol·L-1NaHSO3溶液中加入等体积0.1mol·L-1NaOH溶液,没有明显现象
实验3:0.1mol·L-1Na2SO3溶液中滴加新制饱和氯水,氯水颜色褪去
实验4:将0.1mol·L-1Na2SO3溶液与0.1mol·L-1CaCl2溶液等体积混合,产白色沉淀
下列说法正确的是
A.由实验1可得出:>Ka2(H2SO3)
B.实验2所得的溶液中c(HSO)>c(SO)
C.实验3中发生反应的离子方程式为H2O+Cl2+SO=SO+2H++2Cl-
D.实验4中两溶液混合时有:c(Ca2+)·c(SO)<Ksp(CaSO3)
12.一种电化学“大气固碳”电池工作原理如图所示。该电池在充电时,通过催化剂的选择性控制,只有Li2CO3发生氧化,释放出CO2和O2。下列说法正确的是
A.该电池放电时的正极反应为2Li-2e-+CO32-=Li2CO3
B.该电池既可选用含水电解液,也可选无水电解液
C.充电时阳极发生的反应为C+2Li2CO3-4e-=3CO2+4Li+
D.该电池每放、充4 mol电子一次,理论上能固定1 mol CO2
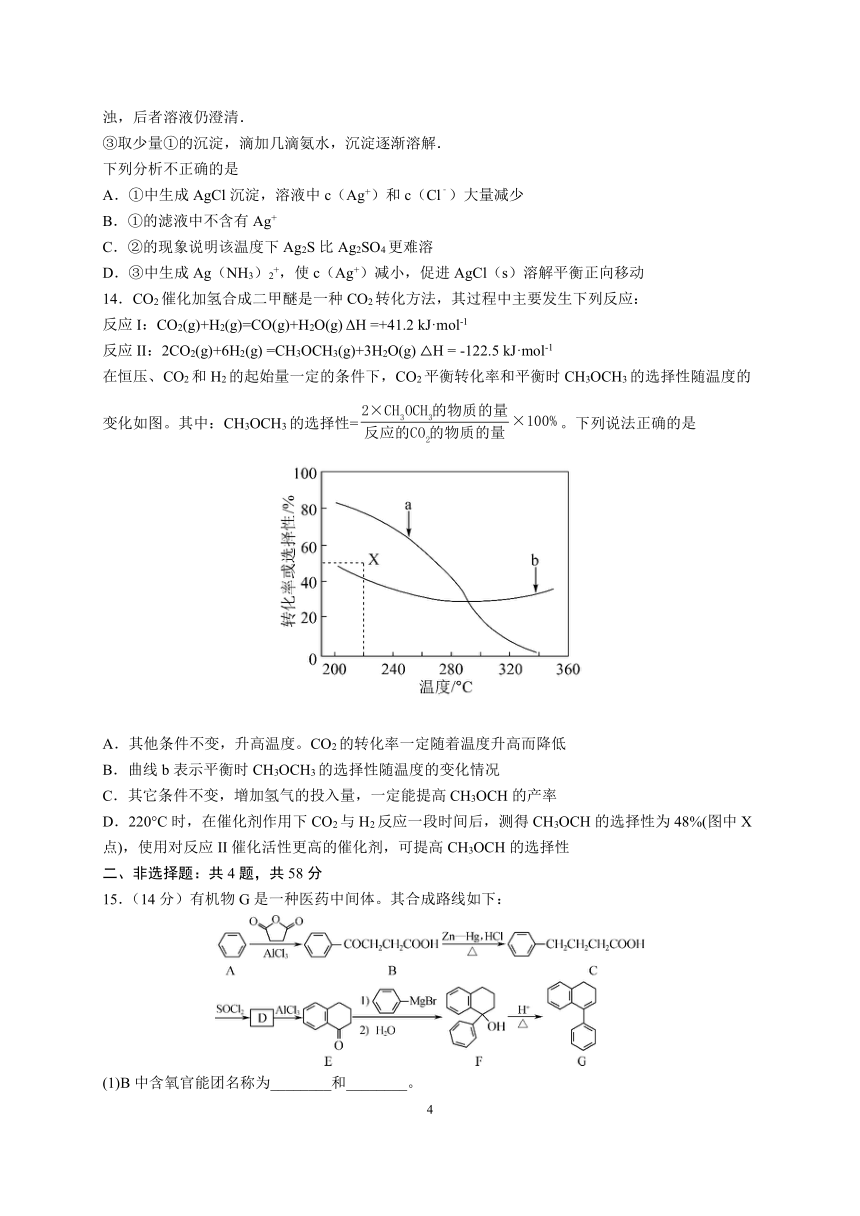
13.实验:①0.1mol/LAgNO3溶液和0.1mol/LNaCl溶液等体积混合得到浊液,过滤.
②取等量①的滤液于两支试管中,分别滴加等浓度等体积的Na2S溶液、Na2SO4溶液,前者出现浑浊,后者溶液仍澄清.
③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解.
下列分析不正确的是
A.①中生成AgCl沉淀,溶液中c(Ag+)和c(Cl﹣)大量减少
B.①的滤液中不含有Ag+
C.②的现象说明该温度下Ag2S比Ag2SO4更难溶
D.③中生成Ag(NH3)2+,使c(Ag+)减小,促进AgCl(s)溶解平衡正向移动
14.CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应I:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH =+41.2 kJ·mol-1
反应II:2CO2(g)+6H2(g) =CH3OCH3(g)+3H2O(g) △H = -122.5 kJ·mol-1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:CH3OCH3的选择性=。下列说法正确的是
A.其他条件不变,升高温度。CO2的转化率一定随着温度升高而降低
B.曲线b表示平衡时CH3OCH3的选择性随温度的变化情况
C.其它条件不变,增加氢气的投入量,一定能提高CH3OCH的产率
D.220°C时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH的选择性为48%(图中X点),使用对反应II催化活性更高的催化剂,可提高CH3OCH的选择性
二、非选择题:共4题,共58分
15.(14分)有机物G是一种医药中间体。其合成路线如下:
(1)B中含氧官能团名称为________和________。
(2)B→C反应类型为________。
(3)D的分子式为C10H11OCl,写出D的结构简式:________。
(4)写出满足下列条件的F的一种同分异构体的结构简式:________。
①分子中含有1个苯环,能发生银镜反应;
②分子中有4种不同化学环境的氢。
(5)请以、和为原料制备,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)________。
16.(15分)工业上以黄铜矿(主要含 CuFeS2,还含FeS等)为原料可以制备Cu,流程如下:
(1)写出“浸取”时 CuFeS2和FeCl3溶液反应的离子方程式:
(2)“稀释”时反应的化学方程式为 。
(3)用(NH4)2SO3还原CuCl2溶液也能获得CuCl,CuCl的产率随溶液pH变化如图所示。
①pH约为4时,CuCl的产率最大。写出该条件下反应的离子方程式:
②pH大于4或小于4时,CuCl的产率都会随pH的增大或减小而降低,原因是
(4)“溶解”前需测定CuCl、S中CuCl的含量,实验过程为:称取0.8000g样品置于烧杯中,向其中加入稍过量的1.5mol·L-1 FeCl3溶液(CuCl+ FeCl3=CuCl2+FeCl2),充分反应后快速过滤,用蒸馏水洗涤烧杯、玻璃棒及滤渣2~3次,将滤液及洗涤滤液一并转移到锥形瓶中,用Ce(SO4)2标准溶液滴定至终点(Ce4++Fe2+=Fe3++Ce3+),消耗0.2000 mol·L-1 Ce(SO4)2标准溶液20.00mL。计算混合物中CuCl的质量分数_______。(写出计算过程)。
17.(16分)氮氧化物(NOx)的排放对环境造成严重污染。回答下列问题:
I.工业上可利用C(s)+2NO(g)=CO2(g)+N2(g)反应处理氮氧化物。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1,碳的燃烧热为393.5kJ·mol-1,则C(s)+2NO(g)=CO2(g)+N2(g) ΔH2=_______kJ·mol-1。
(2)某温度下,向盛有足量单质C的恒容密闭容器通入NO,使其初始浓度为1mol·L-1。根据平衡时以某物质表示的v正(或v逆)、浓度的数值,绘制出下图中甲、乙两点。
①乙点对应的物质是 (填化学式);该反应的平衡常数为____。
②将温度降低至某一温度时,反应重新达到平衡,此时体系的压强为p=105Pa,NO的体积分数为30%,则N2的分压为p(N2)=____Pa(分压=总压×物质的量分数);则图中甲点可能移动至____点位置(填字母标号)。
II.原煤经热解、冷却得到的煤焦可用于NO的脱除。热解温度为500℃、900℃得到的煤焦分别用S-500、S-900表示,相关信息如下表:
煤焦 元素分析(%) 比表面积(cm2 g-1)
C H
S-500 80.79 2.76 105.69
S-900 84.26 0.82 8.98
将NO浓度恒定的废气以固定流速通过如下反应器。不同温度下,进行多组平行实验,测定相同时间内NO的出口浓度,可得NO的脱除率与温度的关系如下图所示。[已知:NO的脱除主要含吸附和化学还原(ΔH<0)两个过程。]
(3)已知煤焦表面存在的官能团有利于NO的吸附,其数量与煤焦中氢碳质量比的值密切相关。由图可知,相同温度下,S-500对NO的脱除率比S-900的高,结合表格数据分析其可能原因是
、 。
(4)350℃后,随着温度升高,NO的脱除率增大的原因是
18.(13分)以软锰矿粉(含MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备电池级MnO2。
(1)浸取。将一定量软锰矿粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入到三颈瓶中(图1),70℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中的溶液是 ;MnO2转化为Mn2+的离子方程式为
(2)除杂。向已经除去Fe、Al、Si的MnSO4溶液(pH约为5)中加入NH4F溶液,溶液中的Ca2+、Mg2+形成氟化物沉淀。若沉淀后上层清液中c(F-)=0.05mol·L-1,则=___。[Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9]
(3)制备MnCO3。在搅拌下向100mL1mol·L-1MnSO4溶液中缓慢滴加1mol·L-1NH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。需加入NH4HCO3溶液的体积约为 。
(4)制备MnO2。MnCO3经热解、酸浸等步骤可制备MnO2。MnCO3在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(×100%)随热解温度变化的曲线如图2所示。已知:MnO与酸反应生成Mn2+;Mn2O3氧化性强于Cl2,加热条件下Mn2O3在酸性溶液中转化为MnO2和Mn2+。
为获得较高产率的MnO2,请补充实验方案:取一定量MnCO3置于热解装置中,通空气气流,
,固体干燥,得到MnO2。(可选用的试剂:1mol·L-1H2SO4溶液、2mol·L-1HCl溶液、BaCl2溶液、AgNO3溶液)。
参考答案
1 2 3 4 5 6 7
B C C D B B D
8 9 10 11 13 13 14
A D B C D B D
15.羰基 羧基 还原反应
16.(1)3Fe3++CuFeS2+Cl-=CuCl+2S+4Fe2+
(2)2Na[CuCl2]=Cu↓+CuCl2+2NaCl
(3)2Cu2++SO+2Cl-+H2O=2CuCl↓+SO+2H+ pH小于4,随pH减少溶液酸性增强,SO转变为SO2逸出,还原剂变少,产率降低;pH大于4,随pH增大Cu2+转变成Cu(OH)2沉淀,产率降低
(4)49.75 %
17.-574 NO Q 热解温度高,煤焦H/C比值小,表面官能团减少 S-900的比表面积小,吸附能力弱 温度升高,反应速率增大
18.(1) H2SO4溶液 MnO2+SO+2H+=Mn2++SO+H2O
(2)100
(3)200mL
(4)加热到450℃充分反应一段时间,将固体冷却后研成粉末,边搅拌边加入一定量1mol·L-1稀H2SO4,加热,充分反应后过滤,洗涤,直到取最后一次洗涤滤液加盐酸酸化的0.1mol·L-1BaCl2溶液不变浑浊
9
一、单项选择题:共14题,每题3分,共42分
1.书法是中华文化之瑰宝,书法之美尽在“笔墨纸砚”之间。下列说法正确的是
A.制作笔尖的“狼毫”的主要成分是纤维素 B.墨汁是一种分散系
C.宣纸的主要成分属于无机物 D.石材雕刻制砚的过程是化学变化
2.下列说法正确的是
A.H2O与H2O2互为同素异形体 B.氡()质量数为86
C.CH3CH2OH与CH3OCH3互为同分异构体 D.HCl含非极性共价键
3.实验室处理含FeBr3废催化剂的溶液,可得到溴的苯溶液和无水FeCl3(已知FeCl3在HCl的气流中加热才可以得到FeCl3固体)下列做法能达到相应实验目的的是
A.用装置甲制取Cl2
B.用装置乙使Br-转化为Br2
C.用装置丙分液,先放出水层,再倒出溴的苯溶液
D.用装置丁将分液后的水层蒸干获得无水FeCl3
4.下列有关物质性质与用途具有对应关系的是
A.浓硫酸具有吸水性,可用于干燥NH3
B.SO2具有氧化性,可用于漂白纸浆
C.Fe2O3能与酸反应,可用于制作红色涂料
D.Al(OH)3能与盐酸反应,可用于治疗胃酸过多
5.短周期元素X、Y、Z、W的原子序数依次增大,X是空气中含量最多的元素,基态时Y原子2p原子轨道上有5个电子,Z的周期序数是族序数的3倍,W与Y属于同一主族。下列说法正确的是
A.原子半径:r(X)
C.Y的简单气态氢化物的热稳定性比W的弱
D.Z的最高价氧化物对应水化物的酸性比W的强
6.碳及其化合物在工农业生产中有着广泛的应用。工业上用CH4与H2O、CO2重整生产H2,CH4(g)+H2O(g)CO(g)+3H2(g) ΔH=+161.1kJ·mol-1。CO是常见的还原剂,可用CH3COO[Cu(NH3)2]溶液吸收CO。CO2可以用于生产CH4、CH3OCH3等有机物,CO2还是侯氏制碱的原料。下列有关说法正确的是
A.CH4能形成分子间氢键
B.CO2中的键角比CH4的大
C.CO的空间构型为三角锥形
D.CH3COO[Cu(NH3)2]中有6个配位键
7.碳及其化合物在工农业生产中有着广泛的应用。工业上用CH4与H2O、CO2重整生产H2,CH4(g)+H2O(g)CO(g)+3H2(g) ΔH=+161.1kJ·mol-1。CO是常见的还原剂,可用CH3COO[Cu(NH3)2]溶液吸收CO。CO2可以用于生产CH4、CH3OCH3等有机物,CO2还是侯氏制碱的原料。在指定条件下,下列选项所示的物质间转化能实现的是
A.CO2(g)NaHCO3(aq) B.CO2(g)Na2CO3(s)
C.CO(g)Mg(s) D.CO(g)N2(g)
8.下列说法正确的是
A.恒容密闭容器中进行的反应:A(s)+3B(g)2C(g)+D(g),如果气体密度保持不变,说明反应已经达到平衡
B.C ( s) + H2O (g) CO ( g) + H2 (g),其他条件不变,缩小容器体积,正速率减小,逆速率增大
C.N2(g) + 3H2(g)2NH3(g) △H=—93kJ·mol—1,往恒容密闭容器中充入0.4 molN2(g)和2 mol H2(g)达到平衡时,可以放出37.2 kJ的热量
D.A(g)+ 3B (g) 2C (g) + D (g),在两种不同情况下的反应速率分别为:①,②,则前者比后者快
9.实验室以含锌废液(主要成分为,还含有少量的、)为原料制备的实验流程如下:
下列说法正确的是
A.过二硫酸钠中硫元素的化合价为价
B.氧化除锰后的溶液中存在:、、、
C.调节时试剂可以选用、、等物质
D.沉锌时的离子方程式为
10.化合物Z是合成某种抗结核候选药物的重要中间体,可由下列反应制得。
下列有关化合物X、Y和Z的说法错误的是
A.X、Z分子中含有相同数目的手性碳原子
B.Y分子中的碳原子处于同一平面
C.X、Z在浓硫酸催化下加热均可发生消去反应
D.X、Z的混合溶液在过量NaOH溶液中加热,能生成两种有机产物
11.室温下,通过下列实验探究NaHSO3、Na2SO3溶液的性质。
实验1:用pH试纸测量0.1mol·L-1NaHSO3溶液的pH,测得pH约为5
实验2:0.1mol·L-1NaHSO3溶液中加入等体积0.1mol·L-1NaOH溶液,没有明显现象
实验3:0.1mol·L-1Na2SO3溶液中滴加新制饱和氯水,氯水颜色褪去
实验4:将0.1mol·L-1Na2SO3溶液与0.1mol·L-1CaCl2溶液等体积混合,产白色沉淀
下列说法正确的是
A.由实验1可得出:>Ka2(H2SO3)
B.实验2所得的溶液中c(HSO)>c(SO)
C.实验3中发生反应的离子方程式为H2O+Cl2+SO=SO+2H++2Cl-
D.实验4中两溶液混合时有:c(Ca2+)·c(SO)<Ksp(CaSO3)
12.一种电化学“大气固碳”电池工作原理如图所示。该电池在充电时,通过催化剂的选择性控制,只有Li2CO3发生氧化,释放出CO2和O2。下列说法正确的是
A.该电池放电时的正极反应为2Li-2e-+CO32-=Li2CO3
B.该电池既可选用含水电解液,也可选无水电解液
C.充电时阳极发生的反应为C+2Li2CO3-4e-=3CO2+4Li+
D.该电池每放、充4 mol电子一次,理论上能固定1 mol CO2
13.实验:①0.1mol/LAgNO3溶液和0.1mol/LNaCl溶液等体积混合得到浊液,过滤.
②取等量①的滤液于两支试管中,分别滴加等浓度等体积的Na2S溶液、Na2SO4溶液,前者出现浑浊,后者溶液仍澄清.
③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解.
下列分析不正确的是
A.①中生成AgCl沉淀,溶液中c(Ag+)和c(Cl﹣)大量减少
B.①的滤液中不含有Ag+
C.②的现象说明该温度下Ag2S比Ag2SO4更难溶
D.③中生成Ag(NH3)2+,使c(Ag+)减小,促进AgCl(s)溶解平衡正向移动
14.CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应I:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH =+41.2 kJ·mol-1
反应II:2CO2(g)+6H2(g) =CH3OCH3(g)+3H2O(g) △H = -122.5 kJ·mol-1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:CH3OCH3的选择性=。下列说法正确的是
A.其他条件不变,升高温度。CO2的转化率一定随着温度升高而降低
B.曲线b表示平衡时CH3OCH3的选择性随温度的变化情况
C.其它条件不变,增加氢气的投入量,一定能提高CH3OCH的产率
D.220°C时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH的选择性为48%(图中X点),使用对反应II催化活性更高的催化剂,可提高CH3OCH的选择性
二、非选择题:共4题,共58分
15.(14分)有机物G是一种医药中间体。其合成路线如下:
(1)B中含氧官能团名称为________和________。
(2)B→C反应类型为________。
(3)D的分子式为C10H11OCl,写出D的结构简式:________。
(4)写出满足下列条件的F的一种同分异构体的结构简式:________。
①分子中含有1个苯环,能发生银镜反应;
②分子中有4种不同化学环境的氢。
(5)请以、和为原料制备,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)________。
16.(15分)工业上以黄铜矿(主要含 CuFeS2,还含FeS等)为原料可以制备Cu,流程如下:
(1)写出“浸取”时 CuFeS2和FeCl3溶液反应的离子方程式:
(2)“稀释”时反应的化学方程式为 。
(3)用(NH4)2SO3还原CuCl2溶液也能获得CuCl,CuCl的产率随溶液pH变化如图所示。
①pH约为4时,CuCl的产率最大。写出该条件下反应的离子方程式:
②pH大于4或小于4时,CuCl的产率都会随pH的增大或减小而降低,原因是
(4)“溶解”前需测定CuCl、S中CuCl的含量,实验过程为:称取0.8000g样品置于烧杯中,向其中加入稍过量的1.5mol·L-1 FeCl3溶液(CuCl+ FeCl3=CuCl2+FeCl2),充分反应后快速过滤,用蒸馏水洗涤烧杯、玻璃棒及滤渣2~3次,将滤液及洗涤滤液一并转移到锥形瓶中,用Ce(SO4)2标准溶液滴定至终点(Ce4++Fe2+=Fe3++Ce3+),消耗0.2000 mol·L-1 Ce(SO4)2标准溶液20.00mL。计算混合物中CuCl的质量分数_______。(写出计算过程)。
17.(16分)氮氧化物(NOx)的排放对环境造成严重污染。回答下列问题:
I.工业上可利用C(s)+2NO(g)=CO2(g)+N2(g)反应处理氮氧化物。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1,碳的燃烧热为393.5kJ·mol-1,则C(s)+2NO(g)=CO2(g)+N2(g) ΔH2=_______kJ·mol-1。
(2)某温度下,向盛有足量单质C的恒容密闭容器通入NO,使其初始浓度为1mol·L-1。根据平衡时以某物质表示的v正(或v逆)、浓度的数值,绘制出下图中甲、乙两点。
①乙点对应的物质是 (填化学式);该反应的平衡常数为____。
②将温度降低至某一温度时,反应重新达到平衡,此时体系的压强为p=105Pa,NO的体积分数为30%,则N2的分压为p(N2)=____Pa(分压=总压×物质的量分数);则图中甲点可能移动至____点位置(填字母标号)。
II.原煤经热解、冷却得到的煤焦可用于NO的脱除。热解温度为500℃、900℃得到的煤焦分别用S-500、S-900表示,相关信息如下表:
煤焦 元素分析(%) 比表面积(cm2 g-1)
C H
S-500 80.79 2.76 105.69
S-900 84.26 0.82 8.98
将NO浓度恒定的废气以固定流速通过如下反应器。不同温度下,进行多组平行实验,测定相同时间内NO的出口浓度,可得NO的脱除率与温度的关系如下图所示。[已知:NO的脱除主要含吸附和化学还原(ΔH<0)两个过程。]
(3)已知煤焦表面存在的官能团有利于NO的吸附,其数量与煤焦中氢碳质量比的值密切相关。由图可知,相同温度下,S-500对NO的脱除率比S-900的高,结合表格数据分析其可能原因是
、 。
(4)350℃后,随着温度升高,NO的脱除率增大的原因是
18.(13分)以软锰矿粉(含MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备电池级MnO2。
(1)浸取。将一定量软锰矿粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入到三颈瓶中(图1),70℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中的溶液是 ;MnO2转化为Mn2+的离子方程式为
(2)除杂。向已经除去Fe、Al、Si的MnSO4溶液(pH约为5)中加入NH4F溶液,溶液中的Ca2+、Mg2+形成氟化物沉淀。若沉淀后上层清液中c(F-)=0.05mol·L-1,则=___。[Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9]
(3)制备MnCO3。在搅拌下向100mL1mol·L-1MnSO4溶液中缓慢滴加1mol·L-1NH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。需加入NH4HCO3溶液的体积约为 。
(4)制备MnO2。MnCO3经热解、酸浸等步骤可制备MnO2。MnCO3在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(×100%)随热解温度变化的曲线如图2所示。已知:MnO与酸反应生成Mn2+;Mn2O3氧化性强于Cl2,加热条件下Mn2O3在酸性溶液中转化为MnO2和Mn2+。
为获得较高产率的MnO2,请补充实验方案:取一定量MnCO3置于热解装置中,通空气气流,
,固体干燥,得到MnO2。(可选用的试剂:1mol·L-1H2SO4溶液、2mol·L-1HCl溶液、BaCl2溶液、AgNO3溶液)。
参考答案
1 2 3 4 5 6 7
B C C D B B D
8 9 10 11 13 13 14
A D B C D B D
15.羰基 羧基 还原反应
16.(1)3Fe3++CuFeS2+Cl-=CuCl+2S+4Fe2+
(2)2Na[CuCl2]=Cu↓+CuCl2+2NaCl
(3)2Cu2++SO+2Cl-+H2O=2CuCl↓+SO+2H+ pH小于4,随pH减少溶液酸性增强,SO转变为SO2逸出,还原剂变少,产率降低;pH大于4,随pH增大Cu2+转变成Cu(OH)2沉淀,产率降低
(4)49.75 %
17.-574 NO Q 热解温度高,煤焦H/C比值小,表面官能团减少 S-900的比表面积小,吸附能力弱 温度升高,反应速率增大
18.(1) H2SO4溶液 MnO2+SO+2H+=Mn2++SO+H2O
(2)100
(3)200mL
(4)加热到450℃充分反应一段时间,将固体冷却后研成粉末,边搅拌边加入一定量1mol·L-1稀H2SO4,加热,充分反应后过滤,洗涤,直到取最后一次洗涤滤液加盐酸酸化的0.1mol·L-1BaCl2溶液不变浑浊
9
同课章节目录
