2021-2022学年人教版九年级化学下册 第九单元 溶液 测试题 (WORD版,含答案)
文档属性
| 名称 | 2021-2022学年人教版九年级化学下册 第九单元 溶液 测试题 (WORD版,含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-03 22:17:35 | ||
图片预览


文档简介
第九单元 溶液 测试题
可能用到的相对原子质量:C-12 O-16 Cl-35.5 Ca-40
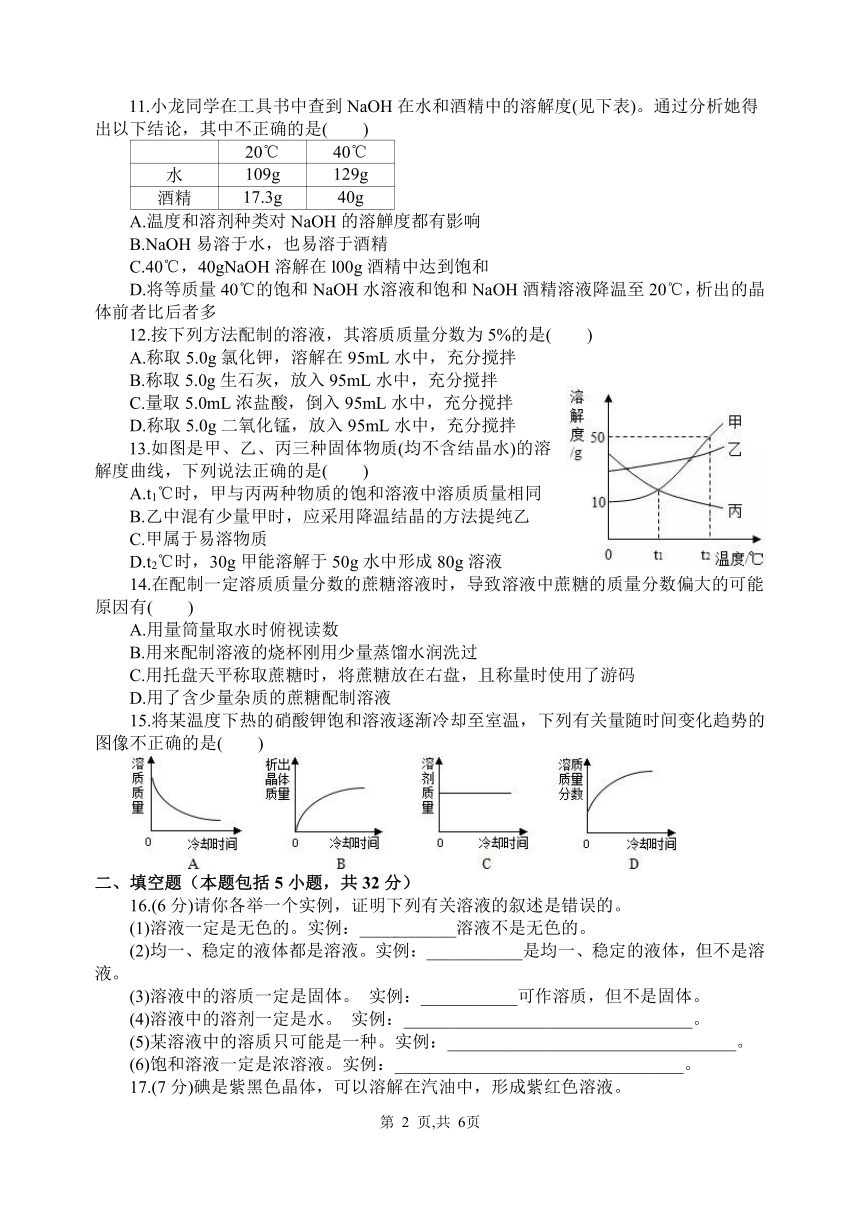
一、选择题(本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意)
1.把少量下列物质分别放入到水中,充分搅拌,不能得到溶液的是( )
A.面粉 B.食盐 C.白酒 D.蔗糖
2.下列有关溶液说法正确的是( )
A.溶液都是均一、稳定的混合物
B.形成溶液的溶质都是固体
C.所有饱和溶液都比不饱和溶液要浓
D.溶液的体积等于溶质的体积与溶剂的体积之和
3.在盛有水的烧杯中加入以下某种物质,形成溶液的过程中,温度下降。这种物质可能是( )
A.氯化钠 B.硝酸铵 C.氢氧化钠 D.蔗糖
4.20℃时,氯化钠的溶解度为36g。对这句话理解错误的是( )
A.20℃时,100g水中最多能溶解氯化钠36g
B.20℃时,100g氯化钠饱和溶液中含氯化钠36g
C.20℃时,氯化钠饱和溶液中水与氯化钠的质量比为100﹕36
D.20℃时,将36g氯化钠溶解于100g水中,所得溶液为该温度下氯化钠的饱和溶液
5.保持其他条件不变,欲使接近饱和的KNO3溶液变为饱和溶液,下列方法中不可行的是( )
A.蒸发溶剂 B.升高温度 C.降低温度 D.加入KNO3固体
6.已知20℃硝酸钾的溶解度为31.6g。在该温度下将20g硝酸钾放入50g水中,充分搅拌,则所得溶液中溶质的质量分数约为( )
A.24.0% B.28.6% C.31.6% D.40.0%
7.实验室配制100g 10%的NaCl溶液,不需要用到的仪器是( )
A.酒精灯 B.托盘天平 C.胶头滴管 D.烧杯
8.下列有关洗涤问题的说法中,不正确的是( )
A.汽油可溶解衣服上的油渍 B.洗洁精可乳化餐具上的油污
C.醋酸能洗去暖水瓶内壁的水垢 D.酒精能洗涤瓷砖上的水锈
9.某温度时,将20g KNO3溶解在100g水中恰好饱和,关于该饱和溶液的叙述正确的是( )
A.m(溶质)﹕m(溶剂)=20﹕120 B.溶质的质量分数为20%
C.升温后,溶质的质量分数增大 D.降温后,有固体析出
10.某次蔗糖溶解实验过程如图所示,不考虑水分蒸发,下列判断错误的是( )
A.②中溶液是饱和溶液
B.③中溶液一定是不饱和溶液
C.②③中溶液的溶质质量分数不相同
D.③中溶液的溶质质量大于②中溶液的溶质质量
11.小龙同学在工具书中查到NaOH在水和酒精中的溶解度(见下表)。通过分析她得出以下结论,其中不正确的是( )
20℃ 40℃
水 109g 129g
酒精 17.3g 40g
A.温度和溶剂种类对NaOH的溶觯度都有影响
B.NaOH易溶于水,也易溶于酒精
C.40℃,40gNaOH溶解在l00g酒精中达到饱和
D.将等质量40℃的饱和NaOH水溶液和饱和NaOH酒精溶液降温至20℃,析出的晶体前者比后者多
12.按下列方法配制的溶液,其溶质质量分数为5%的是( )
A.称取5.0g氯化钾,溶解在95mL水中,充分搅拌
B.称取5.0g生石灰,放入95mL水中,充分搅拌
C.量取5.0mL浓盐酸,倒入95mL水中,充分搅拌
D.称取5.0g二氧化锰,放入95mL水中,充分搅拌
13.如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )
A.t1℃时,甲与丙两种物质的饱和溶液中溶质质量相同
B.乙中混有少量甲时,应采用降温结晶的方法提纯乙
C.甲属于易溶物质
D.t2℃时,30g甲能溶解于50g水中形成80g溶液
14.在配制一定溶质质量分数的蔗糖溶液时,导致溶液中蔗糖的质量分数偏大的可能原因有( )
A.用量筒量取水时俯视读数
B.用来配制溶液的烧杯刚用少量蒸馏水润洗过
C.用托盘天平称取蔗糖时,将蔗糖放在右盘,且称量时使用了游码
D.用了含少量杂质的蔗糖配制溶液
15.将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,下列有关量随时间变化趋势的图像不正确的是( )
二、填空题(本题包括5小题,共32分)
16.(6分)请你各举一个实例,证明下列有关溶液的叙述是错误的。
(1)溶液一定是无色的。实例:___________溶液不是无色的。
(2)均一、稳定的液体都是溶液。实例:___________是均一、稳定的液体,但不是溶液。
(3)溶液中的溶质一定是固体。 实例:___________可作溶质,但不是固体。
(4)溶液中的溶剂一定是水。 实例:_________________________________。
(5)某溶液中的溶质只可能是一种。实例:_________________________________。
(6)饱和溶液一定是浓溶液。实例:_________________________________。
17.(7分)碘是紫黑色晶体,可以溶解在汽油中,形成紫红色溶液。
(1)碘的汽油溶液中,溶质是____________,溶剂是____________;
(2)甲、乙、丙三个同学分别画出下面的示意图,表示溶液中碘分子的分布(汽油分子没有画出)。
①如果乙同学的示意图符合事实,应该观察到的现象是____________;
②根据你在实验中观察到的现象,____________(填甲、乙、丙)的示意图符合事实。
(3)某同学在探究物质的溶解性时,先向试管中加入少许碘,然后加入一定量的水,充分溶解后,再向试管中滴加汽油。实验操作及现象如右图所示:
①用微粒观点解释为什么在取用汽油时会闻到汽油味?_____________。
②仔细观察图示实验,分析产生实验现象的原因:______________;______________。
18.(12分)右图是甲、乙两种固体物质的溶解度曲线。据图回答:
(1)P点的含义是_____________。
(2)要使接近饱和的甲溶液变成饱和溶液,可采用的方法有_____________________(写出一种),当甲中含有少量乙时,可采用_____________________的方法提纯甲。
(3)30℃时,将40g甲物质放入盛有50g水的烧杯中,所得溶液溶质的质量分数为____________________。若将烧杯内物质升温到50℃(不考虑水蒸发),溶液中变化的是___________(选填序号)。
a.溶剂的质量 b.溶液的质量 c.溶质的质量分数
(4)从图中还可获得的信息是_______________(答出一条)。
19.(7分)某同学用提取的精盐配制100g质量分数为11.7%的氯化钠溶液,请你参与完成:
(1)计算:氯化钠的质量为__________g,水为__________g。
(2)称量:用托盘天平称量,氯化钠应放在__________(填“左盘”或“右盘”)。
(3)溶解:用量筒来量取所需的水(水的密度为1g/cm3),量筒的规格是_________(从下列中选用:10 mL、25 mL、50 mL、100 mL)。量取液体时,量筒必须放平,视线与液体的_________保持水平。溶解氯化钠要用到玻璃棒,其作用是__________。
(4)反思:若称取的氯化钠中含有水分,则所配制的溶液溶质质量分数会________(填“偏大”、“偏小”或“无影响”)。
三、实验探究题(本题包括2小题,共28分)
20.(14分)小琴同学发现:将洗衣粉入热水中很快就溶解了,而放到冷水中溶解很慢;小敏同学发现:将蔗糖和食盐分别放入同样的一杯水中,蔗糖溶解的多,而食盐溶解的少……凡此种种,是哪些因素影响着物质溶解的快慢或多少呢?请你任选一种物质,寻找可能影响其溶解快慢或多少的因素,设计实验进行探究:
【提出假设】①__________;②__________;③……
【实验探究】请就你提出的影响因素①或②,设计具体的实验方案,进行探究。
①探究的因素是_____________________;
②需控制不变的因素是_____________________;
③实验过程:_____________________,实验现象:_____________________;
④实验结论:_____________________。
21.(14分)仔细阅读下面的探究实验信息,回答相关问题。
【实验目的】探究溶解过程中,溶液温度的变化情况。
【查阅资料】(1)物质溶解于水的过程包括吸收热量(Q吸)的扩散过程和放出热量(Q放)的水合过程。
(2)实验条件下,水的凝固点为0℃、沸点为100℃。
【提出猜想】物质溶解过程中,溶液的温度可能升高或降低或不变。
【实验探究】某探究小组的同学设计了如图所示的两种方案。在图2所示方案中,每次加入物质b之前均使用温度计控制热水温度,使之保持在99℃。
【实验结论】(1)图1所示实验中,若加入物质a后,发现玻璃片与烧杯底部之间的水结冰,说明溶液的温度________(填“升高”或“降低”或“不变”,下同)。
(2)图2所示实验中,若加入物质b后,热水会突然沸腾,说明溶液的温度________。
【拓展实验】按照图3所示进行实验。若物质c为NaOH,则U型管内的左边液面将________(填“高于”或“低于”或“等于”)右边液面;若U型管内的液面位置变化与之相反,则物质c为________(填序号)。
①CaO ②NH4NO3 ③浓H2SO4
【反思交流】(1)该小组的同学进一步就物质溶解过程中溶液温度变化的原因展开了讨论,分析得出:若Q吸________Q放(填“>”或“<”或“=”,下同),则溶液温度升高;若Q吸与Q放的相对大小与之相反,则溶液温度降低;若Q吸________Q放,则溶液温度不变。
(2)在图2所示方案中,小张同学对实验现象很感兴趣,他继续向热水中加入相同质量的物质b,又看到沸腾现象,至烧杯中出现固体物质后,再继续加入相同质量的物质b,就看不到沸腾现象。请解释不再产生沸腾现象的原因________________________。
四、计算题(本题包括1小题,共10分)
22.小甜利用石灰石和稀盐酸进行如下实验,操作过程和数据如下图所示(样品中的杂质不与酸反应也不溶于水)。
(1)20g石灰石样品中 CaCO3的质量为_________g。
(2)列式计算不饱和溶液 A 的溶质质量分数(结果准确到 0.1%)。
参考答案
一、选择题
1.A 2.A 3.B 4.B 5.B 6.A 7.A 8.D 9.D
10.B 解析:结合某次蔗糖溶解实验过程图示,不考虑水分蒸发,①→②充分溶解后固体有剩余,②中溶液是饱和溶液,②加热形成③中没有剩余固体,③中溶液有可能是饱和溶液,也有可能是不饱和溶液,②③中溶剂质量相同,溶质质量不同,②③中溶液的溶质质量分数一定是不相同的,有图直观看出:③中蔗糖全部溶解,②中蔗糖部分溶解,③中溶液的溶质质量大于②中溶液的溶质质量。
11.D12.A
13.C 解析:通过分析溶解度曲线可知,t1℃时,甲与丙两种物质的溶解度相等,所以饱和溶液中溶质质量分数相同,A错误;乙物质的溶解度受温度变化的影响比甲小,所以乙中混有少量甲时,应采用蒸发结晶的方法提纯乙,B错误;甲物质在0℃时的溶解度是10g,温度升高,溶解度增大,20℃的溶解度大于10g,所以甲属于易溶物质,C正确;t2℃时,甲物质的溶解度是50g,所以30g甲溶解于50g水中形成75g溶液,D错误。
14.A 解析:用量筒量取水时,俯视读数,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,A正确;用来配制溶液的烧杯刚刚用少量蒸馏水润洗过,会造成实际量取的水的体积偏大,则使溶质质量分数偏小,B错误;用托盘天平称取蔗糖时,将蔗糖放在右盘,且称量时使用了游码,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小,C错误;用了含少量杂质的蔗糖配制溶液,会导致溶质的质量小于配制所需要的溶质质量,引起质量分数偏小,D错误。
15.D
二、填空题
16.(1)高锰酸钾 (2)水 (3)CO2 (4)碘酒中的溶剂是酒精 (5)汽水中有柠檬酸、蔗糖等溶质(合理答案均可) (6)澄清的石灰水是饱和溶液,但却是稀溶液
17.(1)碘 汽油
(2)①烧杯中固体逐渐溶解,整杯液体变为紫色 ②甲
(3)①微粒(或分子)不断运动(其他合理答案均可) ②碘在汽油中溶解性比水大 汽油的密度比水小(或汽油不溶于水 同一溶质在不同溶剂中溶解性不同 其他合理答案均可)
18.(1)30℃时,甲的溶解度是60g (2)降低温度(或增加溶质) 冷却甲的热饱和溶液 (3)37.5% bc (4)甲物质的溶解度受温度影响比乙大;t1℃时,甲乙两物质的溶解度相等;温度低于t1℃时,乙物质的溶解度大于甲物质的溶解度;温度高于t1℃时,乙物质的溶解度小于甲物质的溶解度等答出一条即可
19.(1)11.7 88.3 (2)左盘 (3)100 mL 凹液面最低处 搅拌(加速溶解) (4)偏小
三、实验探究题
20.本题是一道开放性题,答案只要切题、合理即可。举例:
【提出假设】①食盐在水中的溶解速率与食盐颗粒的大小有关
②食盐在水中的溶解速率与水的温度有关(或其他合理假设)
【实验探究】①食盐颗粒大小对溶解速率的影响
②温度、外力(搅拌)等
③取质量相同的粉状食盐和颗粒状食盐,放入相同质量、相同温度的水中 观察到粉状食盐先溶解完
④固体溶质的颗粒大小(表面积)影响溶解的速率(或其他合理答案)
21.【实验结论】(1)下降 (2)升高
【拓展实验】低于 ②
【反思交流】(1)< = (2)至烧杯中出现固体物质后,说明溶液达到饱和状态,再继续加入相同质量的物质b,不再溶解放热
解析:【实验结论】(1)若加入物质a后,发现玻璃片与烧杯底部之间的水结冰,说明溶液的温度下降;(2)若加入物质b后,热水会突然沸腾,说明溶液的温度升高。【拓展实验】若物质c为NaOH,氢氧化钠溶于水放热,装置内的气压升高,则U型管内的左边液面将低于右边液面;若U型管内的液面位置变化与之相反,则物质c溶于水吸热,①CaO和水反应放出大量的热,②NH4NO3溶于水吸热,③浓H2SO4溶于水放出大量的热,故物质c为NH4NO3。【反思交流】(1)若Q吸<Q放,则溶液温度升高;若Q吸与Q放的相对大小与之相反,则溶液温度降低;若Q吸=Q放,则溶液温度不变;(2)继续向热水中加入相同质量的物质b,又看到沸腾现象,至烧杯中出现固体物质后,说明溶液达到饱和状态,再继续加入相同质量的物质b,不再溶解放热,因此就看不到沸腾现象。
四、计算题
14.(1)15
(2)设反应生成CaCl2的质量为x,产生的CO2气体质量为 y。
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 111 44
15g x y
100/15g =111/x x=16.65g
100/15g =44/y y=6.6g
不饱和溶液A的质量=15g+100g-6.6g=108.4g
则不饱和溶液A的溶质质量分数为16.65g/108.4g×100% =15.4%
答:(1)20g石灰石样品中 CaCO3的质量为15g;(2)不饱和溶液 A 的溶质质量分数为15.4%。
PAGE
第 7 页,共 7页
可能用到的相对原子质量:C-12 O-16 Cl-35.5 Ca-40
一、选择题(本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意)
1.把少量下列物质分别放入到水中,充分搅拌,不能得到溶液的是( )
A.面粉 B.食盐 C.白酒 D.蔗糖
2.下列有关溶液说法正确的是( )
A.溶液都是均一、稳定的混合物
B.形成溶液的溶质都是固体
C.所有饱和溶液都比不饱和溶液要浓
D.溶液的体积等于溶质的体积与溶剂的体积之和
3.在盛有水的烧杯中加入以下某种物质,形成溶液的过程中,温度下降。这种物质可能是( )
A.氯化钠 B.硝酸铵 C.氢氧化钠 D.蔗糖
4.20℃时,氯化钠的溶解度为36g。对这句话理解错误的是( )
A.20℃时,100g水中最多能溶解氯化钠36g
B.20℃时,100g氯化钠饱和溶液中含氯化钠36g
C.20℃时,氯化钠饱和溶液中水与氯化钠的质量比为100﹕36
D.20℃时,将36g氯化钠溶解于100g水中,所得溶液为该温度下氯化钠的饱和溶液
5.保持其他条件不变,欲使接近饱和的KNO3溶液变为饱和溶液,下列方法中不可行的是( )
A.蒸发溶剂 B.升高温度 C.降低温度 D.加入KNO3固体
6.已知20℃硝酸钾的溶解度为31.6g。在该温度下将20g硝酸钾放入50g水中,充分搅拌,则所得溶液中溶质的质量分数约为( )
A.24.0% B.28.6% C.31.6% D.40.0%
7.实验室配制100g 10%的NaCl溶液,不需要用到的仪器是( )
A.酒精灯 B.托盘天平 C.胶头滴管 D.烧杯
8.下列有关洗涤问题的说法中,不正确的是( )
A.汽油可溶解衣服上的油渍 B.洗洁精可乳化餐具上的油污
C.醋酸能洗去暖水瓶内壁的水垢 D.酒精能洗涤瓷砖上的水锈
9.某温度时,将20g KNO3溶解在100g水中恰好饱和,关于该饱和溶液的叙述正确的是( )
A.m(溶质)﹕m(溶剂)=20﹕120 B.溶质的质量分数为20%
C.升温后,溶质的质量分数增大 D.降温后,有固体析出
10.某次蔗糖溶解实验过程如图所示,不考虑水分蒸发,下列判断错误的是( )
A.②中溶液是饱和溶液
B.③中溶液一定是不饱和溶液
C.②③中溶液的溶质质量分数不相同
D.③中溶液的溶质质量大于②中溶液的溶质质量
11.小龙同学在工具书中查到NaOH在水和酒精中的溶解度(见下表)。通过分析她得出以下结论,其中不正确的是( )
20℃ 40℃
水 109g 129g
酒精 17.3g 40g
A.温度和溶剂种类对NaOH的溶觯度都有影响
B.NaOH易溶于水,也易溶于酒精
C.40℃,40gNaOH溶解在l00g酒精中达到饱和
D.将等质量40℃的饱和NaOH水溶液和饱和NaOH酒精溶液降温至20℃,析出的晶体前者比后者多
12.按下列方法配制的溶液,其溶质质量分数为5%的是( )
A.称取5.0g氯化钾,溶解在95mL水中,充分搅拌
B.称取5.0g生石灰,放入95mL水中,充分搅拌
C.量取5.0mL浓盐酸,倒入95mL水中,充分搅拌
D.称取5.0g二氧化锰,放入95mL水中,充分搅拌
13.如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )
A.t1℃时,甲与丙两种物质的饱和溶液中溶质质量相同
B.乙中混有少量甲时,应采用降温结晶的方法提纯乙
C.甲属于易溶物质
D.t2℃时,30g甲能溶解于50g水中形成80g溶液
14.在配制一定溶质质量分数的蔗糖溶液时,导致溶液中蔗糖的质量分数偏大的可能原因有( )
A.用量筒量取水时俯视读数
B.用来配制溶液的烧杯刚用少量蒸馏水润洗过
C.用托盘天平称取蔗糖时,将蔗糖放在右盘,且称量时使用了游码
D.用了含少量杂质的蔗糖配制溶液
15.将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,下列有关量随时间变化趋势的图像不正确的是( )
二、填空题(本题包括5小题,共32分)
16.(6分)请你各举一个实例,证明下列有关溶液的叙述是错误的。
(1)溶液一定是无色的。实例:___________溶液不是无色的。
(2)均一、稳定的液体都是溶液。实例:___________是均一、稳定的液体,但不是溶液。
(3)溶液中的溶质一定是固体。 实例:___________可作溶质,但不是固体。
(4)溶液中的溶剂一定是水。 实例:_________________________________。
(5)某溶液中的溶质只可能是一种。实例:_________________________________。
(6)饱和溶液一定是浓溶液。实例:_________________________________。
17.(7分)碘是紫黑色晶体,可以溶解在汽油中,形成紫红色溶液。
(1)碘的汽油溶液中,溶质是____________,溶剂是____________;
(2)甲、乙、丙三个同学分别画出下面的示意图,表示溶液中碘分子的分布(汽油分子没有画出)。
①如果乙同学的示意图符合事实,应该观察到的现象是____________;
②根据你在实验中观察到的现象,____________(填甲、乙、丙)的示意图符合事实。
(3)某同学在探究物质的溶解性时,先向试管中加入少许碘,然后加入一定量的水,充分溶解后,再向试管中滴加汽油。实验操作及现象如右图所示:
①用微粒观点解释为什么在取用汽油时会闻到汽油味?_____________。
②仔细观察图示实验,分析产生实验现象的原因:______________;______________。
18.(12分)右图是甲、乙两种固体物质的溶解度曲线。据图回答:
(1)P点的含义是_____________。
(2)要使接近饱和的甲溶液变成饱和溶液,可采用的方法有_____________________(写出一种),当甲中含有少量乙时,可采用_____________________的方法提纯甲。
(3)30℃时,将40g甲物质放入盛有50g水的烧杯中,所得溶液溶质的质量分数为____________________。若将烧杯内物质升温到50℃(不考虑水蒸发),溶液中变化的是___________(选填序号)。
a.溶剂的质量 b.溶液的质量 c.溶质的质量分数
(4)从图中还可获得的信息是_______________(答出一条)。
19.(7分)某同学用提取的精盐配制100g质量分数为11.7%的氯化钠溶液,请你参与完成:
(1)计算:氯化钠的质量为__________g,水为__________g。
(2)称量:用托盘天平称量,氯化钠应放在__________(填“左盘”或“右盘”)。
(3)溶解:用量筒来量取所需的水(水的密度为1g/cm3),量筒的规格是_________(从下列中选用:10 mL、25 mL、50 mL、100 mL)。量取液体时,量筒必须放平,视线与液体的_________保持水平。溶解氯化钠要用到玻璃棒,其作用是__________。
(4)反思:若称取的氯化钠中含有水分,则所配制的溶液溶质质量分数会________(填“偏大”、“偏小”或“无影响”)。
三、实验探究题(本题包括2小题,共28分)
20.(14分)小琴同学发现:将洗衣粉入热水中很快就溶解了,而放到冷水中溶解很慢;小敏同学发现:将蔗糖和食盐分别放入同样的一杯水中,蔗糖溶解的多,而食盐溶解的少……凡此种种,是哪些因素影响着物质溶解的快慢或多少呢?请你任选一种物质,寻找可能影响其溶解快慢或多少的因素,设计实验进行探究:
【提出假设】①__________;②__________;③……
【实验探究】请就你提出的影响因素①或②,设计具体的实验方案,进行探究。
①探究的因素是_____________________;
②需控制不变的因素是_____________________;
③实验过程:_____________________,实验现象:_____________________;
④实验结论:_____________________。
21.(14分)仔细阅读下面的探究实验信息,回答相关问题。
【实验目的】探究溶解过程中,溶液温度的变化情况。
【查阅资料】(1)物质溶解于水的过程包括吸收热量(Q吸)的扩散过程和放出热量(Q放)的水合过程。
(2)实验条件下,水的凝固点为0℃、沸点为100℃。
【提出猜想】物质溶解过程中,溶液的温度可能升高或降低或不变。
【实验探究】某探究小组的同学设计了如图所示的两种方案。在图2所示方案中,每次加入物质b之前均使用温度计控制热水温度,使之保持在99℃。
【实验结论】(1)图1所示实验中,若加入物质a后,发现玻璃片与烧杯底部之间的水结冰,说明溶液的温度________(填“升高”或“降低”或“不变”,下同)。
(2)图2所示实验中,若加入物质b后,热水会突然沸腾,说明溶液的温度________。
【拓展实验】按照图3所示进行实验。若物质c为NaOH,则U型管内的左边液面将________(填“高于”或“低于”或“等于”)右边液面;若U型管内的液面位置变化与之相反,则物质c为________(填序号)。
①CaO ②NH4NO3 ③浓H2SO4
【反思交流】(1)该小组的同学进一步就物质溶解过程中溶液温度变化的原因展开了讨论,分析得出:若Q吸________Q放(填“>”或“<”或“=”,下同),则溶液温度升高;若Q吸与Q放的相对大小与之相反,则溶液温度降低;若Q吸________Q放,则溶液温度不变。
(2)在图2所示方案中,小张同学对实验现象很感兴趣,他继续向热水中加入相同质量的物质b,又看到沸腾现象,至烧杯中出现固体物质后,再继续加入相同质量的物质b,就看不到沸腾现象。请解释不再产生沸腾现象的原因________________________。
四、计算题(本题包括1小题,共10分)
22.小甜利用石灰石和稀盐酸进行如下实验,操作过程和数据如下图所示(样品中的杂质不与酸反应也不溶于水)。
(1)20g石灰石样品中 CaCO3的质量为_________g。
(2)列式计算不饱和溶液 A 的溶质质量分数(结果准确到 0.1%)。
参考答案
一、选择题
1.A 2.A 3.B 4.B 5.B 6.A 7.A 8.D 9.D
10.B 解析:结合某次蔗糖溶解实验过程图示,不考虑水分蒸发,①→②充分溶解后固体有剩余,②中溶液是饱和溶液,②加热形成③中没有剩余固体,③中溶液有可能是饱和溶液,也有可能是不饱和溶液,②③中溶剂质量相同,溶质质量不同,②③中溶液的溶质质量分数一定是不相同的,有图直观看出:③中蔗糖全部溶解,②中蔗糖部分溶解,③中溶液的溶质质量大于②中溶液的溶质质量。
11.D12.A
13.C 解析:通过分析溶解度曲线可知,t1℃时,甲与丙两种物质的溶解度相等,所以饱和溶液中溶质质量分数相同,A错误;乙物质的溶解度受温度变化的影响比甲小,所以乙中混有少量甲时,应采用蒸发结晶的方法提纯乙,B错误;甲物质在0℃时的溶解度是10g,温度升高,溶解度增大,20℃的溶解度大于10g,所以甲属于易溶物质,C正确;t2℃时,甲物质的溶解度是50g,所以30g甲溶解于50g水中形成75g溶液,D错误。
14.A 解析:用量筒量取水时,俯视读数,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,A正确;用来配制溶液的烧杯刚刚用少量蒸馏水润洗过,会造成实际量取的水的体积偏大,则使溶质质量分数偏小,B错误;用托盘天平称取蔗糖时,将蔗糖放在右盘,且称量时使用了游码,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小,C错误;用了含少量杂质的蔗糖配制溶液,会导致溶质的质量小于配制所需要的溶质质量,引起质量分数偏小,D错误。
15.D
二、填空题
16.(1)高锰酸钾 (2)水 (3)CO2 (4)碘酒中的溶剂是酒精 (5)汽水中有柠檬酸、蔗糖等溶质(合理答案均可) (6)澄清的石灰水是饱和溶液,但却是稀溶液
17.(1)碘 汽油
(2)①烧杯中固体逐渐溶解,整杯液体变为紫色 ②甲
(3)①微粒(或分子)不断运动(其他合理答案均可) ②碘在汽油中溶解性比水大 汽油的密度比水小(或汽油不溶于水 同一溶质在不同溶剂中溶解性不同 其他合理答案均可)
18.(1)30℃时,甲的溶解度是60g (2)降低温度(或增加溶质) 冷却甲的热饱和溶液 (3)37.5% bc (4)甲物质的溶解度受温度影响比乙大;t1℃时,甲乙两物质的溶解度相等;温度低于t1℃时,乙物质的溶解度大于甲物质的溶解度;温度高于t1℃时,乙物质的溶解度小于甲物质的溶解度等答出一条即可
19.(1)11.7 88.3 (2)左盘 (3)100 mL 凹液面最低处 搅拌(加速溶解) (4)偏小
三、实验探究题
20.本题是一道开放性题,答案只要切题、合理即可。举例:
【提出假设】①食盐在水中的溶解速率与食盐颗粒的大小有关
②食盐在水中的溶解速率与水的温度有关(或其他合理假设)
【实验探究】①食盐颗粒大小对溶解速率的影响
②温度、外力(搅拌)等
③取质量相同的粉状食盐和颗粒状食盐,放入相同质量、相同温度的水中 观察到粉状食盐先溶解完
④固体溶质的颗粒大小(表面积)影响溶解的速率(或其他合理答案)
21.【实验结论】(1)下降 (2)升高
【拓展实验】低于 ②
【反思交流】(1)< = (2)至烧杯中出现固体物质后,说明溶液达到饱和状态,再继续加入相同质量的物质b,不再溶解放热
解析:【实验结论】(1)若加入物质a后,发现玻璃片与烧杯底部之间的水结冰,说明溶液的温度下降;(2)若加入物质b后,热水会突然沸腾,说明溶液的温度升高。【拓展实验】若物质c为NaOH,氢氧化钠溶于水放热,装置内的气压升高,则U型管内的左边液面将低于右边液面;若U型管内的液面位置变化与之相反,则物质c溶于水吸热,①CaO和水反应放出大量的热,②NH4NO3溶于水吸热,③浓H2SO4溶于水放出大量的热,故物质c为NH4NO3。【反思交流】(1)若Q吸<Q放,则溶液温度升高;若Q吸与Q放的相对大小与之相反,则溶液温度降低;若Q吸=Q放,则溶液温度不变;(2)继续向热水中加入相同质量的物质b,又看到沸腾现象,至烧杯中出现固体物质后,说明溶液达到饱和状态,再继续加入相同质量的物质b,不再溶解放热,因此就看不到沸腾现象。
四、计算题
14.(1)15
(2)设反应生成CaCl2的质量为x,产生的CO2气体质量为 y。
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 111 44
15g x y
100/15g =111/x x=16.65g
100/15g =44/y y=6.6g
不饱和溶液A的质量=15g+100g-6.6g=108.4g
则不饱和溶液A的溶质质量分数为16.65g/108.4g×100% =15.4%
答:(1)20g石灰石样品中 CaCO3的质量为15g;(2)不饱和溶液 A 的溶质质量分数为15.4%。
PAGE
第 7 页,共 7页
同课章节目录
