第12章盐检测题-2021-2022学年九年级化学京改版下册(word版 含答案)
文档属性
| 名称 | 第12章盐检测题-2021-2022学年九年级化学京改版下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 284.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-03 17:16:12 | ||
图片预览



文档简介
第12章《盐》检测题
一、单选题
1.化学实验现象美是化学学科的魅力之一、小东记录的下列实验现象,正确的是
A.打开浓盐酸的试剂瓶口,会看到大量白烟
B.铁丝伸入到盛有氧气的集气瓶中剧烈燃烧,火星四射
C.稀盐酸除铁锈时溶液由无色变为黄色
D.将氢氧化钠溶液滴入硫酸铜溶液中,有白色沉淀产生
2.化学是改造物质、应用物质的自然科学。下列对物质应用中,主要通过物理变化实现的是
A.葡萄酿成美酒 B.海水晒得食盐
C.熟石灰改良酸性土壤 D.海水生产纯碱
3.下列物质间的转化不能通过一步实现的是
A. B.
C. D.
4.下列图像能正确反映其对应的实验操作的是
A.向两份完全相同的稀盐酸中分别加入过量的锌粉、镁粉
B.向盛有一定质量的稀盐酸的烧杯中逐滴滴加氢氧化钠溶液至过量
C.向盛有一定质量的硫酸钠溶液的烧杯中不断滴加硝酸钡溶液至过量
D.一定温度下,向不饱和的氯化钠溶液中加入氯化钠固体并搅拌
5.下列属于含氮复合肥料的是
A.KNO3 B.Ca(NO3)2 C.NH4NO3 D.NaNO3
6.为除去物质中的杂质(括号内为杂质),所选试剂及操作方法均正确的是
物质 选用试剂 操作方法
A Cu(CuO) 氧气 通入氧气并加热
B CO2(HCl) 氢氧化钠溶液 通过盛有氢氧化钠溶液的洗气瓶
C Cu(Fe) 稀硫酸 加足量稀硫酸,充分反应后过滤
D KC1溶液(K2CO3) 氯化钙溶液 加入过量氯化钙溶液充分反应后过滤
A.A B.B C.C D.D
7.推理是学习化学的重要思维方法,下列推理中合理的是
A.碱溶液pH>7,所以pH>7的溶液均为碱溶液
B.溶液是均一、稳定的混合物,但均一、稳定的物质不一定是溶液
C.洗涤剂去油污是利用了乳化作用,汽油去油污也是利用了乳化作用
D.碳酸盐与盐酸反应都有气体生成,与盐酸反应有气体生成的物质一定是碳酸盐
8.下列各组离子在溶液中能大量共存,并能使紫色石蕊溶液变蓝的是
A.H+、Ca2+、、 B.Ca2+、K+、、Cl-
C.Na+、Ba2+、OH-、 D.Na+、Ba2+、OH-、CI-
9.下列实验方案可达实验目的的是
选项 实验目的 实验方案
A 区分硬水和软水 取样,观察颜色
B 除去氯化钙溶液中的少量盐酸 加入过量的碳酸钙,充分反应后过滤
C 比较铁、铜、银的活动性强弱 分别将打磨光亮的铁片和铜片插入硝酸银溶液中
D 鉴别硫酸铵和氯化铵两种化肥 取样,分别与熟石灰混合研磨,闻气味
A.A B.B C.C D.D
10.除去难溶性杂质后的食盐中往往含有少量的Na2SO4、MgCl2、CaCl2等杂质,为了将这些杂质除去,可向食盐溶液中加入过量的NaOH、Na2CO3、BaCl2溶液,然后过滤除去沉淀,再加入盐酸调至溶液pH=7,最后经蒸发得到精盐。下列操作及加入溶液顺序不正确的是
A.BaCl2、Na2CO3、NaOH、过滤、HCl B.BaCl2、NaOH、Na2CO3、过滤、HCl
C.Na2CO3、BaCl2、NaOH、过滤、HCl D.NaOH、BaCl2、Na2CO3、过滤、HCl
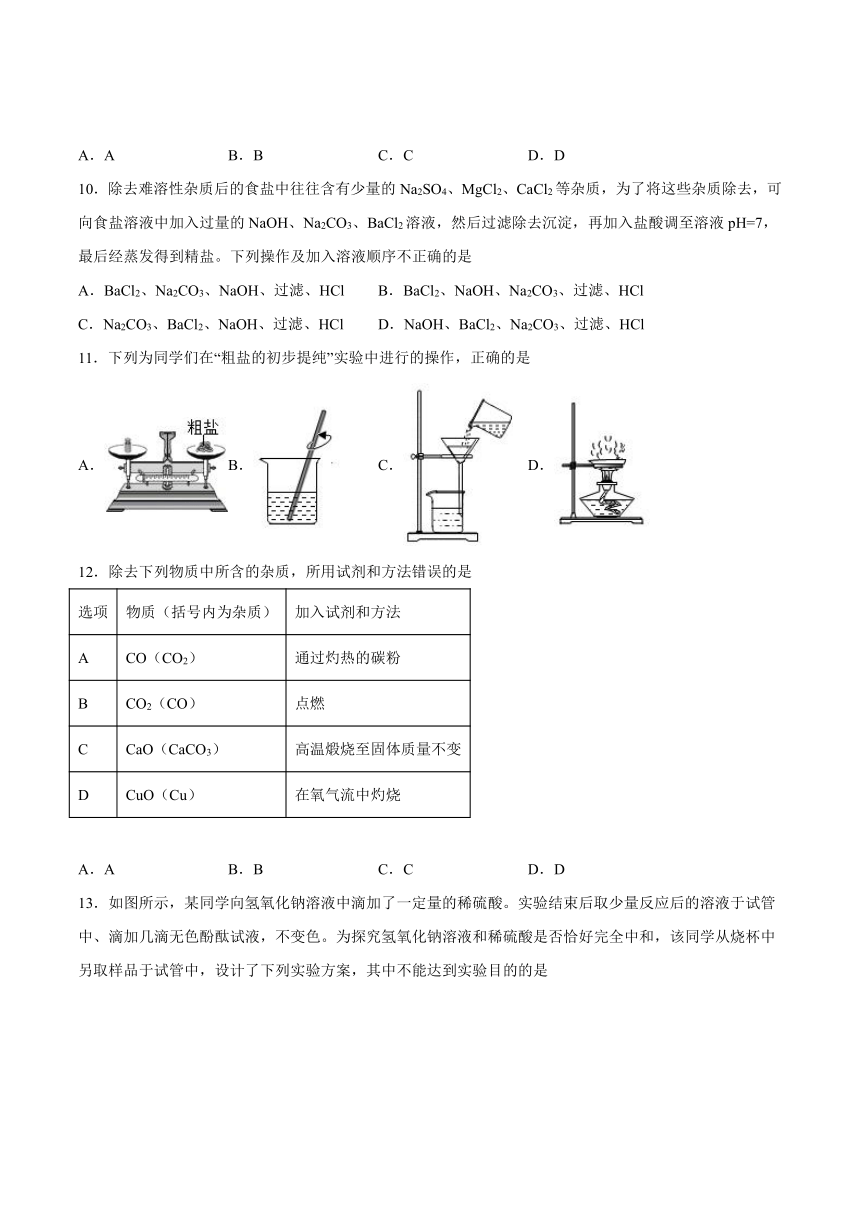
11.下列为同学们在“粗盐的初步提纯”实验中进行的操作,正确的是
A. B. C. D.
12.除去下列物质中所含的杂质,所用试剂和方法错误的是
选项 物质(括号内为杂质) 加入试剂和方法
A CO(CO2) 通过灼热的碳粉
B CO2(CO) 点燃
C CaO(CaCO3) 高温煅烧至固体质量不变
D CuO(Cu) 在氧气流中灼烧
A.A B.B C.C D.D
13.如图所示,某同学向氢氧化钠溶液中滴加了一定量的稀硫酸。实验结束后取少量反应后的溶液于试管中、滴加几滴无色酚酞试液,不变色。为探究氢氧化钠溶液和稀硫酸是否恰好完全中和,该同学从烧杯中另取样品于试管中,设计了下列实验方案,其中不能达到实验目的的是
A.加入碳酸钠粉末,无气泡产生 B.加入锌,无气泡产生
C.加入氯化钡溶液,有白色沉淀产生 D.滴加紫色石蕊试液,试液不变色
二、简答题
14.生活处处是化学。请回答:
(1)下列水的净化方法中净化程度最高的是________(填字母序号)。
A静置沉淀 B吸附沉淀 C蒸馏 D过滤
(2)制衣行业大量使用合成纤维,可用______方法区别合成纤维和羊毛制品。
(3)过度使用化肥也会造成水污染,但为了提高农作物产量又必须合理使用化肥。某稻田禾苗出现泛黄现象,此时应及时追施________(填“氮肥”或“钾肥”)。
(4)燃气公司给用户输送燃气,在初次使用之前需要通入氮气,通入氮气的目的是什么?______________。关闭燃气开关灭火,运用的原理是______
(5)植树造林提高绿化面积可降低_____ (填“温室效应”或“白色污染”)。
15.请用所学知识回答下列生活中的问题。
(1)汽油洗涤剂均能去除油污,二者除油污的原理有何不同?______
(2)服用含小苏打的药物可以治疗胃酸过多症,写出反应的化学方程式。______
三、推断题
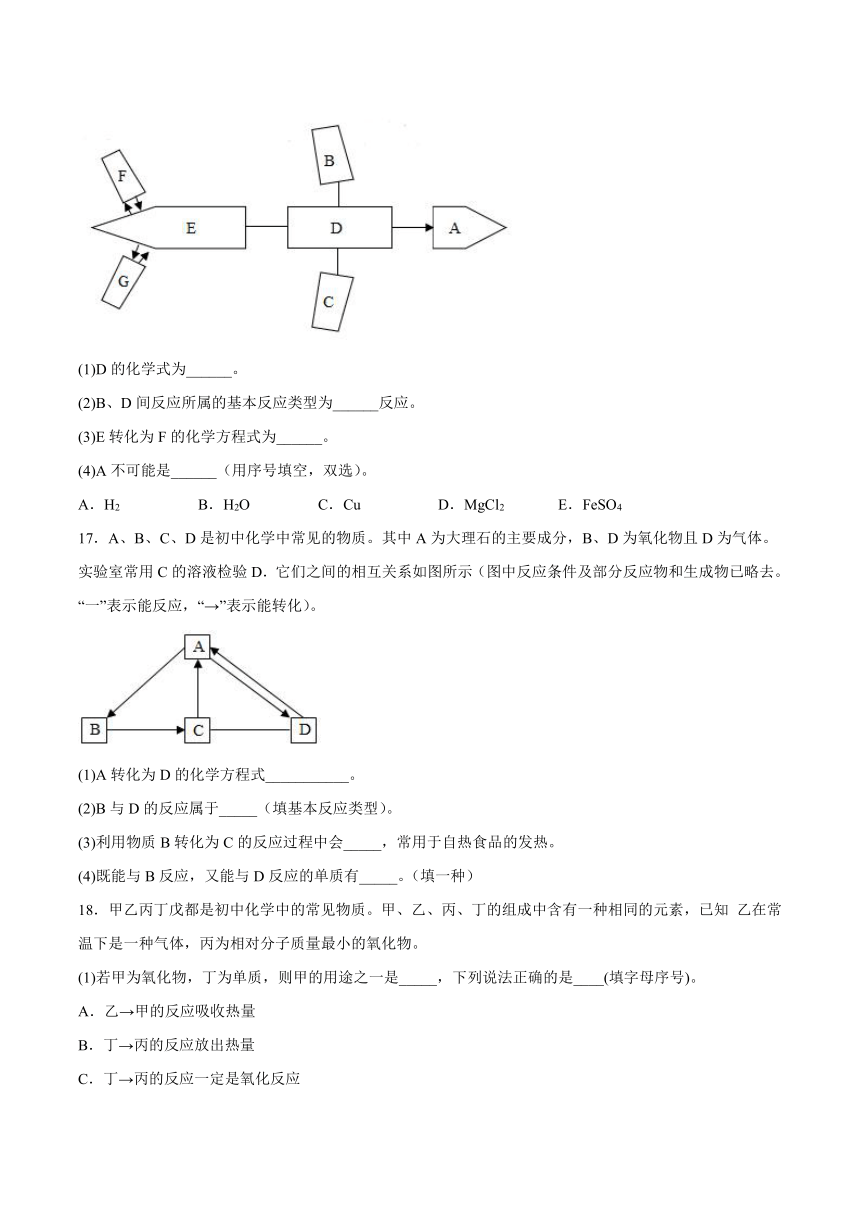
16.化学号大飞机(如图)由初中化学常见的七种物质A~G组成(图中两种物质连接方式“→”表示物质间通过一步反应可以转化,“—”表示物质间可以发生反应,图中所涉及反应均为初中化学常见的反应),其中B、C、D、E、F是不同类别的物质,C、G是同一类化合物, B、C中都含有地壳中含量居第二位的金属元素,D是胃液的主要成分,可帮助消化,E俗称苏打。请回答下列问题:
(1)D的化学式为______。
(2)B、D间反应所属的基本反应类型为______反应。
(3)E转化为F的化学方程式为______。
(4)A不可能是______(用序号填空,双选)。
A.H2 B.H2O C.Cu D.MgCl2 E.FeSO4
17.A、B、C、D是初中化学中常见的物质。其中A为大理石的主要成分,B、D为氧化物且D为气体。实验室常用C的溶液检验D.它们之间的相互关系如图所示(图中反应条件及部分反应物和生成物已略去。“一”表示能反应,“→”表示能转化)。
(1)A转化为D的化学方程式___________。
(2)B与D的反应属于_____(填基本反应类型)。
(3)利用物质B转化为C的反应过程中会_____,常用于自热食品的发热。
(4)既能与B反应,又能与D反应的单质有_____。(填一种)
18.甲乙丙丁戊都是初中化学中的常见物质。甲、乙、丙、丁的组成中含有一种相同的元素,已知 乙在常温下是一种气体,丙为相对分子质量最小的氧化物。
(1)若甲为氧化物,丁为单质,则甲的用途之一是_____,下列说法正确的是____(填字母序号)。
A.乙→甲的反应吸收热量
B.丁→丙的反应放出热量
C.丁→丙的反应一定是氧化反应
D.丁→丙的反应一定是化合反应
E。甲→乙的反应一定是化合反应
(2)若甲、丁均为由三种元素组成的化合物,则丁→丙转化的化学反应方程式为_____,若戊为常温下的一种液体,则戊的化学式为:_____。
四、实验题
19.结合如图所示验证氢氧化钙化学性质的实验图示,回答有关问题。
(1)实验A中,一定能够观察到的明显现象是______;
(2)实验B中发生的反应方程式为 ______;
(3)已知Na2CO3溶液呈碱性,将A、B、C三个实验后的所有物质倒入同一个烧杯中,发现有气泡产生,最后只得到了无色溶液,则最后得到的无色溶液中一定含有的溶质是____。
20.如图A﹣D是初中化学中的四个实验装置,请按要求填空。
(1)图A中的无色液体可用于检验氧气中含少量二氧化碳,该反应的化学方程式为______。
(2)图B所示“铁的锈蚀实验”观察到的现象__________。
(3)粗盐提纯的实验操作步骤为______、______、蒸发,在图C蒸发操作中,玻璃棒的作用是________。
(4)如图D小巍同学向洁净的点滴板上已有物质中分别加入5~6滴稀硫酸后,观察现象。该实验的目的是____________。
21.患有胃酸过多症的人可服用碳酸氢钠片或铝碳酸镁片[主要成分为Al2Mg6(OH)16CO3]进行治疗,某兴趣小组的同学对这两种药物开展了如下探究。
(1)写出碳酸氢钠片与人体中的胃酸反应的化学方程式_____。
(2)如图是小组同学利用数字化实验装置分别模拟碳酸氢钠片、铝碳酸镁片与胃酸的反应(碳酸氢钠片与铝碳酸镁片规格相同,“胃酸”体积相同),探究两种药物中和酸的能力强弱的曲线图。分析图像可知,服用铝碳酸镁片治疗胃酸过多症的效果更好,请说明理由______。
五、计算题
22.向盛有一定质量氢氧化钠溶液的烧杯中加入12g硫酸镁固体,恰好完全反应。过滤得到滤液100g。发生反应的化学方程式为:。请计算:
(1)过滤所得滤渣的质量为___________g。
(2)恰好完全反应时,所得溶液的溶质质量分数。
(3)原烧杯中氢氧化钠溶液的溶质质量分数。
23.某兴趣小组的同学为了测定碳酸钠和氡化钠的混合物中碳酸钠的含量,取该混合物样品与足量稀盐酸在烧杯中反应,有关实验数据如下表:
反应前 反应后
实验数据 烧杯和稀盐酸的质量 混合物样品的质量 烧杯和其中混合物的质量
150g 12g 157.6g
(1)反应生成二氧化碳的质量为_______g。
(2)样品中碳酸钠的质量分数是多少?
参考答案:
1.C 2.B 3.B 4.B 5.A 6.C 7.B 8.D 9.B 10.C 11.B 12.B 13.C
14. C 燃烧闻气味 氮肥 赶走里面的空气,防止点燃时发生爆炸 清除可燃物 温室效应
15. 汽油除油污利用了汽油能溶解油污,洗涤剂除油污利用了洗涤剂的乳化作用
16.(1)HCl
(2)置换反应
(3)Na2CO3 + 2HCl =2NaCl + H2O + CO2↑或Na2CO3 + H2SO4 =Na2SO4 + H2O + CO2↑(合理即可)
(4)CE
17.(1) (或 )
(2)化合反应
(3)放出热量
(4)碳
18.(1) 冶炼金属 ABC
(2)
C2H5OH
19.(1)澄清石灰水变浑浊
(2)Ca(OH)2+2HCl=CaCl2+2H2O
(3)氯化钙和氯化钠
20.(1)
(2)铁丝表面有红色物质生成,烧杯内的红色液体进入导管中
(3) 溶解 过滤 搅拌,防止因局部温度过高造成液滴飞溅
(4)探究酸的化学性质
21.(1)
(2)相同时间内铝碳酸镁片使pH增大的程度更大
22.(1)5.8
(2)设生成硫酸钠的质量为y。
故恰好完全反应时,所得溶液的溶质质量分数为。
(3)设参加反应的氢氧化钠的质量为z。
故原烧杯中氢氧化钠溶液的溶质质量分数为。
23.(1)4.4
(2)解:设样品中碳酸钠的质量为x,则有
样品中碳酸钠的质量分数是×100%≈88.3%;
答:样品中碳酸钠的质量分数是88.3%。
一、单选题
1.化学实验现象美是化学学科的魅力之一、小东记录的下列实验现象,正确的是
A.打开浓盐酸的试剂瓶口,会看到大量白烟
B.铁丝伸入到盛有氧气的集气瓶中剧烈燃烧,火星四射
C.稀盐酸除铁锈时溶液由无色变为黄色
D.将氢氧化钠溶液滴入硫酸铜溶液中,有白色沉淀产生
2.化学是改造物质、应用物质的自然科学。下列对物质应用中,主要通过物理变化实现的是
A.葡萄酿成美酒 B.海水晒得食盐
C.熟石灰改良酸性土壤 D.海水生产纯碱
3.下列物质间的转化不能通过一步实现的是
A. B.
C. D.
4.下列图像能正确反映其对应的实验操作的是
A.向两份完全相同的稀盐酸中分别加入过量的锌粉、镁粉
B.向盛有一定质量的稀盐酸的烧杯中逐滴滴加氢氧化钠溶液至过量
C.向盛有一定质量的硫酸钠溶液的烧杯中不断滴加硝酸钡溶液至过量
D.一定温度下,向不饱和的氯化钠溶液中加入氯化钠固体并搅拌
5.下列属于含氮复合肥料的是
A.KNO3 B.Ca(NO3)2 C.NH4NO3 D.NaNO3
6.为除去物质中的杂质(括号内为杂质),所选试剂及操作方法均正确的是
物质 选用试剂 操作方法
A Cu(CuO) 氧气 通入氧气并加热
B CO2(HCl) 氢氧化钠溶液 通过盛有氢氧化钠溶液的洗气瓶
C Cu(Fe) 稀硫酸 加足量稀硫酸,充分反应后过滤
D KC1溶液(K2CO3) 氯化钙溶液 加入过量氯化钙溶液充分反应后过滤
A.A B.B C.C D.D
7.推理是学习化学的重要思维方法,下列推理中合理的是
A.碱溶液pH>7,所以pH>7的溶液均为碱溶液
B.溶液是均一、稳定的混合物,但均一、稳定的物质不一定是溶液
C.洗涤剂去油污是利用了乳化作用,汽油去油污也是利用了乳化作用
D.碳酸盐与盐酸反应都有气体生成,与盐酸反应有气体生成的物质一定是碳酸盐
8.下列各组离子在溶液中能大量共存,并能使紫色石蕊溶液变蓝的是
A.H+、Ca2+、、 B.Ca2+、K+、、Cl-
C.Na+、Ba2+、OH-、 D.Na+、Ba2+、OH-、CI-
9.下列实验方案可达实验目的的是
选项 实验目的 实验方案
A 区分硬水和软水 取样,观察颜色
B 除去氯化钙溶液中的少量盐酸 加入过量的碳酸钙,充分反应后过滤
C 比较铁、铜、银的活动性强弱 分别将打磨光亮的铁片和铜片插入硝酸银溶液中
D 鉴别硫酸铵和氯化铵两种化肥 取样,分别与熟石灰混合研磨,闻气味
A.A B.B C.C D.D
10.除去难溶性杂质后的食盐中往往含有少量的Na2SO4、MgCl2、CaCl2等杂质,为了将这些杂质除去,可向食盐溶液中加入过量的NaOH、Na2CO3、BaCl2溶液,然后过滤除去沉淀,再加入盐酸调至溶液pH=7,最后经蒸发得到精盐。下列操作及加入溶液顺序不正确的是
A.BaCl2、Na2CO3、NaOH、过滤、HCl B.BaCl2、NaOH、Na2CO3、过滤、HCl
C.Na2CO3、BaCl2、NaOH、过滤、HCl D.NaOH、BaCl2、Na2CO3、过滤、HCl
11.下列为同学们在“粗盐的初步提纯”实验中进行的操作,正确的是
A. B. C. D.
12.除去下列物质中所含的杂质,所用试剂和方法错误的是
选项 物质(括号内为杂质) 加入试剂和方法
A CO(CO2) 通过灼热的碳粉
B CO2(CO) 点燃
C CaO(CaCO3) 高温煅烧至固体质量不变
D CuO(Cu) 在氧气流中灼烧
A.A B.B C.C D.D
13.如图所示,某同学向氢氧化钠溶液中滴加了一定量的稀硫酸。实验结束后取少量反应后的溶液于试管中、滴加几滴无色酚酞试液,不变色。为探究氢氧化钠溶液和稀硫酸是否恰好完全中和,该同学从烧杯中另取样品于试管中,设计了下列实验方案,其中不能达到实验目的的是
A.加入碳酸钠粉末,无气泡产生 B.加入锌,无气泡产生
C.加入氯化钡溶液,有白色沉淀产生 D.滴加紫色石蕊试液,试液不变色
二、简答题
14.生活处处是化学。请回答:
(1)下列水的净化方法中净化程度最高的是________(填字母序号)。
A静置沉淀 B吸附沉淀 C蒸馏 D过滤
(2)制衣行业大量使用合成纤维,可用______方法区别合成纤维和羊毛制品。
(3)过度使用化肥也会造成水污染,但为了提高农作物产量又必须合理使用化肥。某稻田禾苗出现泛黄现象,此时应及时追施________(填“氮肥”或“钾肥”)。
(4)燃气公司给用户输送燃气,在初次使用之前需要通入氮气,通入氮气的目的是什么?______________。关闭燃气开关灭火,运用的原理是______
(5)植树造林提高绿化面积可降低_____ (填“温室效应”或“白色污染”)。
15.请用所学知识回答下列生活中的问题。
(1)汽油洗涤剂均能去除油污,二者除油污的原理有何不同?______
(2)服用含小苏打的药物可以治疗胃酸过多症,写出反应的化学方程式。______
三、推断题
16.化学号大飞机(如图)由初中化学常见的七种物质A~G组成(图中两种物质连接方式“→”表示物质间通过一步反应可以转化,“—”表示物质间可以发生反应,图中所涉及反应均为初中化学常见的反应),其中B、C、D、E、F是不同类别的物质,C、G是同一类化合物, B、C中都含有地壳中含量居第二位的金属元素,D是胃液的主要成分,可帮助消化,E俗称苏打。请回答下列问题:
(1)D的化学式为______。
(2)B、D间反应所属的基本反应类型为______反应。
(3)E转化为F的化学方程式为______。
(4)A不可能是______(用序号填空,双选)。
A.H2 B.H2O C.Cu D.MgCl2 E.FeSO4
17.A、B、C、D是初中化学中常见的物质。其中A为大理石的主要成分,B、D为氧化物且D为气体。实验室常用C的溶液检验D.它们之间的相互关系如图所示(图中反应条件及部分反应物和生成物已略去。“一”表示能反应,“→”表示能转化)。
(1)A转化为D的化学方程式___________。
(2)B与D的反应属于_____(填基本反应类型)。
(3)利用物质B转化为C的反应过程中会_____,常用于自热食品的发热。
(4)既能与B反应,又能与D反应的单质有_____。(填一种)
18.甲乙丙丁戊都是初中化学中的常见物质。甲、乙、丙、丁的组成中含有一种相同的元素,已知 乙在常温下是一种气体,丙为相对分子质量最小的氧化物。
(1)若甲为氧化物,丁为单质,则甲的用途之一是_____,下列说法正确的是____(填字母序号)。
A.乙→甲的反应吸收热量
B.丁→丙的反应放出热量
C.丁→丙的反应一定是氧化反应
D.丁→丙的反应一定是化合反应
E。甲→乙的反应一定是化合反应
(2)若甲、丁均为由三种元素组成的化合物,则丁→丙转化的化学反应方程式为_____,若戊为常温下的一种液体,则戊的化学式为:_____。
四、实验题
19.结合如图所示验证氢氧化钙化学性质的实验图示,回答有关问题。
(1)实验A中,一定能够观察到的明显现象是______;
(2)实验B中发生的反应方程式为 ______;
(3)已知Na2CO3溶液呈碱性,将A、B、C三个实验后的所有物质倒入同一个烧杯中,发现有气泡产生,最后只得到了无色溶液,则最后得到的无色溶液中一定含有的溶质是____。
20.如图A﹣D是初中化学中的四个实验装置,请按要求填空。
(1)图A中的无色液体可用于检验氧气中含少量二氧化碳,该反应的化学方程式为______。
(2)图B所示“铁的锈蚀实验”观察到的现象__________。
(3)粗盐提纯的实验操作步骤为______、______、蒸发,在图C蒸发操作中,玻璃棒的作用是________。
(4)如图D小巍同学向洁净的点滴板上已有物质中分别加入5~6滴稀硫酸后,观察现象。该实验的目的是____________。
21.患有胃酸过多症的人可服用碳酸氢钠片或铝碳酸镁片[主要成分为Al2Mg6(OH)16CO3]进行治疗,某兴趣小组的同学对这两种药物开展了如下探究。
(1)写出碳酸氢钠片与人体中的胃酸反应的化学方程式_____。
(2)如图是小组同学利用数字化实验装置分别模拟碳酸氢钠片、铝碳酸镁片与胃酸的反应(碳酸氢钠片与铝碳酸镁片规格相同,“胃酸”体积相同),探究两种药物中和酸的能力强弱的曲线图。分析图像可知,服用铝碳酸镁片治疗胃酸过多症的效果更好,请说明理由______。
五、计算题
22.向盛有一定质量氢氧化钠溶液的烧杯中加入12g硫酸镁固体,恰好完全反应。过滤得到滤液100g。发生反应的化学方程式为:。请计算:
(1)过滤所得滤渣的质量为___________g。
(2)恰好完全反应时,所得溶液的溶质质量分数。
(3)原烧杯中氢氧化钠溶液的溶质质量分数。
23.某兴趣小组的同学为了测定碳酸钠和氡化钠的混合物中碳酸钠的含量,取该混合物样品与足量稀盐酸在烧杯中反应,有关实验数据如下表:
反应前 反应后
实验数据 烧杯和稀盐酸的质量 混合物样品的质量 烧杯和其中混合物的质量
150g 12g 157.6g
(1)反应生成二氧化碳的质量为_______g。
(2)样品中碳酸钠的质量分数是多少?
参考答案:
1.C 2.B 3.B 4.B 5.A 6.C 7.B 8.D 9.B 10.C 11.B 12.B 13.C
14. C 燃烧闻气味 氮肥 赶走里面的空气,防止点燃时发生爆炸 清除可燃物 温室效应
15. 汽油除油污利用了汽油能溶解油污,洗涤剂除油污利用了洗涤剂的乳化作用
16.(1)HCl
(2)置换反应
(3)Na2CO3 + 2HCl =2NaCl + H2O + CO2↑或Na2CO3 + H2SO4 =Na2SO4 + H2O + CO2↑(合理即可)
(4)CE
17.(1) (或 )
(2)化合反应
(3)放出热量
(4)碳
18.(1) 冶炼金属 ABC
(2)
C2H5OH
19.(1)澄清石灰水变浑浊
(2)Ca(OH)2+2HCl=CaCl2+2H2O
(3)氯化钙和氯化钠
20.(1)
(2)铁丝表面有红色物质生成,烧杯内的红色液体进入导管中
(3) 溶解 过滤 搅拌,防止因局部温度过高造成液滴飞溅
(4)探究酸的化学性质
21.(1)
(2)相同时间内铝碳酸镁片使pH增大的程度更大
22.(1)5.8
(2)设生成硫酸钠的质量为y。
故恰好完全反应时,所得溶液的溶质质量分数为。
(3)设参加反应的氢氧化钠的质量为z。
故原烧杯中氢氧化钠溶液的溶质质量分数为。
23.(1)4.4
(2)解:设样品中碳酸钠的质量为x,则有
样品中碳酸钠的质量分数是×100%≈88.3%;
答:样品中碳酸钠的质量分数是88.3%。
