第十单元酸和碱 课题2酸和碱的中和反应(第2课时)课后练习—2021—2022学年九年级化学人教版下册(word版 含答案)
文档属性
| 名称 | 第十单元酸和碱 课题2酸和碱的中和反应(第2课时)课后练习—2021—2022学年九年级化学人教版下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 105.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-04 17:01:36 | ||
图片预览


文档简介
2021——2022学年度人教版九年级化学下册 第十单元 酸和碱
课题2 酸和碱的中和反应(第2课时)课后练习
一、选择题
1.类推是学习化学时常用的思维方式。下列类推结果正确的是
A.化学反应常伴随能量变化,则人类利用的能量一定是由化学变化提供的
B.碱溶液能使无色酚酞溶液变红,则能使无色酚酞溶液变红的物质一定是碱
C.单质中只含一种元素,则只含一种元素的纯净物一定是单质
D.中和反应生成盐和水,则生成盐和水的反应一定是中和反应
2.下列排序正确的是
A.空气中物质含量: B.溶液的pH:
C.利用金属的年代: D.氯元素化合价:
3.氢氧化钾与氢氧化钠性质相似,下列有关氢氧化钾的说法错误的是
A.氢氧化钾固体露置在空气中易潮解
B.氢氧化钾溶液能使石蕊溶液变蓝
C.氢氧化钾也可用于去油污
D.10g10%的氢氧化钾溶液与10g10%的硫酸溶液恰好完全反应
4.为完全中和一定质量的某强酸溶液,需用10 g溶质的质量分数为4%的KOH溶液。如果改用10 g溶质的质量分数为4%的NaOH溶液,则反应后溶液的pH
A.小于7 B.等于7 C.大于7 D.无法判断
5.用稀硫酸与氢氧化钠溶液反应探究中和反应实验时,测得溶液pH的变化如图所示,溶液温度的变化如图所示。下列说法错是
A.b点和e点表示酸碱恰好完全反应
B.图中温度曲线从室温上升到e点,说明该反应是放热反应
C.c点和f点所示溶液pH>7,能使无色酚酞试液变成红色
D.该实验是将稀硫酸逐滴滴入一定量的氢氧化钠溶液中
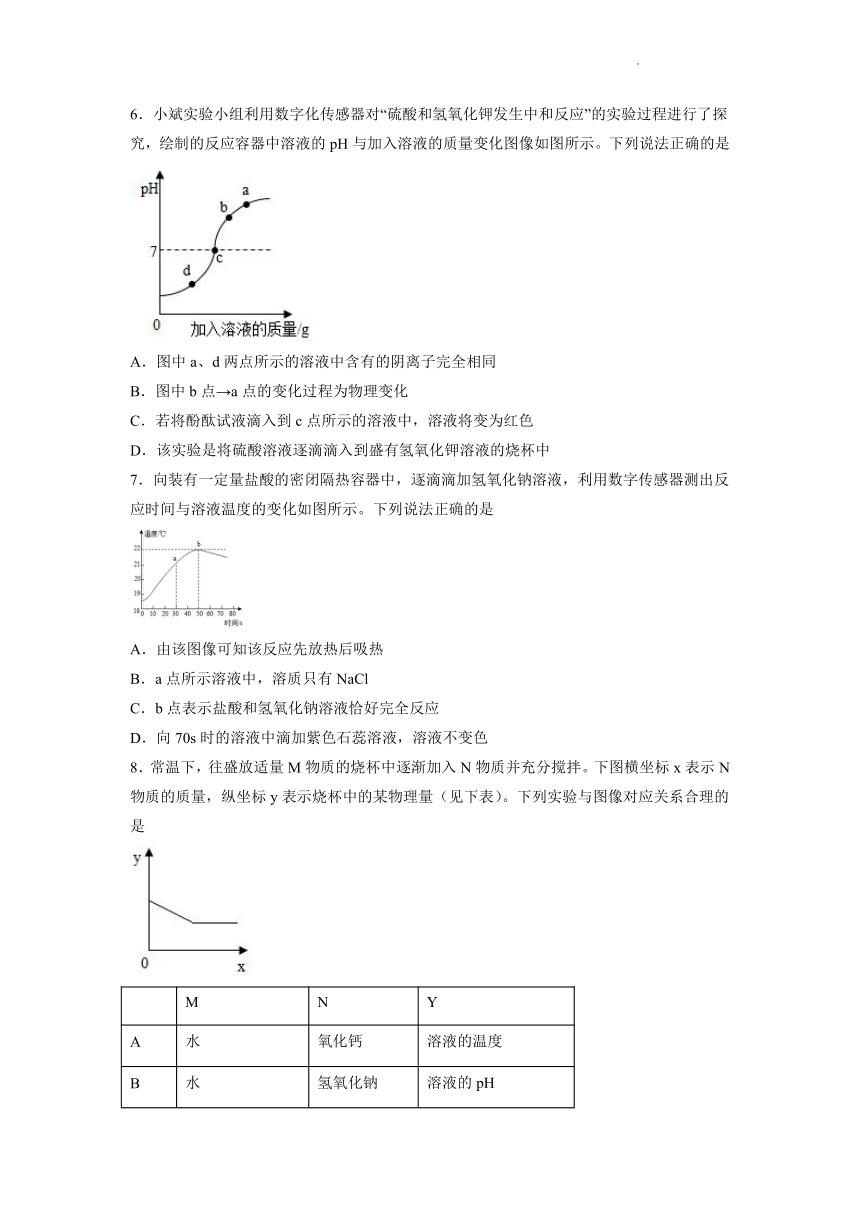
6.小斌实验小组利用数字化传感器对“硫酸和氢氧化钾发生中和反应”的实验过程进行了探究,绘制的反应容器中溶液的pH与加入溶液的质量变化图像如图所示。下列说法正确的是
A.图中a、d两点所示的溶液中含有的阴离子完全相同
B.图中b点→a点的变化过程为物理变化
C.若将酚酞试液滴入到c点所示的溶液中,溶液将变为红色
D.该实验是将硫酸溶液逐滴滴入到盛有氢氧化钾溶液的烧杯中
7.向装有一定量盐酸的密闭隔热容器中,逐滴滴加氢氧化钠溶液,利用数字传感器测出反应时间与溶液温度的变化如图所示。下列说法正确的是
A.由该图像可知该反应先放热后吸热
B.a点所示溶液中,溶质只有NaCl
C.b点表示盐酸和氢氧化钠溶液恰好完全反应
D.向70s时的溶液中滴加紫色石蕊溶液,溶液不变色
8.常温下,往盛放适量M物质的烧杯中逐渐加入N物质并充分搅拌。下图横坐标x表示N物质的质量,纵坐标y表示烧杯中的某物理量(见下表)。下列实验与图像对应关系合理的是
M N Y
A 水 氧化钙 溶液的温度
B 水 氢氧化钠 溶液的pH
C 饱和石灰水溶液 氧化钙 溶液中溶质的质量
D 硫酸铜溶液 铁粉 溶液的质量
A.A B.B C.C D.D
9.下列图象能正确反映其对应变化关系的是
A.向一定质量氯化亚铁和氯化锌的混合溶液中加入镁粉至过量
B.某温度时,向一定量的饱和石灰水中加入少量生石灰,并恢复原温度
C.向等质量的镁、铝中分别加入等质量分数的稀盐酸至过量
D.向一定量的稀盐酸中不断加入NaOH溶液至过量
10.某NaOH固体样品,可能含有固体KOH和不溶于酸的杂质A,取5.6g该样品与100g一定质量分数的稀盐酸反应,恰好完全反应,生成mg水。下列说法不正确的是
A.若样品不含任何杂质,则m>1.8
B.若m=1.8,则样品中一定含有杂质A
C.若m=1.8,则样品中一定含有固体KOH
D.若样品中不含A,则盐酸的溶质质量分数可能为4%
11.推理是化学学习中常用的思维方式,下列推理中正确的是( )
A.碱溶液能跟某些非金属氧化物反应,所以碱溶液能吸收CO气体
B.中和反应生成盐和水,但是生成盐和水的反应不一定是中和反应
C.溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小
D.碱溶液的pH大于7,pH大于7的溶液一定是碱溶液
12.为检验氢氧化钠溶液是否部分变质,分别取少量样品于试管中进行如下实验,一定能 达到实验目的的是
A.滴加少量稀盐酸 B.滴加氢氧化钡溶液
C.滴加 1~2 滴酚酞溶液 D.滴加适量的氯化钙溶液、静置、再滴加酚酞溶液
13.某兴趣小组在实验室中制取 CO2 气体后,对废液进行后续探究,他向一定质量的废液中逐滴加入Na2CO3溶液,加入Na2CO3溶液的质量与溶液的pH变化关系如图所示,下列说法错误的是
A.该曲线说明原废液中有盐酸剩余 B.AB 段的反应中有气泡产生
C.BC 段发生的是氯化钙与碳酸钠的反应 D.CD 段溶液中的溶质只有 NaCl
14.盛有等质量、等质量分数稀盐酸的两只烧杯,放在托盘天平的左右两盘,天平平衡,在左盘烧杯中加入10gCaCO3,恰好完全反应,若要使天平重新平衡,则右盘烧杯中应加入的下列物质是
A.5.6g铁和锌 B.10g镁和氧化镁
C.10g碳酸镁 D.10g碳酸钠和碳酸锌
二、填空题
15.对于硫酸而言,溶质的质量分数越大,溶液的酸性越强。常温下,10%的稀硫酸的pH______2%的稀硫酸的PH。如果要使稀硫酸的PH升高。你采取的方法有:
(1)物理方法:___________________;
(2)化学反应的方法:_____________________。
16.用化学方程式解释下列问题:
(1)用石灰水检验CO2气体____________;
(2)用硫酸铜和熟石灰配制波尔多液时不能在铁桶中配:____________;
(3)写一个有水生成的复分解反应____________。
17.对于稀硫酸而言,溶质的质量分数越大,溶液的酸性越强。常温下,10%的稀硫酸的pH____(填“大于”“小于”或“等于”)2%的稀硫酸的pH。如果要使稀硫酸的pH升高,你采取的方法有:
(1)不发生化学反应的方法:_______。
(2)发生化学反应的方法(要求各种方法中所选的物质类别不同):
①物质为______;反应的化学方程式为______________。
②物质为______;反应的化学方程式为______________。
③物质为______;反应的化学方程式为______________。
18.请结合下列四瓶溶液回答问题:
(1)农业上可以用溶液来选种_________(填写化学式);
(2)医疗上治疗胃酸过多症选用的一种药剂是_________(填写序号);
(3)写出①和③两瓶溶液发生反应的化学方程式__________________________;
(4)①、②、③三种溶液pH值由大到小的顺序是___________________(填写序号)。
19.旧铜器表面的“铜绿”主要成分的化学式为Cu2(OH)2CO3.小强对实验室用稀硫酸洗去“铜绿”所形成的废液进行实验:
(1)观察废液呈____色。测量废液的pH=1,说明废液中还含有____。
(2)取废液滴加到澄清石灰水中,能观察到的现象是____,溶液中发生反应的化学方程式为(写一个)____。
20.用熟石灰中和一定量的盐酸时,溶液的pH与加入的熟石灰质量的关系如右图所示。熟石灰与盐酸反应的化学方程式为____。当加入熟石灰mg时,溶液中的溶质为._____。若改用ng氢氧化钠与相同盐酸反应,所得溶液的pH___7(填“>”、“<”或“=”)。
三、简答题
21.某小型造纸厂向河中非法排放了大量碱性废液。请你根据所学的知识,设计两种检测碱性废液和受污染河水的方法,并试着提出治理的措施。
22.甲工厂排出的废水中含有少量氢氧化钠,与乙工厂排出的废水混合后,测得溶液的pH=7,且只含有氯化钠一种溶质。回答下列问题:
(1)乙工厂的废水中含有的物质为_____(写化学式)。
(2)写出反应的化学方程式_____。
23.在5mL氢氧化钠溶液中滴加2滴酚酞试液,溶液呈______色,再加入5mL稀盐酸,得到无色溶液,则无色溶液一定是_________。
Ⅰ pH≤7 Ⅱ pH=7 Ⅲ pH <7 ⅣpH>7
将无色溶液蒸发至干,看到的现象是____________。
若将40克10%氢氧化钠溶液和足量稀盐酸反应,计算生成氯化钠的物质的量。(根据化学方程式计算)_______
24.向一定量 NaOH 溶液中,滴加稀盐酸,所加盐酸的量与溶液 pH 的变化如图所示:
(1)当加入稀盐酸的体积为_____mL 时,稀盐酸与 NaOH 溶液恰好完全反应;
(2)向上述加了 12mL 稀盐酸后的 NaOH 溶液中滴加紫色石蕊试液,溶液显_____色;
(3)当加入 8 mL 稀盐酸时,溶液中的溶质有_____。
四、综合应用题
25.生活中常见物质的性质、制法等是化学研究的重要内容。
(1)复分解反应发生后,生成物肯定不会是 ___ (填“单质”或“化合物”)。
(2)盐酸与氢氧化钠溶液反应时溶液pH的变化如图1所示。下列说法正确的是 ___ 。
a.m点所示溶液为碱性
b.n点所示溶液中加紫色石蕊溶液显红色
c.p点所示溶液中的溶质为NaCl和NaOH
d.该图所对应操作是将盐酸滴入氢氧化钠溶液中
(3)浓硫酸和浓盐酸敞口放置均会变稀,这是为什么? ____
(4)图2装置可做一氧化碳还原氧化铁的实验,并检验生成的气体产物。
①B装置玻璃管里可观察到的现象为 ___ 。
②C装置中反应的化学方程式为 ___ 。
③实验结束后,若要确定A装置的溶液中溶质的成分,请设计合理的实验方案,简要写出实验步骤、现象和结论。(提示:Na2CO3溶液呈碱性) ____
现有73g溶质质量分数为10%的稀盐酸和127g氢氧化钠溶液恰好完全反应,求反应后溶液中溶质的质量分数 ____ 。
【参考答案】
1.C 2.B 3.D 4.C 5.D 6.B 7.C 8.D 9.D 10.C 11.B 12.D 13.D 14.C
15. 小于 加水 加碱(或活泼金属、等)
16. Ca(OH)2+CO2=CaCO3↓+H2O CuSO4+Fe=FeSO4+Cu HCl + NaOH = NaCl +H2O(答一条合理即可)
17. 小于 加入一定量的水 锌 Zn+H2SO4=ZnSO4+H2↑ 氧化铜 CuO+H2SO4=CuSO4+H2O 氢氧化钠 2NaOH+H2SO4=Na2SO4+2H2O
18. NaCl ④ HCl+NaOH=NaCl+H2O ③>②>①
19. 蓝 硫酸 产生蓝色沉淀
20. HCl、CaCl2 <
21.方法一:取少量河水样品于试管中,滴加2~3滴酚酞溶液,若溶液变红,则说明河水呈碱性。方法二:在白瓷板或玻璃片上放一片pH试纸,用玻璃棒蘸取河水的水样滴到试纸上,然后将试纸与标准比色卡进行比较读值,若pH>7,则说明河水呈碱性。
治理措施:可向该造纸厂的废水中加入一定量的硫酸,调整溶液的pH为7时才排放。
22. HCl NaOH+HCl=NaCl+H2O
23. 红 Ⅰ 白色固体 0.1mol
24. 10 红 氯化钠和氢氧化钠
25. (1) 单质 (2) C (3) 浓硫酸有吸水性,吸收空气中水蒸气使溶剂增多,浓盐酸有挥发性,使溶质减小。 固体红色粉末逐渐变黑 (4)CO2+Ca(OH)2===CaCO3↓+H2O 取少量,A装置中溶液少量放在试管中,加入过量(足量)CaCl2溶液静置,向上层清液中加入几滴酚酞。若溶液变红,则溶质为Na2CO3和NaOH,若溶液没有变成红色则溶质为Na2CO3 (5)
课题2 酸和碱的中和反应(第2课时)课后练习
一、选择题
1.类推是学习化学时常用的思维方式。下列类推结果正确的是
A.化学反应常伴随能量变化,则人类利用的能量一定是由化学变化提供的
B.碱溶液能使无色酚酞溶液变红,则能使无色酚酞溶液变红的物质一定是碱
C.单质中只含一种元素,则只含一种元素的纯净物一定是单质
D.中和反应生成盐和水,则生成盐和水的反应一定是中和反应
2.下列排序正确的是
A.空气中物质含量: B.溶液的pH:
C.利用金属的年代: D.氯元素化合价:
3.氢氧化钾与氢氧化钠性质相似,下列有关氢氧化钾的说法错误的是
A.氢氧化钾固体露置在空气中易潮解
B.氢氧化钾溶液能使石蕊溶液变蓝
C.氢氧化钾也可用于去油污
D.10g10%的氢氧化钾溶液与10g10%的硫酸溶液恰好完全反应
4.为完全中和一定质量的某强酸溶液,需用10 g溶质的质量分数为4%的KOH溶液。如果改用10 g溶质的质量分数为4%的NaOH溶液,则反应后溶液的pH
A.小于7 B.等于7 C.大于7 D.无法判断
5.用稀硫酸与氢氧化钠溶液反应探究中和反应实验时,测得溶液pH的变化如图所示,溶液温度的变化如图所示。下列说法错是
A.b点和e点表示酸碱恰好完全反应
B.图中温度曲线从室温上升到e点,说明该反应是放热反应
C.c点和f点所示溶液pH>7,能使无色酚酞试液变成红色
D.该实验是将稀硫酸逐滴滴入一定量的氢氧化钠溶液中
6.小斌实验小组利用数字化传感器对“硫酸和氢氧化钾发生中和反应”的实验过程进行了探究,绘制的反应容器中溶液的pH与加入溶液的质量变化图像如图所示。下列说法正确的是
A.图中a、d两点所示的溶液中含有的阴离子完全相同
B.图中b点→a点的变化过程为物理变化
C.若将酚酞试液滴入到c点所示的溶液中,溶液将变为红色
D.该实验是将硫酸溶液逐滴滴入到盛有氢氧化钾溶液的烧杯中
7.向装有一定量盐酸的密闭隔热容器中,逐滴滴加氢氧化钠溶液,利用数字传感器测出反应时间与溶液温度的变化如图所示。下列说法正确的是
A.由该图像可知该反应先放热后吸热
B.a点所示溶液中,溶质只有NaCl
C.b点表示盐酸和氢氧化钠溶液恰好完全反应
D.向70s时的溶液中滴加紫色石蕊溶液,溶液不变色
8.常温下,往盛放适量M物质的烧杯中逐渐加入N物质并充分搅拌。下图横坐标x表示N物质的质量,纵坐标y表示烧杯中的某物理量(见下表)。下列实验与图像对应关系合理的是
M N Y
A 水 氧化钙 溶液的温度
B 水 氢氧化钠 溶液的pH
C 饱和石灰水溶液 氧化钙 溶液中溶质的质量
D 硫酸铜溶液 铁粉 溶液的质量
A.A B.B C.C D.D
9.下列图象能正确反映其对应变化关系的是
A.向一定质量氯化亚铁和氯化锌的混合溶液中加入镁粉至过量
B.某温度时,向一定量的饱和石灰水中加入少量生石灰,并恢复原温度
C.向等质量的镁、铝中分别加入等质量分数的稀盐酸至过量
D.向一定量的稀盐酸中不断加入NaOH溶液至过量
10.某NaOH固体样品,可能含有固体KOH和不溶于酸的杂质A,取5.6g该样品与100g一定质量分数的稀盐酸反应,恰好完全反应,生成mg水。下列说法不正确的是
A.若样品不含任何杂质,则m>1.8
B.若m=1.8,则样品中一定含有杂质A
C.若m=1.8,则样品中一定含有固体KOH
D.若样品中不含A,则盐酸的溶质质量分数可能为4%
11.推理是化学学习中常用的思维方式,下列推理中正确的是( )
A.碱溶液能跟某些非金属氧化物反应,所以碱溶液能吸收CO气体
B.中和反应生成盐和水,但是生成盐和水的反应不一定是中和反应
C.溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小
D.碱溶液的pH大于7,pH大于7的溶液一定是碱溶液
12.为检验氢氧化钠溶液是否部分变质,分别取少量样品于试管中进行如下实验,一定能 达到实验目的的是
A.滴加少量稀盐酸 B.滴加氢氧化钡溶液
C.滴加 1~2 滴酚酞溶液 D.滴加适量的氯化钙溶液、静置、再滴加酚酞溶液
13.某兴趣小组在实验室中制取 CO2 气体后,对废液进行后续探究,他向一定质量的废液中逐滴加入Na2CO3溶液,加入Na2CO3溶液的质量与溶液的pH变化关系如图所示,下列说法错误的是
A.该曲线说明原废液中有盐酸剩余 B.AB 段的反应中有气泡产生
C.BC 段发生的是氯化钙与碳酸钠的反应 D.CD 段溶液中的溶质只有 NaCl
14.盛有等质量、等质量分数稀盐酸的两只烧杯,放在托盘天平的左右两盘,天平平衡,在左盘烧杯中加入10gCaCO3,恰好完全反应,若要使天平重新平衡,则右盘烧杯中应加入的下列物质是
A.5.6g铁和锌 B.10g镁和氧化镁
C.10g碳酸镁 D.10g碳酸钠和碳酸锌
二、填空题
15.对于硫酸而言,溶质的质量分数越大,溶液的酸性越强。常温下,10%的稀硫酸的pH______2%的稀硫酸的PH。如果要使稀硫酸的PH升高。你采取的方法有:
(1)物理方法:___________________;
(2)化学反应的方法:_____________________。
16.用化学方程式解释下列问题:
(1)用石灰水检验CO2气体____________;
(2)用硫酸铜和熟石灰配制波尔多液时不能在铁桶中配:____________;
(3)写一个有水生成的复分解反应____________。
17.对于稀硫酸而言,溶质的质量分数越大,溶液的酸性越强。常温下,10%的稀硫酸的pH____(填“大于”“小于”或“等于”)2%的稀硫酸的pH。如果要使稀硫酸的pH升高,你采取的方法有:
(1)不发生化学反应的方法:_______。
(2)发生化学反应的方法(要求各种方法中所选的物质类别不同):
①物质为______;反应的化学方程式为______________。
②物质为______;反应的化学方程式为______________。
③物质为______;反应的化学方程式为______________。
18.请结合下列四瓶溶液回答问题:
(1)农业上可以用溶液来选种_________(填写化学式);
(2)医疗上治疗胃酸过多症选用的一种药剂是_________(填写序号);
(3)写出①和③两瓶溶液发生反应的化学方程式__________________________;
(4)①、②、③三种溶液pH值由大到小的顺序是___________________(填写序号)。
19.旧铜器表面的“铜绿”主要成分的化学式为Cu2(OH)2CO3.小强对实验室用稀硫酸洗去“铜绿”所形成的废液进行实验:
(1)观察废液呈____色。测量废液的pH=1,说明废液中还含有____。
(2)取废液滴加到澄清石灰水中,能观察到的现象是____,溶液中发生反应的化学方程式为(写一个)____。
20.用熟石灰中和一定量的盐酸时,溶液的pH与加入的熟石灰质量的关系如右图所示。熟石灰与盐酸反应的化学方程式为____。当加入熟石灰mg时,溶液中的溶质为._____。若改用ng氢氧化钠与相同盐酸反应,所得溶液的pH___7(填“>”、“<”或“=”)。
三、简答题
21.某小型造纸厂向河中非法排放了大量碱性废液。请你根据所学的知识,设计两种检测碱性废液和受污染河水的方法,并试着提出治理的措施。
22.甲工厂排出的废水中含有少量氢氧化钠,与乙工厂排出的废水混合后,测得溶液的pH=7,且只含有氯化钠一种溶质。回答下列问题:
(1)乙工厂的废水中含有的物质为_____(写化学式)。
(2)写出反应的化学方程式_____。
23.在5mL氢氧化钠溶液中滴加2滴酚酞试液,溶液呈______色,再加入5mL稀盐酸,得到无色溶液,则无色溶液一定是_________。
Ⅰ pH≤7 Ⅱ pH=7 Ⅲ pH <7 ⅣpH>7
将无色溶液蒸发至干,看到的现象是____________。
若将40克10%氢氧化钠溶液和足量稀盐酸反应,计算生成氯化钠的物质的量。(根据化学方程式计算)_______
24.向一定量 NaOH 溶液中,滴加稀盐酸,所加盐酸的量与溶液 pH 的变化如图所示:
(1)当加入稀盐酸的体积为_____mL 时,稀盐酸与 NaOH 溶液恰好完全反应;
(2)向上述加了 12mL 稀盐酸后的 NaOH 溶液中滴加紫色石蕊试液,溶液显_____色;
(3)当加入 8 mL 稀盐酸时,溶液中的溶质有_____。
四、综合应用题
25.生活中常见物质的性质、制法等是化学研究的重要内容。
(1)复分解反应发生后,生成物肯定不会是 ___ (填“单质”或“化合物”)。
(2)盐酸与氢氧化钠溶液反应时溶液pH的变化如图1所示。下列说法正确的是 ___ 。
a.m点所示溶液为碱性
b.n点所示溶液中加紫色石蕊溶液显红色
c.p点所示溶液中的溶质为NaCl和NaOH
d.该图所对应操作是将盐酸滴入氢氧化钠溶液中
(3)浓硫酸和浓盐酸敞口放置均会变稀,这是为什么? ____
(4)图2装置可做一氧化碳还原氧化铁的实验,并检验生成的气体产物。
①B装置玻璃管里可观察到的现象为 ___ 。
②C装置中反应的化学方程式为 ___ 。
③实验结束后,若要确定A装置的溶液中溶质的成分,请设计合理的实验方案,简要写出实验步骤、现象和结论。(提示:Na2CO3溶液呈碱性) ____
现有73g溶质质量分数为10%的稀盐酸和127g氢氧化钠溶液恰好完全反应,求反应后溶液中溶质的质量分数 ____ 。
【参考答案】
1.C 2.B 3.D 4.C 5.D 6.B 7.C 8.D 9.D 10.C 11.B 12.D 13.D 14.C
15. 小于 加水 加碱(或活泼金属、等)
16. Ca(OH)2+CO2=CaCO3↓+H2O CuSO4+Fe=FeSO4+Cu HCl + NaOH = NaCl +H2O(答一条合理即可)
17. 小于 加入一定量的水 锌 Zn+H2SO4=ZnSO4+H2↑ 氧化铜 CuO+H2SO4=CuSO4+H2O 氢氧化钠 2NaOH+H2SO4=Na2SO4+2H2O
18. NaCl ④ HCl+NaOH=NaCl+H2O ③>②>①
19. 蓝 硫酸 产生蓝色沉淀
20. HCl、CaCl2 <
21.方法一:取少量河水样品于试管中,滴加2~3滴酚酞溶液,若溶液变红,则说明河水呈碱性。方法二:在白瓷板或玻璃片上放一片pH试纸,用玻璃棒蘸取河水的水样滴到试纸上,然后将试纸与标准比色卡进行比较读值,若pH>7,则说明河水呈碱性。
治理措施:可向该造纸厂的废水中加入一定量的硫酸,调整溶液的pH为7时才排放。
22. HCl NaOH+HCl=NaCl+H2O
23. 红 Ⅰ 白色固体 0.1mol
24. 10 红 氯化钠和氢氧化钠
25. (1) 单质 (2) C (3) 浓硫酸有吸水性,吸收空气中水蒸气使溶剂增多,浓盐酸有挥发性,使溶质减小。 固体红色粉末逐渐变黑 (4)CO2+Ca(OH)2===CaCO3↓+H2O 取少量,A装置中溶液少量放在试管中,加入过量(足量)CaCl2溶液静置,向上层清液中加入几滴酚酞。若溶液变红,则溶质为Na2CO3和NaOH,若溶液没有变成红色则溶质为Na2CO3 (5)
同课章节目录
