第八单元海水中的化学测试题-2021-2022学年九年级化学鲁教版下册 (word版 含答案)
文档属性
| 名称 | 第八单元海水中的化学测试题-2021-2022学年九年级化学鲁教版下册 (word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 119.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-04 17:06:26 | ||
图片预览



文档简介
第八单元《海水中的化学》测试题
一、单选题
1.下列说法不正确的是
A.粗盐难溶性杂质去除实验中,蒸发结晶时一定要在滤液蒸干时停止加热
B.氢氧化钠溶液能导电是因为其溶液中含有较多自由移动的离子
C.用硝酸钾和水配置5%的硝酸钾溶液的主要步骤依次是计算、称量、量取和溶解
D.消除公路上的积雪可以撒些粗盐,这样能使雪较快的融化
2.物质A、B在不同温度时的溶解度如表所示,下列说法正确的是
温度/℃ 20 40 60 80
溶解度/g A 110 117 126 139
B 31.6 63.9 110 167
A.物质B的溶解度大于物质A的溶解度
B.从A溶液中得到A晶体一般用蒸发溶剂的方法
C.20℃时A的饱和溶液一定不能再溶解其他物质
D.用玻璃棒搅拌会增大物质的溶解度
3.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是
A.20℃时,甲、乙饱和溶液中溶质的质量分数相等
B.将40℃时甲的饱和溶液降温至20℃,溶液质量不变
C.甲的溶解度大于乙的溶解度
D.将20℃时乙的饱和溶液升温至40℃,乙溶液仍为饱和溶液
4.NaCl和KNO3的溶解度曲线如图所示,下列说法正确的是
A.NaCl的溶解度一定大于KNO3
B.NaCl的溶解度受温度影响的程度比KNO3大
C.40℃时,100gKNO3饱和溶液中含有63.9gKNO3
D.将60℃时210gKNO3饱和溶液降温至20℃,析出KNO3晶体78.4g
5.久盛石灰水的试剂瓶内壁常附有一层白膜,要洗去这层白膜最好的方法是
A.用水洗 B.用氢氧化钠溶液洗
C.用稀盐酸洗 D.先用稀盐酸洗再用水洗
6.常温下,向各盛有100g水的甲、乙两个烧杯中分别加入等质量的M、N两种固体物质,搅拌,充分溶解后,发现只有甲烧杯底部有未溶固体存在。下列说法正确的是
A.所得两溶液质量相等 B.N溶液可能是饱和溶液
C.M、N两种物质都是易溶的 D.升高温度,M物质一定能继续溶解
7.物质的性质决定其用途。下列有关物质用途的说法正确的是
A.液态氮气可用于冷藏血液
B.氧气可作为推进火箭上天的高能燃料
C.烧碱用于治疗胃酸过多
D.石灰石用于改良酸性土壤
8.T2℃时,将70.0gKNO3、KCl固体分别加入到各盛有200.0g水的两个烧杯中,完全溶解,降温到T1℃,现象如图1所示。下列说法正确的是
A.甲中加入的固体是KNO3
B.T1℃时,甲中溶液一定不饱和,乙中溶液一定饱和
C.T1℃时,将甲、乙中的物质混合,充分搅拌,一定有固体剩余
D.T2℃时,KCI溶液由a点转化到b点,可加入KCI或恒温蒸发水
9.20℃时,硝酸钾的溶解度为31.6g。对这句话理解错误的是
A.20℃时,100g水中最多能溶解硝酸钾31.6g
B.20℃时,100g硝酸钾饱和溶液中含硝酸钾31.6g
C.20℃时,氯化钠饱和溶液中水与硝酸钾的质量比为100∶31.6
D.20℃时,将31.6g硝酸钾溶解于100g水中,所得溶液为该温度下硝酸钾的饱和溶液
10.下列发生化学变化的是( )
A.干冰用于人工降雨 B.工匠熔化玻璃吹制各种容器
C.大棚蔬菜生产施用二氧化碳气体提高产量 D.海员蒸馏海水获取淡水
二、简答题
11.用所学知识回答问题。
(1)海水淡化是向海水要淡水的一种方法,海水淡化能否作为人类应对淡水短缺的重要途径,为什么?____
(2)在书写具有保存价值的档案时,规定应使用碳素墨水。为什么?____
12.除杂是化学实验中常用的操作。
(1)如何除去CO2中混有的CO?___________。
(2)甲、乙两物质的溶解度随温度变化的差异较大时,可以采用什么方法分离甲、乙两物质?___________。
三、推断题
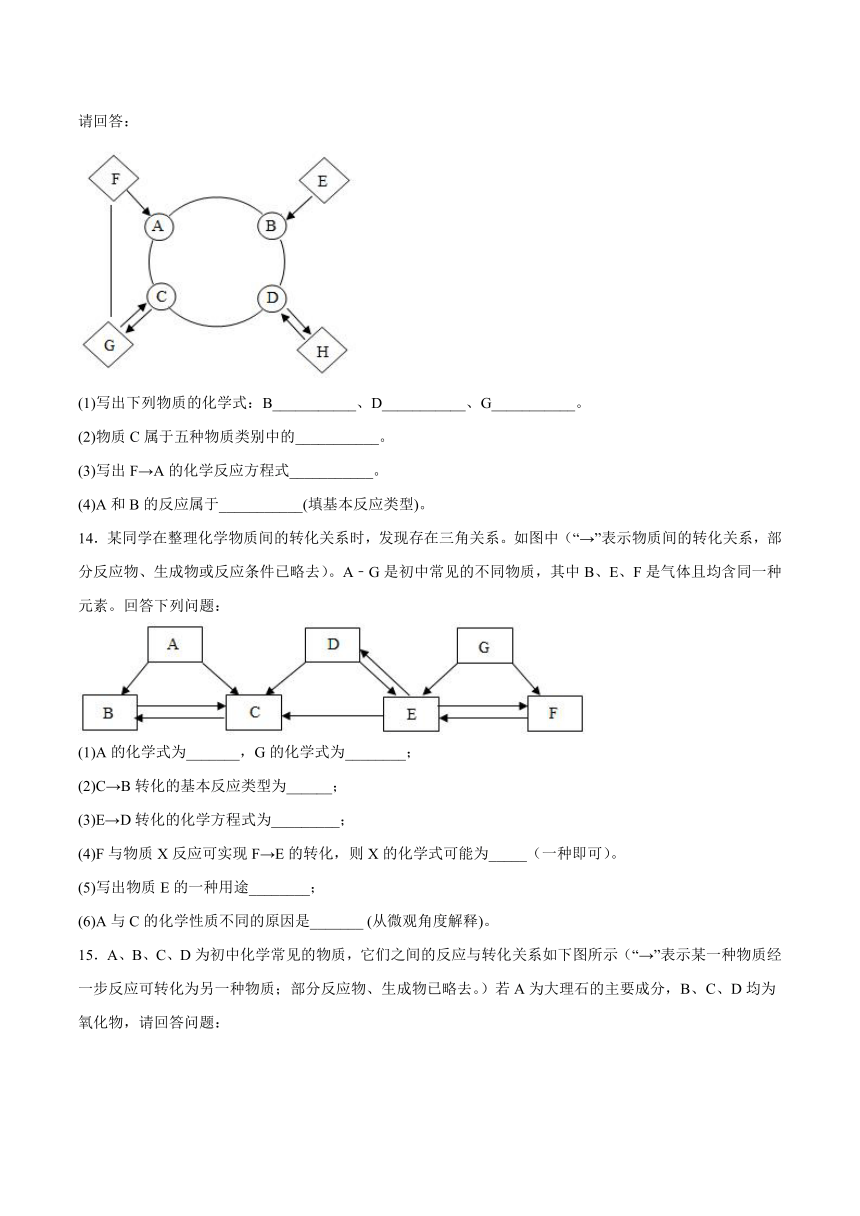
13.A~H是初中化学中常见的物质。已知A、B、C、D、E分别是单质、氧化物、酸、碱、盐中的一种,它们之间的转化关系如图所示(“一”或“”表示两端的物质能发生化学反应,“→”表示物质间在一定条件下存在转化关系,部分反应物生成物及反应条件已略去)。D的溶液呈蓝色常用来配制波尔多液;A是胃酸的主要成分;E是赤铁矿的主要成分;:G俗称苏打;C与D反应生成H;F与G发生反应时有气体生成。请回答:
(1)写出下列物质的化学式:B___________、D___________、G___________。
(2)物质C属于五种物质类别中的___________。
(3)写出F→A的化学反应方程式___________。
(4)A和B的反应属于___________(填基本反应类型)。
14.某同学在整理化学物质间的转化关系时,发现存在三角关系。如图中(“→”表示物质间的转化关系,部分反应物、生成物或反应条件已略去)。A﹣G是初中常见的不同物质,其中B、E、F是气体且均含同一种元素。回答下列问题:
(1)A的化学式为_______,G的化学式为________;
(2)C→B转化的基本反应类型为______;
(3)E→D转化的化学方程式为_________;
(4)F与物质X反应可实现F→E的转化,则X的化学式可能为_____(一种即可)。
(5)写出物质E的一种用途________;
(6)A与C的化学性质不同的原因是_______ (从微观角度解释)。
15.A、B、C、D为初中化学常见的物质,它们之间的反应与转化关系如下图所示(“→”表示某一种物质经一步反应可转化为另一种物质;部分反应物、生成物已略去。)若A为大理石的主要成分,B、C、D均为氧化物,请回答问题:
(1)物质A中的阴离子为______(填写离子符号),物质C由______构成(填写具体微粒名称)。
(2)D物质在生活中的用途为______。
(3)写出A→C反应化学方程式______。
(4)D→C反应所属的基本反应类型为______(填“化合”或“分解”)反应。
四、实验题
16.结合如图所示验证氢氧化钙化学性质的实验图示,回答有关问题。
(1)实验A中,一定能够观察到的明显现象是______;
(2)实验B中发生的反应方程式为 ______;
(3)已知Na2CO3溶液呈碱性,将A、B、C三个实验后的所有物质倒入同一个烧杯中,发现有气泡产生,最后只得到了无色溶液,则最后得到的无色溶液中一定含有的溶质是____。
17.某同学设计了如下图装置制取并收集一矿泉水瓶二氧化碳气体,并用于证明二氧化碳与氢氧化钠溶液能否发生反应。
(1)该同学用大理石与稀盐酸反应来制取二氧化碳,他选用的发生装置是_________,发生反应的化学方程式为_____________。
(2)该同学用图中矿泉水瓶收集一瓶二氧化碳,他检验二氧化碳是否已收集满的正确方法是__________。
(3)为了证明二氧化碳能否与氢氧化钠发生反应,该同学向盛满二氧化碳的矿泉水瓶中加入一定量氢氧化钠溶液,立即盖紧瓶盖,振荡,观察到矿泉水瓶变瘪,请解释变瘪的原因是_____________。
(4)接着该同学向变瘪后的矿泉水瓶内的溶液中加入氯化钡溶液,若观察到___________,即证明有碳酸钠存在,从而证明二氧化碳与氢氧化钠发生了反应。
18.化学实验小组用如图所示实验验证质量守恒定律。
(1)请写出该实验的化学方程式:______。
(2)请写出该实验天平不平衡的原因:______。
五、计算题
19.某石灰石中含有杂质(杂质不溶于水,也不与盐酸反应),一兴趣小组想测定 该样品中碳酸钙的质量,他们将一块样品敲打粉碎后,取出 6g 放入质量为 20g 的烧杯 中,然后加入稀盐酸,用玻璃棒搅拌至不再产生气泡为止,共消耗掉盐酸的质量为 50g。反应所需时间和烧杯及其所盛物质的总质量变化如图所示,求:
(1)生成二氧化碳的质量为______;
(2)此石灰石样品中碳酸钙的质量;
(3)参加反应的盐酸溶液中溶质的质量分数。
20.实验室欲测定一瓶标签破损的稀硫酸中溶质的质量分数,现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化情况如图所示。分析并计算:
(1)写出反应的化学方程式_______。
(2)a点溶液中含有的离子是_______。
(3)当pH=7时,列出求解参加反应的硫酸质量(X)的比例式________。
(4)计算稀硫酸中溶质的质量分数________。
(5)若用质量分数98%的浓硫酸配制上述实验所需稀硫酸,需要浓硫酸质量为________。
(6)向恰好完全反应时的溶液中加入24克水,所得溶液的溶质质量分数_______。
参考答案:
1.A 2.B 3.A 4.D 5.D 6.B 7.A 8.D 9.B 10.C
11. 参考答案一:能,在沿海地区利用海水淡化技术能为生产、生活提供淡水资源并综合利用了海水资源;参考答案二:不能,海水淡化需要较大的成本,为内陆地区提供水资源很不方便 碳在常温下化学性质稳定
12. 通过灼热的氧化铜 加水溶解、降温结晶、过滤、对滤液蒸发结晶
13.(1) Fe CuSO4 Na2CO3
(2)碱
(3)
(4)置换反应
14.(1) H2O2 C
(2)分解反应
(3)
(4)O2或CuO(合理即可)
(5)灭火
(6)分子构成不同
15.(1) 二氧化碳分子
(2)做燃料
(3)
(4)化合
16.(1)澄清石灰水变浑浊
(2)Ca(OH)2+2HCl=CaCl2+2H2O
(3)氯化钙和氯化钠
17.(1) B
(2)将燃着的木条放在瓶口,木条熄灭,证明已满
(3)可能是CO2与NaOH发生了反应,也可能是CO2溶于水了
(4)产生白色沉淀
18.(1)
(2)碳酸钠和稀盐酸反应生成了二氧化碳,二氧化碳是气体,散逸到了空气中
19.(1)2.2g
(2)解:设该石灰石样品中碳酸钙的质量为x,稀盐酸中溶质的质量为y
(3)该盐酸中溶质的质量分数:。
答:反应中生成二氧化碳的质量为2.2g;此石灰石样品中碳酸钙的质量为5g;参加反应的盐酸溶液中溶质的质量分数为7.3%。
20.(1)
(2)H+、Na+、
(3)
(4)9.8%
(5)1g
(6)解:设生成硫酸钠的质量为z
加24克水后所得溶液的溶质质量分数为
答:所得溶液的溶质质量分数为2.84%。
一、单选题
1.下列说法不正确的是
A.粗盐难溶性杂质去除实验中,蒸发结晶时一定要在滤液蒸干时停止加热
B.氢氧化钠溶液能导电是因为其溶液中含有较多自由移动的离子
C.用硝酸钾和水配置5%的硝酸钾溶液的主要步骤依次是计算、称量、量取和溶解
D.消除公路上的积雪可以撒些粗盐,这样能使雪较快的融化
2.物质A、B在不同温度时的溶解度如表所示,下列说法正确的是
温度/℃ 20 40 60 80
溶解度/g A 110 117 126 139
B 31.6 63.9 110 167
A.物质B的溶解度大于物质A的溶解度
B.从A溶液中得到A晶体一般用蒸发溶剂的方法
C.20℃时A的饱和溶液一定不能再溶解其他物质
D.用玻璃棒搅拌会增大物质的溶解度
3.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是
A.20℃时,甲、乙饱和溶液中溶质的质量分数相等
B.将40℃时甲的饱和溶液降温至20℃,溶液质量不变
C.甲的溶解度大于乙的溶解度
D.将20℃时乙的饱和溶液升温至40℃,乙溶液仍为饱和溶液
4.NaCl和KNO3的溶解度曲线如图所示,下列说法正确的是
A.NaCl的溶解度一定大于KNO3
B.NaCl的溶解度受温度影响的程度比KNO3大
C.40℃时,100gKNO3饱和溶液中含有63.9gKNO3
D.将60℃时210gKNO3饱和溶液降温至20℃,析出KNO3晶体78.4g
5.久盛石灰水的试剂瓶内壁常附有一层白膜,要洗去这层白膜最好的方法是
A.用水洗 B.用氢氧化钠溶液洗
C.用稀盐酸洗 D.先用稀盐酸洗再用水洗
6.常温下,向各盛有100g水的甲、乙两个烧杯中分别加入等质量的M、N两种固体物质,搅拌,充分溶解后,发现只有甲烧杯底部有未溶固体存在。下列说法正确的是
A.所得两溶液质量相等 B.N溶液可能是饱和溶液
C.M、N两种物质都是易溶的 D.升高温度,M物质一定能继续溶解
7.物质的性质决定其用途。下列有关物质用途的说法正确的是
A.液态氮气可用于冷藏血液
B.氧气可作为推进火箭上天的高能燃料
C.烧碱用于治疗胃酸过多
D.石灰石用于改良酸性土壤
8.T2℃时,将70.0gKNO3、KCl固体分别加入到各盛有200.0g水的两个烧杯中,完全溶解,降温到T1℃,现象如图1所示。下列说法正确的是
A.甲中加入的固体是KNO3
B.T1℃时,甲中溶液一定不饱和,乙中溶液一定饱和
C.T1℃时,将甲、乙中的物质混合,充分搅拌,一定有固体剩余
D.T2℃时,KCI溶液由a点转化到b点,可加入KCI或恒温蒸发水
9.20℃时,硝酸钾的溶解度为31.6g。对这句话理解错误的是
A.20℃时,100g水中最多能溶解硝酸钾31.6g
B.20℃时,100g硝酸钾饱和溶液中含硝酸钾31.6g
C.20℃时,氯化钠饱和溶液中水与硝酸钾的质量比为100∶31.6
D.20℃时,将31.6g硝酸钾溶解于100g水中,所得溶液为该温度下硝酸钾的饱和溶液
10.下列发生化学变化的是( )
A.干冰用于人工降雨 B.工匠熔化玻璃吹制各种容器
C.大棚蔬菜生产施用二氧化碳气体提高产量 D.海员蒸馏海水获取淡水
二、简答题
11.用所学知识回答问题。
(1)海水淡化是向海水要淡水的一种方法,海水淡化能否作为人类应对淡水短缺的重要途径,为什么?____
(2)在书写具有保存价值的档案时,规定应使用碳素墨水。为什么?____
12.除杂是化学实验中常用的操作。
(1)如何除去CO2中混有的CO?___________。
(2)甲、乙两物质的溶解度随温度变化的差异较大时,可以采用什么方法分离甲、乙两物质?___________。
三、推断题
13.A~H是初中化学中常见的物质。已知A、B、C、D、E分别是单质、氧化物、酸、碱、盐中的一种,它们之间的转化关系如图所示(“一”或“”表示两端的物质能发生化学反应,“→”表示物质间在一定条件下存在转化关系,部分反应物生成物及反应条件已略去)。D的溶液呈蓝色常用来配制波尔多液;A是胃酸的主要成分;E是赤铁矿的主要成分;:G俗称苏打;C与D反应生成H;F与G发生反应时有气体生成。请回答:
(1)写出下列物质的化学式:B___________、D___________、G___________。
(2)物质C属于五种物质类别中的___________。
(3)写出F→A的化学反应方程式___________。
(4)A和B的反应属于___________(填基本反应类型)。
14.某同学在整理化学物质间的转化关系时,发现存在三角关系。如图中(“→”表示物质间的转化关系,部分反应物、生成物或反应条件已略去)。A﹣G是初中常见的不同物质,其中B、E、F是气体且均含同一种元素。回答下列问题:
(1)A的化学式为_______,G的化学式为________;
(2)C→B转化的基本反应类型为______;
(3)E→D转化的化学方程式为_________;
(4)F与物质X反应可实现F→E的转化,则X的化学式可能为_____(一种即可)。
(5)写出物质E的一种用途________;
(6)A与C的化学性质不同的原因是_______ (从微观角度解释)。
15.A、B、C、D为初中化学常见的物质,它们之间的反应与转化关系如下图所示(“→”表示某一种物质经一步反应可转化为另一种物质;部分反应物、生成物已略去。)若A为大理石的主要成分,B、C、D均为氧化物,请回答问题:
(1)物质A中的阴离子为______(填写离子符号),物质C由______构成(填写具体微粒名称)。
(2)D物质在生活中的用途为______。
(3)写出A→C反应化学方程式______。
(4)D→C反应所属的基本反应类型为______(填“化合”或“分解”)反应。
四、实验题
16.结合如图所示验证氢氧化钙化学性质的实验图示,回答有关问题。
(1)实验A中,一定能够观察到的明显现象是______;
(2)实验B中发生的反应方程式为 ______;
(3)已知Na2CO3溶液呈碱性,将A、B、C三个实验后的所有物质倒入同一个烧杯中,发现有气泡产生,最后只得到了无色溶液,则最后得到的无色溶液中一定含有的溶质是____。
17.某同学设计了如下图装置制取并收集一矿泉水瓶二氧化碳气体,并用于证明二氧化碳与氢氧化钠溶液能否发生反应。
(1)该同学用大理石与稀盐酸反应来制取二氧化碳,他选用的发生装置是_________,发生反应的化学方程式为_____________。
(2)该同学用图中矿泉水瓶收集一瓶二氧化碳,他检验二氧化碳是否已收集满的正确方法是__________。
(3)为了证明二氧化碳能否与氢氧化钠发生反应,该同学向盛满二氧化碳的矿泉水瓶中加入一定量氢氧化钠溶液,立即盖紧瓶盖,振荡,观察到矿泉水瓶变瘪,请解释变瘪的原因是_____________。
(4)接着该同学向变瘪后的矿泉水瓶内的溶液中加入氯化钡溶液,若观察到___________,即证明有碳酸钠存在,从而证明二氧化碳与氢氧化钠发生了反应。
18.化学实验小组用如图所示实验验证质量守恒定律。
(1)请写出该实验的化学方程式:______。
(2)请写出该实验天平不平衡的原因:______。
五、计算题
19.某石灰石中含有杂质(杂质不溶于水,也不与盐酸反应),一兴趣小组想测定 该样品中碳酸钙的质量,他们将一块样品敲打粉碎后,取出 6g 放入质量为 20g 的烧杯 中,然后加入稀盐酸,用玻璃棒搅拌至不再产生气泡为止,共消耗掉盐酸的质量为 50g。反应所需时间和烧杯及其所盛物质的总质量变化如图所示,求:
(1)生成二氧化碳的质量为______;
(2)此石灰石样品中碳酸钙的质量;
(3)参加反应的盐酸溶液中溶质的质量分数。
20.实验室欲测定一瓶标签破损的稀硫酸中溶质的质量分数,现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化情况如图所示。分析并计算:
(1)写出反应的化学方程式_______。
(2)a点溶液中含有的离子是_______。
(3)当pH=7时,列出求解参加反应的硫酸质量(X)的比例式________。
(4)计算稀硫酸中溶质的质量分数________。
(5)若用质量分数98%的浓硫酸配制上述实验所需稀硫酸,需要浓硫酸质量为________。
(6)向恰好完全反应时的溶液中加入24克水,所得溶液的溶质质量分数_______。
参考答案:
1.A 2.B 3.A 4.D 5.D 6.B 7.A 8.D 9.B 10.C
11. 参考答案一:能,在沿海地区利用海水淡化技术能为生产、生活提供淡水资源并综合利用了海水资源;参考答案二:不能,海水淡化需要较大的成本,为内陆地区提供水资源很不方便 碳在常温下化学性质稳定
12. 通过灼热的氧化铜 加水溶解、降温结晶、过滤、对滤液蒸发结晶
13.(1) Fe CuSO4 Na2CO3
(2)碱
(3)
(4)置换反应
14.(1) H2O2 C
(2)分解反应
(3)
(4)O2或CuO(合理即可)
(5)灭火
(6)分子构成不同
15.(1) 二氧化碳分子
(2)做燃料
(3)
(4)化合
16.(1)澄清石灰水变浑浊
(2)Ca(OH)2+2HCl=CaCl2+2H2O
(3)氯化钙和氯化钠
17.(1) B
(2)将燃着的木条放在瓶口,木条熄灭,证明已满
(3)可能是CO2与NaOH发生了反应,也可能是CO2溶于水了
(4)产生白色沉淀
18.(1)
(2)碳酸钠和稀盐酸反应生成了二氧化碳,二氧化碳是气体,散逸到了空气中
19.(1)2.2g
(2)解:设该石灰石样品中碳酸钙的质量为x,稀盐酸中溶质的质量为y
(3)该盐酸中溶质的质量分数:。
答:反应中生成二氧化碳的质量为2.2g;此石灰石样品中碳酸钙的质量为5g;参加反应的盐酸溶液中溶质的质量分数为7.3%。
20.(1)
(2)H+、Na+、
(3)
(4)9.8%
(5)1g
(6)解:设生成硫酸钠的质量为z
加24克水后所得溶液的溶质质量分数为
答:所得溶液的溶质质量分数为2.84%。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
